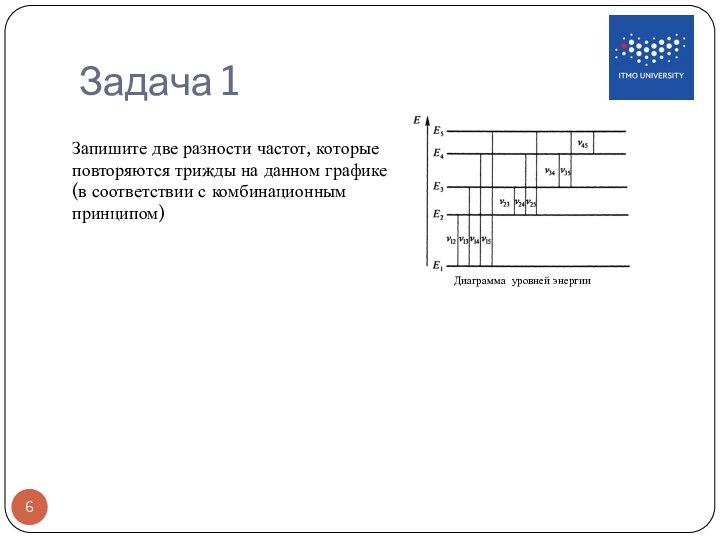
может находится только в особых стационарных или квантовых состояниях, каждому из которых
соответствует определенная энергия En. В стационарных состояниях атом не излучает.Энергетические уровни атома и условное изображение процессов поглощения и испускания фотонов
Второй постулат Бора (правило частот) формулируется следующим образом: при переходе атома из одного стационарного состояния с энергией En в другое стационарное состояние с энергией Em излучается или поглощается квант, энергия которого равна разности энергий стационарных состояний:
hνnm=En–Em, h – постоянная Планка
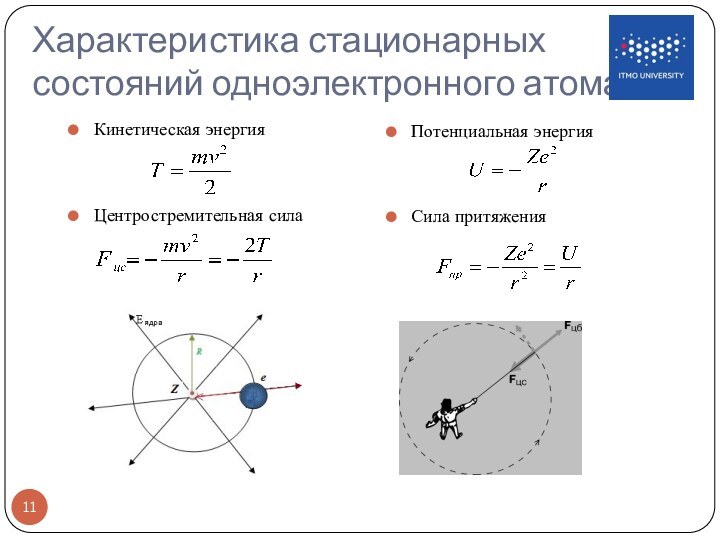
Этот постулат находится в явном противоречии с классической механикой, согласно которой энергия движущегося электрона может быть любой. Он находится в противоречии и с электродинамикой, так как допускает возможность ускоренного движения электронов без излучения электромагнитных волн.
Второй постулат Бора также противоречит электродинамике Максвелла, так как частота излучения определяется только изменением энергии атома и никак не зависит от характера движения электрона.