- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Производство серы и серной кислоты
Содержание
- 2. Производство элементарной серы
- 3. Элементарная сера: Известна с доисторических времен; У
- 4. Статистика производства серы: Мировой объем производства -
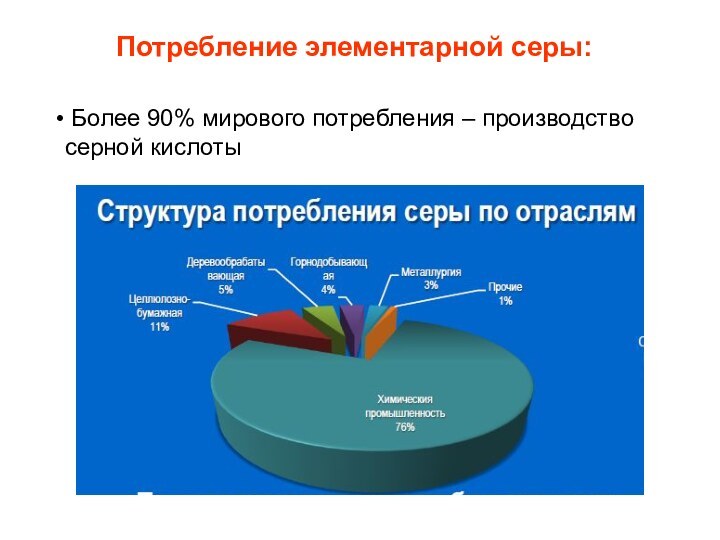
- 5. Потребление элементарной серы: Более 90% мирового потребления – производство серной кислоты
- 6. Источники сырья: Природные месторождения элементарной серы (>1.5
- 7. Технологии производства серы: Добыча и очистка природной
- 8. Добыча и очистка природной элементарной серы открытая
- 9. Получение серы из H2S Источники сероводорода Переработка
- 10. Получение серы из H2S Реакции получения серы
- 11. Получение серы из H2SОкисление сероводорода кислородом воздуха H2S
- 12. Процесс КлаусаОсновная технология производства серыКарл Ф.Клаус –
- 13. Процесс КлаусаПечь КлаусаГомогенное окисление кислого газа кислородом
- 14. Процесс КлаусаКаталитические стадииРавновесие: желательно снижение температурыПроблема: конденсации
- 15. Процессы доочистки хвостовых газов установок КлаусаРеакция Клауса
- 16. Процессы дожига хвостовых газов установок КлаусаОкисление H2S,
- 17. Производство серной кислоты
- 18. История промышленного производства: Известна очень давно (более
- 19. Производство серной кислоты Общее производство в мире
- 20. Области применения:В ХХ-ом веке – индикатор развития экономики
- 21. Источники сырья:Сырье: Пириты, колчедан и пр.
- 22. Общая схема производства серной кислотыПолучение диоксида серы.Подготовка
- 23. Получение диоксида серы Сжигание серы S +
- 24. Подготовка газа удаление пыли; удаление брызг и
- 25. Окисление SO2SO2 + ½ O2 SO3
- 26. Окисление SO2Проблема: реакция обратима и экзотермична T = T0 + Tад*х адиабатический разогрев
- 27. Пути смещения равновесия при окислении SO2Снижение температуры
- 28. Ведение реакции в нескольких слоях катализатора с
- 29. Промежуточная абсорбция триоксида серыПроцесс ДК/ДА (двойное контактирование
- 30. Стадия абсорбции триоксида серыSO3 + H2O
- 31. Стадия доочистки отходящих газовРеальный уровень выбросов SO2
- 32. Типичный вид сернокислотных установок
- 33. Реверс-процесс окисления диоксида серыРазработка ИК СО РАН
- 34. Реверс-процесс окисления диоксида серыВ эксплуатации находятся
- 35. Скачать презентацию
- 36. Похожие презентации























Слайд 3
Элементарная сера:
Известна с доисторических времен;
У алхимиков
олицетворяла «основное начало» горючести;
оборота элементов в жизненных циклах
Слайд 4
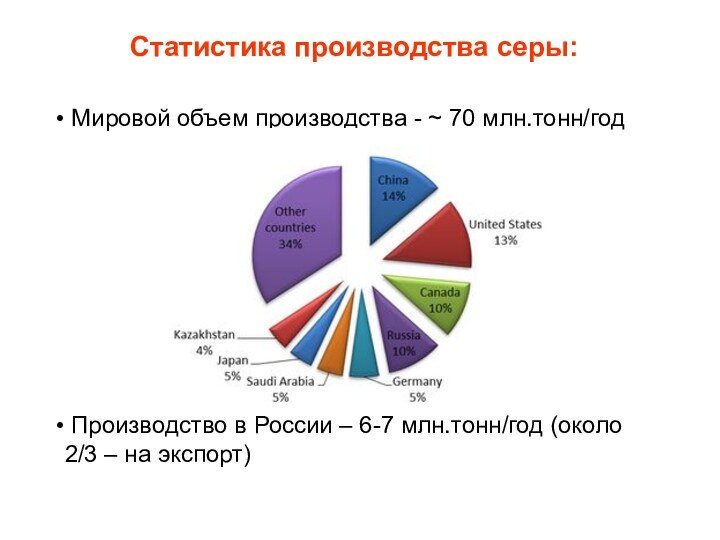
Статистика производства серы:
Мировой объем производства - ~
70 млн.тонн/год
Производство в России – 6-7 млн.тонн/год (около
2/3 – на экспорт)
Слайд 6
Источники сырья:
Природные месторождения элементарной серы (>1.5 млрд.
тонн)
Сульфидные руды (пириты)
Сернистые соединения в
природном газе (H2S) Сернистые соединения в нефти
SO2 в отходящих газах металлургических предприятий (Норильск)
Перспективные источники:
Сероводород-содержащая вода (Черное море, геотермальные источники)
Переработка биогаза
Мировые запасы серы существенно превосходят потребности человечества в обозримом будущем
Слайд 7
Технологии производства серы:
Добыча и очистка природной элементарной
серы
Получение серы из пиритов
Получение серы из
H2SПолучение серы из SO2
Слайд 8
Добыча и очистка природной элементарной серы
открытая добыча
(шахты, открытые карьеры)
подземная выплавка (Н. Frasch – 1890
г.)ХVI-ый век
очистка серы от примесей – переплавка и фильтрация
Слайд 9
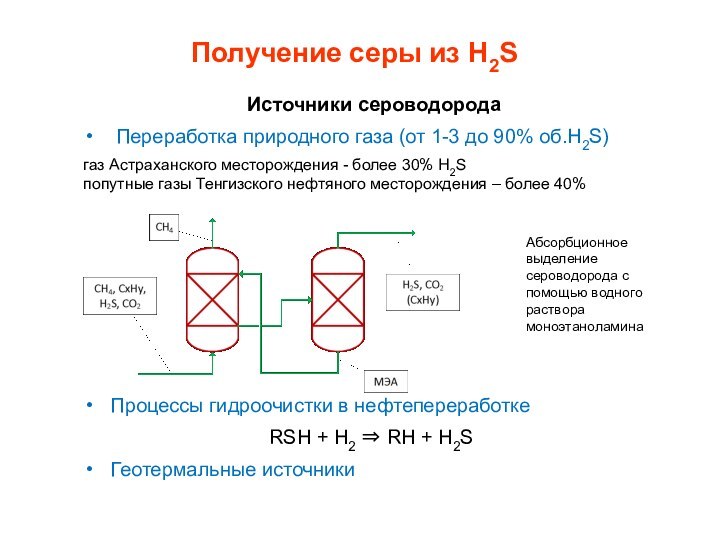
Получение серы из H2S
Источники сероводорода
Переработка природного
газа (от 1-3 до 90% об.H2S)
газ Астраханского месторождения -
более 30% H2S
попутные газы Тенгизского нефтяного месторождения – более 40%Процессы гидроочистки в нефтепереработке
RSH + H2 RH + H2S
Геотермальные источники
Абсорбционное выделение сероводорода с помощью водного раствора моноэтаноламина
Слайд 10
Получение серы из H2S
Реакции получения серы из
сероводорода
Разложение сероводорода
H2S H2 + 1/n Sn -
Qвозможность получения водорода
равновесные ограничения – для эффективного протекания реакции нужна высокая температура (конверсия 10% - ~700С, полная конверсия – более 2000С)
Окисление сероводорода
H2S + ½ О2 S + Н2О + Q
экзотермическая реакция – положительный энергетический баланс
Основной реакционный путь производства серы
Слайд 11
Получение серы из H2S
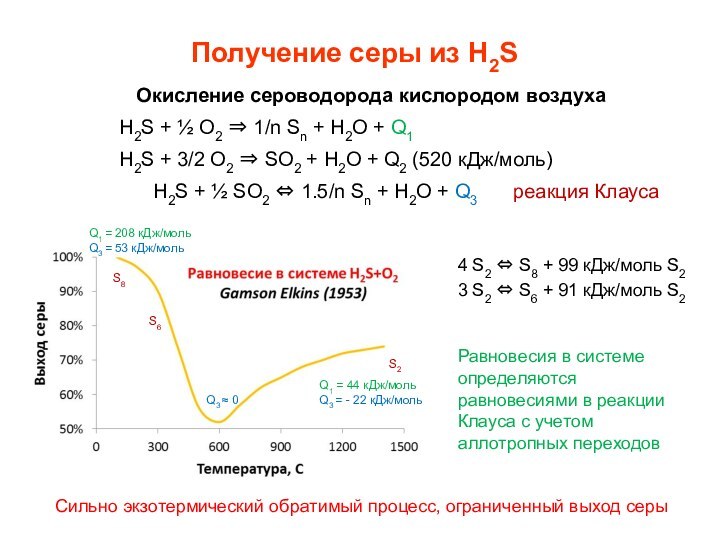
Окисление сероводорода кислородом воздуха
H2S +
½ О2 1/n Sn + Н2О + Q1
H2S
+ 3/2 О2 SO2 + Н2О + Q2 (520 кДж/моль)H2S + ½ SО2 1.5/n Sn + Н2О + Q3 реакция Клауса
4 S2 S8 + 99 кДж/моль S2
3 S2 S6 + 91 кДж/моль S2
S2
S8
S6
Q1 = 208 кДж/моль
Q3 = 53 кДж/моль
Q1 = 44 кДж/моль
Q3 = - 22 кДж/моль
Q3 0
Равновесия в системе определяются равновесиями в реакции Клауса с учетом аллотропных переходов
Сильно экзотермический обратимый процесс, ограниченный выход серы
Слайд 12
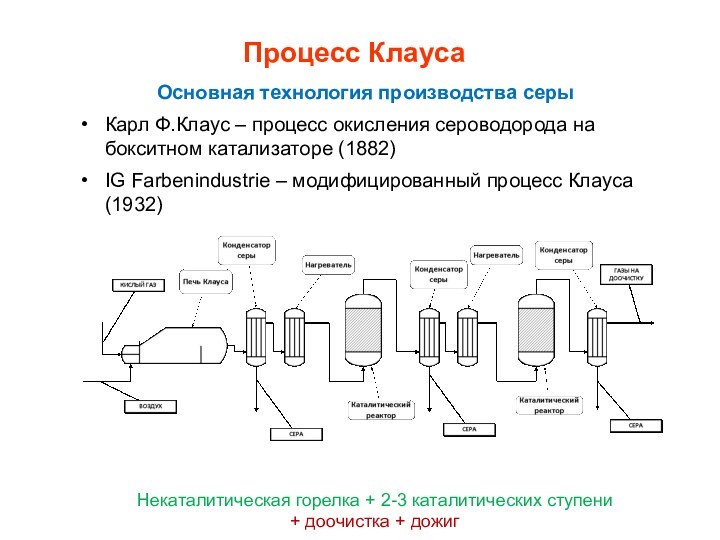
Процесс Клауса
Основная технология производства серы
Карл Ф.Клаус – процесс
окисления сероводорода на бокситном катализаторе (1882)
IG Farbenindustrie – модифицированный
процесс Клауса (1932)Некаталитическая горелка + 2-3 каталитических ступени
+ доочистка + дожиг
Слайд 13
Процесс Клауса
Печь Клауса
Гомогенное окисление кислого газа кислородом воздуха
900-2000С
Целевые
реакции
H2S + ½ О2 1/n Sn + Н2О
H2S + 3/2 О2 SO2 + Н2О
H2S + ½ SО2 1.5/n Sn + Н2О
Выход серы 60-65%
Побочные реакции
СхНу + О2 СО2 + Н2О
СхНу + О2 СО + Н2О
СхНу + Н2О СО + Н2
СО2 + H2S COS + H2O
COS + H2S CS2 + H2O
NH3 + O2 NOx + H2O
…
Производство серы из SO2
SO2 + CH4 Sn + H2S + H2O + CO2
(…+COS/CS2 + CO/H2)
Аналогичный состав продуктов
Слайд 14
Процесс Клауса
Каталитические стадии
Равновесие: желательно снижение температуры
Проблема: конденсации серы
(Тр 180-270С), дезактивация катализатора
Решение: многостадийный процесс (2-3 стадии)
1-ый реактор
270-350СH2S + ½ SО2 1.5/n Sn + Н2О
COS + H2O H2S + CO2
CS2 + 2 H2O 2 H2S + CO2
Степень извлечения серы до 85-90%
2-ой реактор – 230-270С
H2S + ½ SО2 1.5/n Sn + Н2О
Степень извлечения серы до 96%
Катализаторы
- Al2O3
TiO2
V2O5
3-ий реактор – 180-220С
Степень извлечения серы до 98%
Реальная степень извлечения серы – 90-96%
Проблема: поддержание соотношения H2S/SO2 = 2
Слайд 15
Процессы доочистки хвостовых газов установок Клауса
Реакция Клауса при
низкой температуре (120-140С) с конденсацией/адсорбцией серы – Sulfreen
Процессы с
гидрированием SO2, COS/CS2, S до H2S с рециклом сероводорода в «голову» процесса - SCOT Процессы селективного окисления H2S в серу (180-250С, катализатор FeOx) – SuperClaus, ИК
Реактор селективного окисления сероводорода на Омском НПЗ
(разработка ИК СО РАН)
Слайд 16
Процессы дожига хвостовых газов установок Клауса
Окисление H2S, S,
COS, CS2 в избытке воздуха в SO2
гомогенное сжигание (печь
дожига)каталитические процессы
Грануляция и складирование серы
Слайд 18
История промышленного производства:
Известна очень давно (более 1000
лет);
С XV века – сухая перегонка железного
купороса;
Первый завод – 1740 г. (Англия) –
нагревание смеси серы и селитры в
присутствии воды;С конца XIX века – окисление SO2 оксидами азота SO2 + NO2 SO3 + NO (нитрозный метод);
1831 г. (Англия) – окисление SO2 на Pt катализаторе;
1931 г. (Г.К.Боресков, СССР) – ванадиевые катализаторы окисления диоксида серы.
Слайд 19
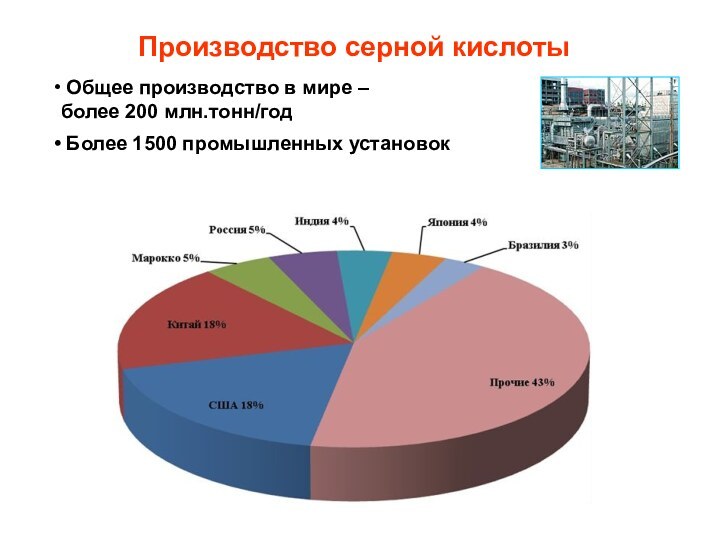
Производство серной кислоты
Общее производство в мире –
более 200 млн.тонн/год
Более 1500 промышленных установок
Слайд 21
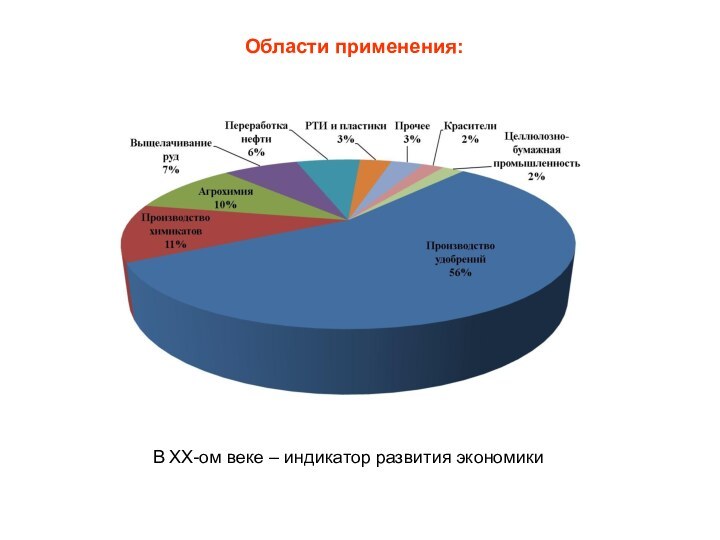
Источники сырья:
Сырье:
Пириты, колчедан и пр.
Элементарная
сера – природная и газовая ~80%
Диоксид серы,
сероводород (отходящие газы) Тенденция - снижение целенаправленной добычи сырья, расширение использования отходящих газов нефте/газопереработки и металлургии
Слайд 22
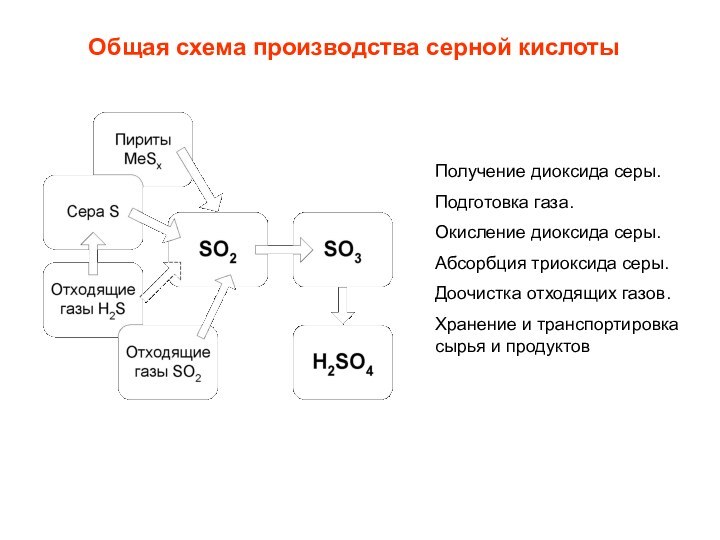
Общая схема производства серной кислоты
Получение диоксида серы.
Подготовка газа.
Окисление
диоксида серы.
Абсорбция триоксида серы.
Доочистка отходящих газов.
Хранение и транспортировка сырья
и продуктов
Слайд 23
Получение диоксида серы
Сжигание серы S + O2
SO2
Обжиг пиритов FeS2 + O2 Fe3O4
+ SO2Окисление сероводорода
Отходящие газы металлургии, нефтепереработки, газы ТЭЦ и пр.
Специфические проблемы
газы окисления пиритов и металлургические отходящие газы –пыль и нежелательные примеси
отходящие газы нефтепереработки и газы ТЭЦ – высокая влажность, невозможность сведения «водного баланса»
(для получения концентрированной кислоты в исходном газе должно быть CSO2 ≥ CH2O)
Слайд 24
Подготовка газа
удаление пыли;
удаление брызг и тумана
серной кислоты;
удаление токсичных примесей и каталитических ядов;
осушка
газа.Пыль: исходное содержание до 300-1000 мг/м3, удаление – циклоны, электрофильтры, фильтры
Туман и брызги образуются при снижении температуры газа, удаление – фильтры, электрофильтры
Каталитические яды и токсичные примеси – мышьяк, селен и фтор (металлургические газы, обжиговые газы, природная сера). Удаление As2O3 и SeO2, SiF4 – растворение в H2SO4 (абсорбция в промывных башнях).
Осушка газа – промывка газов концентрированной кислотой, конденсация воды при пониженной температуре
Слайд 25
Окисление SO2
SO2 + ½ O2 SO3 +
99 кДж/моль
Катализаторы
(V2O5 + K2S2O7)/SiO2
Активный компонент – расплав V2O5 +
K2S2O7Механизм
[A] + SO2 [B] + SO3 [B] + SO2 [C]
[C] + O2 [A]+ SO3 [C] V24+ + SO3
где [A], [B], [C] – комплексы пятивалентного ванадия ([A] соответствует V25+O22-, [B] - V25+O2-,[C] - V25+SO32-).
Кинетика (уравнение Борескова – Иванова)
Г.К.Боресков
Слайд 26
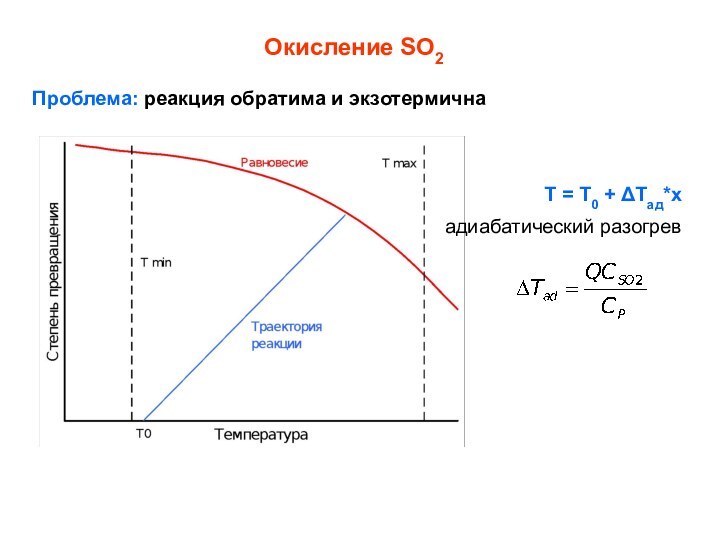
Окисление SO2
Проблема: реакция обратима и экзотермична
T = T0
+ Tад*х
адиабатический разогрев
Слайд 27
Пути смещения равновесия при окислении SO2
Снижение температуры и
вывод SO3 из состава реакционной смеси
Снижение входной температуры газа
ведет к росту конверсии, но: снижается скорость реакции
температура плавления активного компонента – не ниже 3600С;
дезактивация катализатора за счет образования кристаллической фазы V4+ при пониженных температурах
Пути повышения конверсии диоксида серы:
ведение реакции в нескольких слоях катализатора с промежуточным теплоотводом
промежуточная абсорбция SO3
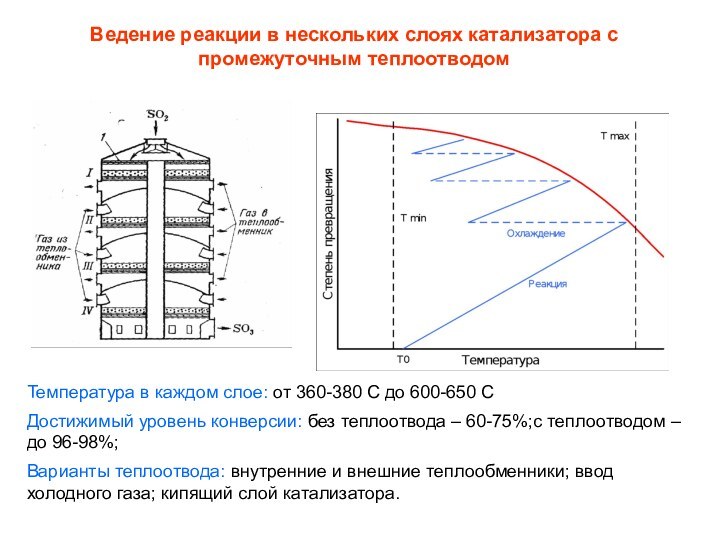
Слайд 28 Ведение реакции в нескольких слоях катализатора с промежуточным
теплоотводом
Температура в каждом слое: от 360-380 С до 600-650
СДостижимый уровень конверсии: без теплоотвода – 60-75%;с теплоотводом – до 96-98%;
Варианты теплоотвода: внутренние и внешние теплообменники; ввод холодного газа; кипящий слой катализатора.
Слайд 29
Промежуточная абсорбция триоксида серы
Процесс ДК/ДА (двойное контактирование /
двойная абсорбция)
cдвиг равновесия за счет вывода SO3
Достижимый уровень конверсии:
до 99.9-99.95%
Слайд 30
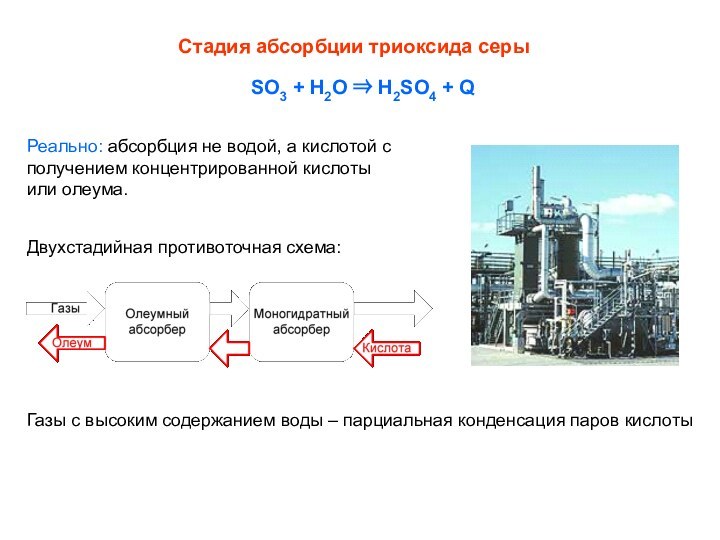
Стадия абсорбции триоксида серы
SO3 + H2O H2SO4
+ Q
Реально: абсорбция не водой, а кислотой с
получением
концентрированной кислоты
или олеума.Двухстадийная противоточная схема:
Газы с высоким содержанием воды – парциальная конденсация паров кислоты
Слайд 31
Стадия доочистки отходящих газов
Реальный уровень выбросов SO2 –
не ниже 300-500 ррм
Современные требования – до 50 ррм
Способы
доочистки:абсорбция SO2 раствором известняка
абсорбция аммиачной водой
Проблемы:
относительно высокая капитальная стоимость (до 25% от стоимости основной установки)
потребление реагентов и химикатов
образование побочных отходов
Слайд 33
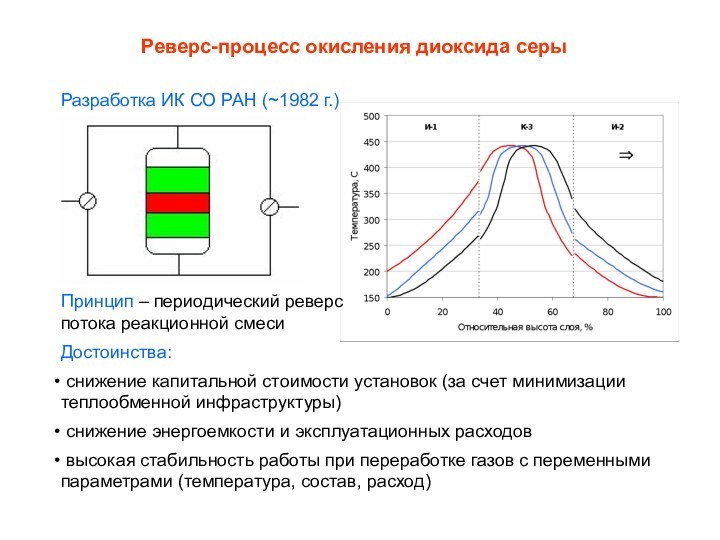
Реверс-процесс окисления диоксида серы
Разработка ИК СО РАН (~1982
г.)
Принцип – периодический реверс
потока реакционной смеси
Достоинства:
снижение капитальной
стоимости установок (за счет минимизации теплообменной инфраструктуры)снижение энергоемкости и эксплуатационных расходов
высокая стабильность работы при переработке газов с переменными параметрами (температура, состав, расход)





























