на поверхности частиц.
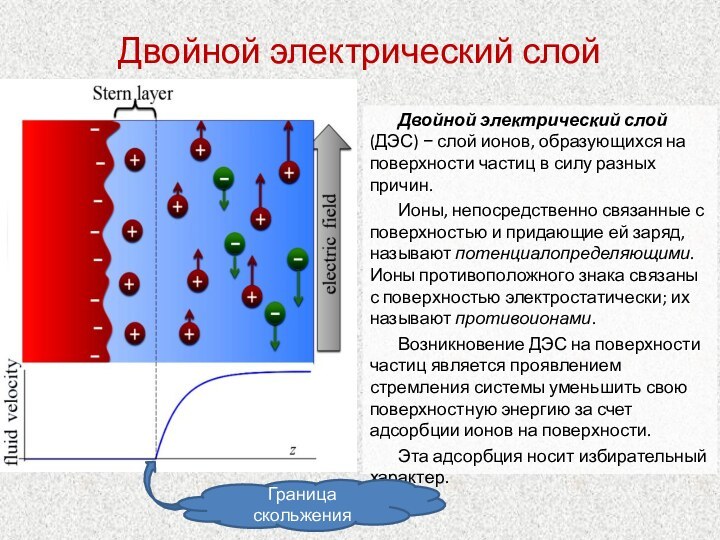
Строение двойного электрического слоя (ДЭС).
Модель ДЭС по
Гельгольцу-Перрену.Модель диффузной части ДЭС Гуи и Чепмена.
Внутренняя часть ДЭС. Модель Штерна.
Адсорбционный и электрокинетический потенциалы.
Влияние индифферентных и неиндифферентных электролитов на ДЭС.
Уравнение Гельмгольца – Смолуховского.
Электрокинетические явления: электрофорез, электроосмос, потенциалы
течения и седиментации.
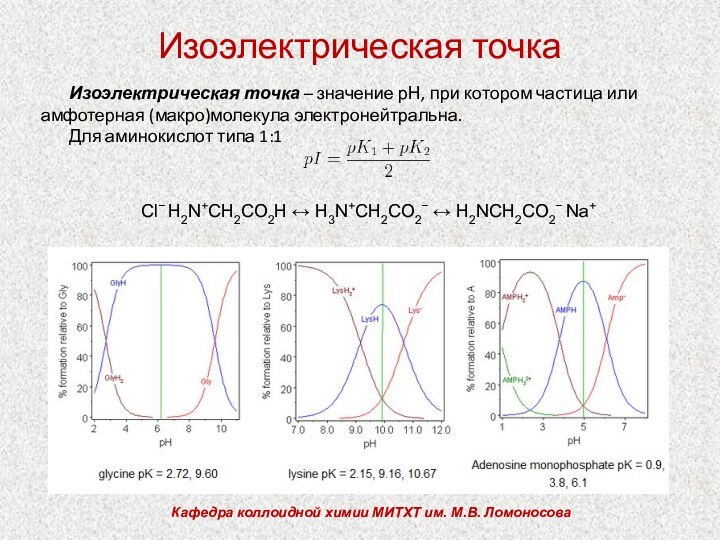
Изоэлектрическая точка материалов.
Кафедра коллоидной химии МИТХТ им. М.В. Ломоносова