Слайд 2
Биопсия — метод исследования, при котором проводится прижизненный
забор клеток или тканей (биоптата) из организма с диагностической
целью.
Показания к проведению биопсии:
1.в случае, если результатов других неинвазивных методов исследования недостаточно для подтверждения предварительного диагноза заболевания
2.определение характера и степени тяжести заболевания
3.определение объёма оперативного вмешательства
4.установление особенностей течения, тяжести поражения, прогноза
5.коррекция терапии
Биопсия является обязательным методом подтверждения диагноза при подозрении на наличие онкологических заболеваний.
Слайд 3
отказ пациента от письменного проинформированного соглашения или отказ
его в сотрудничестве со специалистом в проведении исследования
нарушения
системы свёртываемости крови
доступность равносильных методов неинвазивной диагностики
отсутствие позитивной терапевтической динамики
Противопоказания к проведению биопсии:
Слайд 4
Виды биопсии
Эксцизионная биопсия — в результате хирургического вмешательства
происходит изъятие всего исследуемого образования или органа.
Инцизионная биопсия —
в результате хирургического вмешательства происходит изъятие части образования или органа.
Пункционная биопсия — в результате прокола полой иглой исследуемого образования происходит забор фрагментов или столбика ткани.
Аспирационная биопсия — материал получают с помощью вакуум-экстракции из органа.
Прицельная биопсия — с помощью биопсийных щипцов
эксфолиативная цитодиагностика (эксфолиация - слущивание) - получение материала на цитологическое исследование методом слущивания клеточных элементов с подозрительных участков с помощью специальных щеточек, абразивных баллончиков, шпателей и других устройств;
Слайд 5
Правила хранения и транспортировки биологического материала
Патологогистологическому исследованию подлежат диагностические
биопсии, а также все органы и ткани, удаленные при
хирургических операциях.
Доставка объектов для исследования в патологоанатомическое отделение:
Объекты для исследования доставляются немедленно после операции и диагностической биопсии в фиксирующей жидкости (10% р-р формальдегида).
Крупные объекты могут быть доставлены в патологоанатомическое отделение сразу же после операции в незафиксированном виде, так же доставляют кусочки экспресс-биопсий (срочных интраопсрационных биопсий).
Направление на патологогистологическое исследование заполняют в двух экземплярах. Направление заполняет и подписывает лечащий врач.
Доставленный на исследование материал должен быть тщательно маркирован.
Материал для гистологического исследования хранить при tº +2, +8ºC— не более 3 суток.
Транспортировка: в термоконтейнерах с охлаждающими элементами.
Слайд 6
Рубрики Направления на патологогистологическое исследование
дата и часы направления
материала,
отделение, номер стационарного (амбулаторного) больного,
фамилия, имя и
отчество больного,
пол,
возраст;
биопсия — первичная, вторичная (при повторной биопсии указать номер и дату первичной).
дата и вид операции,
маркировка материала,
число объектов.
клинические данные (продолжительность заболевания, проведенное лечение, данные о предшествовавших исследованиях, их номер),
при наличии опухоли: точная локализация, темпы роста, размеры, консистенция, отношение к окружающим тканям, метастазы, наличие других опухолевых узлов, специальное лечение;
при исследовании лимфоузлов указать анализ крови;.
клинический диагноз
Слайд 7
Методы исследования биоптата
Гистологическое исследование –исследование определённого интересующего участка
ткани под микроскопом.
Этапы:
участки ткани обезвоживаются при помощи специфически
приготовленных растворов, ткани становятся жирорастворимыми
ткани перемещаются в заранее подготовленные формочки и пропитываются парафином, приобретая вид твёрдых кубиков
при помощи специального ножа с ультратонким лезвием, делаются небольшие срезы толщиной не более 3 микрометров
полученные срезы фиксируются на предметном стекле
срезы промываются этанолом
срезы окрашиваются различными видами красителей
изучение срезов под микроскопом
Слайд 8
Методы исследования биоптата. срочный гистологический анализ
Срочное гистологическое исследование
занимает не более 30 минут, в то время как
для проведения обычного гистологического анализа необходимо не менее трёх дней.
Разница данных методов заключается в том, что в случае срочного исследования препарат подвергается молниеносной заморозке в воде, избегая стадии обработки его парафином, а далее по описанной выше схеме.
Качество результата срочного исследования уступает качеству и достоверности обычного гистологического исследования, соответственно и точность заключения иногда ставится под сомнение.
Слайд 9
Методы исследования биоптата
Цитологическое исследование – представляет собой подробное
исследование клеток под микроскопом.
Данный метод применяется в тех
случаях, когда извлечение участка ткани невозможно или же нецелесообразно.
Такие исследования выполняются с целью исключения либо выявления на ранних стадиях предопухолевых состояний, то есть патологических процессов, на фоне которых, впоследствии, возможно развитие злокачественных новообразований.
Принцип метода заключается в заборе клеток с поверхности сомнительного образования.
Полученные клетки подвергаются обработке, из них готовится препарат, который далее окрашивается и изучается под микроскопом.
Слайд 10
Роль биопсии в прижизненной диагностике опухолей.
Получение объективных данных,
подтверждающих диагноз
Позволяет судить о динамике процесса
Характере течения болезни
Прогнозе
Целесообразности использования
того или иного метода терапии
Побочном действии лекарств
Возможность изучить изменения клеток и тканей при отсутствии клинических проявлений болезни
Слайд 11
ОПУХОЛЕВАЯ ПРОГРЕССИЯ
Опухолевая прогрессия — генетически закреплённое, наследуемое опухолевой
клеткой и необратимое изменение одного или нескольких свойств клетки
по мере её роста.
Как правило, опухолевая прогрессия идёт в направлении усиления малигнизации.
При опухолевой прогрессии создаются клоны клеток с самой различной комбинацией признаков (феномен клональной селекции бластомы). В связи с этим разные субклоны клеток одного новообразования могут весьма существенно отличаться друг от друга.
Слайд 12
Положения о прогрессии опухолей (L. Foulds, 1969)
Независимая прогрессия
множественных опухолей.
Прогрессия не зависит от роста опухоли.
Прогрессия может быть постепенной или прерывистой.
Прогрессия не всегда достигает конечной стадии на протяжении жизни организма.
Прогрессия следует одним из альтернативных путей развития.
Независимая прогрессия различных признаков опухоли.
Слайд 13
Значение опухолевой прогрессии.
Повышение изменчивости генотипа опухолевых клеток
Постоянное изменение
фенотипа опухолевых клеток
Возрастание степени приспособляемости клеток опухоли
Повышение резистентности клеток
опухоли
Слайд 14
Условия,определяющие свойства и скорость прогрессии
врожденные генетические или эпигенетические
нарушения, в результате мутаций, генетического полиморфизма;
неполноценное функционирование так называемых
«стражевых» и хромосомных сегрегаторов генов, которые несут ответственность за целостность генома;
воздействие на механизмы и мишени, которые определяют природу эпигеномного и эпигенетического кодов;
опухолевое микроокружение, формирующееся окружающими стромальными клетками, состоянием иммунной системы
Слайд 15
Морфологические факторы прогноза опухолевой прогрессии
Маркеры изменения ядра клетки
Маркеры
регуляции апоптоза
Факторы ангиогенеза, молекулы клеточных мембран
Факторы роста
Маркеры пролиферативной активности
Слайд 16
Маркеры изменения ядра клетки
Наряду с TNM‐стадиями важнейшим прогностическим
фактором опухолевой прогрессии является степень ядерной градации по Фурману
1 степень - характерны округлые ядра,около 10 мкм в диаметре, правильной формы, ядрышки не определяются.
2 степень характеризуется неправильными контурами ядер, диаметр их больше ‐ около 15 мкм, определяются ядрышки (при увеличении 400).
3 степень: умеренная или выраженная неравномерность контуров ядер, их диаметр еще больше ‐ около 20 мкм, определяются крупные ядрышки (при увеличении 100).
4 степень: ядра примерно такие же, как при 3‐й степени, но часто мультилобулярные, неправильной формы, с крупными зернами или глыбками хроматина.
Слайд 17
2. Маркеры регуляции апоптоза.
Важнейшей точкой приложения деятельности онкогенов
и опухолевых супрессоров является апоптоз (программированная гибель клетки).
Одним из
наиболее изученных генов супрессоров является ген р53 . Это белок, регулирующий клеточный цикл, отвечающий за репарацию ДНК, за поддержание целостности генома. Активация гена р53 дает мощный сигнал к индукции апоптоза. Чаще он встречается в опухолях с предпочтительно унифокальным ростом.
Важным фактором агрессивности опухоли, ее метастатического потенциала и негативного прогноза является протоонкоген c‐erb‐2 (HER‐2neu), поддерживающий пролиферативную активность опухолевых клеток. Он также способствует толерантности опухолевых клеток к апоптозу. Была отмечена обратно пропорциональная зависимость между уровнем гена со степенью дифференцировки опухоли.
Слайд 18
3. Факторы ангиогенеза.
Известно, что для развития опухоли важным
является процесс ангиогенеза.
Внимание ряда исследователей было привлечено к
эндотелиальному фактору роста (VEGF). Исследования, посвященные измерению факторов ангиогенеза у больных раком и у группы здоровых людей показали, что уровень сывороточного значения VEGF был значительно повышен по сравнению со здоровыми людьми.
Также было отмечено, что уровень VEGF выше при распространенном раке, чем при локализованном.
Слайд 19
4. Факторы роста опухоли.
Существуют системы регуляции роста опухолевой
ткани. Эти системы обнаружены во всех опухолях независимо от
гистологического типа.
В настоящее время наиболее изученным фактором является эпидермальный фактор роста (EGFR) .
Повышение этого фактора указывает на то, что эти системы приобретают защиту от управления и контроля опухолевым ростом.
Уровень повышения маркера прямо пропорционален стадии опухоли и является показателем агрессивного роста опухоли и, соответственно, неблагоприятным прогностическим фактором.
Слайд 20
5. Маркеры пролиферативной активности.
Высокие уровни экспрессии маркеров пролиферативной
активности (PCNA, Ki‐67) негативно влияют на выживаемость больных раком.
Антиген Ki‐67 участвует практически во всех фазах митотического цикла и отражает степень пролиферации.
Уровень этого антигена, по мнению ряда авторов, напрямую коррелирует со степенью ядерной градации по Фурману, а также имеет прямую связь со стадией опухоли, ее размерами и наличием метастазов.
Индекс Ki‐67 прогнозирует выживаемость пациентов и коррелирует с плохим прогнозом и высоким риском метастазирования.
Слайд 21
Иммуногистохимическое исследование
Иммуногистохимическое исследование – это разновидность морфологического
метода диагностики. Метод заключается в определении конкретного вещества в
тканях. Для этого используются специальные антитела, способные связываться с антигеном – искомым веществом. Образовавшееся соединение окрашивается, что позволяет увидеть его под микроскопом.
Иммуногистохимическое исследование проводится при опухолях неопределенного происхождения (например, в ситуациях, когда опухоль состоит сплошь из недифференцированных клеток), а также для поиска малого количества злокачественных клеток (например, определение метастазов в лимфоузлах).
Слайд 22
Молекуляно-генетическое исследование
Молекулярно-генетическое исследование злокачественных новообразований основано на выявлении
нарушений на молекулярном уровне. Суть исследования – в выявлении
специфичных молекулярных маркеров.
Молекулярно-генетическое исследование позволяет:
выявить группы риска по развитию злокачественных опухолей;
подобрать оптимальное лечение - например, выбрать химиопрепарат, к которому данная опухоль наиболее чувствительна;
достаточно точно прогнозировать рост опухоли.
В настоящее время в клинической онкологии утвержден к применению молекулярно-генетический тест на мутации EGFR (HER) (эпидермальный фактор роста).
Слайд 23
требования предъявляемы к материалу
Материалом для исследования являются парафиновые
блоки, содержащие опухолевую ткань.
В качестве источника биологического материала могут
использоваться как хирургически удалённые участки опухоли, так и материал, полученный при биопсии
Главный критерий пригодности биологического материала – большое содержание опухолевых клеток; предпочтение следует отдавать тем препаратам, в которых содержание опухолевых клеток составляет 50-80% и более.
Время забора биологического материала не имеет значения: материал, взятый при биопсии на этапе диагностики, операционный материал, а также ткань, полученная из рецидива опухоли, полностью пригодны для анализа. Абсолютно допустимо запрашивать из патоморфологического архива препараты, изготовленные несколько лет назад.
В качестве источника опухолевой ткани может использоваться как первичная опухоль, так и метастатические очаги.
Для анализа на наличие мутаций достаточно предоставлять 1 образец опухолевого материала.
Слайд 24
ТАРГЕТНАЯ терапия
таргетная терапия – это терапия направленного действия, то есть, воздействия на
опухолевые «мишени» (белки, рецепторы, гены), имеющие важнейшее значение для
развития новообразования.
Благодаря направленному действию целевые препараты поражают в основном опухолевые клетки и практически не повреждают здоровые органы и ткани, на которых мишени отсутствуют или их повреждение не является критичным.
Слайд 25
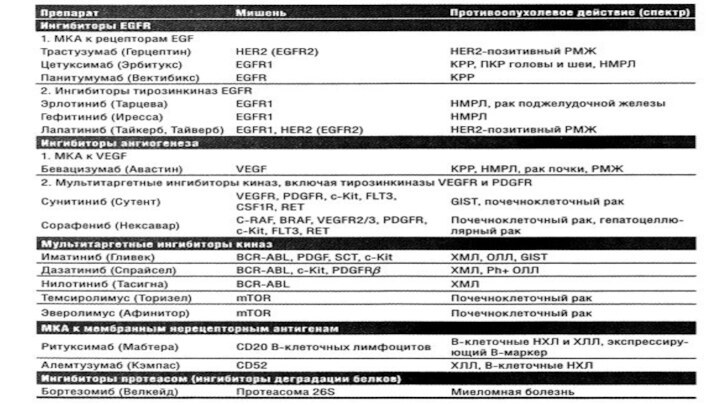
Группы таргетных препаратов
Моноклональные антитела к факторам роста и
их рецептора- Трастузумаб (Герцептин), Цетуксимаб (Эрбитукс), Бевацизумаб (Авастин)
Нерецепторные моноклональные
антитела – Ритуксимаб (Мабтера), Алемтузумаб (Кэмпас)
Малые синтетические молекулы – ингибиторы протеинкиназ – Эрлотиниб (Тарцева), Гефитиниб (Иресса), Иматиниба мезилат (Гливек)
Короткие синтетические отрезки ДНК, связывающиеся с мРНК – антисмысловые нуклеотиды – Облимерсен (Генасенс)
Природные соединения – Неовастат, Флавоперидол
Вирусы – AdP53, ONIX - 015
Слайд 26
По принципу действия таргетные препараты делятся на 2
группы:
Нацеленные на пути передачи сигнала в опухолевой клетке –
блокировка передачи митогенных и антиапоптических сигналов.
Базируются на том, что в норме лиганды (молекулы гормонов,цитокинов,факторов роста) взаимодействуют с рецепторами клетки,а те передают сигнал через цепь молекул к ядру, что определяет способность клетки к пролиферации, ангиогенезу, апоптозу, дифференцировке.
Мишень препаратов, блокирующих передачу митогенных и антиапоптических сигналов - рецепторы эпидермального фактора роста EGFR. Семейство трансмембранных EGFR состоит из 4 типов: EGFR1 (HER1,ErbB1), EGFR2 (HER2,ErbB2), EGFR3 (HER3,ErbB3), EGFR4 (HER4,ErbB4).
Слайд 27
По принципу действия таргетные препараты делятся на 2
группы:
2. Нацеленные на уникальный фенотип опухолевой клетки - препараты
распознающие и блокирующие специфические нерецепторные антигены на поверхности клеток и оказывающие прямое цитотоксическое действие на эти клетки.
К таким препаратам относятся Ритуксимаб (антитело к поверхностному антигену CD20 В-клеток), Алемтузумаб (гликопротеид CD25 Т-,В-клеток).