- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
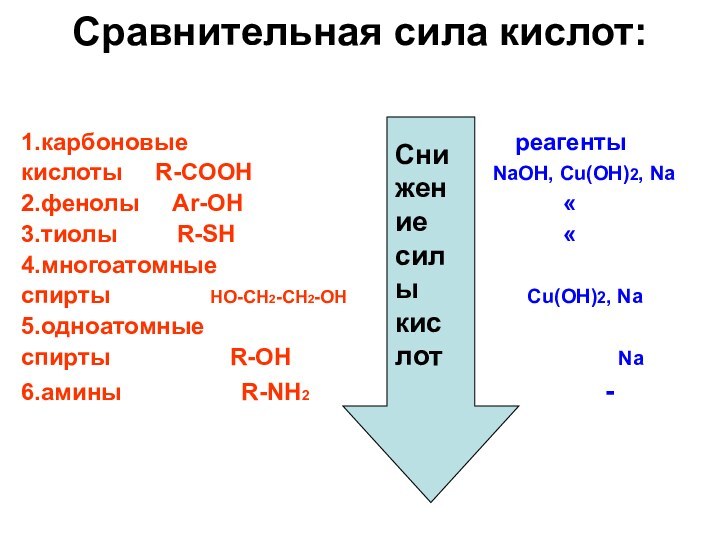
Презентация на тему Сравнительная сила кислот:
Содержание
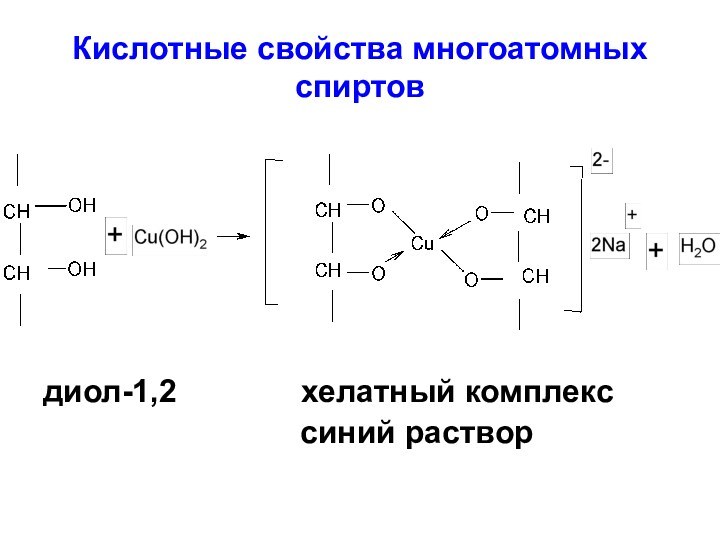
- 2. Кислотные свойства многоатомных спиртовдиол-1,2
- 3. Основания Брёнстеда - акцепторы протона В:- +
- 4. Сравнительная сила основных центров:
- 5. Основные свойства аминов
- 6. ОКИСЛИТЕЛЬНО- ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
- 8. Стандартный восстановительный потенциал 0
- 9. Виды биохимических окислительно-восстановительных процессов:ФЕРМЕНТАТИВНЫЕСВОБОДНОРАДИКАЛЬНЫЕ
- 10. 1А. дегидрогеназное окисление -
- 12. Окислительно-восстановительные реакции основных классов органических соединений
- 14. 1.Алканы Окислитель кофермент ФАД
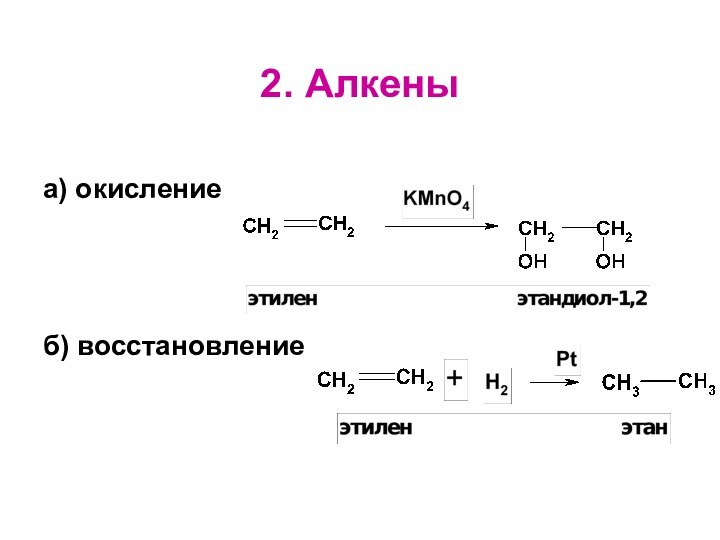
- 15. 2. Алкены а) окислениеб) восстановление
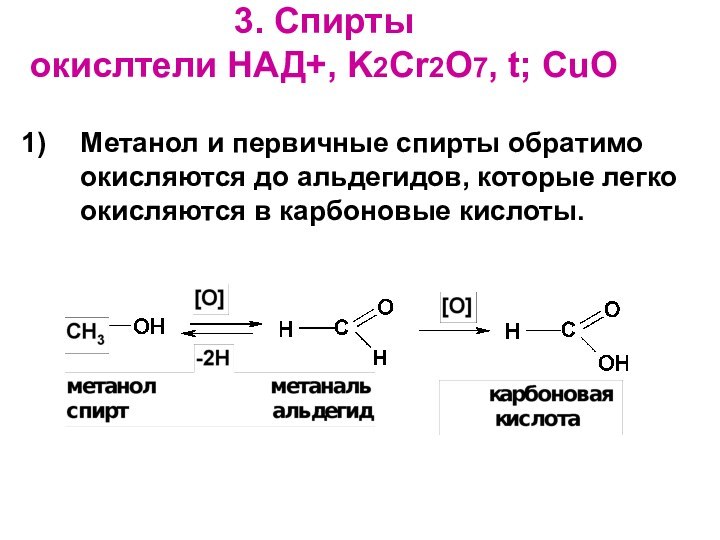
- 16. 3. Спирты окислтели НАД+, K2Cr2O7, t;
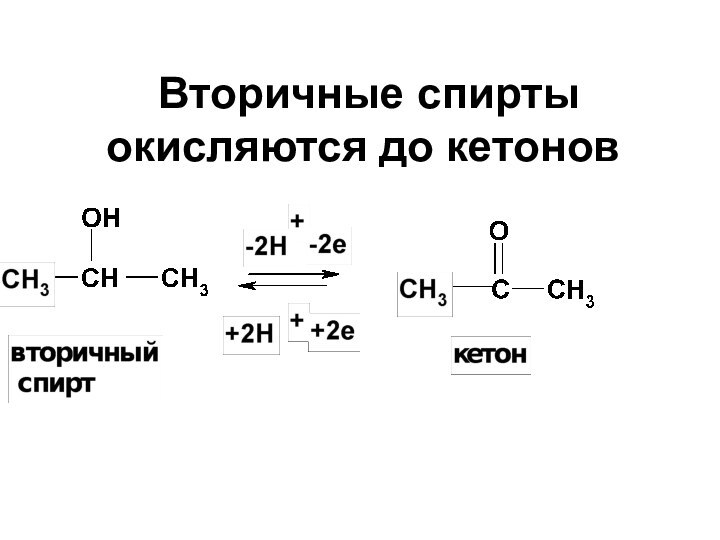
- 17. Вторичные спирты окисляются до кетонов
- 18. Третичные спирты устойчивы к окислению
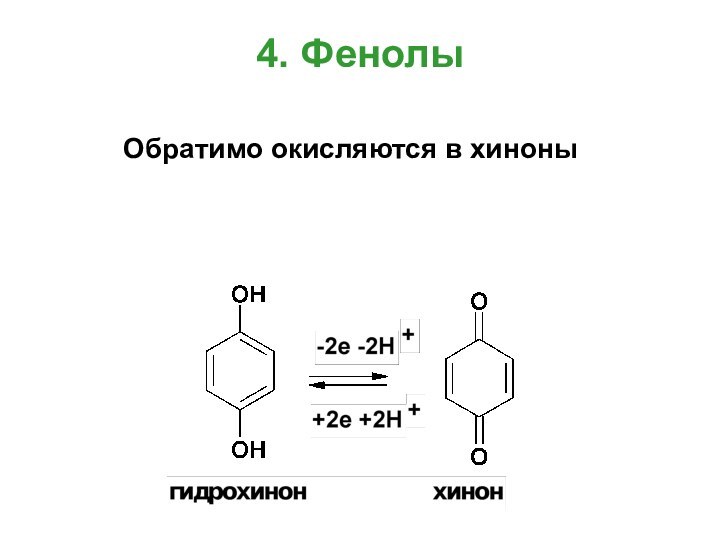
- 19. 4. Фенолы Обратимо окисляются в хиноны
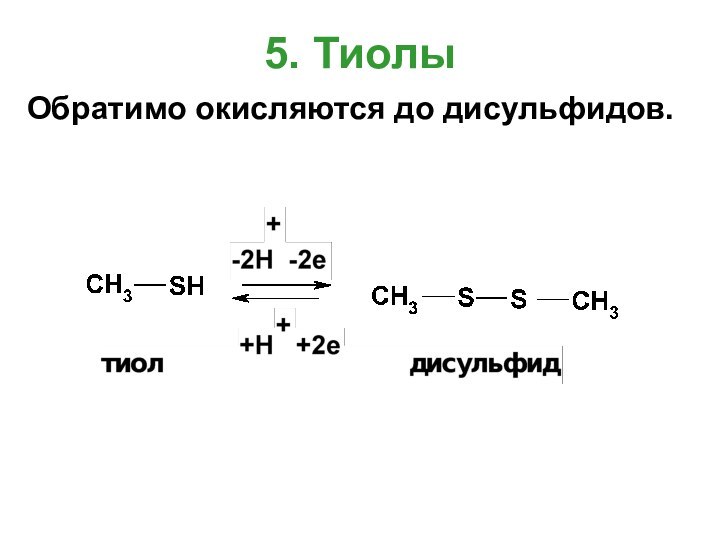
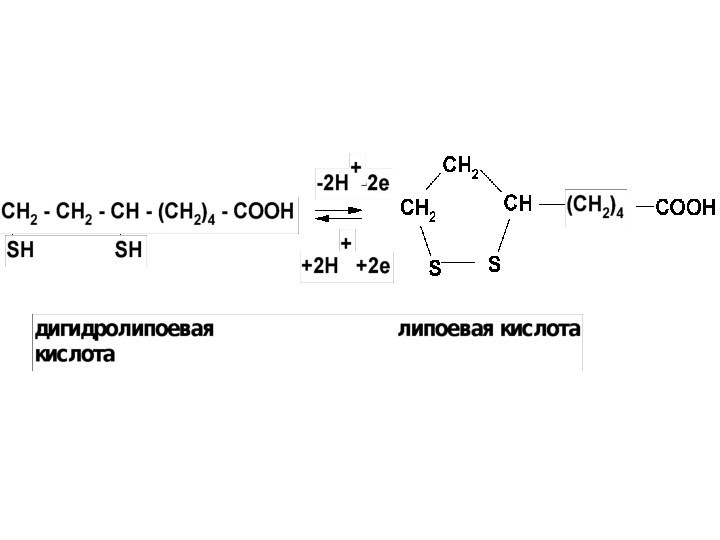
- 20. 5. ТиолыОбратимо окисляются до дисульфидов.
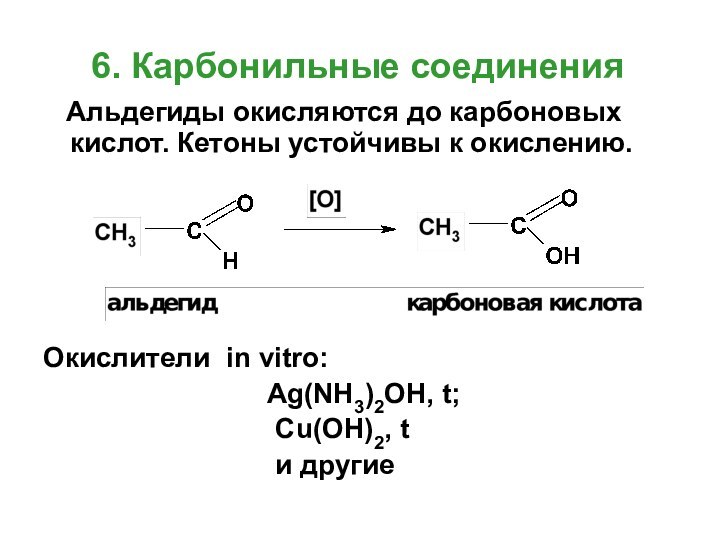
- 22. 6. Карбонильные соединения Альдегиды окисляются
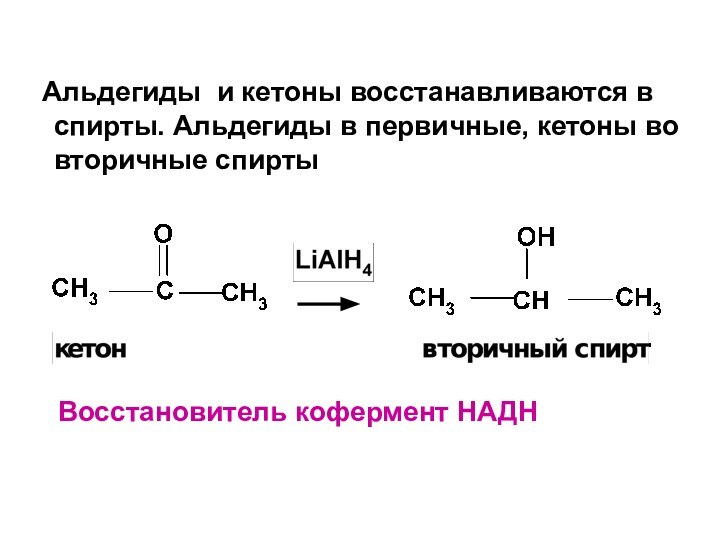
- 23. Альдегиды и кетоны восстанавливаются в спирты.
- 24. II. Характерные реакции органических соединений
- 25. Основные понятияСубстрат – вещество, у
- 26. Образование реагентов А. радикалыРадикал (свободный радикал) R
- 27. Б. нуклеофилы и электрофилы Нуклеофил –реагент
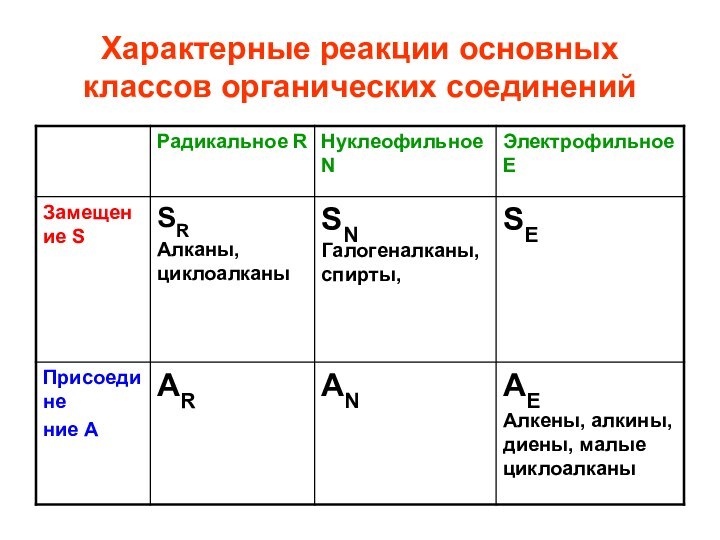
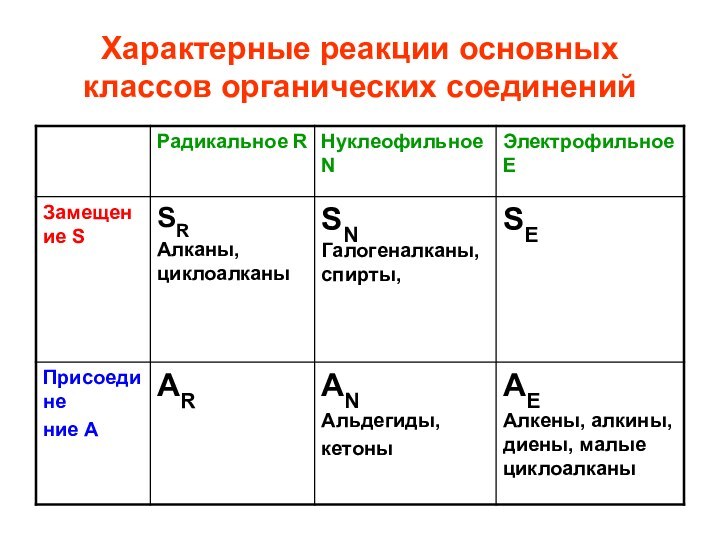
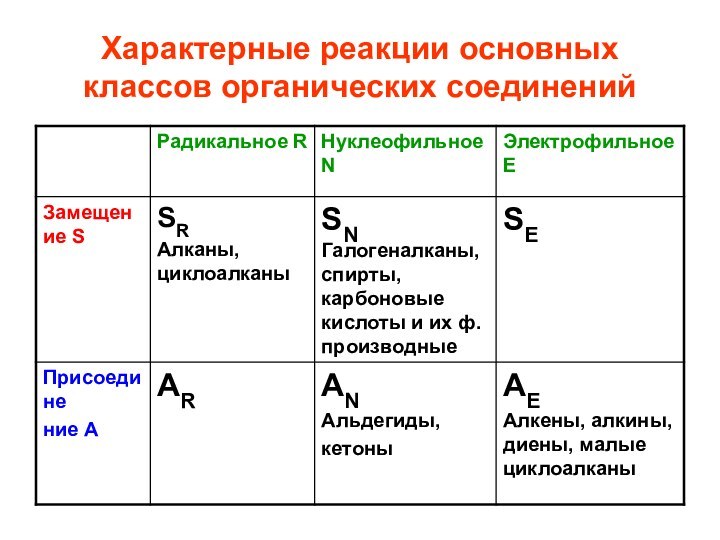
- 28. Типы реакций: 1. замещение Sхарактерны для насыщенных,
- 29. 2. присоединение А характерны для ненасыщенных соединений, содержащих -связи и малых циклов (циклопропан, циклобутан)
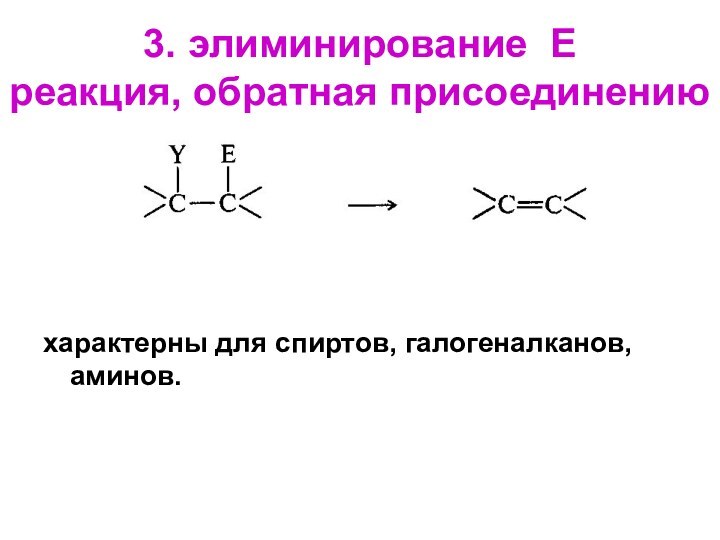
- 30. 3. элиминирование Е реакция, обратная присоединениюхарактерны для спиртов, галогеналканов, аминов.
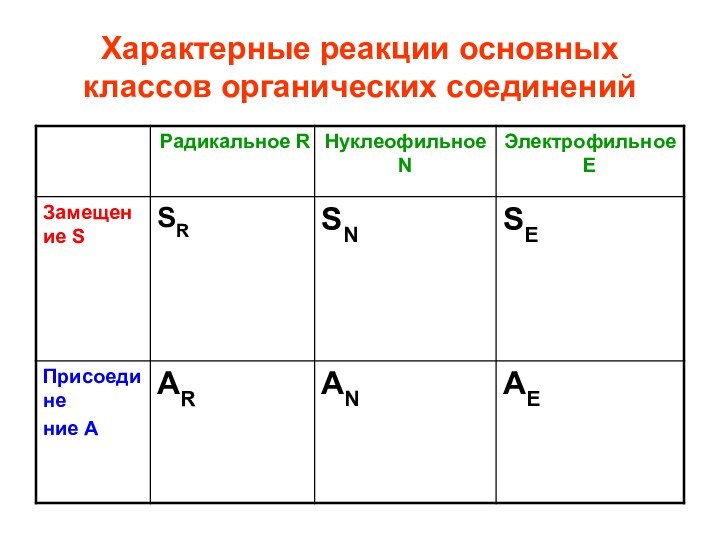
- 31. Характерные реакции основных классов органических соединений
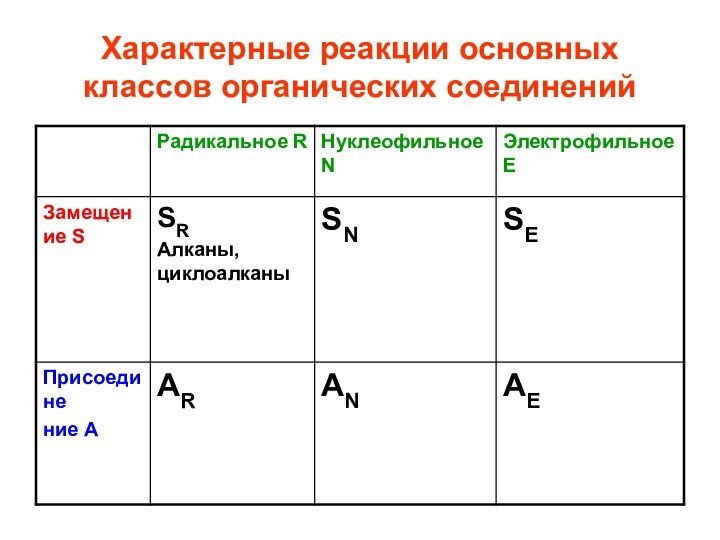
- 32. Характерные реакции основных классов органических соединений
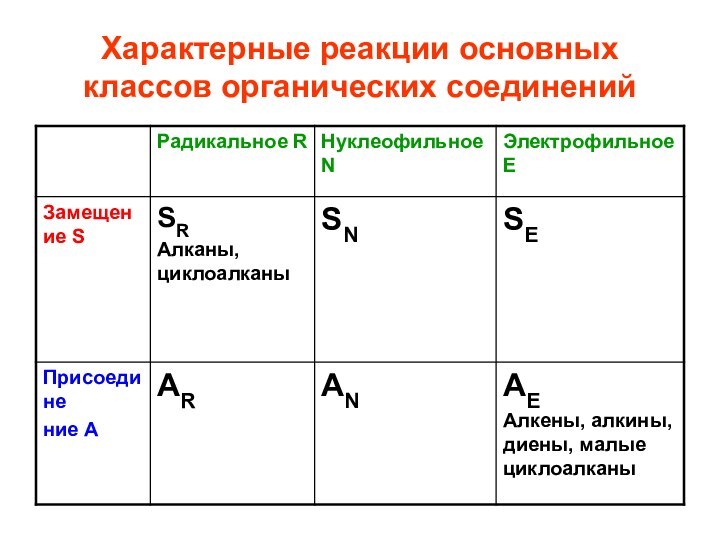
- 33. Характерные реакции основных классов органических соединений
- 34. Характерные реакции основных классов органических соединений
- 35. Характерные реакции основных классов органических соединений
- 36. Характерные реакции основных классов органических соединений
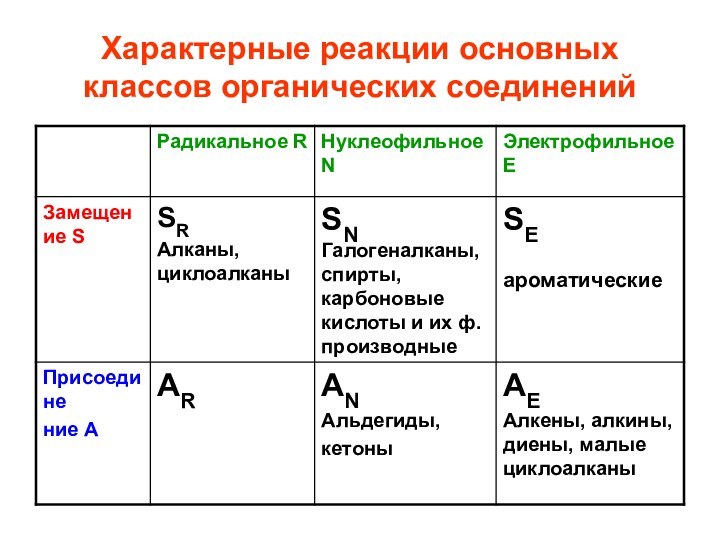
- 37. Характерные реакции основных классов органических соединений
- 38. Электронодоноры активизируют субстрат в реакциях SE , AEЭлектроноакцепторы активизируют субстрат в реакциях SN , AN.
- 39. Алканы и циклоалканы SR, радикальное замещение. Цепной
- 40. Алкены АЕ , электрофильное присоединение (стр.123-135 Тюкавкина) Гидрирование Галогенирование Гидрогалогенирование Гидратация
- 41. правило МарковниковаВ несимметричных алкенах водород присоединяется к
- 42. Ароматические соединения SE, электрофильное замещение (стр.135-144,
- 43. Ориентирующее действие заместителей в бензольном кольцеЗаместители (ориентанты)
- 44. Пример: галогенирование фенола идет очень активно в
- 45. Спирты
- 46. Реакции нуклеофильного замещения SN у насыщенного
- 47. Характерные химические реакции спиртов Нуклеофильное замещение SN.
- 48. 2. Внутримолекулярная дегидратация, Е правило Зайцева: водород отщепляется от менее гидрогенизированного атома углерода
- 49. Карбонильные соединения: альдегиды и кетоныАльдегидыМетаналь илиформальдегид
- 50. Реакция нуклеофильного присоединения, AN
- 51. Примеры реакций АNГидратацияР-ция с синильной кислотой
- 52. 3. Реакция со спиртами. Образование полуацеталей (полукеталей) и ацеталей (кеталей)
- 53. 4. Альдольная конденсация В результате углеродный скелет удлиняется на два атома углерода
- 54. Дисмутация альдегидов Альдегиды, у которых отсутствует
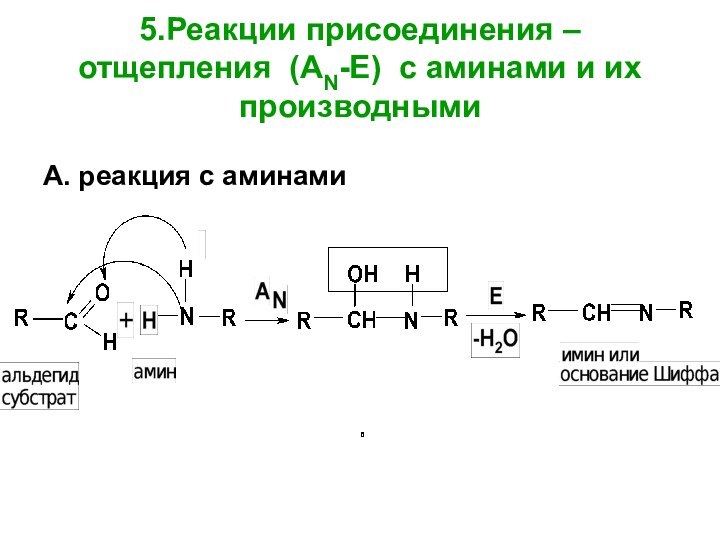
- 55. 5.Реакции присоединения – отщепления (AN-E) с аминами и их производнымиА. реакция с аминами
- 56. Б. С гидроксиламином NH2 – OH альдегиды
- 57. Иодоформная проба
- 58. Карбоновые кислоты и их функциональные производные, SN
- 59. дикарбоновые
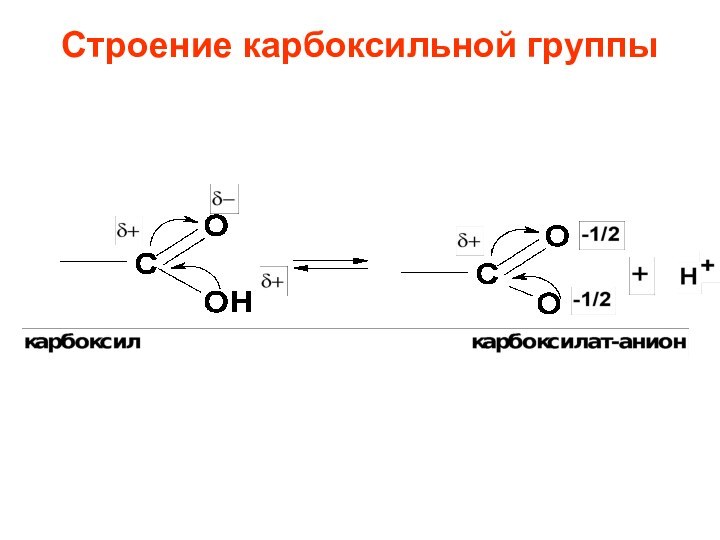
- 60. Строение карбоксильной группы
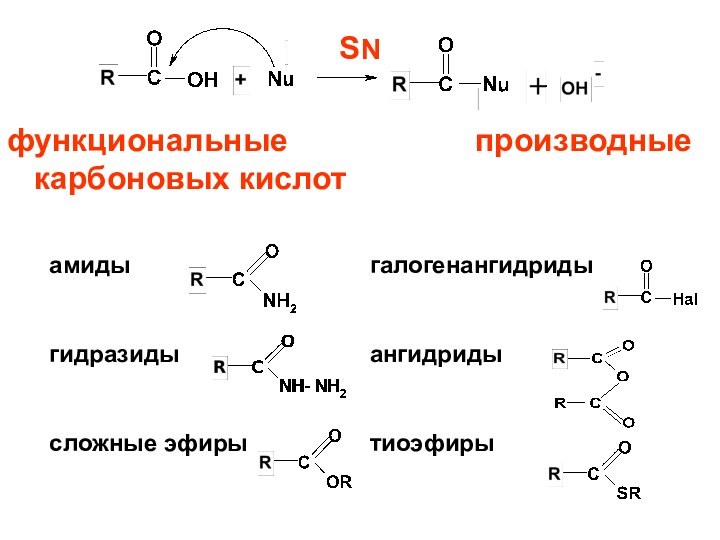
- 61. SN функциональные производные карбоновых кислот
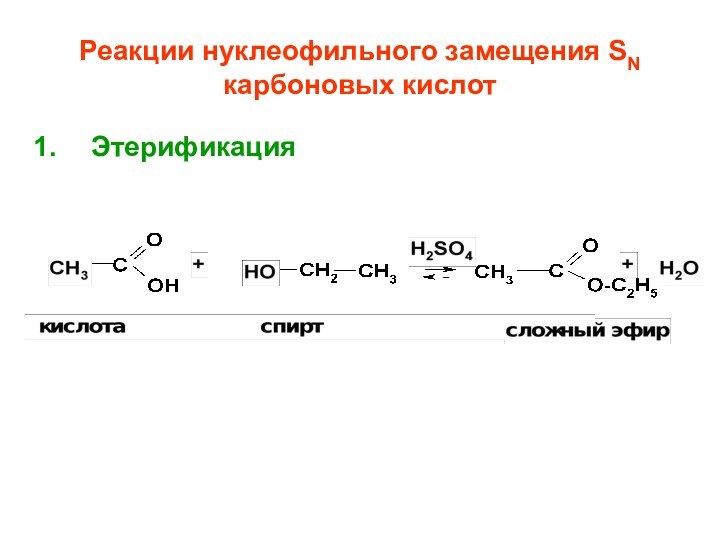
- 62. Реакции нуклеофильного замещения SN карбоновых кислотЭтерификация
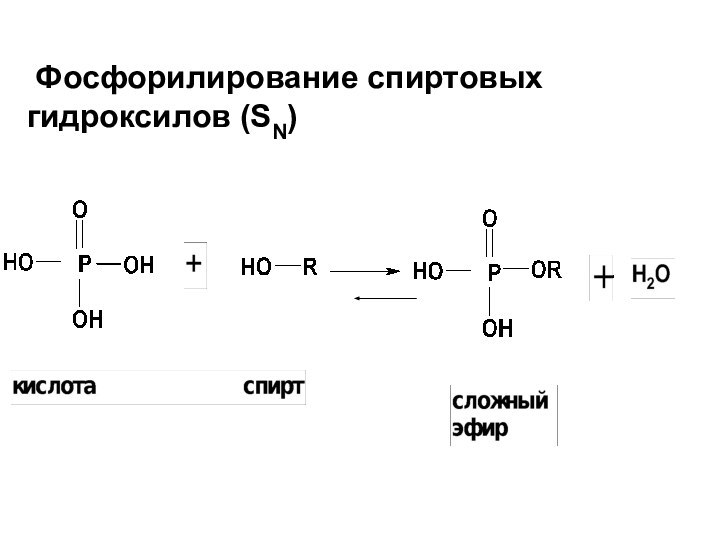
- 63. Фосфорилирование спиртовых гидроксилов (SN)
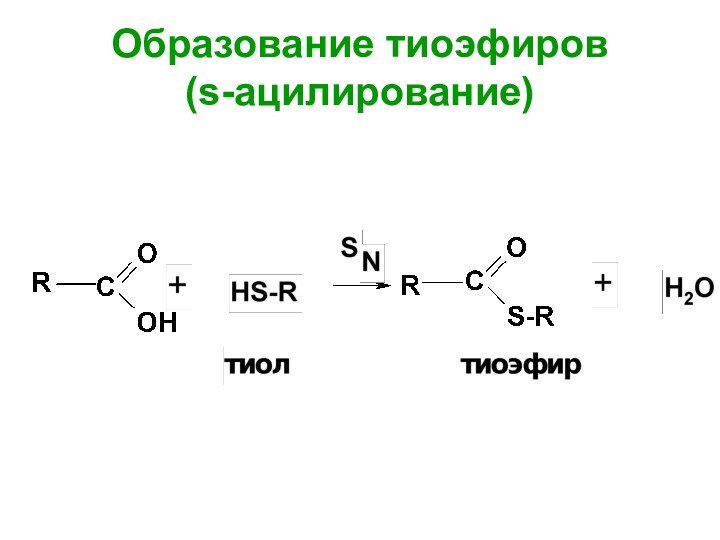
- 64. Образование тиоэфиров (s-ацилирование)
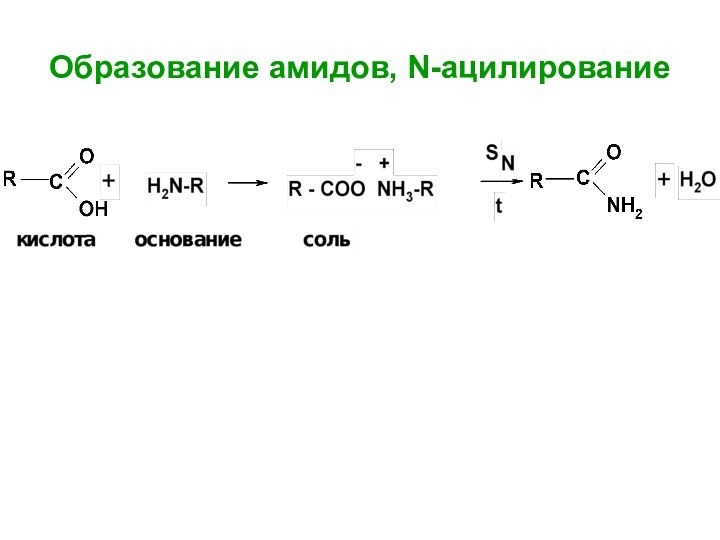
- 65. Образование амидов, N-ацилирование
- 66. 2. Реакции SN функциональных производных. Гидролиз сложных эфиров а) кислый катализ, гидролиз обратим
- 67. в) щелочной гидролиз (омыление) необратим
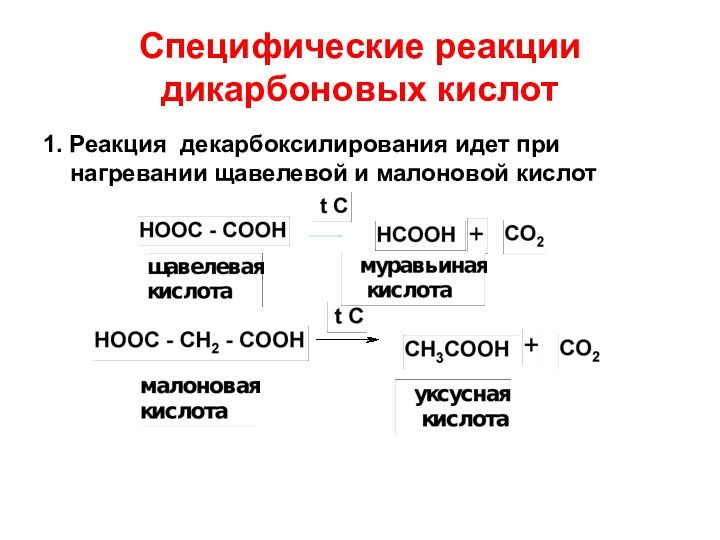
- 68. Специфические реакции дикарбоновых кислот1. Реакция декарбоксилирования идет при нагревании щавелевой и малоновой кислот
- 69. Скачать презентацию
- 70. Похожие презентации
Кислотные свойства многоатомных спиртовдиол-1,2 хелатный комплекс синий раствор

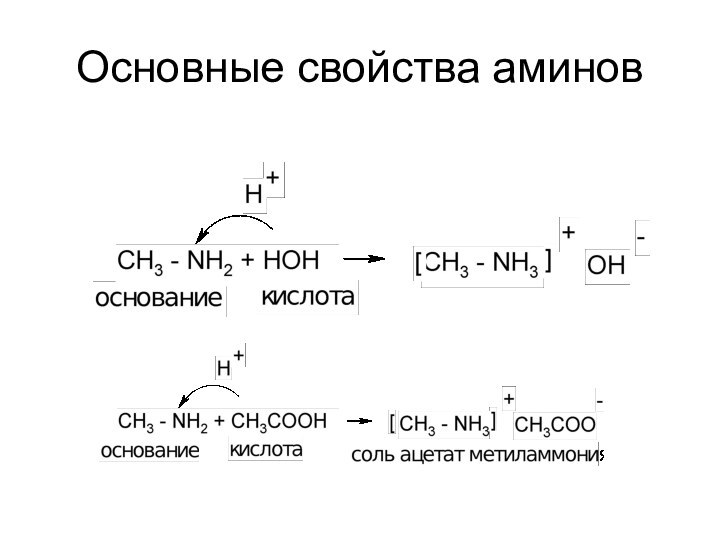


















Слайд 3 Основания Брёнстеда - акцепторы протона В:- + Н+
= В – Н
основание сопряженная кислота анионы более сильные основания, чем молекулы
Слайд 4
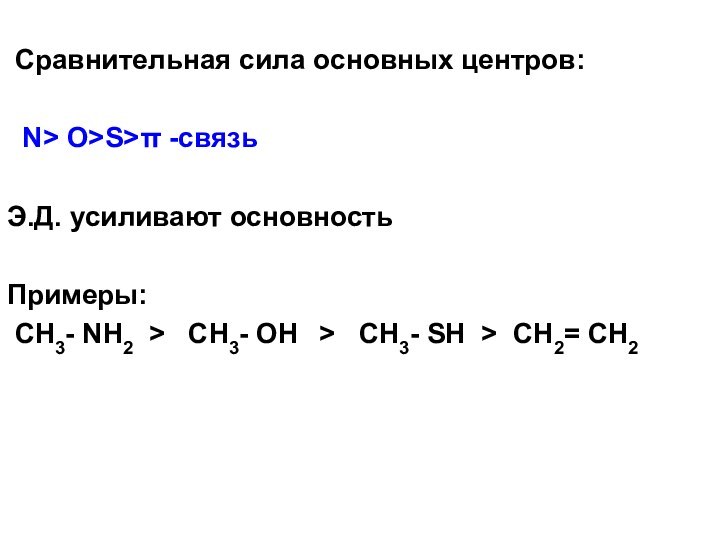
Сравнительная сила основных центров:
N OS -связь
Э.Д. усиливают основность
Примеры:
CH3- NH2 CH3- OH CH3- SH CH2= CH2
Слайд 7
Окислительно-восстановительные реакции (ОВР), сопровождаются переносом электронов от одной
частицы к другой и изменением степени окисления.
Слайд 8
Стандартный восстановительный потенциал 0
2Н+/Н2
0 = 0ВНормальный восстановительный потенциал 0
2Н+/Н2 0 = -0,42В
Слайд 9
Виды биохимических окислительно-восстановительных процессов:
ФЕРМЕНТАТИВНЫЕ
СВОБОДНОРАДИКАЛЬНЫЕ
Слайд 10
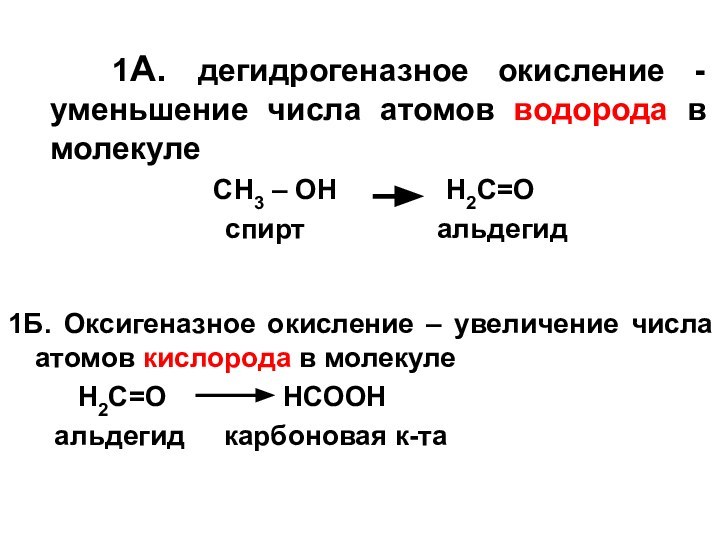
1А. дегидрогеназное окисление - уменьшение числа
атомов водорода в молекуле
СН3 – ОН Н2С=Оспирт альдегид
1Б. Оксигеназное окисление – увеличение числа атомов кислорода в молекуле
Н2С=О НСООН
альдегид карбоновая к-та
Слайд 16
3. Спирты
окислтели НАД+, K2Cr2O7, t; CuO
Метанол и
первичные спирты обратимо окисляются до альдегидов, которые легко окисляются
в карбоновые кислоты.
Слайд 22
6. Карбонильные соединения
Альдегиды окисляются до карбоновых
кислот. Кетоны устойчивы к окислению.
Окислители in vitro:
Ag(NH3)2OH, t;Cu(OH)2, t
и другие
Слайд 23 Альдегиды и кетоны восстанавливаются в спирты. Альдегиды
в первичные, кетоны во вторичные спирты
Восстановитель кофермент
НАДН
Слайд 25
Основные понятия
Субстрат – вещество, у которого
происходит разрыв связи у атома углерода. Определяет
тип реакцииРеагент – вещество (частица), атакующая субстрат (радикал, электрофил, нуклеофил). Определяет механизм реакции.
Слайд 26
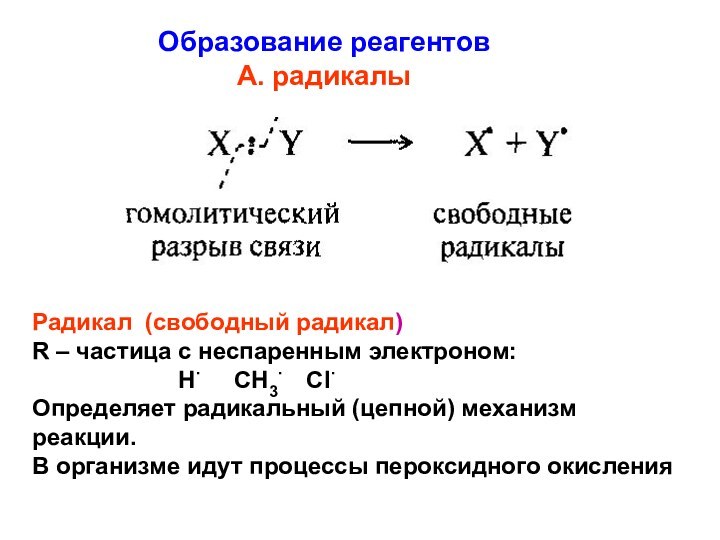
Образование реагентов
А. радикалы
Радикал (свободный радикал)
R – частица
с неспаренным электроном:
Н СН3 СlОпределяет радикальный (цепной) механизм реакции.
В организме идут процессы пероксидного окисления
Слайд 27
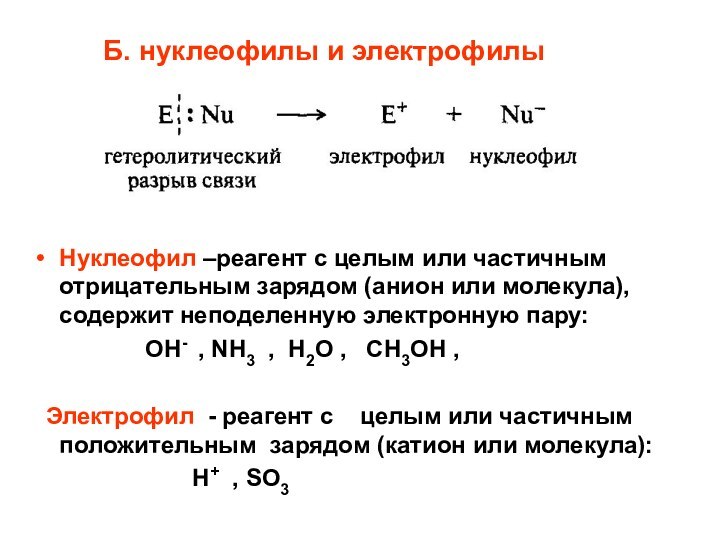
Б. нуклеофилы и электрофилы
Нуклеофил –реагент с целым
или частичным отрицательным зарядом (анион или молекула), содержит неподеленную
электронную пару:ОН- , NH3 , H2O , CH3OH ,
Электрофил - реагент с целым или частичным положительным зарядом (катион или молекула):
Н+ , SO3
Слайд 28
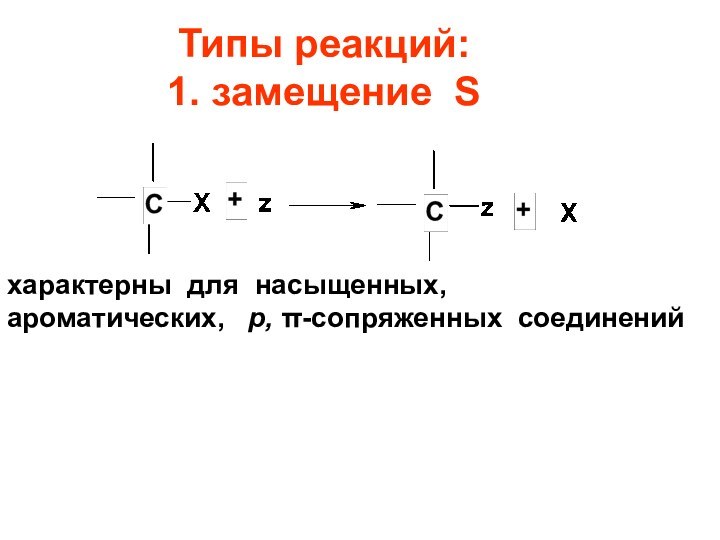
Типы реакций:
1. замещение S
характерны для насыщенных,
ароматических, р, -сопряженных соединений
Слайд 29
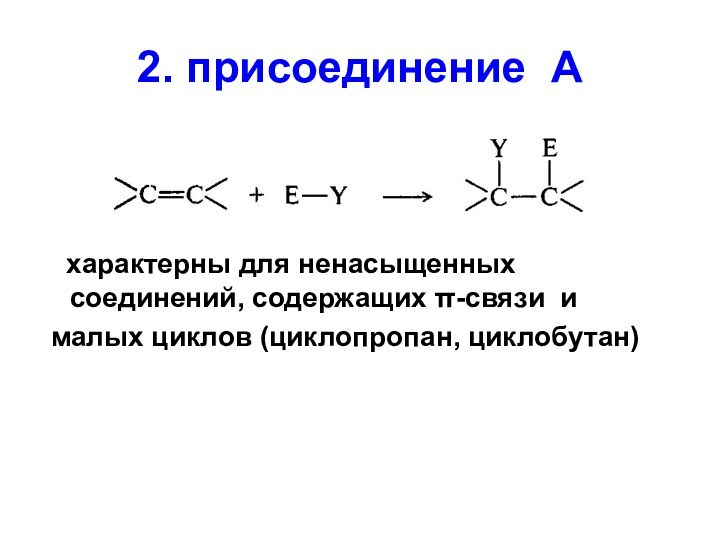
2. присоединение А
характерны для ненасыщенных соединений,
содержащих -связи и
малых циклов (циклопропан, циклобутан)
Слайд 30
3. элиминирование Е
реакция, обратная присоединению
характерны для спиртов,
галогеналканов, аминов.
Слайд 38
Электронодоноры активизируют субстрат в реакциях SE , AE
Электроноакцепторы
активизируют субстрат в реакциях SN , AN.
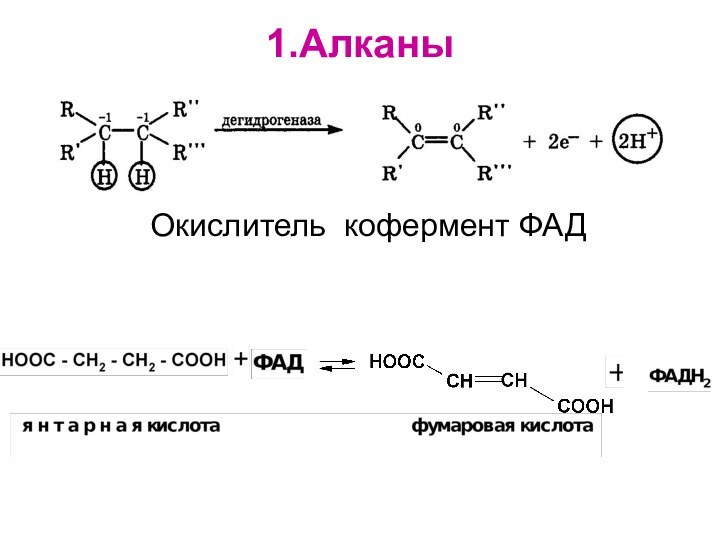
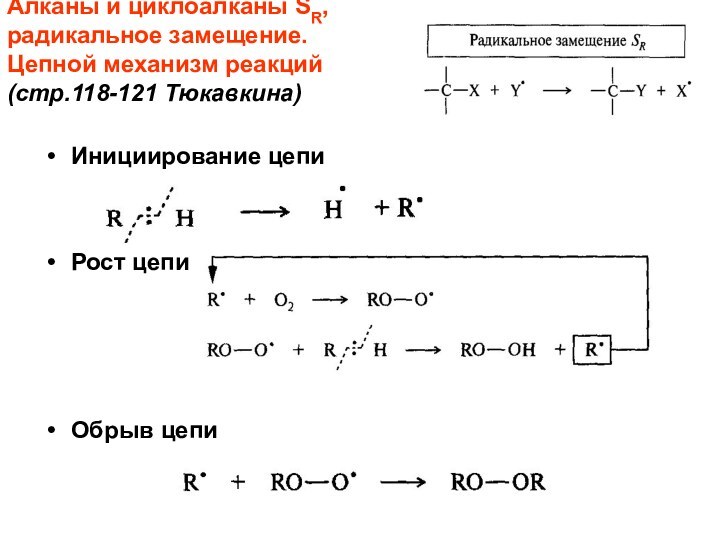
Слайд 39 Алканы и циклоалканы SR, радикальное замещение. Цепной механизм реакций (стр.118-121
Тюкавкина)
Инициирование цепи
Рост цепи
Обрыв цепи
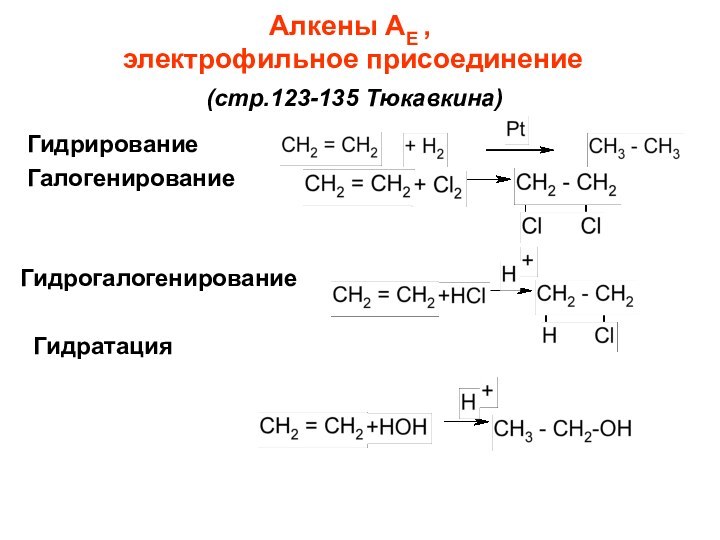
Слайд 40
Алкены АЕ ,
электрофильное присоединение
(стр.123-135 Тюкавкина)
Гидрирование
Галогенирование
Гидрогалогенирование
Гидратация
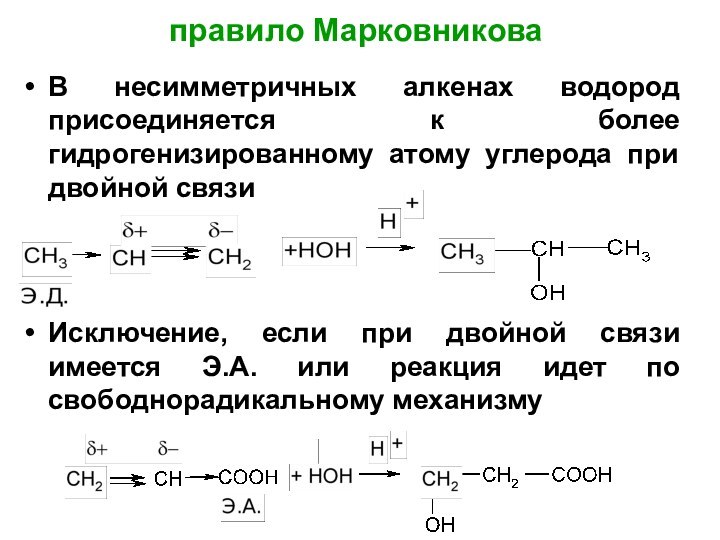
Слайд 41
правило Марковникова
В несимметричных алкенах водород присоединяется к более
гидрогенизированному атому углерода при двойной связи
Исключение, если при двойной
связи имеется Э.А. или реакция идет по свободнорадикальному механизму
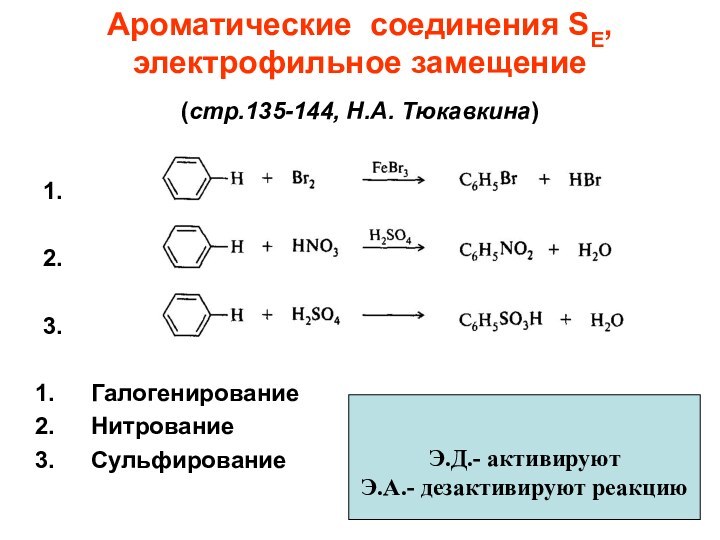
Слайд 42
Ароматические соединения SE,
электрофильное замещение
(стр.135-144, Н.А. Тюкавкина)
1.
2.
3.
Галогенирование
Нитрование
Сульфирование
Э.Д.- активируют
Э.А.- дезактивируют реакцию
Слайд 43
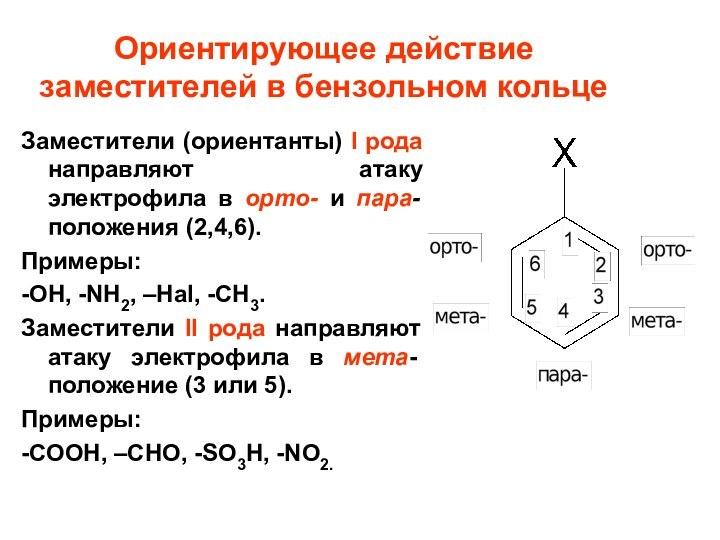
Ориентирующее действие заместителей в бензольном кольце
Заместители (ориентанты) I
рода направляют атаку электрофила в орто- и пара- положения
(2,4,6).Примеры:
-OH, -NH2, –Hal, -CH3.
Заместители II рода направляют атаку электрофила в мета- положение (3 или 5).
Примеры:
-COOH, –CHO, -SO3H, -NO2.
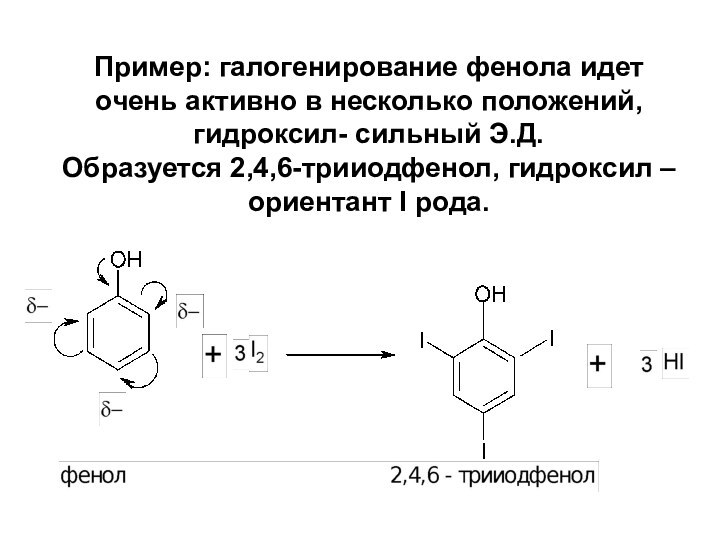
Слайд 44 Пример: галогенирование фенола идет очень активно в несколько
положений, гидроксил- сильный Э.Д. Образуется 2,4,6-трииодфенол, гидроксил – ориентант
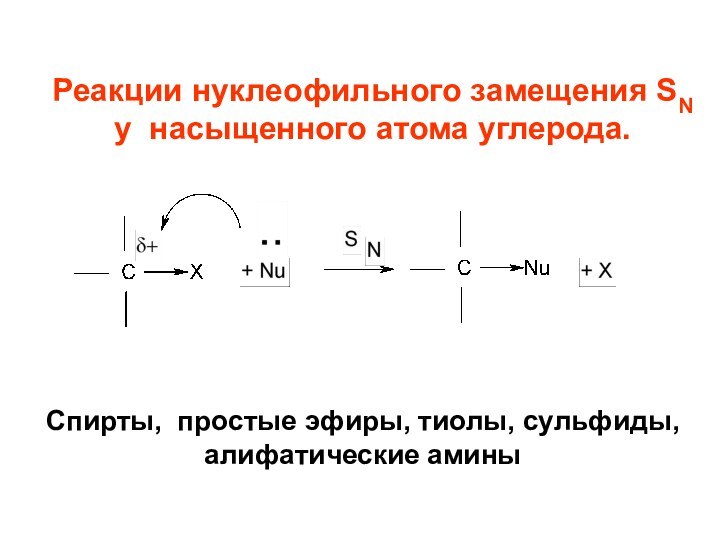
I рода.Слайд 46 Реакции нуклеофильного замещения SN у насыщенного атома углерода.
Спирты, простые эфиры, тиолы, сульфиды, алифатические амины
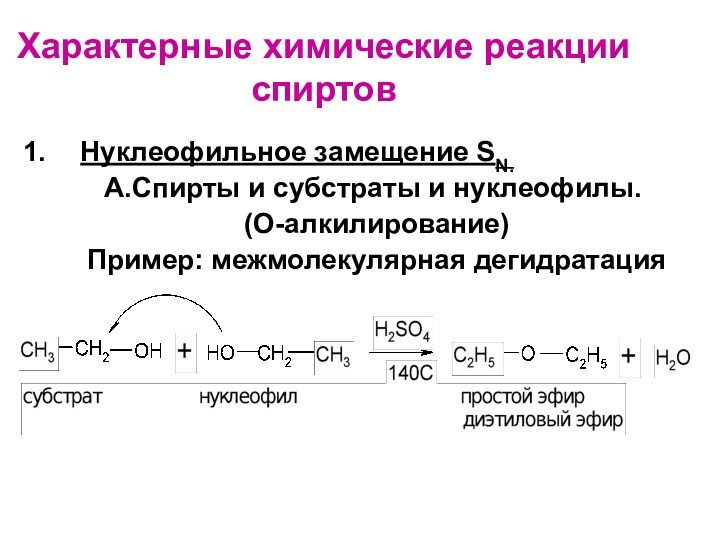
Слайд 47
Характерные химические реакции спиртов
Нуклеофильное замещение SN.
А.Спирты
и субстраты и нуклеофилы.
(О-алкилирование)
Пример: межмолекулярная дегидратация
Слайд 48
2. Внутримолекулярная дегидратация, Е
правило Зайцева: водород отщепляется
от менее гидрогенизированного
атома углерода
Слайд 49
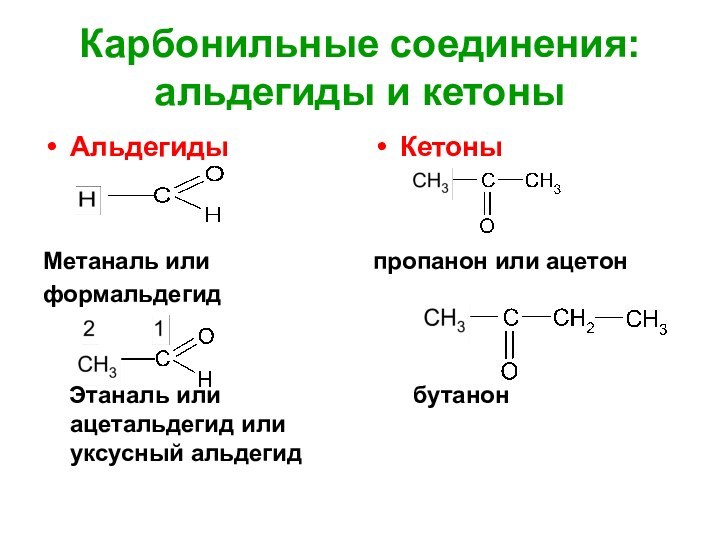
Карбонильные соединения: альдегиды и кетоны
Альдегиды
Метаналь или
формальдегид
Этаналь
или ацетальдегид или уксусный альдегид
Кетоны
пропанон или ацетон
бутанон
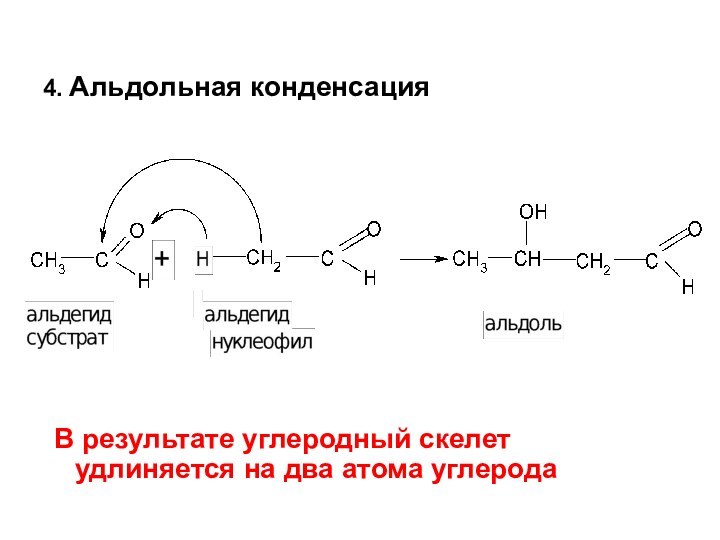
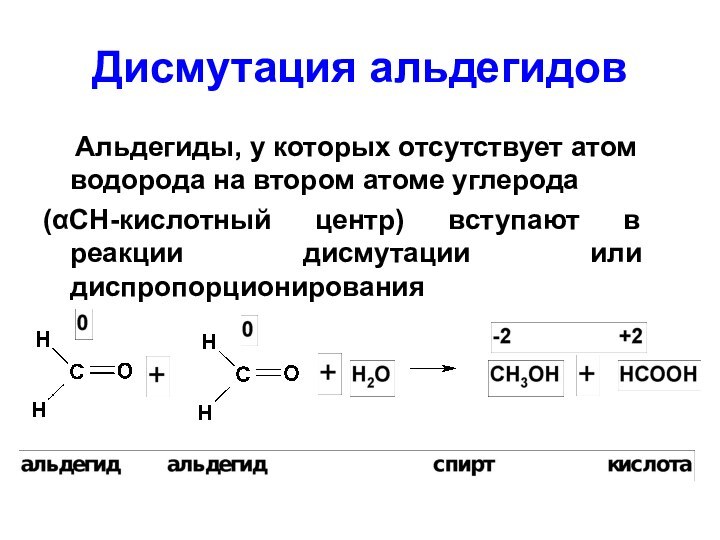
Слайд 54
Дисмутация альдегидов
Альдегиды, у которых отсутствует атом
водорода на втором атоме углерода
(СН-кислотный центр) вступают
в реакции дисмутации или диспропорционированияСлайд 55 5.Реакции присоединения – отщепления (AN-E) с аминами и
их производными
А. реакция с аминами
Слайд 56
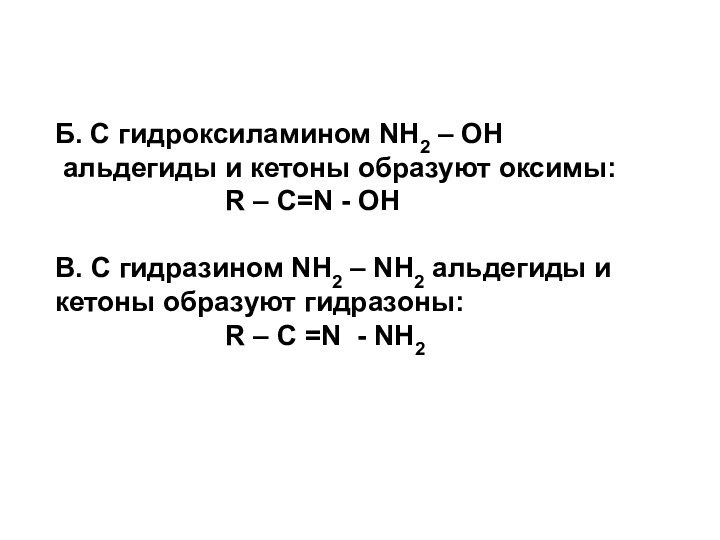
Б. С гидроксиламином NH2 – OH
альдегиды и
кетоны образуют оксимы:
R – С=N - OHВ. С гидразином NH2 – NH2 альдегиды и кетоны образуют гидразоны:
R – С =N - NH2
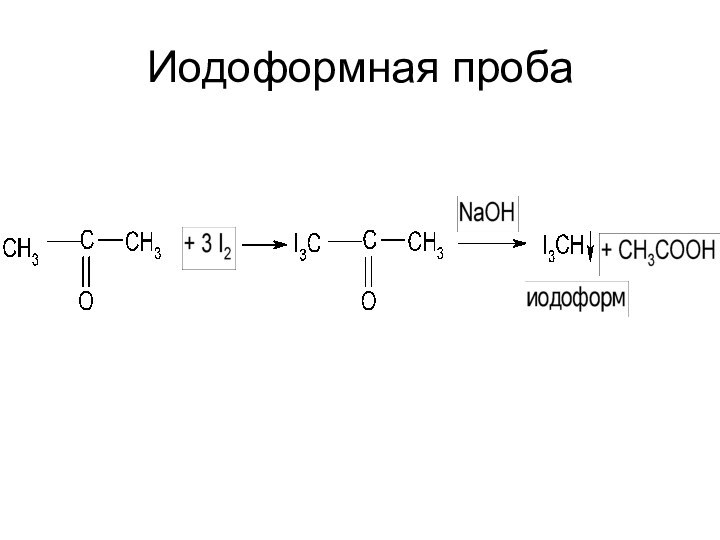
Слайд 59
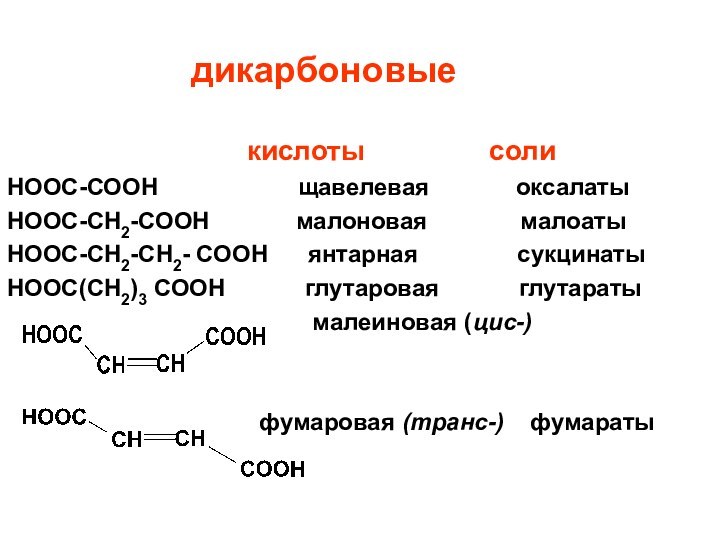
дикарбоновые
кислоты
солиНООС-СООН щавелевая оксалаты
НООС-СН2-СООН малоновая малоаты
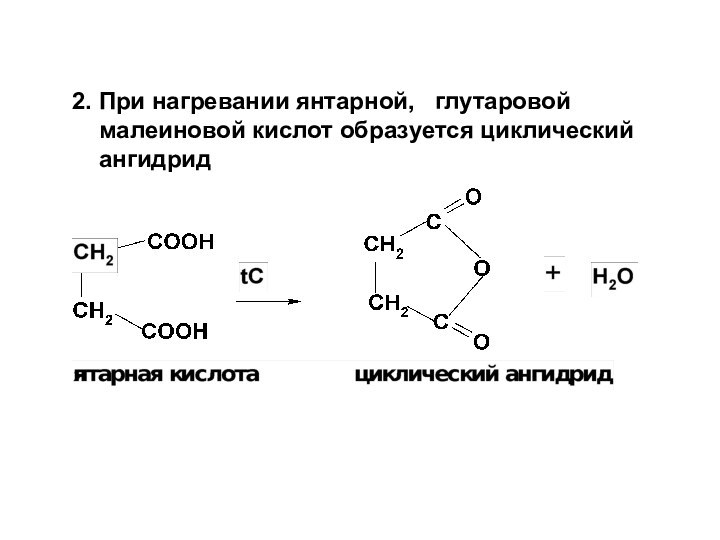
НООС-СН2-СН2- СООН янтарная сукцинаты
НООС(СН2)3 СООН глутаровая глутараты
малеиновая (цис-)
фумаровая (транс-) фумараты