Слайд 2
Состав твердого топлива
Рабочая масса топлива – это его
состав при подаче в топочное устройство для сжигания.
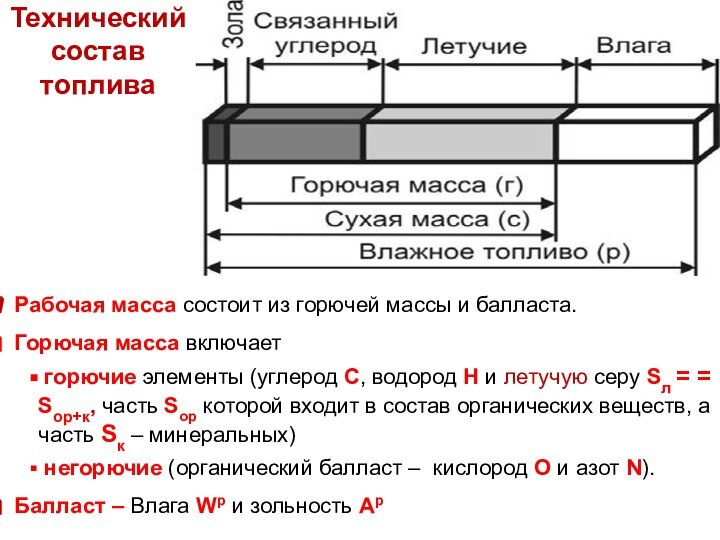
Технический состав
рабочей массы топлива –информация о содержании влаги Wp, зольности (минеральной части) Ар, а также летучих веществ Vp, и связанного (твёрдого) углерода Cсвp, на которые распадается горючая часть топлива при нагревании
Wр + Aр + Vр + Cсвр = 100 масс. %
Элементарный состав рабочей массы топлива
Wр + Aр + C р + H р + O р + S р + N р = 100 масс. %;
Состав соединений, входящих в минеральную часть (зольность) топлива, который определяет ее плавкость и влияет на надежность работы топочного устройства, изменяется в процессе сжигания и превращается в золу
Слайд 3
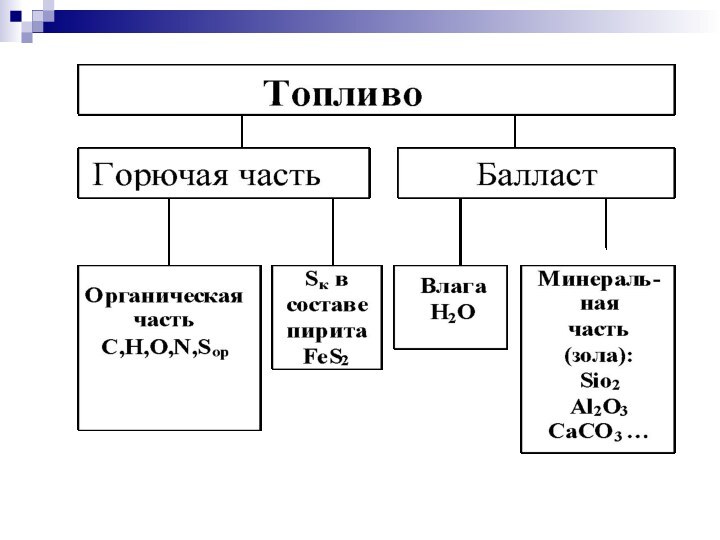
Рабочая масса состоит из горючей массы и
балласта.
Горючая масса включает
горючие элементы (углерод С,
водород Н и летучую серу Sл = = Sор+к, часть Sор которой входит в состав органических веществ, а часть Sк – минеральных)
негорючие (органический балласт – кислород O и азот N).
Балласт – Влага Wр и зольность Aр
Технический
состав топлива
Слайд 5
Основу органической части (массы) топлива составляют
углерод С, водород Н и кислород О
Кроме того, органическая масса топлива в небольших количествах содержит органическую серу Sор и азот N
В минеральную часть топлива входит колчеданная сера Sк (в составе железного колчедана или пирита FeS2), которая также принимает участие в процессе горения.
Вещества С, Н, О, Sор+к , N составляют горючую массу топлива. Различие между органической и горючей частями большинства топлив обычно мало (Sк ).
Суммарное количество органической и колчеданной серы иногда называется летучей серой: Sл = Sор+к.
Органическая и горючая части топлива
Слайд 6
Горючая масса Органическая масса
Горючая масса содержит часть
минеральной массы –колчеданную серу, входящую в неорганическое соединение железный
колчедан (пирит) FeS2
Слайд 7
Основным элементом горючей части всех топлив является
углерод С, горение которого обусловливает выделение основного количества тепла
(в древесине Сг 50 масс.%).
Однако чем больше углерода в топливе, тем труднее оно воспламеняется (ниже реакционная способность); антрацит – самый калорийный, но и самый низкореакционный уголь.
Содержание водорода Н в горючей массе твердых и жидких топлив колеблется от 2 до 10 % масс. Больше – в мазуте и горючих сланцах, особенно много в природном газе, меньше всего в антраците. При сгорании водород выделяет на единицу веса примерно в 4,4 раза больше тепла, чем углерод.
Слайд 8
Рабочая, сухая и горючая массы топлива
Рабочая масса (as
fired, as delivered)
Cр + Hр + Oр
+ Nр + Sор+кр+ Aр + Wр =100%
Сухая масса (dry basis, d.b.)
Cс + Hс + Oс + Nс + Sор+кс + Aс = 100%
Горючая масса (dry ash-free basis, d.a.f.)
Cг + Hг + Oг + Nг + Sор+к г =100%
Органическая масса ( горючей массе)
Cо + Hо + Oо + Nо + Sоро =100%
Слайд 9
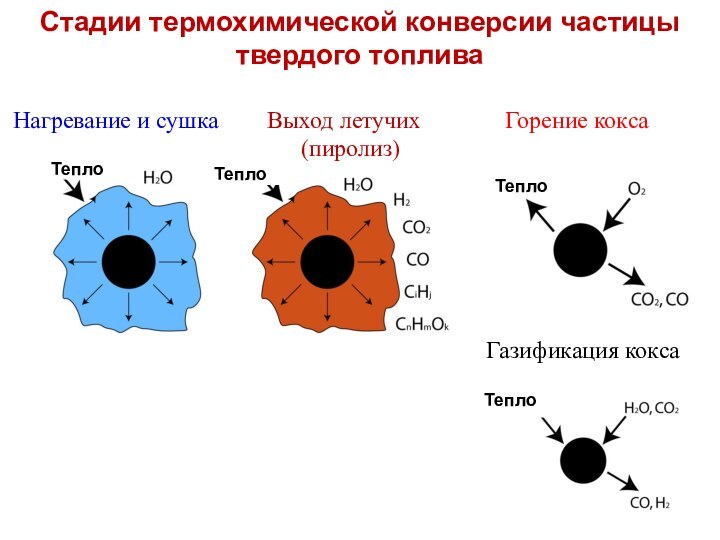
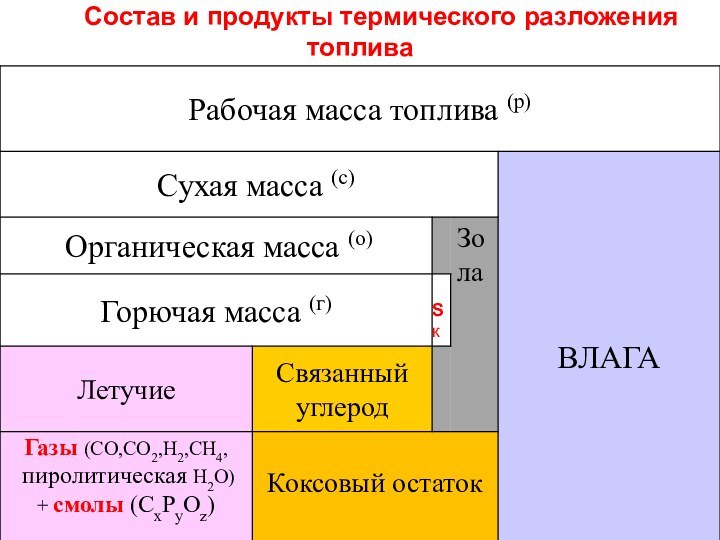
Летучие вещества и связанный углерод (коксовый остаток)
Одной из
основных особенностей поведения твердых топлив при нагревании является термическое
разложение их органической массы на газообразные летучие вещества и твердый коксовый остаток (связанный углерод Ссв, зола, следы О и Н).
Летучие продукты состоят из неконденсирующихся газов (СО, Н2, СН4, СО2, включая пиролитическую влагу Н2О) и конденсирующихся высокомолекулярных смол (СxНyОz)
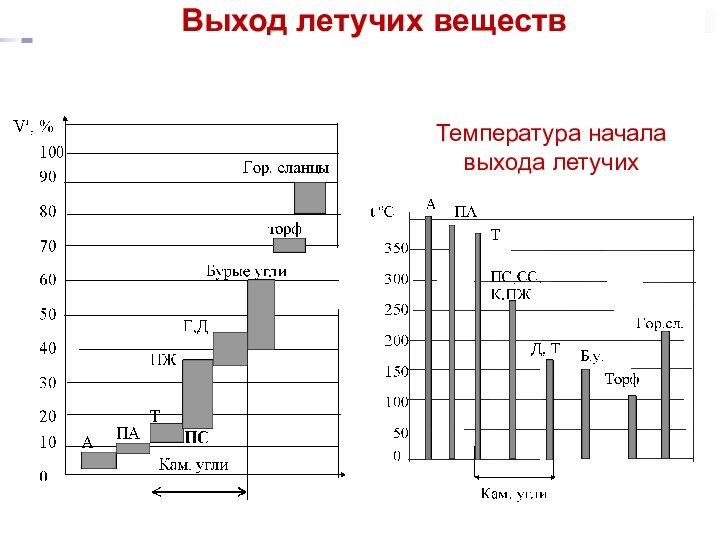
Чем меньше степень углефикации топлива, тем больше оно содержит термически неустойчивых соединений и тем больше выделяет летучих:
биомасса > гор.сланцы > торф > б.угли >к.угли > антрацит
Выше выход летучих – выше реакционная способность, ниже теплотворная способность.
Слайд 10
Стадии термохимической конверсии частицы твердого топлива
Нагревание и
сушка Выход летучих
Горение кокса
(пиролиз)
Тепло
Тепло
Газификация кокса
Тепло
Слайд 11
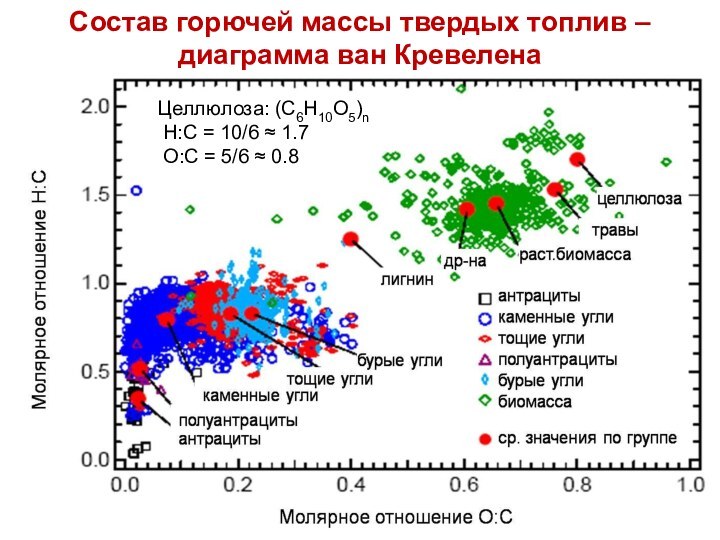
Целлюлоза: (С6Н10О5)n
Н:С = 10/6 1.7
О:С = 5/6 0.8
Состав горючей массы твердых топлив
– диаграмма ван Кревелена
Слайд 12
Состав и продукты термического разложения топлива
Слайд 13
Выход летучих веществ
Температура начала выхода летучих
Слайд 14
Органический балласт топлива
Кислород О и азот N в
топливе являются органическим балластом: наличие их в топливе уменьшает
содержание горючих элементов - углерода и водорода.
Особенно велико содержание кислорода в древесине (Ог = 42%) и торфе.
Топливный азот N является основным источником токсичных оксидов NOx при сжигании биомассы и низкотемпературном сжигании ископаемого топлива, т.е. он может частично или полностью окисляться и в принципе должен относиться горючим элементом.
При оценке экологических аспектов процесса горения образование NOx является одной из основных задач.
Однако при расчетах теплового и материального балансов котла горением азота пренебрегают в связи с его малым содержанием, а также малыми объёмами NOx.
Слайд 15
Сера
В твердых топливах обычно немного, но в некоторых
бурых и каменных углях доходит до 7-8% на горючую
массу топлива.
В нефти входит в состав органических соединений; при переработке большая часть переходит в мазут (0,3-3,5%).
В природных газах практически отсутствует, в попутных газах некоторых нефтяных месторождений содержится немного серы в виде сероводорода H2S и сернистого газа SO2.
При горении серы тепла выделяется примерно в 3.5 раза меньше, чем при горении углерода.
Коррозия низкотемпературных поверхностей нагрева из-за серного ангидрида SO3, который сильно повышает температуру конденсации водяных паров (точку росы) в продуктах сгорания топлива.
Присутствие сернистого газа SO2 в продуктах сгорания топлива, выбрасываемых в атмосферу через дымовую трубу, приводит к загрязнению окружающего воздуха (яд; кислотные дожди).
Слайд 16
ЭЛЕМЕНТАРНЫЕ РЕАКЦИИ ГОРЕНИЯ ТОПЛИВА
С + О2 = СО2
полное сгорание углерода
2С + О2 = 2СО неполное
сгорание углерода
2Н2 + О2 = 2Н2О горение водорода
S + O2 = SO2 горение органической серы
2FeS2 +5.5 O2 = Fe2O3 + 4 SO2 горение колчеданной серы
Слайд 17
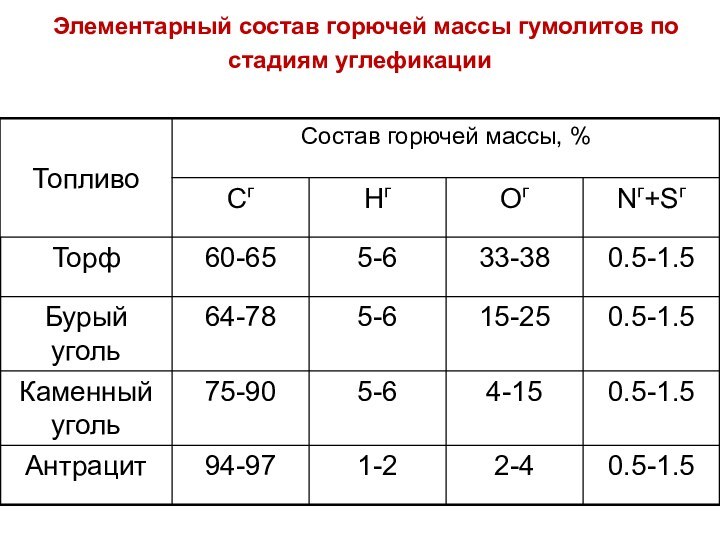
Элементарный состав горючей массы гумолитов по стадиям
углефикации
Слайд 18
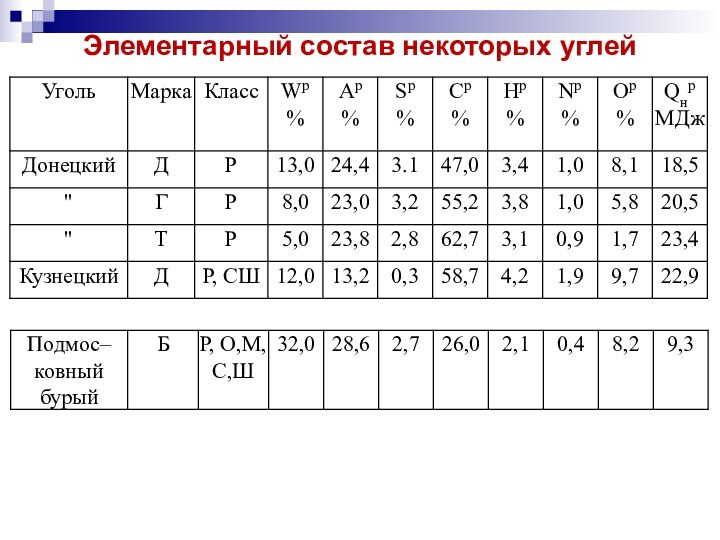
Элементарный состав некоторых углей
Слайд 20
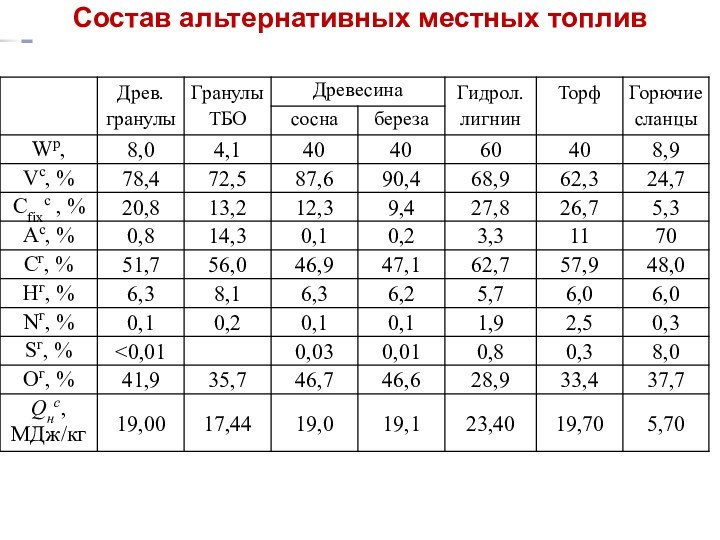
Состав альтернативных местных топлив
Слайд 21
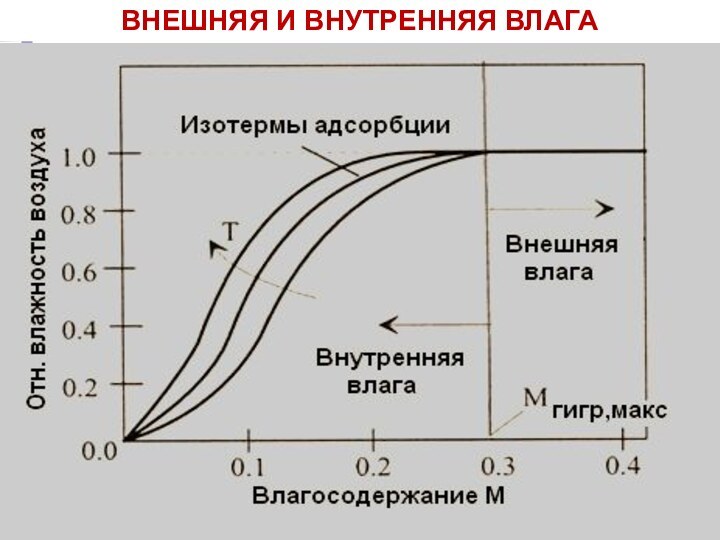
Влажность твердых топлив
Влажность Wр – масса влаги, отнесенная
к рабочей (влажной) массе топлива:
Влагосодержание M – масса влаги,
отнесенная к сухой массе топлива:
Слайд 22
Внешняя (поверхностная и капиллярная) влага удаляется путем сушки
топлива при комнатной температуре.
Внутренняя (гигроскопическая или коллоидная и
гидратная) влага удаляется сушкой при 102-105 оС.
Слайд 24
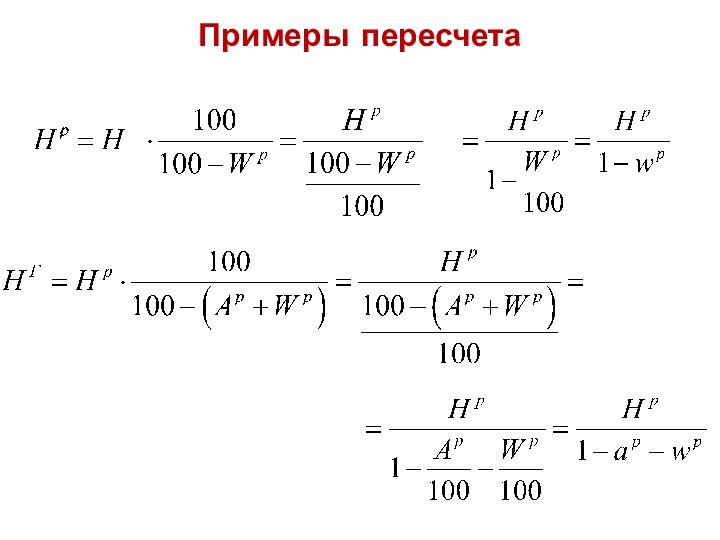
Пересчет состава топлива на другую массу
При проектировании и
эксплуатации котельных установок часто приходится производить пересчеты состава топлива.
Причина:
влажность Wр и зольность Aр могут колебаться в широких пределах, в то время как состав горючей ( органической) массы гораздо более стабилен.
Это позволяет легко пересчитывать рабочий состав топлива на другие влажность и (или) зольность, не производя полного элементарного анализа топлива.
Слайд 26
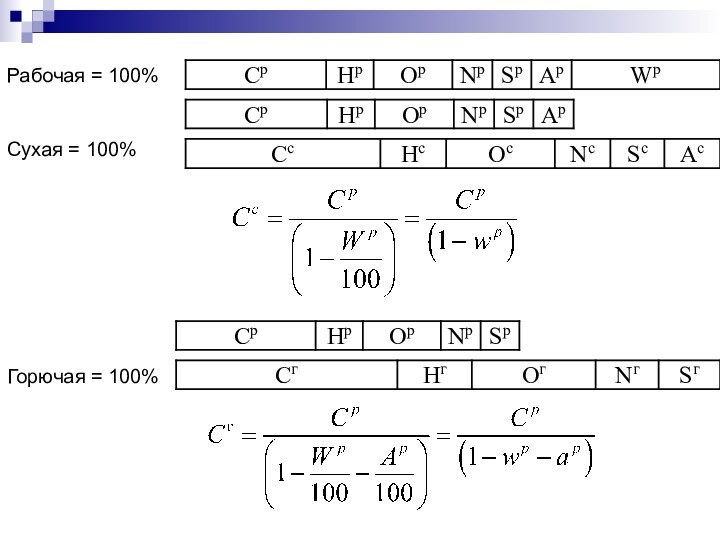
Рабочая = 100%
Сухая = 100%
Горючая = 100%
Слайд 28
Коэффициенты пересчета
(ap =Аp/100, wp=Wp/100 – в массовых
долях!!!)
Слайд 29
Горючие сланцы:
особенности
пересчёта
– известное содержание углекислоты карбонатов, %, которые
разлагаются при t = 900 oC
Истинная зольность рабочей массы:
СaCO3 = CaO + CO2
Слайд 30
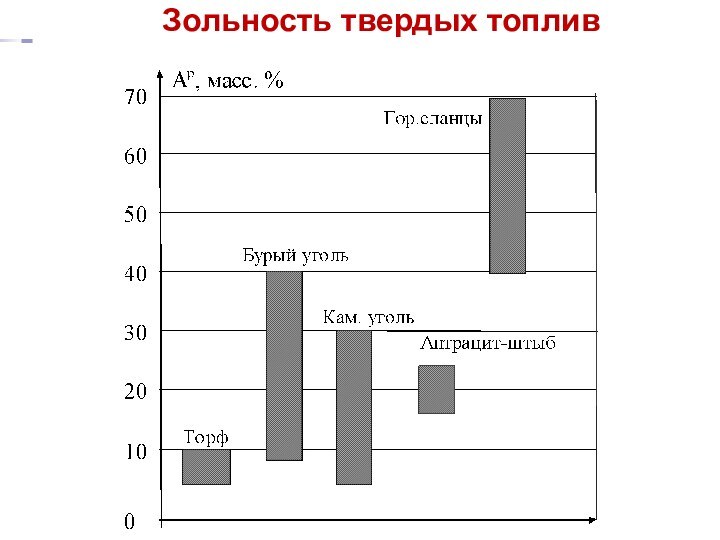
Зольность твердых топлив
Золой топлива называется остаток при прокаливании
топлива при 800 оС. Вес остатка принимается за содержание
золы (зольность) в пробе исследуемого топлива.
Зольность топлива следует отличать от его минеральной части, которая превращается в золу при прокаливании.
Часть исходных минеральных примесей при
прокаливании остаётся неизменной;
Другая часть распадается и улетучивается;
Третья – "набирает вес" за счёт окисления.
Слайд 31
Трансформации минеральной части
Потери кристаллизационной влаги гипсом
(CaSO4·2H2O), силикатами (МеSiO3·хH2O);
Разложение карбонатов с выделением
углекислоты
CaСO3 = СаO + СО2
(содержание карбонатной СО2 в гор.сланцах – до 20 %);
Реакции связывания серы
2 CaO + 2 SО2 + О2 = 2 СаSО4
2(40+16) + 2(32+2·16) + 2·16 = 2(40+32+4·16)
112 кг 272 кг
Горение железного колчедана (пирита)
2 FeS2 +5.5 O2 = Fe2O3 + 4 SO2
2(56+2·32) + 5.5·2·16 = (2·56+3·16) + 4·(32+2·16)
112 кг железа 160 кг
Слайд 33
Компоненты золы
Легкоплавкие (800 – 1000 оС)
Оксиды железа FeО и Fe2O3
Оксиды
щелочных металлов Na2O, R2O
Тугоплавкие (1600 – 2800 оС)
Диоксид кремния (кремнекислота) SiO2
Глинозём Al2O3
Оксиды кальция CaO (известь) и магния MgО (магнезия)
При определённых соотношениях некоторые компоненты могут образовывать легкоплавкие эвтектики – соединения, температура плавления которых ниже, чем входящих в них компонентов.
Слайд 34
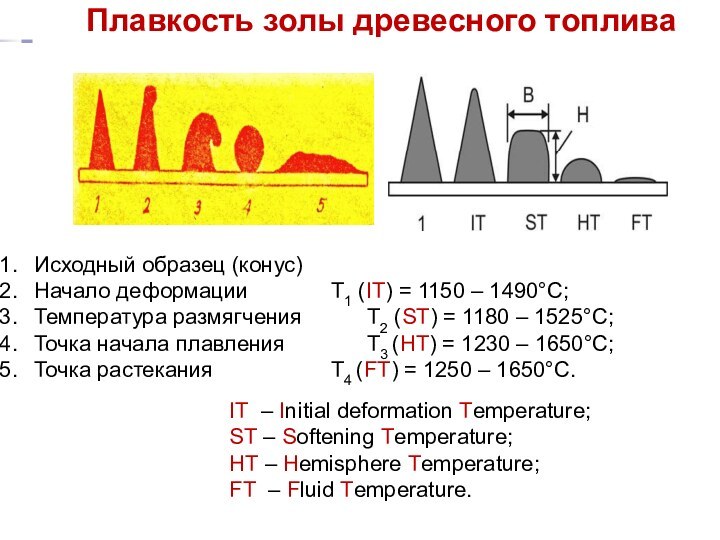
Плавкость золы древесного топлива
Исходный образец (конус)
Начало деформации T1
(IT) = 1150 – 1490°C;
Температура размягчения T2 (ST)
= 1180 – 1525°C;
Точка начала плавления T3 (HT) = 1230 – 1650°C;
Точка растекания T4 (FT) = 1250 – 1650°C.
IT – Initial deformation Temperature;
ST – Softening Temperature;
HT – Hemisphere Temperature;
FT – Fluid Temperature.
Слайд 35
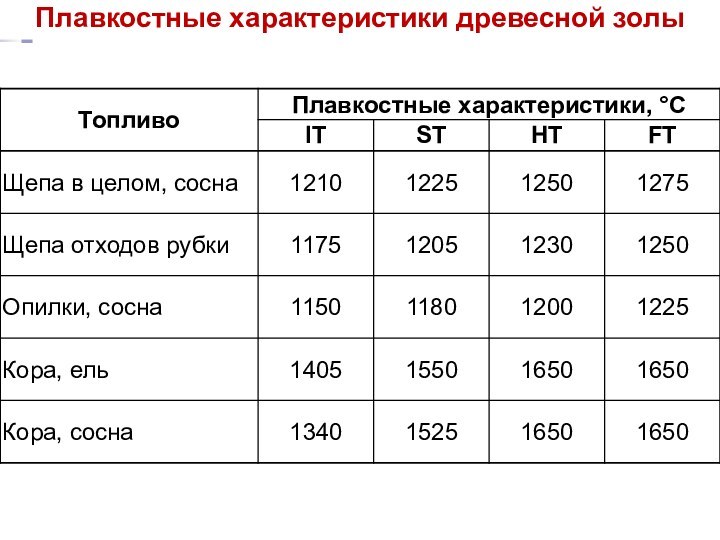
Плавкостные характеристики древесной золы
Слайд 36
Теплота сгорания (теплотворная способность) топлива
Высшая теплота сгорания количество
теплоты, выделяющееся при полном сгорании 1 кг твердого и
жидкого топлива (кДж/кг) или 1 нм3 газообразного топлива (кДж/м3) и охлаждении образовавшихся продуктов сгорания до 25оС, т.е. с конденсацией содержащихся в них паров воды и выделением скрытой теплоты конденсации
r = 2,44 МДж/кг.
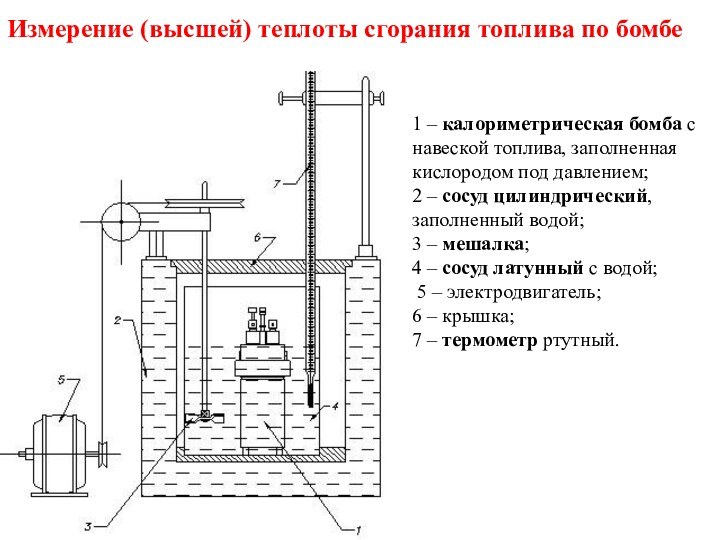
Qвр определяется экспериментально в т.н. калориметрической бомбе с введением расчетных поправок на образование и растворение в воде серной и азотной кислот.
Слайд 37
1 – калориметрическая бомба с навеской топлива, заполненная
кислородом под давлением;
2 – сосуд цилиндрический, заполненный водой;
3 – мешалка;
4 – сосуд латунный с водой;
5 – электродвигатель;
6 – крышка;
7 – термометр ртутный.
Измерение (высшей) теплоты сгорания топлива по бомбе
Слайд 38
Низшая теплота сгорания Qнр – количество тепла,
выделяющееся при полном сгорании 1 кг твердого и жидкого
(кДж/кг) топлива или 1 нм3 газообразного топлива (кДж/м3)
за вычетом теплоты конденсациии паров воды, содержащихся в продуктах сгорания.
Продукты сгорания (дымовые газы), как правило, выходят из котельных агрегатов при температуре, превышающей температуру конденсации паров воды (точку росы), поэтому в тепловых расчетах энергетических устройств используется Qнр .
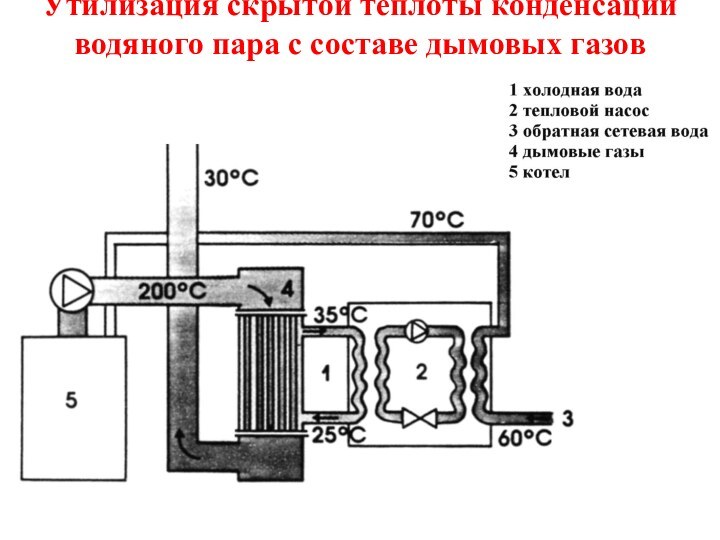
скрытая теплота конденсации r может частично утилизироваться путем конденсации водяных паров в специальных теплообменниках (проблемы – низкий тепловой потенциал, коррозия).
Слайд 39
Утилизация скрытой теплоты конденсации водяного пара с составе
дымовых газов
Слайд 40
Формула Менделеева длярасчёта Qнр твердого и жидкого топлива
Qнр
= 339 Cр +1025 Hр – 108.5 (Oр -
Sрор+к) – 25 Wр , кДж/кг
кДж/кг
кДж/кг
Слайд 41
Формулы пересчета теплоты сгорания
Qвр = Qнр +225 Hр+25
Wр
Qвг = Qнг +225 Нг
Qвс = Qнс +225 Нс
Слайд 42
Горючие сланцы: учёт теплоты разложения карбонатов
– содержание углекислоты
карбонатов в рабочей массе %, задаётся в составе топлива.
–
истинная зольность рабочей массы.
СaCO3 = CaO + CO2
Слайд 43
Пересчет теплоты сгорания при изменении влажности
топлива
Qнр см= b1Qнр1+(1- b1) Qнр2,
Определение теплотворной способности
бинарной смеси
топлив
b1 –массовая доля одного из топлив в смеси.
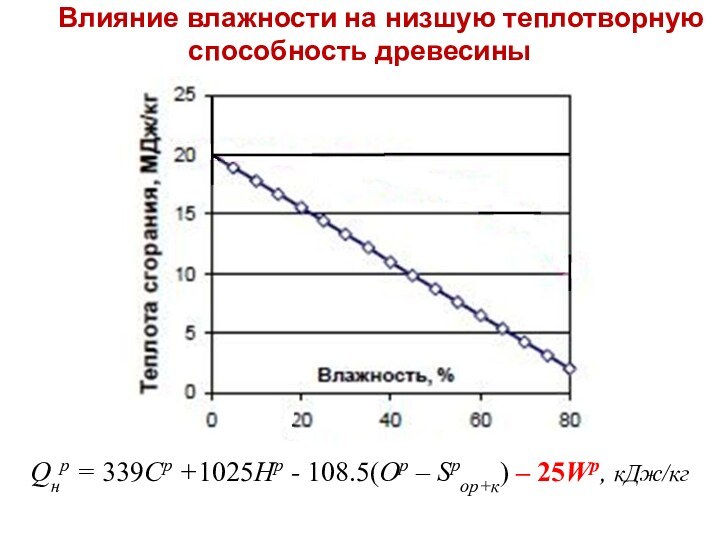
Слайд 44
Влияние влажности на низшую теплотворную способность древесины
Qнр =
339Cр +1025Hр - 108.5(Oр – Sрор+к) – 25Wр, кДж/кг
Слайд 45
6 200-7 500 кДж/кг (многозольные сланцы, высоковлажные биомасса,
торф, бурый уголь)
20 000 кДж/кг (сухая биомасса)
25 000-29
000 кДж/кг (высококалорийный каменный уголь)
38 000-42 000 кДж/кг (нефтепродукты).
Низшая теплота сгорания основных видов органического топлива
Слайд 46
Городской мусор (ТБО)
На 40-50% состоит из
органических горючих материалов, на 20-40% - из металла.
стекла, керамики
Низшая теплотворная способность ТБО:
7-8 МДж/кг (выше горючих сланцев, но ниже бурых углей)
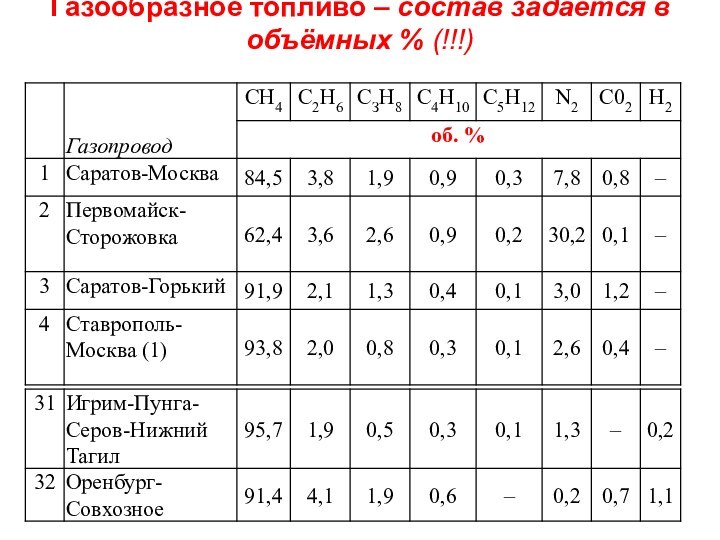
Слайд 47
Газообразное топливо – состав задаётся в объёмных %
(!!!)
Слайд 48
Низшая теплота сгорания сухих горючих газов
Qнс =
108Н2+126СО+239H2S+358СН4+591C2H4+860C3H6+
+ 913C3H8+1135C4H8+1187C4H10+1461C5H12+1403C6H6, кДж/м3
В среднем для природного газа Qнс
35,6 МДж/м3.
Для влажного газа
Высшая теплота сгорания сухих горючих газов
Qвр = Qнр + r (mH2O / mтопл)
r = 2440 кДж/кг (25оС)
Слайд 49
Пример: низшая теплота сгорания метана
Qнр =
Qвр – r (mH2O / mтопл)
СН4 +
2О2 = СО2 + 2Н2О
r = 2440 кДж/кг (25оС)
Qвр = 55 500 кДж/кг (табл. данные)
mH2O = 2 (2 1 + 16) = 36 кг воды
mтопл = 12 + 4 1 = 16 кг метана
Qнр = 55 500 – 2440 (36/16) = 50 000 кДж/кг =
= 50 000 / ρСН4= 50 000/(МСН4/22.4)= 35714 кДж/м3