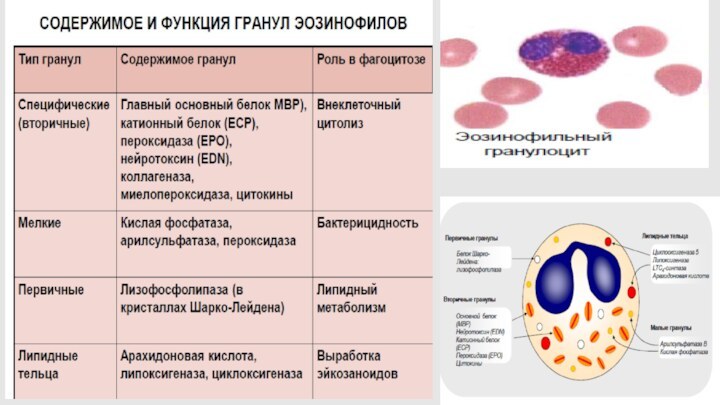
Слайд 2
Врожденный иммунитет-
наследственно закрепленная система защиты многоклеточных организмов от
любых патогенных и непатогенных м/о, эндогенных продуктов тканевой
деструкции, формируется в онтогенезе вне зависимости от «запроса»
Действует на основе:
воспаления и фагоцитоза,
защитных белков (комплемент, интерфероны, вибронектин и др.)
Реагирует на
корпускулярные агенты (микроорганизмы, чужеродные клетки и др.)
токсические вещества, разрушающие клетки и ткани, вернее, на
корпускулярные продукты этого разрушения.
Слайд 3
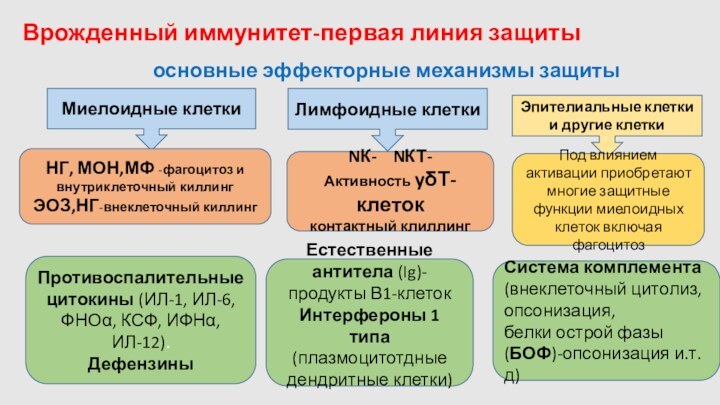
Врожденный иммунитет-первая линия защиты
Миелоидные клетки
Лимфоидные клетки
Эпителиальные клетки и
другие клетки
НГ, МОН,МФ -фагоцитоз и внутриклеточный киллинг
ЭОЗ,НГ-внеклеточный киллинг
NК-
NКТ-
Активность yδТ-клеток
контактный клиллинг
Под влиянием активации приобретают многие защитные функции миелоидных клеток включая фагоцитоз
Противоспалительные цитокины (ИЛ-1, ИЛ-6, ФНОα, КСФ, ИФНα, ИЛ-12).
Дефензины
Естественные антитела (Ig)-продукты В1-клеток
Интерфероны 1 типа
(плазмоцитотдные дендритные клетки)
Система комплемента
(внеклеточный цитолиз,
опсонизация,
белки острой фазы (БОФ)-опсонизация и.т.д)
основные эффекторные механизмы защиты
Слайд 4
Часть 1.Клеточные механизмы врожденного иммунитета
Слайд 6
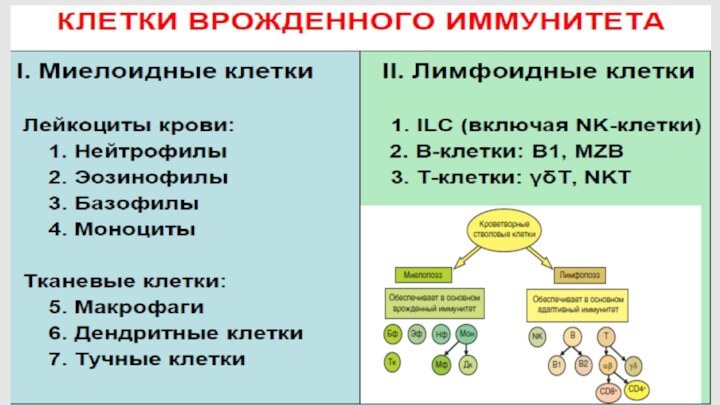
Эффекторные клетки врожденного иммунитета
всегда готовы к осуществлению эффекторных
функций
(не требуется пролиферации, дифференцировки и межклеточных взаимодействий)
не имеют
иммунологической памяти
содержат в цитоплазме широкий спектр эффекторных молекул, используемых при фагоцитозе (внутриклеточно) и при экзоцитозе (внеклеточно)
активируются при распознавании специальными рецепторами (PRR) не индивидуальных молекул, а их групп (образов) – PAMP
Слайд 7
ПАТТЕРН-РАСПОЗНАЮЩИЕ РЕЦЕПТОРЫ(PRR )
PAMP- патоген-ассоциированные молекулы –– консервативный рисунок
аминокислотных последовательностей, характерный для большинства м/о и не встречающийся
у многоклеточных (Ch. Janeway, 2001)
PAMP взаимодействуют с паттерн-распознающими (PRR) рецепторами на поверхности клеток (МФ, НГ,ДК).
Основные функции PRR
опсонизация
активация комплемента
синтез провоспалительных цитокинов
индукция апоптоза
фагоцитоз
Слайд 8
Рецепторные молекулы миелоидных клеток
Рецепторы обеспечивающие
Распознавание -сигнальные
(TLR1-11 и др)
3.Рецеторы
опсонинов (Fc-рецепторы к Ig,
к компонентам комплемента СR1,CR2,CR3)
5. Рецепторы
обеспечивающие взаимодействие с ЛФ
МНС классов I и II,
костимулирующих молекул CD40, CD80, CD86
2.Обеспечивающие миграцию(рецепторы хемокинов, молекулы адгезии:селиктины,
адрессины,интегрины)
4.Рецепторы для КСФ,
интерферонов,
провоспалительных цитокинов TFN,L-6,IL-1 и др)
6.Внутриклеточные
NOD- подобные (NRL)
RIG-подобные (RNL)
-сигнальные молекулы
DAI-ДНК –зависимый активатор факторов интерферона
Слайд 9
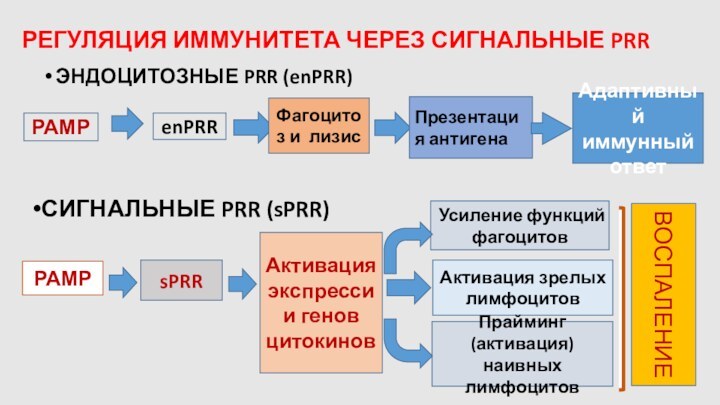
РЕГУЛЯЦИЯ ИММУНИТЕТА ЧЕРЕЗ СИГНАЛЬНЫЕ PRR
ЭНДОЦИТОЗНЫЕ PRR (enPRR)
РАМР
enPRR
Фагоцитоз и лизис
Презентация антигена
Адаптивный иммунный ответ
РАМР
sPRR
Активация экспрессии генов цитокинов
Усиление функций фагоцитов
Активация зрелых лимфоцитов
СИГНАЛЬНЫЕ PRR (sPRR)
Прайминг (активация) наивных лимфоцитов
ВОСПАЛЕНИЕ
Слайд 10
Scavenger рецепторы
Стрессорные молекулы – образы опасности DAMP
(Danger-associatied molecular patterns)
собственные молекулы организма, экспрессируемые на мембране при
клеточном стрессе и сигнализирующие преимущественно об опасности эндогенного происхождения (повреждающее действие: температурное, лучевое, инфекционное и.т.д.)
Реагируют на алармины (белки теплового шока -НSP, белки образующиеся при некрозе клеток-НМGВ1,мочевая кислота образующаяся при некротической гибели клеток, дефензины, кателицидины, тимозины и.т.д)
усиление хемотаксиса, активация фагоцитов, ускорение созревания дендритных клеток , продукции цитокинов
Слайд 11
главные клетки
врожденного
иммунитета-
ФАГОЦИТЫ-
микрофагоциты
макрофагоциты
НГ
МОН/МФ
Фагоцитоз- особый процесс поглощения клеткой
,крупных макромолекулярных комплексов или корпускулярных структур.
Слайд 12
ФАГОЦИТОЗ
–комплекс клеточных событий, в основе которых лежит распознавание,
поглощение и элиминация из организма корпускулярных частиц, размером >
0,5 мкм
первая линия в защите от патогенных м/о
составная часть воспаления, как защитной реакции организма
поглощение бактерий является защитной реакцией, направленной на элиминацию возбудителя
может быть:
И.И. Мечников
Фагоцитарная теория иммунитета
завершенным- заканчивается разрушением микроба
Незавершенным
когда м/о проявляют устойчивость к лизосомальным ферментам и размножаются внутри клетки
Слайд 14
Нейтрофильные гранулоциты
Первыми (в течении 30 мин ) приходят
в очаг воспаления, где проявляют разные виды эффекторной активности:
фагоцитоз, интрацелюлярный киллинг, воспаление и повреждение тканей
захватывают и поглощают чужеродные объекты
реализуют комплекс бактерицидных эффектов
продуцируют хемотаксины и медиаторы, регулирующие активность других клеток
Составляют 35-75% (2/3) от общего числа лейкоцитов, имеют сегментированное ядро 3-5 сегментов ,гранулы в цитоплазме
основная функция НГ-защита организма от бактериальных инфекций
Слайд 15
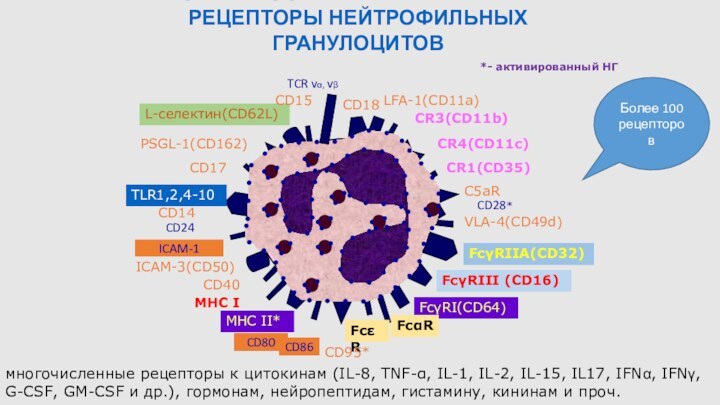
ПОВЕРХНОСТНЫЕ МЕМБРАННЫЕ РЕЦЕПТОРЫ НЕЙТРОФИЛЬНЫХ
ГРАНУЛОЦИТОВ
CR3(CD11b)
CR1(CD35)
C5aR
LFA-1(CD11a)
VLA-4(CD49d)
FcRIII (CD16)
CD18
FcRIIA(CD32)
FcRI(CD64)*
CR4(CD11c)
L-селектин(CD62L)
PSGL-1(CD162)
CD15
CD17
TLR1,2,4-10
CD14
FcR
FcR
ICAM-3(CD50)
CD40
MHC I
MHC II*
*- активированный НГ
CD95*
многочисленные рецепторы к цитокинам
(IL-8, TNF-α, IL-1, IL-2, IL-15, IL17, IFNα, IFNγ, G-CSF, GM-CSF и др.), гормонам, нейропептидам, гистамину, кининам и проч.
CD80
CD86
ICAM-1
CD24
CD28*
TCR v, vβ
Более 100
рецепторов
Слайд 16
(E.Kolaczkowska, P. Kubes Neutrophil recruitment and
function in health and inflammation. Nature Reviews Immunology 13,
159-175 (March 2013) | doi:10.1038/nri3399)
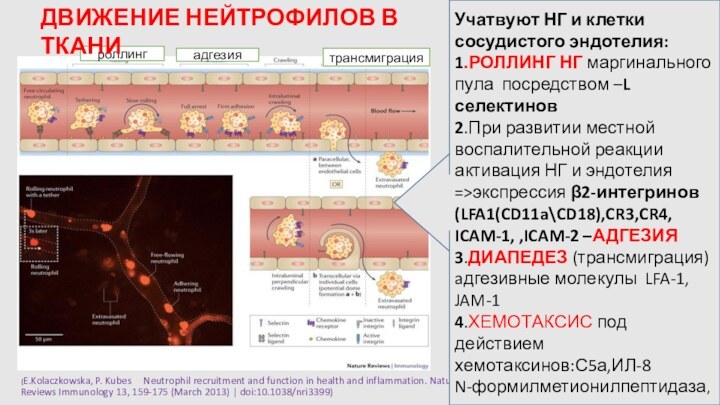
трансмиграция
роллинг
адгезия
Учатвуют НГ и клетки сосудистого эндотелия:
1.РОЛЛИНГ НГ маргинального пула посредством –L селектинов
2.При развитии местной воспалительной реакции активация НГ и эндотелия =>экспрессия β2-интегринов (LFA1(CD11a\CD18),CR3,CR4,
ICAM-1, ,ICAM-2 –АДГЕЗИЯ
3.ДИАПЕДЕЗ (трансмиграция)
aдгезивные молекулы LFA-1, JAM-1
4.ХЕМОТАКСИС под действием
хемотаксинов:С5а,ИЛ-8
N-формилметионилпептидаза,
ДВИЖЕНИЕ НЕЙТРОФИЛОВ В ТКАНИ
Слайд 17
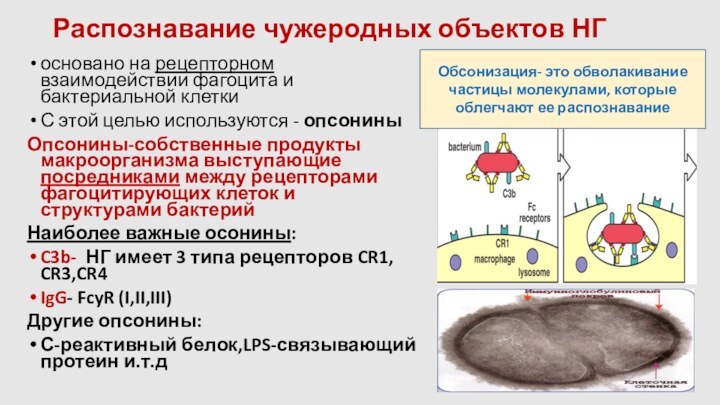
Распознавание чужеродных объектов НГ
основано на рецепторном взаимодействии фагоцита
и бактериальной клетки
С этой целью используются - опсонины
Опсонины-собственные продукты
макроорганизма выступающие посредниками между рецепторами фагоцитирующих клеток и структурами бактерий
Наиболее важные осонины:
C3b- НГ имеет 3 типа рецепторов CR1, CR3,CR4
IgG- FcyR (I,II,III)
Другие опсонины:
С-реактивный белок,LPS-связывающий протеин и.т.д
Обсонизация- это обволакивание частицы молекулами, которые облегчают ее распознавание
Слайд 18
Поглощение и уничтожение микробов
Взаимодействие НГ с опсонизируемой частицей
инициирует процесс поглощения ее внутрь клетки
Процесс поглощения занимает 2
минуты
НГ обладает самым мощным литическим потенциалом среди всех клеток организма
Слайд 19
Специфические гранулы
(вторичные)
Лактоферин
Лизоцим
Цитохром b558
NADPH-оксидаза
Коллагеназа
Кателицидин
Липокартин
фосфолипаза
CD11b/CD18
fMLP-R
Азурофильные гранулы (первичные)
Миелопероксидаза
Дефенсины
Нейтральные протеазы
Катепсин G,
эластаза, протеиназа 3
Лизоцим
Азуроцидин
Белок повышающий проницаемость
мембран бактерий
Желатиназные гранулы
CD11b/CD18
Цитохром b558
Желатиназа
Лизоцим
Ацетилтрансфераза
Секреторные везикулы
CD11/Cd18
Цитохром
b558
CR1
Щелочная фосфатаза
fMLP-R
Реактивные формы
кислорода
Быстрая фаза бактериолиза
Медленная фаза бактериолиза
Обеспечение миграции
Взаимодействие с микроокружением
Слайд 20
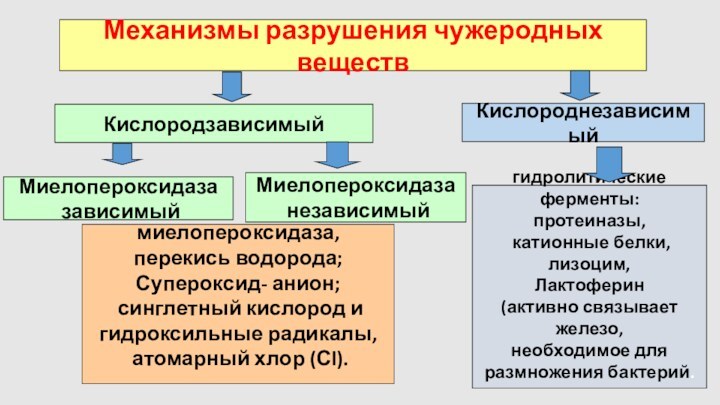
Механизмы разрушения чужеродных веществ
Кислородзависимый
Кислороднезависимый
гидролитические ферменты:
протеиназы,
катионные белки,
лизоцим,
Лактоферин
(активно связывает железо,
необходимое для
размножения бактерий.
миелопероксидаза,
перекись водорода;
Супероксид- анион;
синглетный кислород и
гидроксильные радикалы,
атомарный хлор (Сl).
Миелопероксидаза
зависимый
Миелопероксидаза
независимый
Слайд 21
Кислород независимые факторы защиты
Естественные полипептидные антибиотики-
против Грамм(+), Грамм(-)
бактерий, грибков и вирусов
Основа литической активности- способность формировать множественные
ионные каналы.
-Дефензины (Катионные белки (КБ) )- компонент первичных гранул НГ
известно 4 НГ-HNP-1,2,3,4) и 2 кишечных-HD-5,6) -дефензина,β-дефензины- в эпителиальных клетках дыхательных путей
Кателицидины (LL-37)- в НГ- в специфических гранулах
Бактерицидный протеин(ВPI)-КБ-в НГ и ЭОЗ-связывает LPS стенок бактерий вызывая летальное увеличение проницаемости мембран.
Рекомбинантный ВРI-применяют в качестве эндотоксин-нейтрализуешего фактора при лечении больных сепсисом вызванным Грамм (-)бактериями
Слайд 22
Кислород независимые факторы защиты
Серпроцидины-семейство сериновых нейтральных протеаз:
Эластаза
Азуроцидин- работает
как ВPI-бактерицидный протеин
Протеиназа 3
Катепсин G-имеет самую высокую бектерицидную активность
в группе
Катионные гликопротеины-структурно имеют сходство с гранзимами ЦТЛ
Эластаза-способна разрушать соединительную ткань, что обеспечивает движение НГ в тканях. Негативная сторона- при развитии системного воспаления-артриты, эмфизема
Протеиназа 3- обладает широким спектром бактерицидной активности но на неё нарабатываются аутоантитела ANCA-C (anti –neutrophil cytoplasm antigen-C) при гранулематозе Вегенера. Как и эластаза участвует в патогенезе эмфиземы легких.
Слайд 23
Природные антибиотики-связующее звено между врожденным и адаптивным иммунитетом
Дефензины
НГ
индуцируют миграцию МОН, ДК, наивных Тhо(CD4+CD45RA+) и цитотоксических CD8+Тл
усиливают
гуморальный ответ на АГ
Серпроцидины
стимулируют секрецию ИЛ-8
регулируют образование провоспалительных цитокинов
(TNF-α, IL-1β, IL-2, IL-6)
При высоких концентрациях ИЛ в зоне воспаления разрушают и блокируют соответствующие клеточные рецепторы
Слайд 24
Кислород независимые факторы защиты
Лизоцим-(азурофильные и специфические гранулы НГ)
расщепляет
пиптидогликаны микробной клетки, хитиновый слой грибковых клеток, что приводит
к повышению проницаемости мембраны и лизису
присутствует в крови, в большом количестве в секретах (слюна, слезная жидкость)
Лактоферрин (Fe-связывающий белок)-специфические гранулы НГ.
ограничивает их доступность ионов Fe необходимых для жизни бактерий -бактериостатическое действие.
Содержится в грудном молоке, слезной жидкости, слюне, кишечном тракте
Витамин В12 связывающий протеин- «конфискует» у бактерий цианкобаломин
Слайд 25
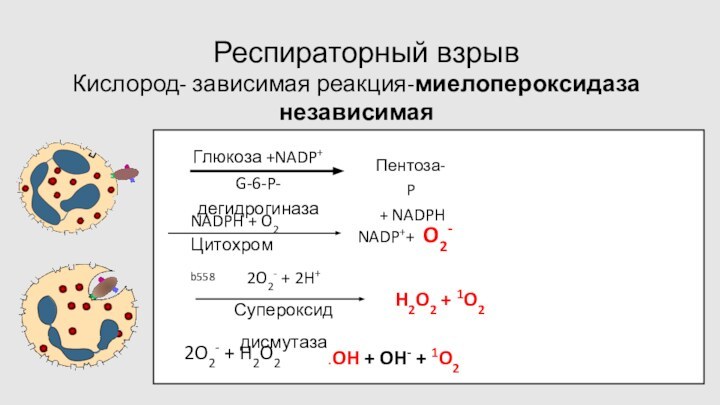
Инициация фагоцитоза
Запуск через
Поступающий в клетку О2 не используется
для энергии
расходуется на образование бактерицидных метаболитов
скорость потребления О2
настолько высока, что процесс активации называют «респираторным взрывом»
превращение О2 начинается с активации НАДФ-Н (NADPH) -источник этого комплекса- пентозный цикл углеводного обмена
характеризуется:
увеличением продукции перекиси водорода, супероксидного аниона и синглетного кислорода
КИСЛОРОДЗАВИСИМЫЕ ФАКТОРЫ ЗАЩИТЫ-более эффективны
Слайд 26
Респираторный взрыв
Кислород- зависимая реакция-миелопероксидаза независимая
Слайд 27
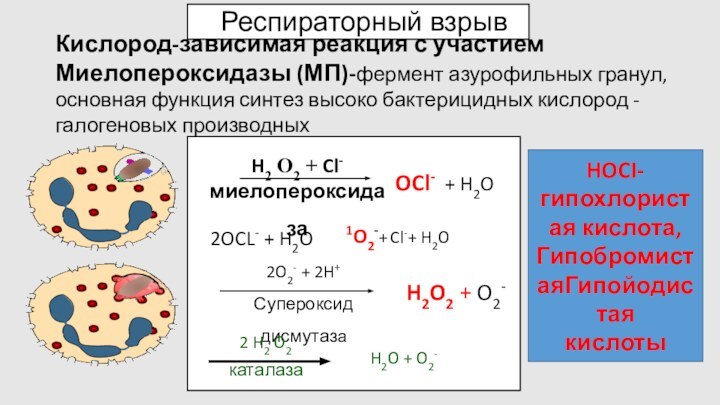
Респираторный взрыв
Кислород-зависимая реакция с участием Миелопероксидазы (МП)-фермент азурофильных
гранул, основная функция синтез высоко бактерицидных кислород -галогеновых производных
HOCI-гипохлористая
кислота,
ГипобромистаяГипойодистая
кислоты
Слайд 28
Цитохимические методы диагностики внутриклеточных ферментов клеток гранулоцитарного ряда
Положительная реакция
на миелопероксидазу
(миелоцит)
Положительная реакция
на миелопероксидазу
(нейтрофил)
Отрицательная –
(лимфоцит)
Положительная
реакция
на миелопероксидазу
в нейтрофиле (1)
Резко-положительная-
В эозинофиле (2)
МПО
Слайд 29
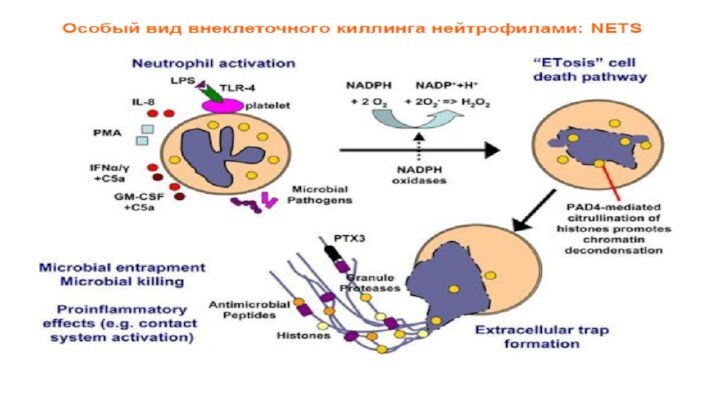
Экстрацеллюлярные нейтрофильные сети
(Neutrophil extracellular traps)
Активированные НГ экстрацеллюлярно выделяют
белки гранул, ядерный (митохондриальный) хроматин (ДНК)
и формируют экстрацеллюлярные нити (сети) – ловушки (NET) , способные связывать и убивать грамм(+) и грамм(–) бактерии, грибы, разрушать факторы их вирулентности.
При этом НГ погибают не через некроз или апоптоз, а “NETOSIS” (T.A.Fuchs,U.Abed, C.Goosman et al., 2007;
Слайд 31
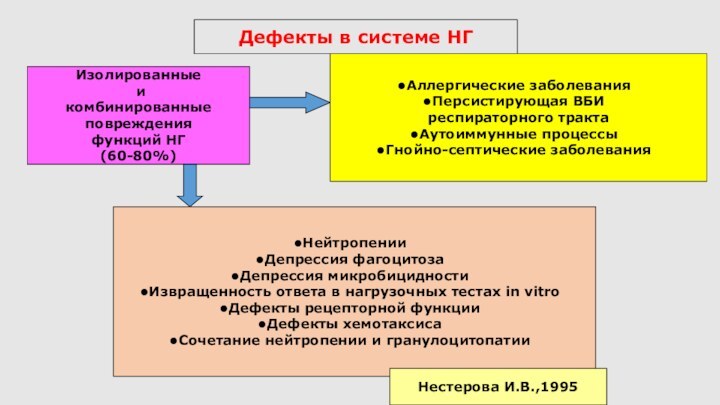
Дефекты в системе НГ
Аллергические заболевания
Персистирующая ВБИ
респираторного тракта
Аутоиммунные
процессы
Гнойно-септические заболевания
Изолированные
и
комбинированные
повреждения
функций НГ
(60-80%)
Нейтропении
Депрессия фагоцитоза
Депрессия микробицидности
Извращенность ответа
в нагрузочных тестах in vitro
Дефекты рецепторной функции
Дефекты хемотаксиса
Сочетание нейтропении и гранулоцитопатии
Нестерова И.В.,1995
Слайд 32
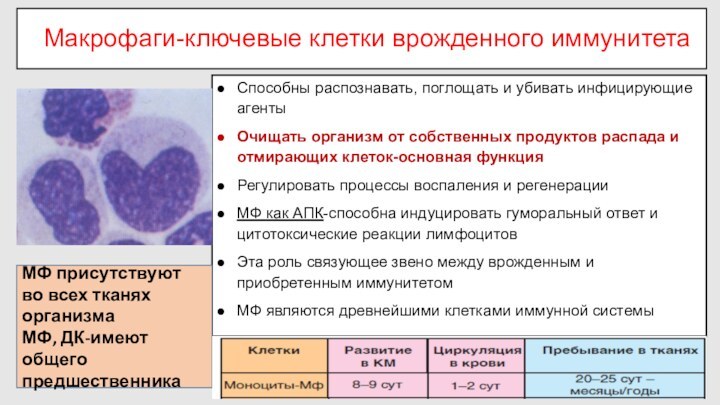
Макрофаги-ключевые клетки врожденного иммунитета
Способны распознавать, поглощать и убивать
инфицирующие агенты
Очищать организм от собственных продуктов распада и отмирающих
клеток-основная функция
Регулировать процессы воспаления и регенерации
МФ как АПК-способна индуцировать гуморальный ответ и цитотоксические реакции лимфоцитов
Эта роль связующее звено между врожденным и приобретенным иммунитетом
МФ являются древнейшими клетками иммунной системы
МФ присутствуют во всех тканях организма
МФ, ДК-имеют общего предшественника
Слайд 34
Роль макрофага в иммунной системе:
Слайд 35
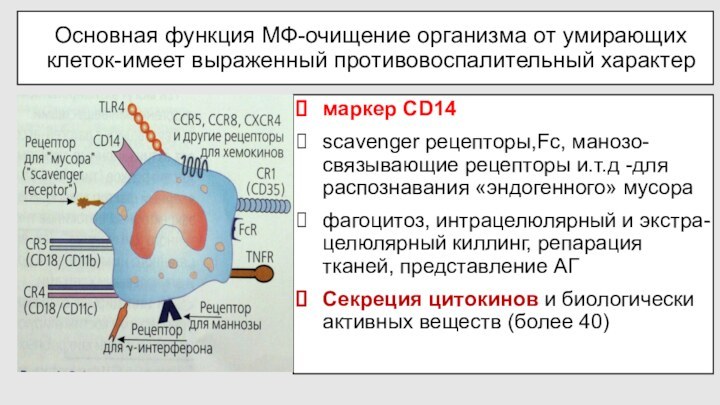
Основная функция МФ-очищение организма от умирающих клеток-имеет выраженный
противовоспалительный характер
маркер CD14
scavenger рецепторы,Fc, манозо-связывающие рецепторы и.т.д -для распознавания
«эндогенного» мусора
фагоцитоз, интрацелюлярный и экстра-целюлярный киллинг, репарация тканей, представление АГ
Секреция цитокинов и биологически активных веществ (более 40)
Слайд 37
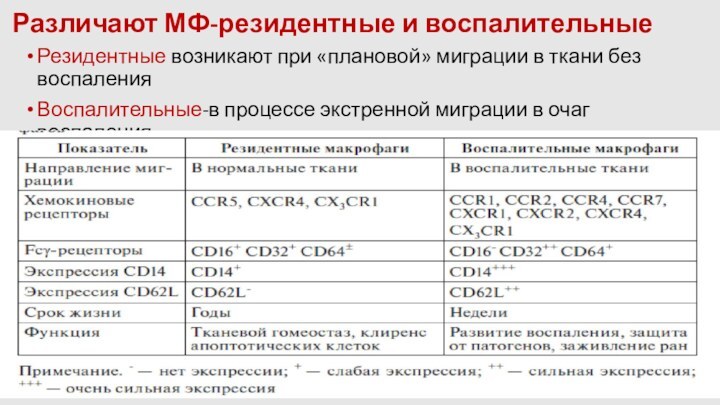
Различают МФ-резидентные и воспалительные
Резидентные возникают при «плановой» миграции
в ткани без воспаления
Воспалительные-в процессе экстренной миграции в очаг
воспаления
Слайд 38
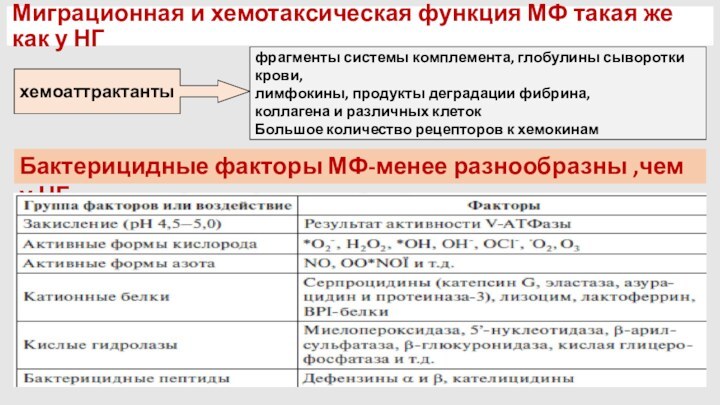
Миграционная и хемотаксическая функция МФ такая же как
у НГ
хемоаттрактанты
фрагменты системы комплемента, глобулины сыворотки крови,
лимфокины, продукты
деградации фибрина,
коллагена и различных клеток
Большое количество рецепторов к хемокинам
Бактерицидные факторы МФ-менее разнообразны ,чем у НГ
Слайд 39
Способность одномоментно производить реактогенные метаболиты азота и кислорода
существенно повышают бактерицидный потенциал МФ
Слайд 40
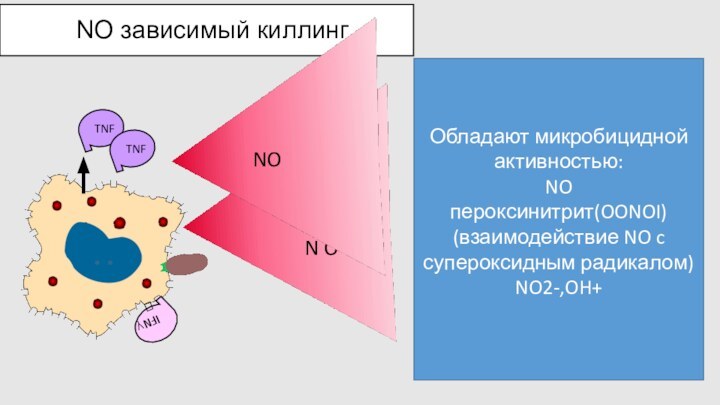
NO зависимый киллинг
Обладают микробицидной активностью:
NO
пероксинитрит(OONOI)
(взаимодействие NO c
супероксидным радикалом)
NO2-,OH+
Слайд 41
Дендритные клетки-профессиональные АПК
Превосходят МФ по экспрессии HLA II
класса
Имеют костномозговое происхождение
В периферической крови ДК на промежуточной стадии,
затем мигрируют в ткани
Дк -может иметь как миелоидное так и лимфоидное происхождение
Миелоидные ДК
Лимфоидные ДК
Зрелые ДК
Не зрелые ДК
Зрелые ДК
Не зрелые ДК
Маркеры миелоидных предшественников СD11c
и НLAII
Плазмоцитоидные ДК
Наиболее многочисленная популяция ДК в крови
CD45RA, IL-3, RAG
Слайд 43
ЭОЗИНОФИЛЫ, ТУЧНЫЕ КЛЕТКИ ,БАЗОФИЛЫ
Основные эффекторы антипаразитарного иммунитета и
аллергических реакций-открыл Пауль Эрлих
Их объединяет:
наличие гранул
способность к экзоцитозу (выбросу
содержимого гранул наружу)
Данная способность позволяет:
оказывать токсическое действие на объекты превосходящие их по размеру
повреждающе воздействовать на собственные секреторные, мышечные, сосудистые и нервные клетки
Слайд 45
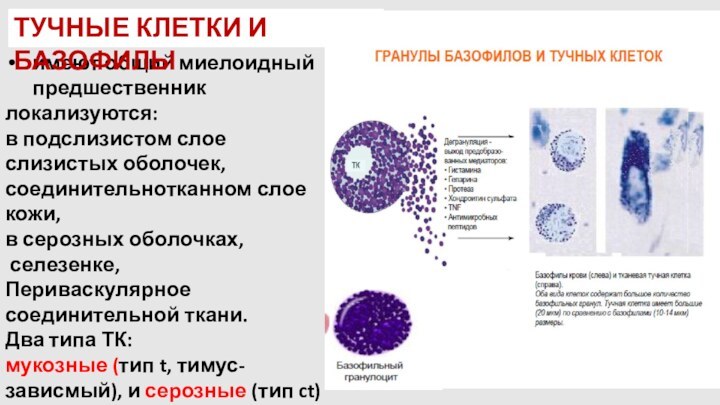
имеют общий миелоидный предшественник
локализуются:
в подслизистом слое слизистых
оболочек, соединительнотканном слое кожи,
в серозных оболочках,
селезенке,
Периваскулярное
соединительной ткани.
Два типа ТК:
мукозные (тип t, тимус-зависмый), и серозные (тип ct)
ТУЧНЫЕ КЛЕТКИ И БАЗОФИЛЫ
Слайд 46
Естественные киллеры (NK-клетки, от nature killer)
циркулирующие в крови
CD56dim(мало)/CD16+
(Re для Fc-фрагмента IgG).
популяция лимфоцитов, лишенных признаков
Т‑ и В‑л. Клеточные мембранные маркеры молекулы CD16 и CD56.
Существует 2 субпопуляции NK-клеток
с мембранным фенотипом
БОЛЬШИЕ ГРАНУЛЯРНЫЕ ЛИМФОЦИТЫ
тканевые
CD56(bright)много/CD16
(в печени и децидуальной оболочке беременной матки)
Слайд 47
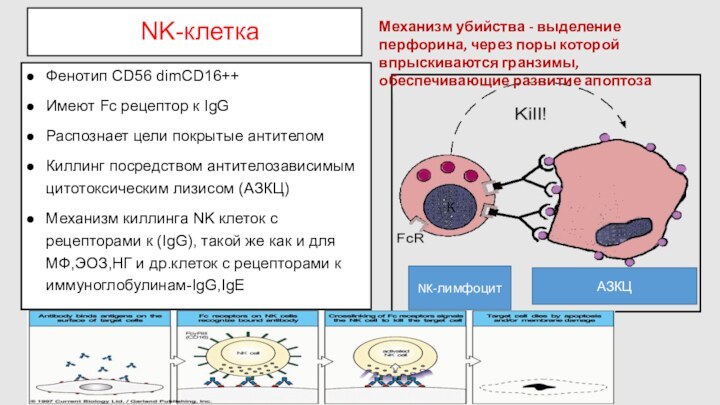
NK-клетка
Фенотип CD56 dimСD16++
Имеют Fc рецептор к IgG
Распознает цели
покрытые антителом
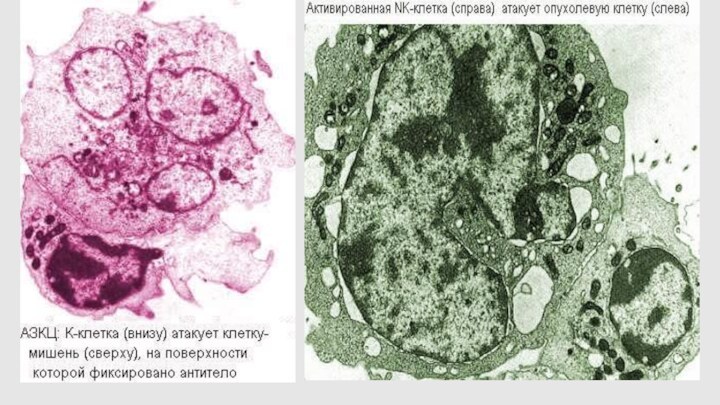
Киллинг посредством антителозависимым цитотоксическим лизисом (АЗКЦ)
Механизм киллинга NK
клеток с рецепторами к (IgG), такой же как и для МФ,ЭОЗ,НГ и др.клеток с рецепторами к иммуноглобулинам-IgG,IgЕ
NK-лимфоцит
АЗКЦ
Механизм убийства - выделение перфорина, через поры которой впрыскиваются гранзимы, обеспечивающие развитие апоптоза
Слайд 49
Активированные NK клетки цитокинами
IL2
IFN
IFN
IL2
Главная физиологическая функция – киллерная
в отношении активированных лимфоцитов.
Основная роль-обнаружение и уничтожение опухолевых
и инфицированных вирусами клеток
субпопуляция экспрессирует хемокины и L –cелектиновые рецепторы,что позволяет им мигрировать в ЛУ, секретировать различные цитокины
В печени эти NK-клетки убивают лимфоциты, принесенные из кишечника в кровь и активированные на пищевые АГ
NK-клетка CD56bright/CD16
Слайд 50
Другие рецепторы естественных киллеров
сложная система рецепторов распознающих:
молекулы собственных
клеток организма
стресс-индуцированные клеточные лиганды, которые свидетельствуют о повреждении
клетки:
NCRs, NKG2D-естественные Re цитотоксичности - активируют цитотоксические функции NK.
Цитокиновые рецепторы
Цитокины играют ключевую роль в активации NK, служат сигналом для NK о присутствии вирусных патогенов.
В активации NK участуют цитокины IL-12, IL-15, IL-18, IL-2 и CCL5.
KLRs , KIRs- активирующие и ингибирующие рецепторы-
для предотвращения атаки на неповрежденные клетки на NK
Слайд 51
Активирующий и ингибирующий сигналы NK.
система регуляторных Re (inhibitory
NK cell receptors).
2 больших семейства:
KLRs (killer lectin-like receptors)—гомологи Re
-лектинов С типа.
KIRs (killer cell immunoglobulin-like receptors)—Re содержащие иммуноглобулин-подобные домены.
Связывание активирующих Re NK со своими лигандами (присутствующими только на повреждённых клетках) активирует цитотоксическую функцию NK.
Регуляторные Re, связываясь с неповреждёнными молекулами MHC I, индуцируют ингибиторный сигнал, подавляя активацию NK .
Слайд 52
NKT - лимфоциты
«Неклассическая» субпопуляция Т-лимфоцитов врожденного иммунитета
сочетает признаки
Т-л и NK, экспрессируют одновременно
ТСR-СD3+ (как Т- л)
лектиновые и KIR рецепторы- NK,
CD1d – неклассическую антигенпрезентирующюю молекулу МНС I класса.
Распознают гликолипидные АГ.
Обнаруживаются в тимусе, селезенке, печени, костном мозге; мало в Л/У, единичные в слизистых оболочках кишечника.
Могут мигрировать в зону воспаления.
Связывание ТСR приводит к быстрой выработке провоспалительных цитокинов, влияющих на другие клетки, в т.ч. на NK, Т-, В-л, ДК
Выполняют эффекторную и иммунорегуляторную функцию во врожденном и адаптивном иммунитете.
Слайд 53
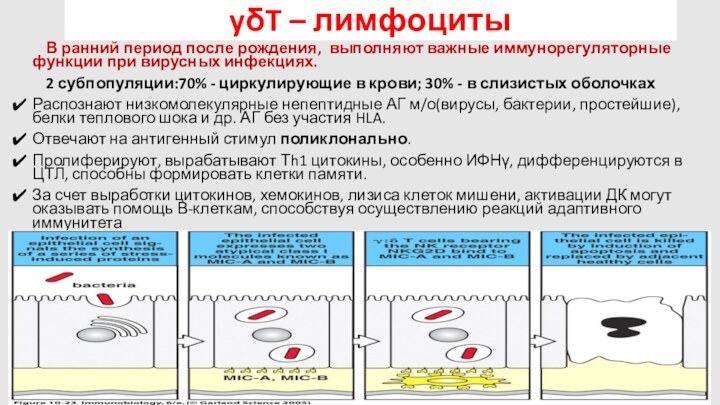
yδT – лимфоциты
В ранний период после рождения, выполняют
важные иммунорегуляторные функции при вирусных инфекциях.
2 субпопуляции:70% -
циркулирующие в крови; 30% - в слизистых оболочках
Распознают низкомолекулярные непептидные АГ м/о(вирусы, бактерии, простейшие), белки теплового шока и др. АГ без участия HLA.
Отвечают на антигенный стимул поликлонально.
Пролиферируют, вырабатывают Тh1 цитокины, особенно ИФНγ, дифференцируются в ЦТЛ, способны формировать клетки памяти.
За счет выработки цитокинов, хемокинов, лизиса клеток мишени, активации ДК могут оказывать помощь В-клеткам, способствуя осуществлению реакций адаптивного иммунитета
Слайд 54
Часть 2.ГУМОРАЛЬНЫЕ ФАКТОРЫ ВРОЖДЕННОГО ИММУНИТЕТА
Слайд 55
СИСТЕМА КОМПЛЕМЕНТА (С)-
-КОМПЛЕКС белков комплемента, их расщепленных фрагментов,
рецепторов к компонентам комплемента, а также белков, регулирующих активность
отдельных компонентов комплемента.
Функция системы комплемента и биологические эффекты:
разрушение (лизис) клеток
привлечение лейкоцитов в очаг воспаления (хемотаксис-С5а)
облегчение фагоцитоза (опсонизация-С3b,C4b и др),
стимуляция воспаления и реакций гиперчувствительности (анафилатоксины-С5а,С3а)
Индукция и контроля воспаления
Регуляция адаптивного иммунного ответа
Слайд 56
Белки системы комплемента
представлены сывороточными белками (> 30), циркулирующими
в кровеносном русле и присутствующими на мембранах клеток
С1 (qrs),
С2, С3, С4, С5, С6, С7, С8, С9
факторы, В, D, Н и I, пропердина (Р)
Манноза-связывающий лектин (MBL), MBL ассоциированные серинопротеазы (MASP-1 MASP-2)
C1 ингибитор (C1-INH, серпин), C4-связывающий белок (C4-ВР), распад ускоряется фактором (DAF),
С1-рецептор (CR1), белок-S (витронектина)
Жюль Борде
1919г.Нобелевская премия
Слайд 57
КОМПОНЕНТЫ КОМПЛЕМЕНТА СИНТЕЗИРУЮТСЯ:
в печени- гепатоцитами (90%)
макрофагами
эпителием
кишечника, почечных канальцев
клетками эндотелия, кератинобластами, фибробластами и др.
астроциты
и микроглия (ЦНС) –осуществляют полный биосинтез системы комлемента (компоненты, рецепторы, регуляторы)
Компоненты комплемента циркулируют в крови в неактивной форме.
При определенных условиях их взаимодействие запускает каскад ферментативных реакций ведет к последовательной активации каждого из компонентов системы комплемента.
Слайд 58
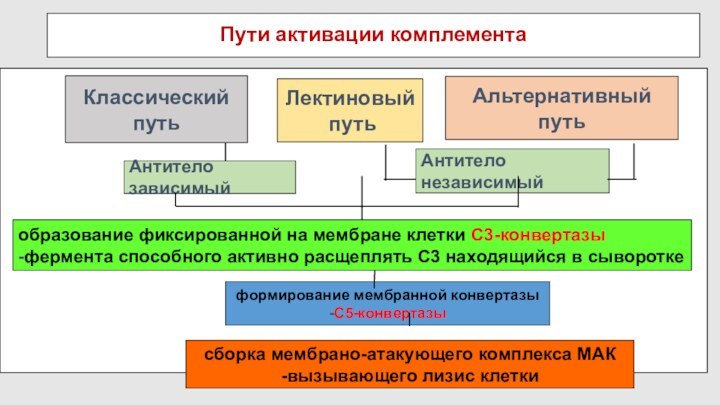
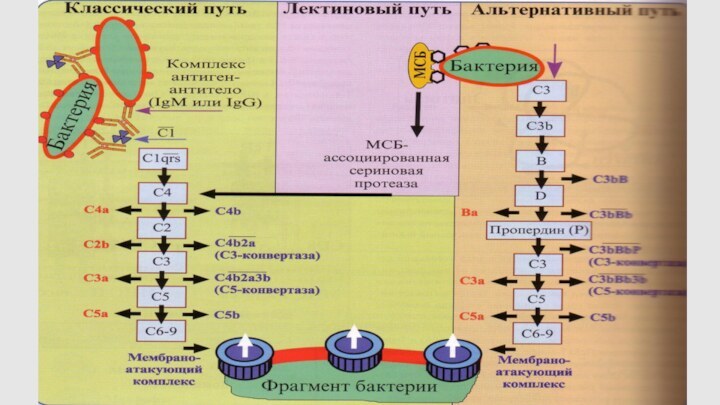
Пути активации комплемента
Классический путь
Альтернативный путь
Лектиновый
путь
Слайд 59
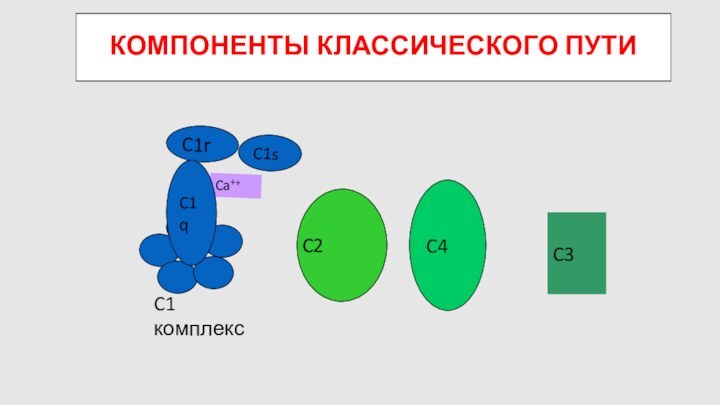
КОМПОНЕНТЫ КЛАССИЧЕСКОГО ПУТИ
C4
C2
C3
C1 комплекс
Слайд 60
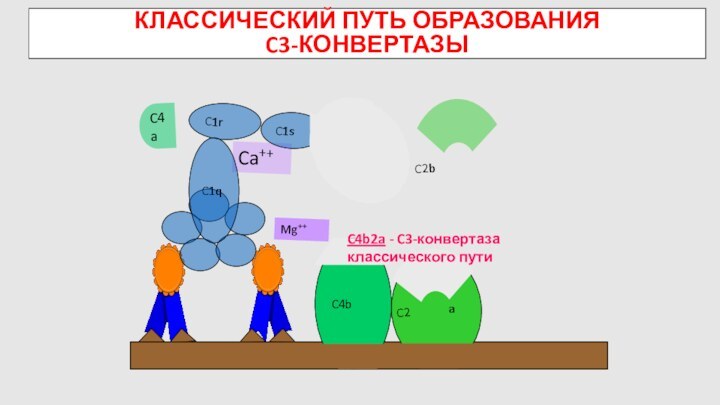
C4
КЛАССИЧЕСКИЙ ПУТЬ ОБРАЗОВАНИЯ
C3-КОНВЕРТАЗЫ
Активация системы комплемента по
классическому пути- индуцируется иммунными комплексами АГ-АТ
Слайд 61
КЛАССИЧЕСКИЙ ПУТЬ ОБРАЗОВАНИЯ
C3-КОНВЕРТАЗЫ
C4b
Mg++
C4a
C2
C4b2a - C3-конвертаза классического
пути
Слайд 62
КЛАССИЧЕСКИЙ ПУТЬ ОБРАЗОВАНИЯ
C5-КОНВЕРТАЗЫ
C4b
Mg++
C4a
C2b
C3
C4b2a3b -C5 конвертаза; запускает сборку
МАК
Слайд 63
Компоненты литического комплекса
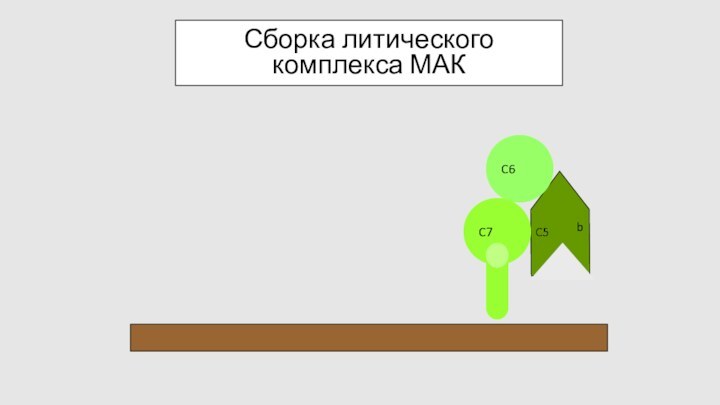
C6
C9
C5
C9
C9
C9
Слайд 65
Сборка литического комплекса МАК
C6
Слайд 66
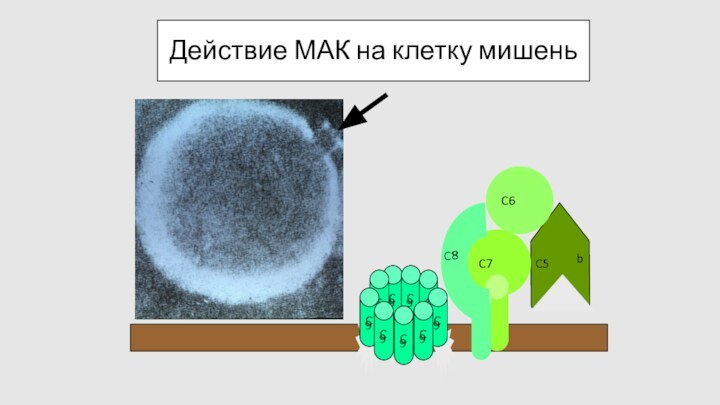
Действие МАК на клетку мишень
C
9
C
9
C
9
C
9
C
9
C
9
C
9
C
9
C
9
Слайд 67
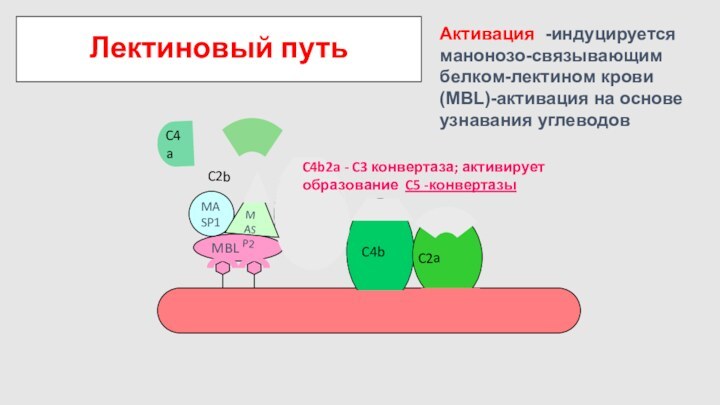
Лектиновый путь
C4
C2
C4b2a - C3 конвертаза; активирует образование C5
-конвертазы
MASP1
MASP2
Активация -индуцируется манонозо-связывающим белком-лектином крови (MBL)-активация на основе узнавания
углеводов
Слайд 69
Сборка литического комплекса МАК
C6
Слайд 70
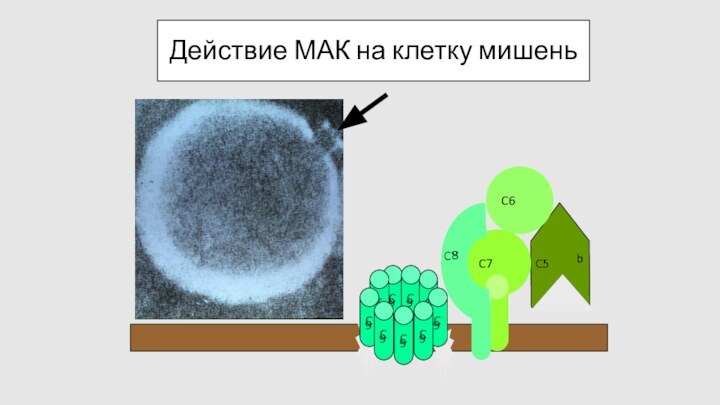
Действие МАК на клетку мишень
C
9
C
9
C
9
C
9
C
9
C
9
C
9
C
9
C
9
Слайд 71
Компоненты альтернативного пути
C3
B
D
P
Запуск начинается с С3
Содержание С3 составляет
½ концентрации всех белков комплемента
Для образования С3-конвертазы эволюция создала
«холостой» механизм образования С3b
Спонтанный гидролиз
С3- С3а+С3b
Н2О
Факторы присутствующие в крови
активатором являются компоненты микробов и агрегаты различных белков
Слайд 72
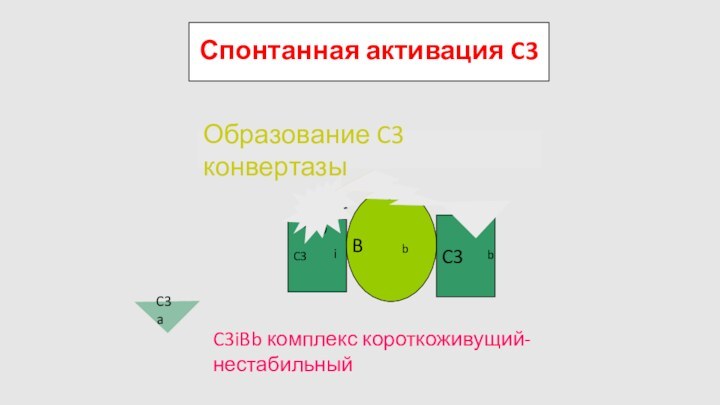
Спонтанная активация C3
C3
H2O
B
D
Образование C3 конвертазы
C3iBb комплекс короткоживущий-нестабильный
C3
Слайд 73
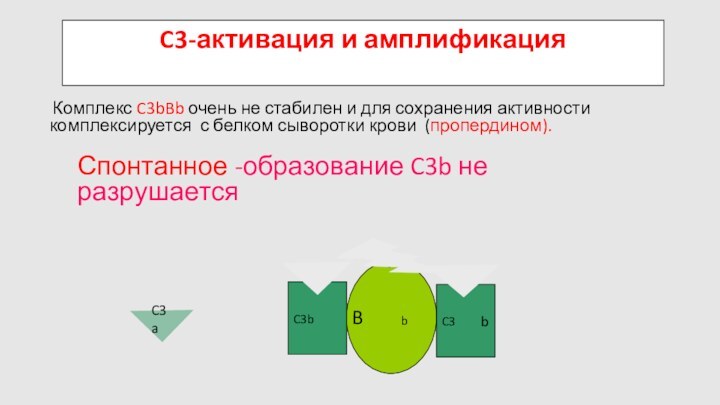
B
D
Спонтанное -образование C3b не разрушается
C3-активация и амплификация
C3
Комплекс
C3bBb очень не стабилен и для сохранения активности комплексируется
с белком сыворотки крови (пропердином).
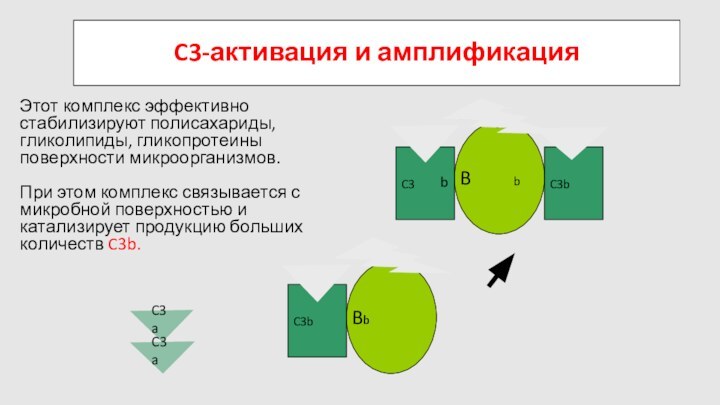
Слайд 74
C3a
B
D
C3
C3-активация и амплификация
Этот комплекс эффективно стабилизируют полисахариды, гликолипиды,
гликопротеины поверхности микроорганизмов.
При этом комплекс связывается с микробной
поверхностью и катализирует продукцию больших количеств C3b.
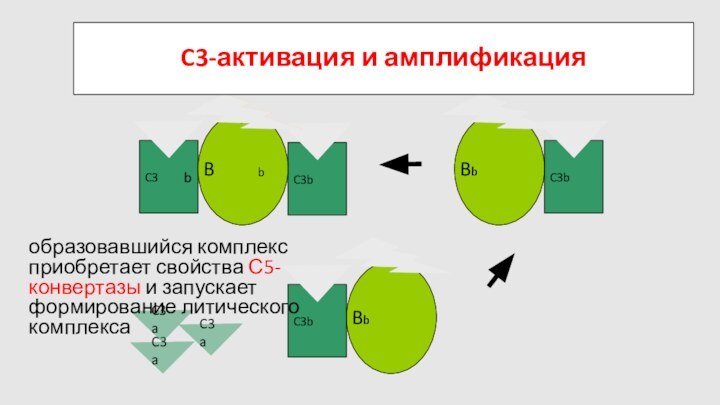
Слайд 75
C3a
C3a
C3
B
D
C3-активация и амплификация
образовавшийся комплекс приобретает свойства С5-конвертазы и
запускает формирование литического комплекса
Слайд 77
Сборка литического комплекса МАК
C6
Слайд 78
Действие МАК на клетку мишень
C
9
C
9
C
9
C
9
C
9
C
9
C
9
C
9
C
9
Слайд 79
C5-конвертазы классического, лектинового и альтернативного путей
C3b
Bb
C3b
C5-конвертаза
альтернативного пути
C5-конвертаза
классического и лектинового путей
Слайд 81
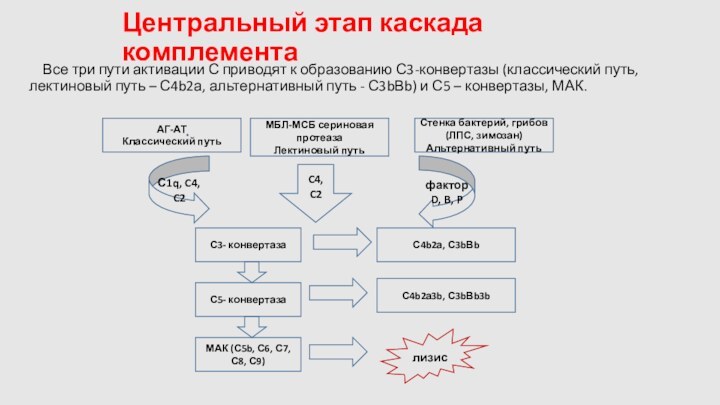
Центральный этап каскада комплемента
Все три пути активации С
приводят к образованию С3-конвертазы (классический путь, лектиновый путь –
С4b2а, альтернативный путь - С3bВb) и С5 – конвертазы, МАК.
С1q, C4, C2
фактор D, B, P
C4, C2
АГ-АТ
Классический путь
МБЛ-МСБ сериновая протеаза
Лектиновый путь
Стенка бактерий, грибов (ЛПС, зимозан)
Альтернативный путь
С5- конвертаза
С4b2а, С3bВb
С3- конвертаза
МАК (С5b, С6, С7, С8, С9)
С4b2а3b, С3bВb3b
лизис
:
Слайд 83
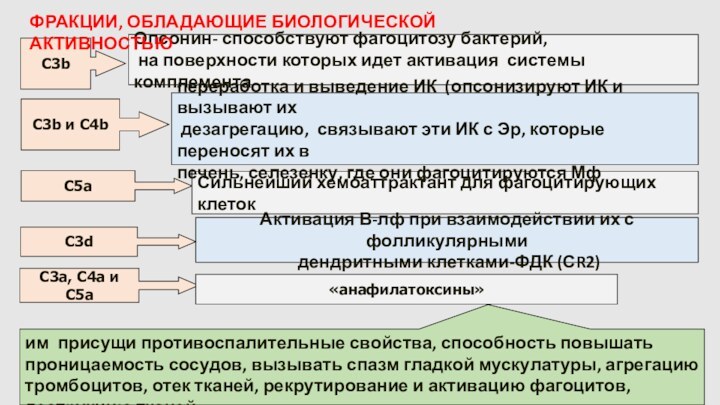
C3b
Опсонин- способствуют фагоцитозу бактерий,
на поверхности которых
идет активация системы комплемента
C5a
Сильнейший хемоаттрактант для фагоцитирующих клеток
C3a, C4a
и C5a
«анафилатоксины»
им присущи противоспалительные свойства, способность повышать проницаемость сосудов, вызывать спазм гладкой мускулатуры, агрегацию тромбоцитов, отек тканей, рекрутирование и активацию фагоцитов, деструкцию тканей
C3b и C4b
переработка и выведение ИК (опсонизируют ИК и вызывают их
дезагрегацию, связывают эти ИК с Эр, которые переносят их в
печень, селезенку, где они фагоцитируются Мф
Активация В-лф при взаимодействии их с фолликулярными
дендритными клетками-ФДК (СR2)
C3d
ФРАКЦИИ, ОБЛАДАЮЩИЕ БИОЛОГИЧЕСКОЙ АКТИВНОСТЬЮ
Слайд 84
Биологические эффекты C5a
Активация нейтрофилов
Адгезия
нейтрофилов
Миграция и хемотаксис
нейтрофилов
4.Активация моноцитов
5.Дегрануляция
тучных клеток
спазм гладкой мускулатуры увеличение проницаемости сосудов
Слайд 85
Обсонизация и фагоцитоз
комплемент
бактерия
Фагоцитирующие клетки
обсонизация
распознавание
фагоцитоз
Слайд 86
РЕЦЕПТОРЫ К КОМПОНЕНТАМ КОМПЛЕМЕНТА
Эр
Т-лф
В-лФ
НГ,МФ,ЭОЗ
ДК
CR1(СD35)
опсонизация
В-лф
Тимоциты
ДК
CR2(СD21)
для связывания С3d и для
прикрепления вируса Эпштейна-Барр - возбудителя инфекционного мононуклеоза
Все
лейкоциты
CR3 и
CR4
(CD11b/CD18)
адгезионные молекулы
лейкоцитов
ТК
Баз
Эоз
НГ
Мон,МФ
лф
C3a и C5a
Для анафилотоксинов
Слайд 87
РЕГУЛЯЦИЯ АКТИВНОСТИ КОМПЛЕМЕНТА
Регуляторы – белки, подавляющие отдельные стадии
каскада активации С, ограничивают действие С на собственные клетки,
блокируют его литический потенциал.
Мембранные:
DAF (CD55) – Decay-acceleraiting Factor – фактор, ускоряющий распад– препятствует сборке МАК и усиливает катаболизм С3- и С5-конвертаз.
МСР (CD46 )–Membran Cofactor Protein – мембранны кофакторный белок – обладает кофакторной активностью в протеолизе С3b/C4b, опосредованном фактором I.
CR1 (CD35) ограничивает ранние стадии активации С, препятствует образованию С3-конвертаз классического и альтернативного путей активации.
р18 (CD59) – связывает С8,С9 и ограничивает образование мембрано-атакующего комплекса.
Слайд 88
РЕГУЛЯЦИЯ АКТИВНОСТИ КОМПЛЕМЕНТА
Растворимые:
Ингибитор С1 - эстеразы (C1-INH или
С1-inh) блокирует протеолиз С2 и С4 под действием С1s
, т.е. классически путь активации С
С3b инактиватор (C3b-ina или фактор I) инактивирует С3b в сочетании с фактором H (1H), который способствует диссоциации С3b. Фактор I способствует превращению C3B в iC3b, который как и C3b, может служить опсонином.
Фактор Н соединяется с фрагментом C3b, ускоряет распад конвертазы, вызывает диссоциацию C3b на неактивные субъединицы (способен связывать ВИЧ)
С4-bp – связывает С4b и ускоряет распад конвертазы, служит кофактором в расщеплении С4b
Белок S - препятствует взаимодействию комплекса С5b,6,7 с клеточной мембраной
Растворимые рецепторы комплемента (СR1, CR2 др.)
Слайд 90
Нарушения в системе комплемента
ГЕНЕТИЧЕСКИ-ДЕТЕРМИНИРОВАННЫЕ
дефекты
компонентов C1 - C4
дефекты
любых компонентов
проявляются аутоиммунными заболеваниями (СКВ, гломерулонефрит)
проявляются рецидивирующими бактериальными и
грибковыми инфекциями
Слайд 91
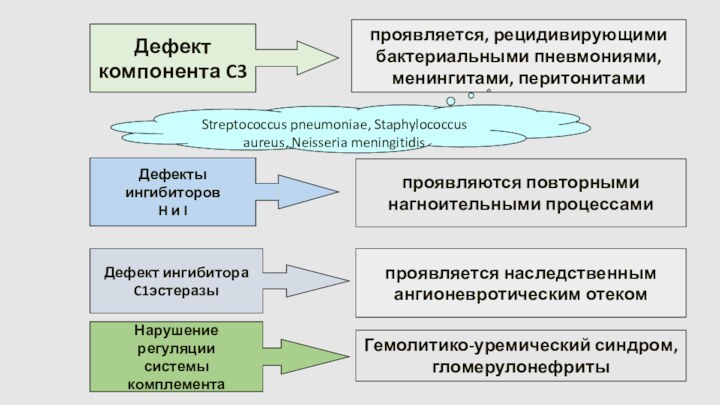
Дефект
компонента C3
проявляется, рецидивирующими
бактериальными пневмониями,
менингитами, перитонитами
Streptococcus pneumoniae,
Staphylococcus aureus, Neisseria meningitidis
Дефекты ингибиторов
H и I
проявляются повторными
нагноительными процессами
Дефект ингибитора
C1эстеразы
проявляется наследственным
ангионевротическим отеком
Нарушение регуляции
системы комплемента
Гемолитико-уремический синдром,
гломерулонефриты
Слайд 92
Дефицит C1-ингибитора: ангионевротический отек
Слайд 93
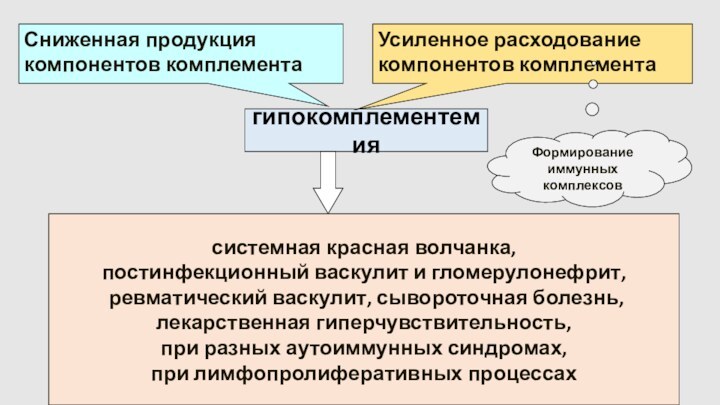
гипокомплементемия
Сниженная продукция компонентов комплемента
Усиленное расходование
компонентов комплемента
Формирование
иммунных комплексов
системная красная
волчанка,
постинфекционный васкулит и гломерулонефрит,
ревматический васкулит, сывороточная болезнь,
лекарственная гиперчувствительность,
при разных аутоиммунных синдромах,
при лимфопролиферативных процессах
Слайд 94
-группа протеинов синтезируемая гепатоцитами.
В ответ на
стрессорные факторы (воспаление, малигнизация, травма, обширное оперативное вмешательство, инфаркт
миокарда и.т.д.) уровни реактантов (БОФ) резко повышаются в течение 24 часов под влиянием провоспалительных цитокинов (ИЛ1, ИЛ6, ФНО- α и ФНО -β, ИНФ, тромбоцитактивирующий фактор);
.
Входят : с-реактивный белок, маннозосвязывающий белок, гаптоглобин, церулоплазмин и фибриноген, α1-антитрипсин, другие ингибиторы протеаз.
Гуморальные факторы: Белки острой фазы воспаления (реактанты).
Слайд 95
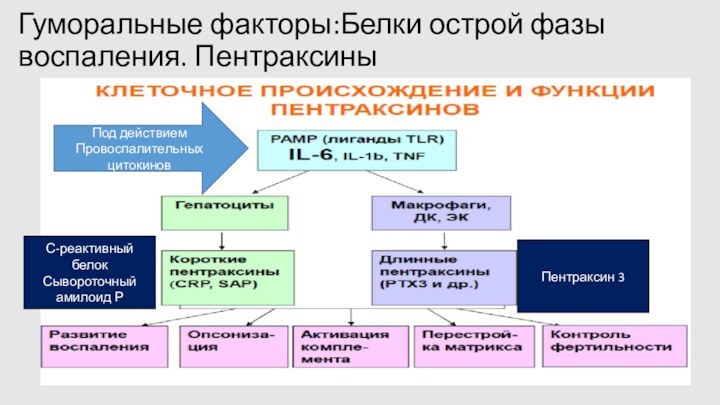
Гуморальные факторы:Белки острой фазы воспаления. Пентраксины
С-реактивный белок
Сывороточный амилоид
Р
Под действием
Провоспалительных цитокинов
Пентраксин 3
Слайд 96
С- реактивный белок (СРБ)
В норме (≈ 1
мкг/мл), при воспалительных процессах быстро нарастает в 20-25 раз.
Обладает свойствами С- лектинов → связывает углеводные группы.
Другие лиганды → фосфорилхолин, ДНК, полиэлектролиты, белки межклеточного матрикса.
СРБ связывается с фосфорилхолином Грамм (+) м/о открывая новые участки молекул способные связываться с комплементом и активизировать его классический и альтернативные пути)
Связанный СРБ - хемоатрактант для НГ
После расщепления СРБ фагоцитами→ высвобождаются фрагменты способные → активировать Мон.
• СРБ способен связываться с Re Т-лимфоцитов
Т-л могут синтезировать СРБ в небольшом количестве
Функция СРБ
▪ способствует фагоцитозу;
▪ увеличивает подвижность лейкоцитов;
▪ активирует иммунные реакции;
▪ активируют связывание комплемента.
Слайд 97
Маннозосвязывающий лектин – МСЛ (MBL)-
относится к семейству коллектинов - подобен компоненту комплемента C1q.
Исходная
концентрация в сыворотке крови – 0,1 – 1 мг/мл, в острой фазе повышается в 5 – 10 раз.
МСЛ - связывается с остатками маннозы на поверхности патогенов (грибы, вирусы, бактерии) → изменяет свою конфигурацию и приобретает активность сериновой протеиназы/эстеразы.
Эта протеиназа способна расщеплять С4 и С2 и индуцирует активацию комплемента по лектиновому пути.
Функции
Опсонизирует микроорганизмы для фагоцитоза моноцитами
Активация комплемента по лектиновому пути
Белки сурфактанта SP-A и SP-D (сурфактантные протеины)
Относится к семейству коллектинов, секретируемых эпителиальными клетками бронхиол (SP-A), эпителием дыхательных путей (SP-D). Многие Г- и Г+ бактерии, респираторные вирусы, грибы и микобактерии служат мишенями для белков сурфактанта.
Функции
Активируют фагоцитоз
Слайд 98
Под влиянием патогенов МФ,НГ ,ЭК активируются, секретируют цитокины
и хемокины
Лейкоциты мигрируют через сосудистую стенку в ткани
М/о фагоцитируются
в очаге воспаления НГ и МФ
Слайд 99
Фагоциты. В начале данного этапа их эффективность невелика:
число
НГ и МФ в месте внедрения недостаточно для развития
эффективной реакции,
их возможности в отношении распознавания и разрушения микробов ограничены, поскольку они не активированы.
При наличии в организме естественных антител к микроорганизмам, эффективность фагоцитоза значительно повышается.
Комплемент. Активируется по альтернативному пути, так как
на поверхности микробных клеток отсутствуют DAF или CD59,
пропердин стабилизирует образующиеся комплексы СЗb—Вb.
Повышение количества фиксированных на поверхности микробной клетки фрагментов СЗb способствует распознаванию их фагоцитами.