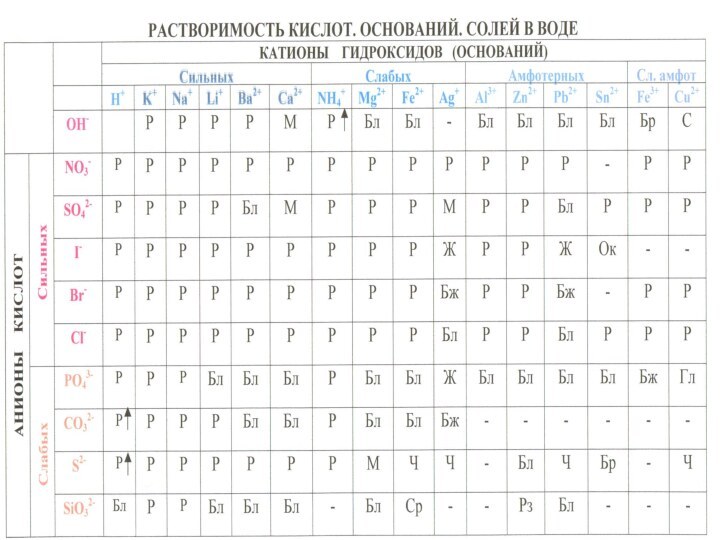
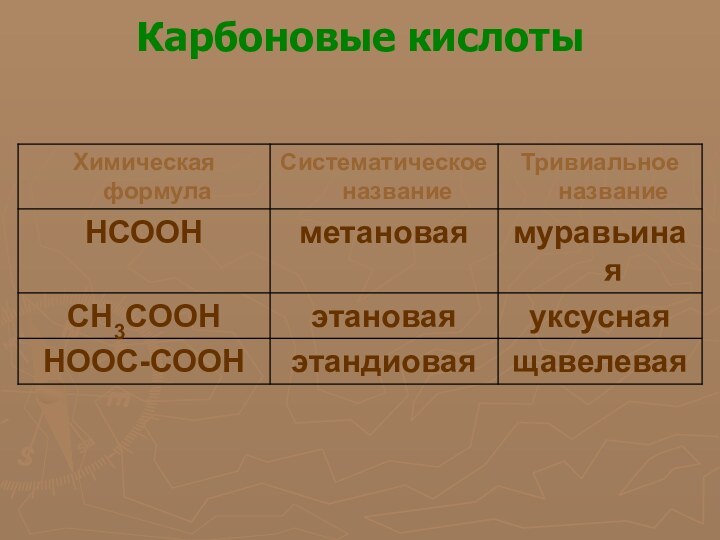
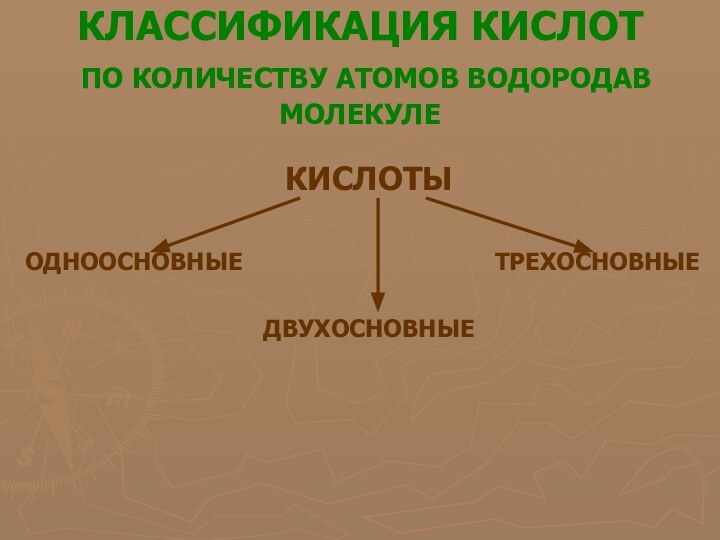
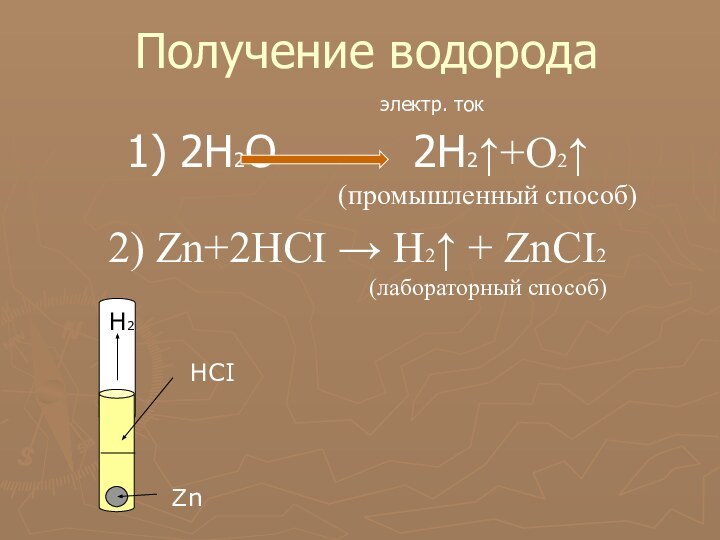
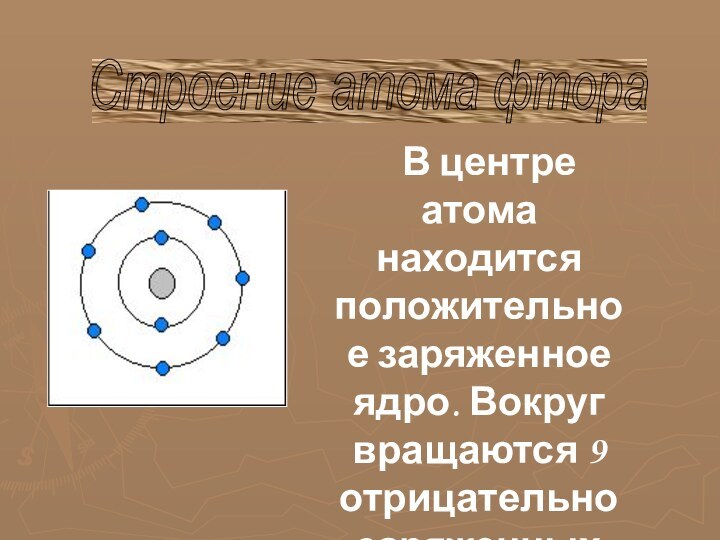
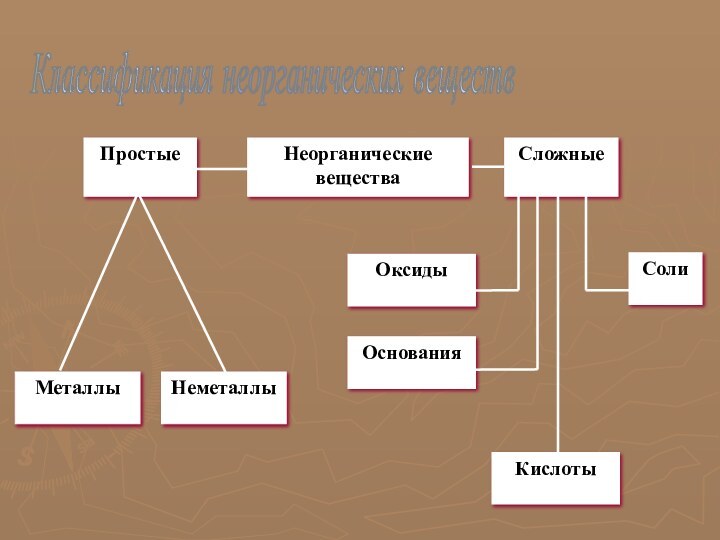
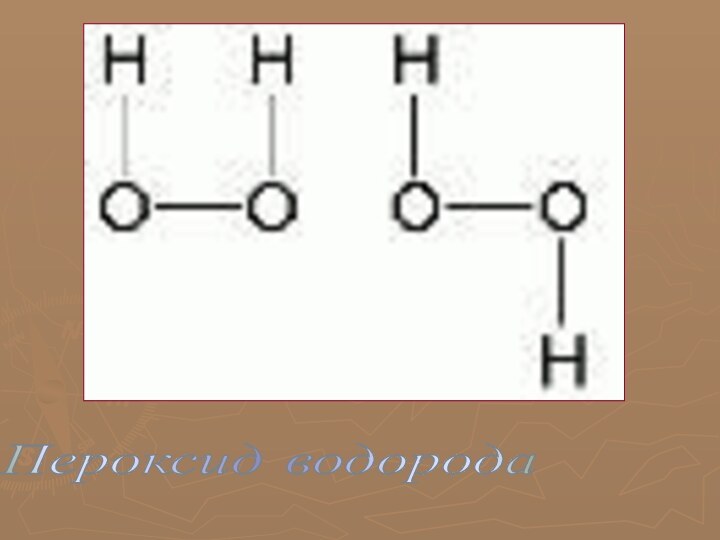
многообразие окружающей нас природы состоит из сочетаний сравнительно небольшого
числа химических элементов.
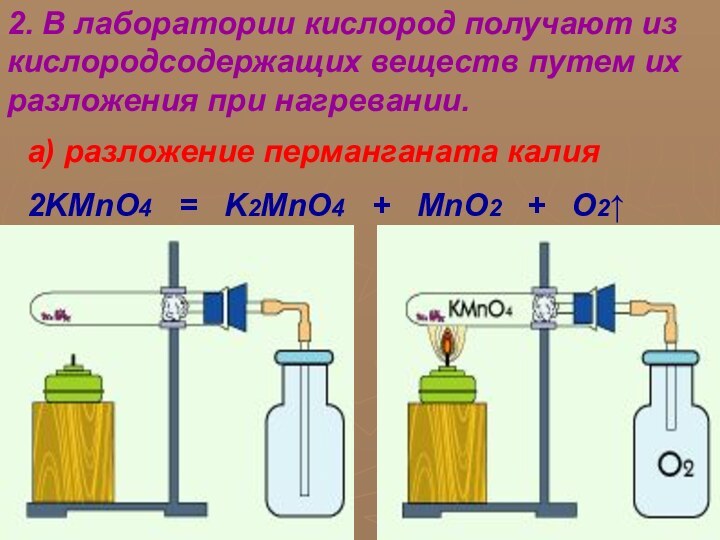
В различные исторические эпохи в понятие «элемент» вкладывался различный смысл. Древнегреческие философы в качестве «элементов» рассматривали четыре «стихии» – тепло, холод, сухость и влажность. Сочетаясь попарно, они образовывали четыре «начала» всех вещей – огонь, воздух, воду и землю. В средние века к этим началам добавились соль, сера и ртуть. В XVII веке Р. Бойль указал на то, что все элементы носят материальный характер и их число может быть достаточно велико.
Слайд 3
В 1787 году французский химик А. Лавуазье создал
«Таблицу простых тел». В нее вошли все известные к
тому времени элементы. Под последними понимались простые тела, которые не удавалось разложить химическими методами на еще более простые. Впоследствии выяснилось, что в таблицу вошли и некоторые сложные вещества.
Слайд 4
В настоящее время понятие «химический элемент» установлено точно.
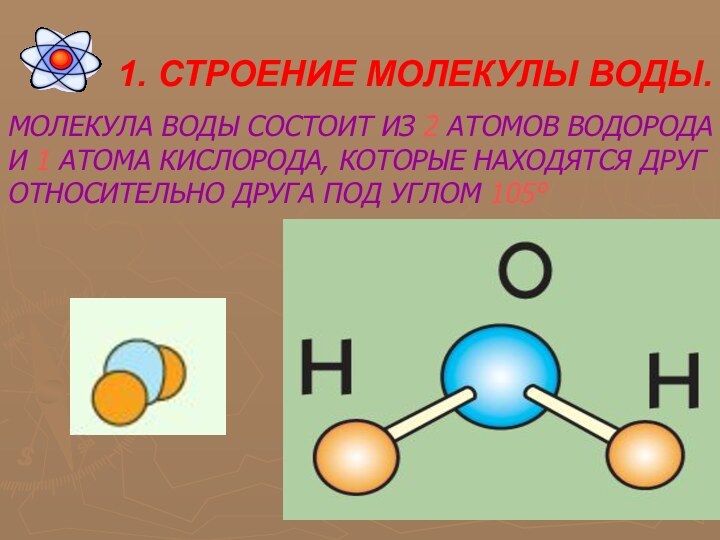
Химический
элемент – вил атомов с одинаковым положительным зарядом ядра.
(Последний равен порядковому номеру элемента в таблице Менделеева.)
В настоящее время известно 107 элементов. Около 90 из них существуют в природе. Остальные получены искусственно с помощью ядерных реакций. 104-107 элементы были синтезированы учеными-физиками в Объединенном институте ядерных исследований в городе Дубне. В настоящее время продолжаются работы по искусственному получению химических элементов с более высокими порядковыми элементами.
Слайд 5
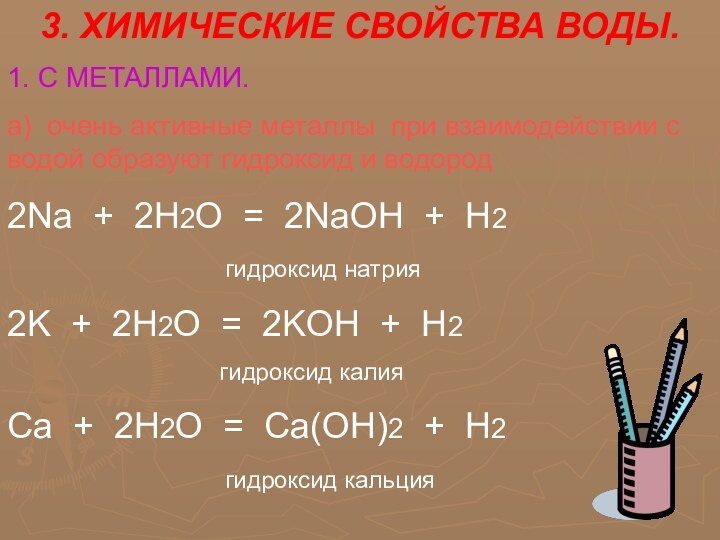
Все элементы делятся на металлы и неметаллы. Из
107 элементов 85 относятся к металлам. К неметаллам относят
следующие элементы: гелий, неон, аргон, криптон, ксенон, радон, фтор, хлор, бром, йод, астат, кислород, сера, селен, теллур, азот, фосфор, мышьяк, углерод, кремний, бор, водород. Однако это деление условное. При определенных условиях некоторые металлы могут проявлять неметаллические свойства, а некоторые неметаллы – металлические свойства.
Слайд 6
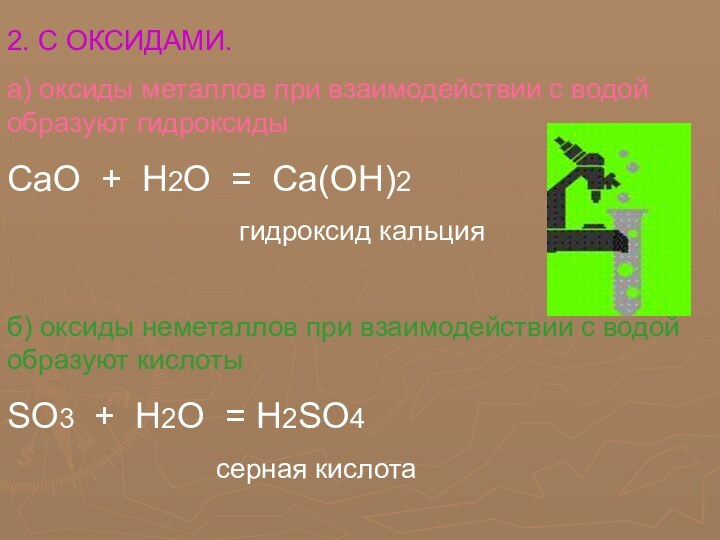
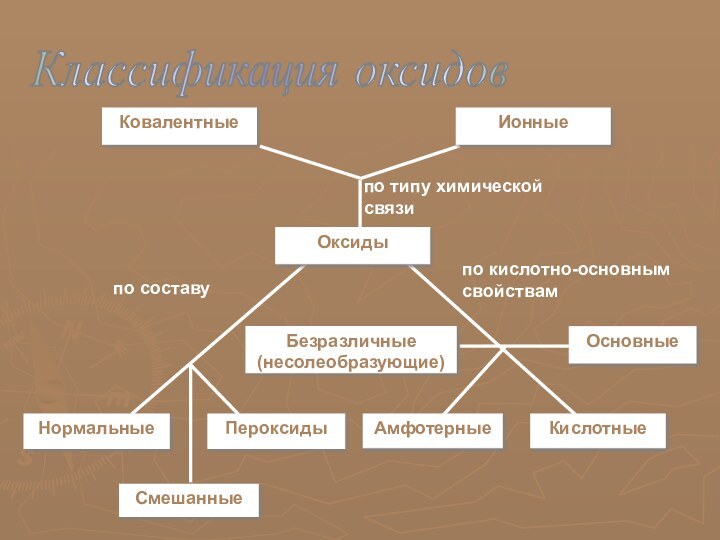
Положение неметаллических элементов в периодической системе химических элементов.
Нахождение в природе. Общие химический и физические свойства
Неметаллических элементов
по сравнению к металлическими элементами относительно немного. Их размещение в периодической системе химических элементов Д.И. Менделеева отражено в таблице №1.
Слайд 8
Как видно из таблицы №1 неметаллические элементы в
основном расположены в правой верхней части периодической системы
Слайд 9
Так как в периодах слева направо у атомов
элементов увеличивается заряды ядер и уменьшаются атомные радиусы, а
в группах сверху вниз атомные радиусы также возрастают, то понятно, почему атому неметаллов сильнее, чем атомы металлов, притягивают наружные электроны. В связи с этим у неметаллов преобладают окислительные свойства. Особенно сильные окислительные свойства, т.е. способность присоединять электроны, проявляют неметаллы, находящиеся во 2-ом и 3-м периодах VI-VII групп. Самым сильным окислителем является фтор. В соответствии с численными значениями относительных электроотрицательностей окислительные способности неметаллов увеличивается в следующем порядке: Si, B, H, P, C, S, I, N, Cl, O, F. Следовательно, энергичнее всего взаимодействует с водородом и металлами фтор:
H2 + F2 ? 2HF
Слайд 10
Менее энергично реагирует кислород:
2H2 +O2 ? 2H2 О
Фтор
– самый типичный неметалл, которому нехарактерны восстановительные свойства, т.е.
способность отдавать электроны в химических реакциях.
Кислород же, судя по его соединениям с фтором, может проявлять и положительную степень окисления, т.е. являться восстановителем.
Все остальные неметаллы проявляют восстановительные свойства. Причем эти свойства постепенно возрастают от кислорода к кремнию: O, Cl, N, I, S, C, P, H, B, Si. Так, например, хлор непосредственно с кислородом не соединяется, но косвенным путем можно получить его оксиды (Cl2 O, ClO2 , Cl2O2 ), в которых хлор проявляет положительную степень окисления. Азот при высокой температуре непосредственно соединяется с кислородом и, следовательно, проявляет восстановительные свойства. Еще легче с кислородом реагирует сера: она проявляет и окислительные свойства.
Слайд 11
Перейдем к рассмотрению строения молекул неметаллов. Неметаллы образуют
как одноатомные, так и двухатомные молекулы.
К одноатомным неметаллам относятся
инертные газы, практически не реагирующие даже с самыми активными веществами. Инертные газы расположены в VIII группе Периодической системы, а химические формулы соответствующих простых веществ следующие: He, Ne, Ar, Kr, Xe и Rn.
Некоторые неметаллы образуют двухатомные молекулы. Это H2, F2, Cl2, Br2, I2 (элементы VII группы Периодической системы ), а также кислород O2 и азот N2. Из трехатомных молекул состоит газ озон (O3).
Слайд 12
Для веществ неметаллов, находящихся в твердом состоянии, составить

химическую формулу довольно сложно. Атомы углерода в графите соединены
друг с другом различным образом. Выделить отдельную молекулу в приведенных структурах затруднительно. При написании химических формул таких веществ, как и в случае с металлами, вводится допущение, что такие вещества состоят только из атомов. Химические формулы, при этом, записываются без индексов - C, Si, S и т.д.
Такие простые вещества, как озон и кислород, имеющие одинаковый качественный состав (оба состоят из одного и того же элемента - кислорода), но различающиеся по числу атомов в молекуле, имеют различные свойства. Так, кислород запаха не имеет, в то время как озон обладает резким запахом, который мы ощущаем во время грозы. Свойства твердых неметаллов, графита и алмаза, имеющих также одинаковый качественный состав, но разное строение, резко отличаются (графит хрупкий, алмаз твердый). Таким образом, свойства вещества определяются не только его качественным составом, но и тем, сколько атомов содержится в молекуле вещества и как они связаны между собой.
Неметаллы в виде простых тел находятся в твердом или газообразном состоянии (исключая бром – жидкость). Они не имеют физических свойств, присущих металлам. Твердые неметаллы не обладают характерным для металлов блеском, они обычно хрупки, плохо проводят электрический ток и тепло (за исключением графита).
Слайд 13
Общие химические свойства неметаллов
Оксиды неметаллов относят к
кислотным оксидам, которым соответствуют кислоты. С водородом неметаллы образуют
газообразные соединения (например HCl, H2S, NH3). Водные растворы некоторых из них (например, галогеноводородов) – сильные кислоты. С металлами типичные неметаллы дают соединения с ионной связью (например, NaCl). Неметаллы могут при определенных условиях между собой реагировать, образуя соединения с ковалентной полярной (H2O, HCl) и неполярной связями (CO2).
С водородом неметаллы образуют летучие соединения, как, например, фтороводород HF, сероводород H2S, аммиак NH3, метан CH4. При растворении в воде водородные соединения галогенов, серы, селена и теллура образуют кислоты той же формулы, что и сами водородные соединения: HF, HCl, HCl, HBr, HI, H2S, H2Se, H2Te.
Слайд 14
При растворении в воде аммиака образуются аммиачная вода,
обычно обозначаемая формулой NH4OH и называемая гидроксидом аммония. Ее
также обозначают формулой NH3 • H2O и называют гидратом аммиака.
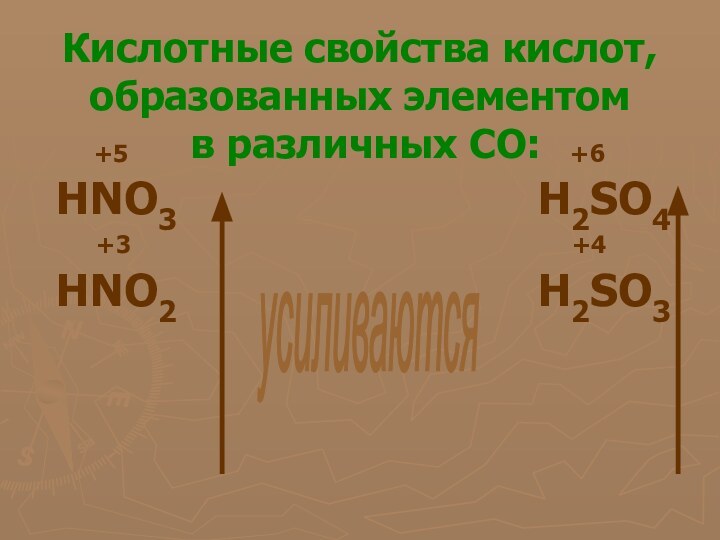
С кислородом неметаллы образуют кислотные оксиды. В одних оксидах они проявляют максимальную степень окисления, равную номеру группы (например, SO2, N2O5), а других – более низкую (например, SO2, N2O3). Кислотным оксидам соответствуют кислоты, причем из двух кислородных кислот одного неметалла сильнее та, в которой он проявляет более высокую степень окисления. Например, азотная кислота HNO3 сильнее азотистой HNO2, а серная кислотаH2SO4 сильнее сернистой H2SO3.
Слайд 15
Строение и свойства простых веществ – неметаллов
Самые
типичные неметаллы имеют молекулярное строение, а менее типичные –
немолекулярное. Этим и объясняется отличие их свойств. Наглядно это отражено в схеме №2.
Слайд 17
Кристаллический бор В (как и кристаллический кремний) обладает
очень высокой температурой плавления (2075°С) и большой твердостью. Электрическая
проводимость бора с повышением температуры сильно увеличивается, что дает возможность широко применять его в полупроводниковой технике. Добавка бора к стали и к сплавам алюминия, меди, никеля и др. улучшает их механические свойства.
Слайд 18
Бориды (соединения бора с некоторыми металлами, например с
титаном: TiB, TiB2) необходимы при изготовлении деталей реактивных двигателей,
лопаток газовых турбин.
Как видно из схемы №2, углерод С, кремний Si, бор В имеют сходное строение и обладают некоторыми общими свойствами. Как простые вещества они встречаются в двух видоизменениях – в кристаллическом и аморфном. Кристаллические видоизменения этих элементов очень твердые, с высокими температурами плавления. Кристаллический кремний обладает полупроводниковыми свойствами.
Слайд 19
Все эти элементы образуют соединения с металлами –
карбиды, силициды и бориды (CaC2, Al4C3, Fe3C, Mg2Si, TiB,
TiB2). Некоторые из них обладают большей твердостью, например Fe3C, TiB. Карбид кальция используется для получения ацетилена.
Если сравнить расположение электронов по орбиталям ф атомах фтора, хлора и других галогенов, то можно судить и об их отличительных свойствах. У атома фтора свободных орбиталей нет. Поэтому атомы фтора могут проявить только валентность I и степень окисления – 1. В атомах других галогенов, например в атоме хлора, на том же энергетическом уровне имеются свободные d-орбитали. Благодаря этому распаривание электронов может произойти тремя разными путями.
Слайд 20
В первом случае хлор может проявить степень окисления
+3 и образовать хлористую кислоту HClO2, которой соответствуют соли
– хлориты, например хлорит калия KClO2.
Во втором случае хлор может образовать соединения, в которых степень окисления хлора +5. К таким соединениям относятся хлороноватая кислота HClO3 и ее соли – хлораты, например хлорат калия КClO3 (бертолетова соль).
В третьем случае хлор проявляет степень окисления +7, например в хлорной кислоте HClO4 и в ее солях – перхлоратах, например в перхлорате калия КClO4.
Слайд 21
Кислородные и водородные соединения неметаллов
С кислородом неметаллы
образуют кислотные оксиды. В одних оксидах они проявляют максимальную
степень окисления, равную номеру группы (например, SO2, N2O5), а других – более низкую (например, SO2, N2O3). Кислотным оксидам соответствуют кислоты, причем из двух кислородных кислот одного неметалла сильнее та, в которой он проявляет более высокую степень окисления. Например, азотная кислота HNO3 сильнее азотистой HNO2, а серная кислота H2SO4 сильнее сернистой H2SO3.
Слайд 22
Характеристики кислородных соединений неметаллов:
Свойства высших оксидов (т.е.
оксидов, в состав которых входит элемент данной группы с
высшей степенью окисления) в периодах слева направо постепенно изменяются от основных к кислотным.
В группах сверху вниз кислотные свойства высших оксидов постепенно ослабевают. Об этом можно судить по свойствам кислот, соответствующих этим оксидам.
Возрастание кислотных свойств высших оксидов соответствующих элементов в периодах слева направо объясняется постепенным возрастанием положительного заряда ионов этих элементов.
В главных подгруппах периодической системы химических элементов в направлении сверху вниз кислотные свойства высших оксидов неметаллов уменьшаются.
Слайд 23
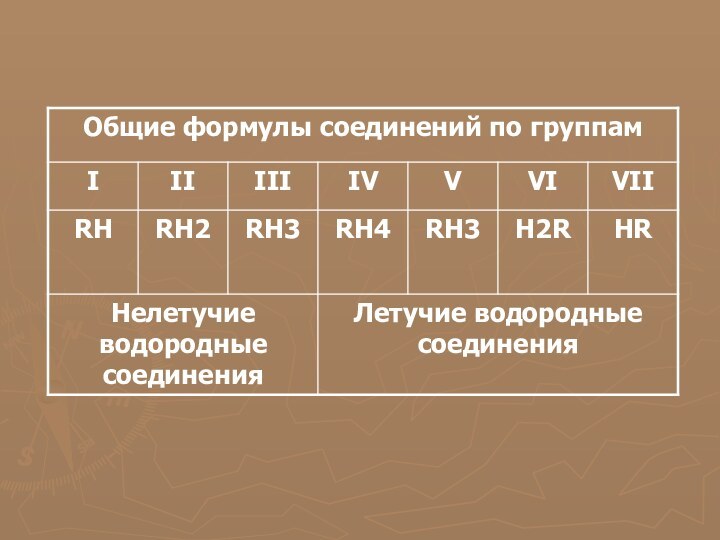
Общие формулы водородных соединений по группам периодической системы
химических элементов приведены в таблице №3.
Слайд 25
С металлами водород образует (за некоторым исключением) нелетучие
соединения, которые являются твердыми веществами немолекулярного строения. Поэтому их
температуры плавления сравнительно высоки.
С неметаллами водород образует летучие соединения молекулярного строения. В обычных условиях это газы или летучие жидкости.
В периодах слева направо кислотные свойства летучих водородных соединений неметаллов в водных растворах усиливается. Это объясняется тем, что ионы кислорода имеют свободные электронные пары, а ионы водорода – свободную орбиталь, то происходит процесс, котроый выглядит следующим образом:
H2O + HF ? H3O + F
Фтороводород в водном растворе отщепляет положительные ионы водорода, т.е. проявляет кислотные свойства. Этому процессу способствует и другое обстоятельство: ион кислорода имеет неподеленную электронную пару, а ион водорода – свободную орбиталь, благодаря чему образуется донорно-акцепторная связь.
Слайд 26
При растворении аммиака в воде происходит противоположный процесс.
А так как ионы азота имеют неподеленную электронную пару,
а ионы водорода – свободную орбиталь, возникает дополнительная связь и образуются ионы аммония NH4+ и гидроксид-ионы ОН-. В результате раствор приобретает основные свойства. Этот процесс можно выразить формулой:
H2O + NH3 ? NH4 + OH
Молекулы аммиака в водном растворе присоединяют положительные ионы водорода, т.е. аммиак проявляет основные свойства.
Теперь рассмотрим, почему водородное соединение фтора – фтороводород HF – в водном растворе является кислотой, но более слабой, чем хлороводородная. Это объясняется тем, что радиусы ионов фтора значительно меньше, чем ионов хлора. Поэтому ионы фтора гораздо сильнее притягивают к себе ионы водорода, чем ионы хлора. В связи с этим степень диссоциации фтороводородной кислоты значительно меньше, чем соляной кислоты, т.е. фтороводородная кислота слабее соляной кислоты.
Слайд 27
Из приведенных примеров можно сделать следующие общие выводы:
В

периодах слева направо у ионов элементов положительный заряд увеличивается.
В связи с этим кислотные свойства летучих водородных соединений элементов в водных растворах усиливаются.
В группах сверху вниз отрицательно заряженные анионы все слабее притягивают положительно заряженные ионы водорода Н+. В связи с этим облегчается процесс отщепления ионов водорода Н+ и кислотные свойства водородных соединений увеличиваются.
Водородные соединения неметаллов, обладающие в водных растворах кислотными свойствами, реагируют со щелочами. Водородные же соединения неметаллов, обладающие в водных растворах основными свойствами, реагируют с кислотами.
Окислительная активность водородных соединений неметаллов в группах сверху вниз сильно увеличивается. Например, окислить фтор из водородного соединения HF химическим путем нельзя, окислить же хлор из водородного соединения HCl можно различными окислителями. Это объясняется тем, что в группах сверху вниз резко возрастают атомные радиусы, в связи с чем отдача электронов облегчается.
Слайд 28
Но ещё 280 слайдов ждут Вас!!!
Далее я буду
рассматривать неМе на примерах.
Вот так я описал неМЕ…………
Слайд 29
дата
Сера: строение, физические и химические свойства, применение
Слайд 30
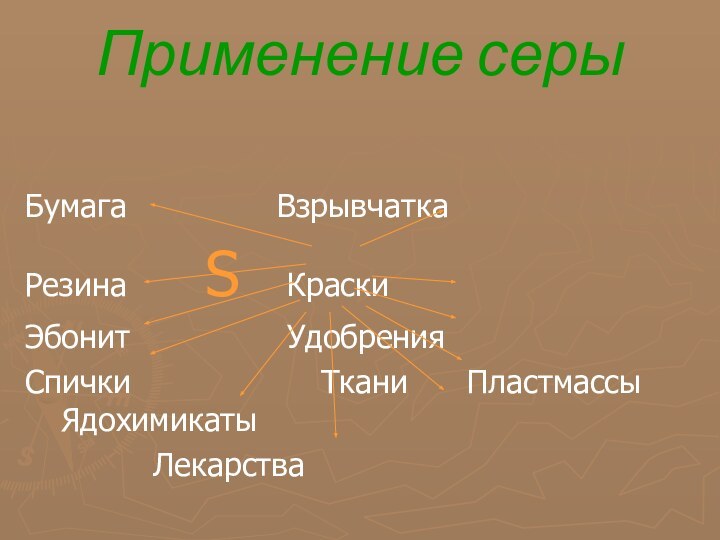
Применение серы
Бумага Взрывчатка
Резина S Краски
Эбонит Удобрения
Спички Ткани
Пластмассы Ядохимикаты
Лекарства
Слайд 32
Сера,
строение, физические, химические свойства
Слайд 33
Характеристика S по положению в периодической системе Д.И.
Менделеева
Сера, S, порядковый номер 16, 6 группа, главная подгруппа,
VI А, 3 период, неметалл, Ar (S) = 32.
Строение атома: Z ядра = + 16, р+ =16, е- = 16, n0 = 16, 3 электронных слоя, 6 электронов на внешнем слое.
1s22s22p63s23p4
Слайд 34
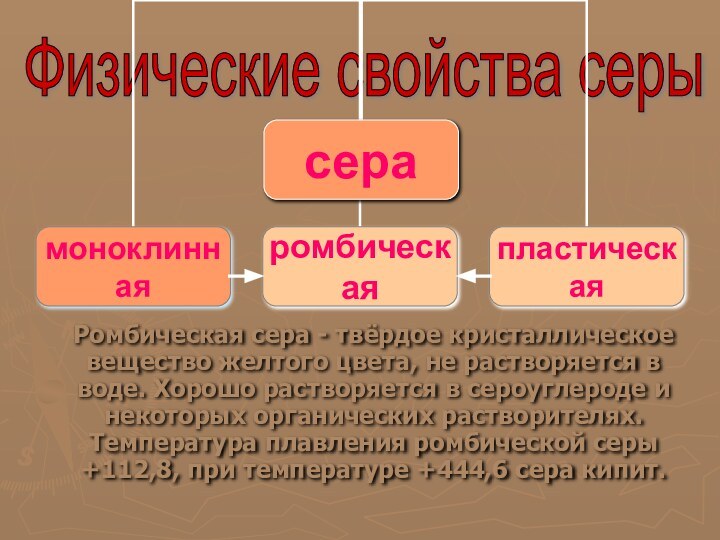
Сера – простое вещество
Аллотропые видоизменения:
Ромбическая
Слайд 35
Сера – простое вещество
Аллотропые видоизменения:
Моноклинная
Слайд 36
Сера – простое вещество
Аллотропые видоизменения:
Пластическая
Слайд 40
Диоксид серы, оксид серы (IV), SO2
Слайд 43
Сера существует в следующих формах:
атом, простое вещество, соединение
Слайд 44
Аллотропные модификации серы:
ромбическая,
моноклинная,
пластическая
Слайд 45
Степени окисления серы:
0, -2, +4, +6
Слайд 46
Сера является восстановителем в реакциях:
с кислородом
Слайд 47
Сера является окислителем в реакциях:
с металлами, водородом
Слайд 48
Химия инертных газов
Инертные газы также являются неМЕ поэтому
поговорим о них
Слайд 49
Словосочетание „химия инертных газов“ звучит парадоксально. В самом
деле, какая химия может быть у инертного вещества, если
в его атомах заполнены все электронные оболочки и, стало быть, оно по определению ни с чем не должно взаимодействовать? Однако во второй половине XX века химикам удалось преодолеть оборону заполненных оболочек и синтезировать неорганические соединения инертных газов. А в XXI веке учёные из России и Финляндии получили вещества, которые состоят только из атомов инертного газа, углерода и водорода.
Слайд 50
Всё начиналось со фторидов
Собственно говоря, о том, что

химические соединения криптона, ксенона и радона с сильными окислителями
вполне могут существовать, Лайнус Полинг упоминал ещё в 1933 году. Однако прошло около тридцати лет, прежде чем в 1962 году Нил Бартлетт синтезировал в Канаде первое из таких соединений — XePtF 6, при этом в реакции участвовали благородный газ и мощный окислитель, гексафторид платины. Соображения, на которые учёный опирался в своём поиске, были весьма простыми и интуитивно понятными каждому химику: если гексафторид платины столь силён, что отбирает электрон даже у молекулярного кислорода, то почему он не может это сделать с ксеноном? Ведь внешний электрон у атома этого газа привязан к ядру ничуть не сильнее, чем у кислорода, — об этом свидетельствуют почти одинаковые значения потенциала ионизации. После того как успешный синтез подтвердил гипотезу, было получено целое семейство соединений ксенона с сильными окислителями — фторидов, оксифторидов, оксидов, солей ксеноновой кислоты и многочисленные комплексы. Химики синтезировали также хлорид ксенона и фторсодержащие соединения со связями Xe–B и Xe–N.
Слайд 51
В последующие двадцать лет интригующие события развернулись на
стыке химии ксенона и органической химии. В семидесятые годы
появилось сообщение о синтезе нестабильной молекулы FXeCF 3, а затем и Xe(CF 3 ) 2. В конце восьмидесятых получили уже стабильные ионные соли, в которых катион содержал связь Xe–C (в качестве аниона, как правило, выступал борфторид). Среди соединений такого типа особый интерес (почему — станет понятно позже) представляет соль алкинилксенония — [t–BuC¤CXe] + [BF 4] –, которую синтезировали В.В. Жданкин, П. Стэнг и Н.С. Зефиров в 1992 году. Вообще-то, подобные соединения можно считать как органическими, так и неорганическими, но в любом случае их получение стало большим шагом вперёд и для теоретической, и для синтетической химии.
Слайд 52
Гораздо труднее сдавался криптон. Однако и его удалось
сначала соединить со фтором, а затем встроить и в
более сложные молекулы.
Слайд 53
Не нужно думать, что все эти соединения —
некая забавная экзотика. По крайней мере, один класс из
них, фториды ксенона и, прежде всего, его дифторид, довольно часто применяют, если в лабораторных опытах нужно что-то профторировать. Работают они и для вскрытия минерального сырья, и, естественно, как промежуточные соединения при синтезе новых производных ксенона.
Слайд 54
В целом „бартлеттовское“ направление в химии инертных газов
имеет две главные особенности. Во-первых, оно принадлежит к ионной
химии. Так, формулу первого соединения ксенона правильнее записывать как Xe + [PtF 6] –. Во всех случаях инертный газ служит восстановителем. Это понятно из самых общих соображений: при всём желании атом с заполненной электронной оболочкой не способен принять ещё один электрон, а вот отдать — может. Главное, чтобы партнёр был агрессивен и настойчив, то есть обладал ярко выраженными окислительными свойствами. Неудивительно, что легче других расстаётся со своим „октетным благородством“ ксенон: у него электроны внешней оболочки расположены дальше от ядра и удерживаются слабее.
Слайд 55
Во-вторых, современная химия инертных газов тесно привязана к
химии фтора. В состав подавляющего большинства соединений входят атомы
фтора, и даже в тех редких случаях, когда фтора нет, путь к их получению всё равно лежит через фториды.
Слайд 56
А может ли быть иначе? Существуют ли соединения
инертных газов не только без фтора, но и без
каких-либо других окислителей? Например, в виде нейтральных стабильных молекул, где атом инертного газа связан с водородом и ни с чем больше? До недавнего времени такой вопрос, повидимому, даже не приходил в голову ни теоретикам, ни экспериментаторам. Между тем именно о таких молекулах речь пойдёт дальше.
Слайд 57
Лирическое отступление о роли благородства
Прежде чем говорить о
гидридах инертных газов, давайте вернёмся к самому началу, а
именно — к инертности благородных газов. Несмотря на всё сказанное выше, элементы главной подгруппы восьмой группы вполне оправдывают своё групповое название. И человек использует их естественную инертность, а не вынужденную реакционную способность.
Слайд 58
Например, физико-химики любят применять такой метод: заморозить смесь

инертного газа с молекулами какого-либо вещества. Остыв до температуры
между 4 и 20К, эти молекулы оказываются в изоляции в так называемой матрице твёрдого инертного газа. Далее можно действовать светом или ионизирующим излучением и смотреть, что за промежуточные частицы получаются. В других условиях такие частицы не видны: они слишком быстро вступают в реакции. А с инертным газом, как считалось в течение многих лет, прореагировать очень непросто. Такими исследованиями на протяжении многих лет занимались в наших лабораториях — в Научно-исследовательском физико-химическом институте им. Л.Я. Карпова, а затем и в Институте синтетических полимерных материалов РАН, причём использование матриц с различными физическими свойствами (аргона, криптона, ксенона) рассказало много нового и интересного о влиянии окружения на радиационно-химические превращения изолированных молекул. Но это — тема для отдельной статьи. Для нашей же истории важно, что такая матричная изоляция неожиданно для всех привела в совершенно новую область химии инертных газов. И случилось это в результате одной встречи на международной конференции по матричной изоляции в США, которая произошла в 1995 году. Именно тогда научный мир впервые узнал о существовании новых необычных соединений ксенона и криптона.
Слайд 59
Гидриды выходят на сцену
Финские химики из Университета Хельсинки
Мика Петтерсон, Ян Лунделл и Маркку Расанен наполняли твёрдые
матрицы инертных газов галогеноводородами (HCl, HBr, HI) и смотрели, как эти вещества распадаются под действием света. Как оказалось, если ксеноновую матрицу после лазерного фотолиза, который проводили при температуре ниже 20К, нагреть до 50К, то в ней появляются новые и очень интенсивные полосы поглощения в ИК-спектре в области между 2000 и 1000 см –1. (В классической колебательной спектроскопии, в „среднем“ и „дальнем“ ИК-диапазонах, традиционно используют шкалу волновых чисел — эквивалентов частот колебаний, выраженных в обратных сантиметрах. Именно в таком виде характеристики колебательных спектров приведены почти во всех учебниках, справочниках и статьях.) В криптоновой матрице этот же эффект проявлялся после нагрева до 30К, а в аргоновой никаких новых полос заметно не было.
Слайд 60
Исследователи из Хельсинки сделали смелое предположение: поглощение обусловлено
валентными колебаниями связей H–Xe и H–Kr. То есть при
нагреве облучённых образцов возникают новые молекулы, содержащие атомы инертных газов. Эксперименты с изотопным замещением и квантово-химические расчёты полностью подтвердили эту догадку. Таким образом, семейство соединений инертных газов пополнилось сразу несколькими новыми членами весьма необычного вида — HXeCl, HXeBr, HXeI, HKrCl и HXeH. Последняя из перечисленных формул произвела особенно сильное впечатление на химиков, воспитанных на классических традициях: только ксенон и водород, никаких сильных окислителей!
Слайд 61
Здесь важно отметить: для того чтобы новое соединение
появилось на химической карте мира, необходимо его однозначно идентифицировать.
Расанен и его коллеги решились поверить своим глазам, рискнули высказать смелое предположение и смогли доказать его. Между тем подобные эксперименты с инертными матрицами проводили и другие учёные. Вполне вероятно, что они наблюдали полосы поглощения гидридов ксенона и криптона, но не смогли их опознать. Во всяком случае, дигидрид ксенона несомненно получался в наших экспериментах, только мы об этом не подозревали. Зато, рассматривая вместе с финскими коллегами наш стенд на той самой конференции, где были впервые представлены сенсационные данные хельсинкской группы, мы сразу же это соединение смогли обнаружить. В отличие от финских коллег, мы в ксеноне замораживали углеводороды, а потом облучали их быстрыми электронами. Гидрид же возникал при нагреве до 40К.
Слайд 62
Образование нового, столь необычного соединения инертного газа именно
при нагреве означает: всё дело во вторичных реакциях. Но
какие частицы в них участвуют? На этот вопрос первые эксперименты ответа не давали.
Слайд 63
Метастабильная связь в газовом льду
Следуя „ионной традиции“ в
химии ксенона, финские исследователи предположили, что и здесь предшественниками
служат ионные частицы — протоны и соответствующие анионы. Проверить это предположение, опираясь только на данные ИК-спектроскопии, было невозможно, ведь полосы в спектрах при нагреве появлялись внезапно, как будто из ничего. Однако в нашем распоряжении был ещё метод электронного парамагнитного резонанса (ЭПР). С его помощью удаётся определить, что за атомы и радикалы возникают при облучении и как быстро они исчезают. В частности, атомы водорода в ксеноновой матрице дают прекрасные сигналы ЭПР, которые ни с чем нельзя спутать вследствие характерного взаимодействия неспаренного электрона с магнитными ядрами изотопов ксенона (129Xe и 131Xe).
Слайд 64
Примерно так выглядят блуждания атомов водорода по энергетическим
ямам: глобальный минимум, отвечающий молекуле HY, лежит намного ниже,
но барьер между двумя состояниями оказывается достаточно большим, чтобы обеспечить относительную устойчивость промежуточного соединения с участием инертного газа.
Слайд 65
Вернувшись с памятной конференции 1995 года, мы сразу
же провели эксперименты, где и выяснили, что при нагреве
ксеноновой матрицы атомы водорода исчезают. Причём их гибель, зафиксированная по данным ЭПР, хорошо коррелирует с возникновением дигидрида ксенона, о котором свидетельствуют ИК-спектры: оба процесса протекают в очень узком диапазоне температур (38–40К). Если же в матрицу добавить вещества, которые подавляют образование атомов водорода при облучении, то и выход дигидрида ксенона при последующем нагреве резко снижается. То есть дело вовсе не в ионах-предшественниках, о которых думали финны: молекула HXeH возникает в результате реакций подвижных атомов водорода. Когда два атома сближаются в матрице настолько, что между ними остаётся лишь один атом ксенона, вместо привычной рекомбинации с образованием Н 2 возникает молекула нового соединения. Финские учёные, в свою очередь, обнаружили, что и HXeI образуется схожим образом.
Слайд 66
В результате этих экспериментов получилась схема образования гидридов
инертных газов в ксеноновых и криптоновых матрицах. Она выглядит
так. Когда твёрдую матрицу достаточно нагреют (до 30–32К для криптона или 38–40К для ксенона), замороженные ранее атомы водорода начинают диффундировать, то есть прыгают от одной ловушки к другой. И делают это до тех пор, пока ловушка не окажется слишком глубокой. Один из глубоких локальных минимумов энергии соответствует молекуле HXY, где Y — второй водород или какой-то галоген, а X — ксенон или криптон. Этот гидрид, несомненно, метастабилен, ведь глобальный минимум, который отвечает молекуле HY, лежит намного ниже. Однако барьер между двумя состояниями не так уж мал: при столь низкой температуре преодолеть его не удаётся и промежуточное соединение оказывается устойчивым. Во всяком случае, при той температуре, когда инертный газ ещё существует в твёрдом виде.
Слайд 67
«Ударная пятилетка» гидридов
Большинство молекул HXY — линейные, но
есть и угловые, например HXeOH и HXeSH. Практически все
они (за исключением, естественно, линейного центросимметричного дигидрида ксенона) обладают большим дипольным моментом
Слайд 68
Такая схема оказалась неплохим руководством к действию для

направленного синтеза новых молекул. Вскоре выяснилось, что в роли
Y может выступать любой атом или радикал с относительно высоким сродством к электрону. В течение пяти лет группа Расанена получила целую серию новых гидридов ксенона: HXeCN, HXeNC, HXeSH, HXeOH. Последнее из этих соединений интересно тем, что с формальной точки зрения представляет собой продукт внедрения атома ксенона в молекулу воды. Список криптонсодержащих молекул пополнился двумя соединениями — HKrCN и HKrF. Но, пожалуй, главной сенсацией стало первое нейтральное химическое соединение аргона — HArF: оно возникает при фотолизе фтористого водорода в аргоновой матрице. Отметим, что в получении HArF и других соединений активное участие принимал бывший сотрудник Санкт-Петербургского университета Леонид Хрящев, который работает в группе Расанена с 1996 года. В целом стало окончательно ясно, что в ближайшем будущем школьным учебникам химии не удастся избежать сильной корректировки.
Слайд 69
После падения „аргонового бастиона“ для химиков, кажется, не
осталось ничего незыблемого. Во всяком случае, теоретики уже всерьёз
обсуждают возможность существования молекулы HHeF. Правда, надежда на то, что удастся экспериментально зафиксировать рождение такого соединения, весьма мала: скорее всего, оно будет жить очень недолго — атом водорода просочится под энергетическим барьером и соединится непосредственно со фтором без благородного посредника.
Слайд 70
Путь к ксеноноорганике
Синтез гидридов инертных газов был одним
из эффектных заключительных достижений химии XX века. И всё
же к началу нового столетия эта глава химической истории закончилась. В самом деле, почти все предсказанные простые молекулы HXY были получены. Редкие теоретически устойчивые, но до сих пор не найденные исключения — это — HXeF и HXeSiF 3 или экзотическое соединение гелия. Между тем каждый химик знает, что органических соединений известно во много раз больше, чем неорганических. И возможности для комбинирования здесь почти безграничны.
Слайд 71
Можно ли получить органические гидриды инертных газов? Никаких
принципиальных препятствий для этого нет: нужно лишь представить, что
в роли Y выступает органический радикал, обладающий достаточной электроотрицательностью. Каковы шансы обнаружить их практически? В современной химии расчёт часто предшествует эксперименту, и химия инертных газов здесь не исключение.
Слайд 72
Квантово-химические расчёты органических молекул с атомом ксенона, внедрённым
по связи О–Н, появились вскоре после открытия первых гидридов.
Слайд 73
Более того, уже известный нам Ян Лунделл из
Хельсинки вместе с Ариком Коэном и Робертом Гербером (Израиль–США)
предсказали: могут существовать углеводороды с атомом ксенона, внедрённым по связи С–Н. При этом речь шла об очень простых и весьма популярных среди химиков углеводородах — ацетилене, бензоле, феноле. О своей идее авторы рассказали на 4-й Международной конференции по химии низких температур в Финляндии в августе 2002 года. Реакции экспериментаторов были разнообразными: от охотничьего азарта до нескрываемого пессимизма. Наибольший интерес вызвали расчёты соединения ксенона с ацетиленом, которое должно быть особенно стабильным. Не испытать возможность синтеза такого многообещающего вещества было бы просто грешно.
Слайд 74
Ксеноновый ацетилен
Каждый, кто изучал органическую химию хотя бы
в объёме средней школы, помнит типичные задания: написать схему
получения сложных органических молекул из неорганических соединений. Все эти цепочки начинались одинаково: карбид кальция плюс вода — получается ацетилен. Именно поэтому ксенон, присоединённый к ацетилену, способен открыть дверь в новую своеобразную область элементоорганической химии.
Слайд 75
ЭПР-спектры показывают, что при нагреве атомы водорода почти
полностью исчезли, количество радикалов ·CCH уменьшилось и образовалось немного
винильных радикалов (линии, отмеченные звёздочками). А из ИК-спектров следует, что облучение уничтожило ацетилен, зато нагрев создал новые вещества и их линии соответствуют соединениям ксенона.
Слайд 76
Вернувшись с конференции, мы решили сразу же проверить
предсказание теоретиков, и всё прошло как по нотам. Сначала
с помощью ЭПР-спектров удалось выяснить, что при облучении электронами молекула ацетилена (HCCH) в ксеноновой матрице действительно диссоциирует на атом Н· и этинильный радикал ·С¤СН. При разогреве до 40–45К атомы Н исчезают почти полностью, одновременно уменьшается количество этинильных радикалов и появляется немного винильных ·HС=CH 2.
Слайд 77
Здесь как раз и разворачивается интрига: при столь
низкой температуре двигаться в ксеноне могут только атомы водорода.
А тяжёлые этинильные радикалы на это не способны. Значит, гибель последних — результат реакции с участием атомов водорода. На первый взгляд причина могла бы быть тривиальной: атомы и радикалы рекомбинируют, воссоздавая исходную молекулу ацетилена. Но не тут-то было: ИК-спектры показывают, что количество ацетилена при таком разогреве не только не растёт, но даже немного снижается — он расходуется на образование винильных радикалов. Следовательно, реакция атомов водорода с радикалами ·С¤СН в ксеноне даёт что-то другое, и тут уже опыт, интуиция и азарт сливаются воедино: это должна быть молекула HXeC¤CH!
Слайд 78
Осталось совсем немного — непосредственно доказать её образование.
Здесь на первый план выходит ИК-спектроскопия. Нижняя часть рисунка
со спектрами показывает, что облучение приводит к заметному расходованию молекул ацетилена, а при последующем разогреве действительно появляются новые интенсивные полосы. Пара полос с максимумами при 1180 и 1166 см –1 уже знакома нам по прежним исследованиям — это дигидрид ксенона. А ещё более интенсивная полоса с максимумом при 1486 см –1 возникает как раз примерно там, где, согласно предсказаниям теоретиков, должны проявляться колебания Xe–H в молекуле HХeC¤CH. (Отклонение от расчёта связано с эффектами ангармонизма и влияния матричного окружения, которыми теоретики пренебрегали.) Окончательное доказательство дали опыты с дейтерированным ацетиленом: наблюдаемый сдвиг полосы поглощения говорил о том, что водород связан с более тяжёлым атомом, чем углерод, — в исследуемой системе на роль такого атома годится только ксенон.
Слайд 79
Формирование ксенонового ацетилена
Сопоставление данных ЭПР- и ИК-спектроскопических исследований
позволило нам составить приближённую схему, которая учитывает все основные
процессы, и определить, какая доля атомов Н реагирует по различным направлениям (при не очень больших конверсиях):
C2 H2 ® H· + ·CCH
H· + Xe + ·CCH ® HXeCCH ( ~ 30%)
H· + Xe + ·H ® HXeH ( ~ 60%)
H· + C2 H 2 ® ·C2 H 3 ( ~ 10%)
Слайд 80
Итак, спустя четыре месяца после обнародования предсказания теоретиков
углеводород с внедрённым атомом ксенона был получен. Оказалось, что
одновременно и независимо (в те же самые дни и недели) работа шла и в Хельсинки. Обе статьи, сообщающие о получении HXeC¤CH, появились в одном и том же номере „Journal of the American Chemical Society“ (примечательная синхронность, если учесть, что этот престижный химический журнал выходит еженедельно!). Финские химики, как и прежде, использовали лазерный фотолиз, причём в их распоряжении были только ИК-спектры, поэтому общая картина процессов выглядела не так ясно, как у нас. Это не помешало им, однако, не только зафиксировать молекулы HXeC¤CH, но и высказать предположение об образовании двух других частиц — радикала HXeC¤C· и молекулы HXeC¤CXeH — при больших степенях конверсии, когда начинают интенсивно протекать вторичные реакции и в матрице образуются частицы C2 в результате распада первичных этинильных радикалов.
Слайд 81
Кстати, внимательный читатель может заметить, что HXeC¤CH в
некотором смысле „дальний родственник“ ионной соли, о которой шла
речь в начале этой статьи. Конечно, наличие ковалентной связи Xe–H делает свойства нового соединения совсем иными и в гораздо большей мере сближает его с новой семьёй гидридов инертных газов.
Слайд 82
Полимер с атомами ксенона в главной цепи?
А почему
бы и нет…
Теперь, как говорится, лиха беда начало. Следующие
углеводороды, которые могут принять в свой состав атомы ксенона, — бензол и производные ацетилена. Впрочем, ими список конечно же не исчерпывается. Вполне перспективны производные бензола и этилена с электроноакцепторными группами, некоторые гетероциклы. Наряду с внедрением по связи С–Н остаётся возможность использования связей O–H и N–H. По существу, не только экспериментаторы, но и теоретики находятся в самом начале пути.
Слайд 83
Одна из наиболее интересных перспектив — получение длинных
молекул, содержащих несколько атомов ксенона в цепи. Принципиальная возможность
реализации такого варианта предсказана всё в той же работе Лунделла, Коэна и Гербера: им удалось теоретически показать, что цепочки вида H(XeC¤C)nXeH устойчивы при n = 1 и 2. Дальше просто не хватает современных расчётных возможностей, но принципиальных ограничений нет.
И в заключение несколько замечаний на общие темы
Слайд 84
Первое — о единстве химии. История новых соединений
инертных газов началась с физико-химических исследований: группа Расанена изучала
динамику фотодиссоциации простых молекул в твёрдых матрицах, мы исследовали механизмы радиационнохимических превращений органических молекул. Первые находки были в значительной мере случайными. Однако вскоре финские химики, по существу, уже занимались направленным неорганическим синтезом соединений ксенона, а недавние исследования в Москве и в Хельсинки обозначили новый поворот — к органической химии. А дальше? Вполне возможно, нас ждёт прорыв в химию макромолекул или даже биологически важных соединений… Поучительный пример в век узкой специализации.
Слайд 85
Второе — о роли химической интуиции. Казалось бы,
сегодня большинство достижений химии связаны с использованием сложнейших методов
и базируются на мощных вычислениях. Тем не менее найти ключ помогает очень простая догадка — то, что мы иногда называем интуицией химика. Скорее всего, именно такая интуиция сработала у молодого аспиранта Мики Петтерсона. Квантово-химические расчёты высокого уровня, дорогие эксперименты с изотопномечеными соединениями — всё это очень важно, но они были потом.
Слайд 86
И третье, последнее, — о значении непосредственного общения
учёных. Можно предположить, что в наше время тотального интернета
и неограниченного доступа к электронной и печатной информации „живые“ конференции становятся анахронизмом. Однако на самом деле именно таким путём большинство учёных получают не только информацию из первых рук, но и импульс к действию. Трудно сказать, как сложились бы наши взаимоотношения с химией инертных газов, не будь встречи с Расаненом и его коллегами в 1995 году.
Слайд 87
Мы вполне могли бы просто пропустить их первую
статью о фотолизе галогеноводородов как „непрофильную“: ведь наша тема
— радиационная химия органических молекул. Ещё более показательна история с получением соединения ацетилена с ксеноном. Именно доклад теоретиков на конференции послужил толчком к началу „охоты“, а к тому моменту, когда появилась журнальная статья Лунделла и его соавторов, основные эксперименты были уже закончены — и в Москве, и в Хельсинки. Значит, и в XXI веке осталось место для простых и ярких результатов в самой что ни на есть классической химии, время романтиков не ушло, и не всё решает цена приборов и количество сотрудников.
Слайд 88
Когда эта статья была уже подготовлена к печати,
пришло сообщение о том, что Леониду Хрящеву и его
финским коллегам аналогичным способом удалось получить первое органическое соединение криптона — HKrCCH. Так что эта история только начинается…
Слайд 89
О природе гидридов благородных газов
Отличительная особенность новых соединений
инертных газов, которая и позволила их открыть, — очень
интенсивные полосы поглощения, которые отвечают валентным колебаниям X–H. Эти полосы не только служат „визитной карточкой“ новых молекул, но и дают важную информацию о природе связи: чем выше частота максимума, тем прочнее связь. Диапазон изменений простирается от 1851 см –1 в весьма прочной молекуле HXeNC до 1119 см –1 в наиболее слабой — HXeSH. Интенсивности этих полос огромны — чуть ли не в десять раз больше величин, которые характерны для большинства спектров известных веществ. То есть атом водорода при колебаниях X–H смещается достаточно далеко.
Слайд 90
Раз интенсивность полос велика, то и следить за
гидридами инертных газов с помощью ИК-спектроскопии легко, даже если
их концентрации очень малы: чувствительность этого метода оказывается рекордно высокой. Поскольку положение полос сильно зависит от окружения молекул, они оказываются высокочувствительными ИК-спектроскопическими зондами для исследований структуры и динамики твёрдых матриц при низких температурах.
Слайд 91
Другое свойство обосновано скорее теоретически, чем экспериментально. Речь
идёт о том, что все молекулы типа HXY —
метастабильные, богатые энергией системы. Например, при превращении одной молекулы HXeCCH в ксенон и ацетилен должно выделиться 4,5 эВ (примерно 104 ккал / моль ). Ещё больше энергии запасено в дигидриде ксенона. Другими словами, твёрдые матрицы с гидридами инертных газов можно рассматривать как аккумуляторы энергии, запасённой в виде относительно слабо связанных атомов и радикалов. Высвободить эту энергию при очень низких температурах в принципе можно путём инициирования цепного разложения с помощью ИК-лазера. И при этом никакой грязи не возникнет — только водород и ксенон!
Слайд 92
Что касается химических свойств гидридов инертных газов, то
они пока практически не изучены. Известно, что некоторые из
этих соединений наблюдаются до тех пор, пока матрица устойчива (в случае твёрдого ксенона — примерно до 75–80К), а потом исчезают вместе с образцом, который „слетает“ с подложки. В этих условиях сказать что-то определённое о механизме их гибели трудно. Однако, например, HXeOH гибнет уже при 55К, скорее всего превращаясь в воду и ксенон. Следовательно, „химическая индивидуальность“ у этих молекул безусловно есть — она проявляется хотя бы в разной устойчивости.
Слайд 93
Конечно, для того, чтобы всерьёз говорить о перспективах

использования гидридов инертных газов, нужно научиться получать их в
чистом виде, желательно — при обычных температурах. Пока этого сделать не удалось, однако дело не безнадёжное. Согласно расчётам, энергия диссоциации HXY на нейтральные фрагменты (H + X + Y) находится между 0,4 и 1,5 эВ, то есть, в более привычных для химиков единицах, от 9 до 35 ккал / моль (верхняя граница соответствует, например, энергии диссоциации молекул F2 или I2). Это означает: наиболее прочные молекулы такого сорта в принципе вполне могут быть устойчивы при комнатной и даже более высоких температурах. Очень важно, что молекулы гидридов ксенона уже получены в матрицах других инертных газов (криптона и неона). Значит, мы имеем дело с „нормальными“ молекулами, которые, возможно, удастся перенести в другую среду. Перспективы прямого газофазного или жидкофазного синтеза за счёт тримолекулярных реакций выглядят весьма туманными. А вот возможность получения гидридов инертных газов в полостях твёрдых матриц различной микроструктуры, например в каналах цеолитов или микропорах полимеров, представляется гораздо более реалистичной. Можно даже представить, что направленный синтез в таких микрореакторах позволит получить ксенонсодержащие макромолекулы, которые будут устойчивыми при комнатной температуре. Впрочем, об их свойствах пока можно только фантазировать.
Слайд 96
галогены
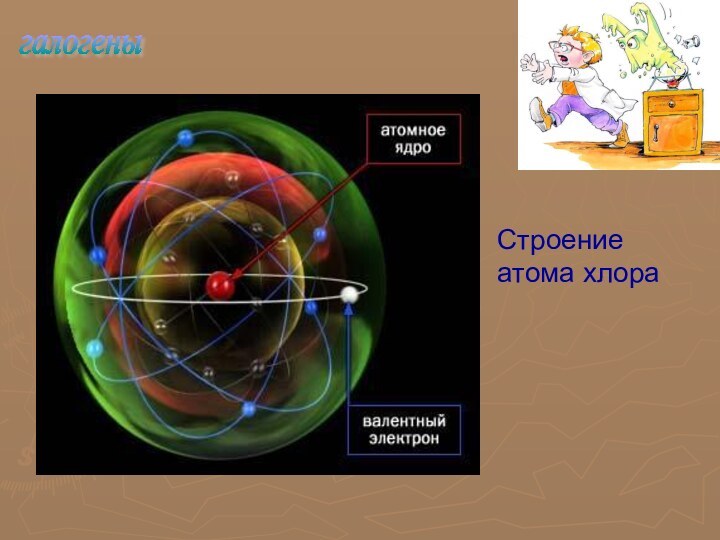
Главная подгруппа VII группа
Фтор F, хлор Cl,
бром Br, йод I, астат At – типичные неметаллы
На
внешнем энергетическом уровне – 7 электронов
электронная конфигурация
s2p5
До завершения не хватает одного электрона
Самое характерное свойство – присоединение электрона с образованием однозарядного иона
Cl +ē = Cl 1-
Очень сильные окислители
Радиус атома возрастает от фтора к астату
Слайд 99
галогены
Почему галогены встречаются в природе только в
виде соединений ?
Каким образом изменяются окислительные свойства галогенов?
Почему?
Какие свойства характерны для фтора, его степень окисления?
Возможно ли проявление галогенами восстановительных свойств?
Слайд 100
галогены
Окислительные свойства уменьшаются от фтора к йоду:
с
увеличением порядкового номера
с увеличением радиуса атома
уменьшается значение относительной электроотрицательности
Восстановительные
свойства усиливаются
от хлора к йоду
Окислительные свойства уменьшаются
от фтора к йоду
Слайд 101
галогены
Фтор только окислитель
степень окисления -1
Слайд 102
галогены
Фтор только окислитель
степень окисления -1
Слайд 103
галогены
Проявляют окислительные свойства в соединениях с металлами,
водородом, менее электроотрицательными элементами (степень окисления -1)
Проявляют восстановительные
свойства в соединениях с более электроотрицательными элементами (степень окисления +1, +3, +5, +7)
Слайд 104
галогены
Радиоактивный элемент.
Наиболее устойчивый его изотоп At210 имеет
период полураспада 8,3 часа («астат» означает «неустойчивый»)
В земной коре
его ничтожно мало.
Получают искусственным путем с помощью ядерных реакций.
Слайд 105
галогены
Молекулы двухатомные
Ковалентная неполярная связь
Молекулярная кристаллическая решетка
F2,Cl2 –
газы
Br2 – жидкость
I2 – твердое кристаллическое вещество
простые вещества
Слайд 106
галогены
Фтор –
светло-желтый газ,
с резким раздражающим запахом.
Не
сжижается при обычной температуре.
Tпл. = -220°С, Tкип. =
-188°С
Слайд 107
галогены
Хлор –
желто-зеленый газ,
с резким удушливым запахом.
Сжижается
при обычной температуре под давлением.
Tпл. = -101°С, Tкип.
= -34°С
Растворяется в воде,
образуя желтоватую хлорную воду
Слайд 108
галогены
Бром –
буровато-коричневая жидкость
с резким, зловонным запахом
Tпл.
= -7°С, Tкип. = +58°С
Растворяется в воде,
образуя коричневатую
бромную воду
Слайд 109
галогены
Йод –
черно-фиолетовое твердое вещество с металлическим
блеском
Запах резкий
Tпл. = +114°С, Tкип. = +186°С
Плохо растворим в
воде, хорошо растворяется в органических растворителях (спирте)
Слайд 110
галогены
галогены
галогены
галогены
Получение
Слайд 111
галогены
2КMnO4 + 16HCl = 5Cl2 + 2MnCl2
+ 2KCl + 8H2O
Получение хлора в лаборатории
Слайд 112
галогены
Химическая активность галогенов как неметаллов от фтора
к йоду ослабевает
галогены
галогены
галогены
Слайд 113
галогены
галогены
галогены
галогены
Кристаллики сурьмы в колбе
с хлором, красиво вспыхивают и сгорают, образуя смесь двух
хлоридов сурьмы (III и V)
Слайд 114
галогены
галогены
галогены
галогены
Кристаллики сурьмы в колбе
с хлором, красиво вспыхивают и сгорают, образуя смесь двух
хлоридов сурьмы (III и V)
2Sb + 3Cl2 = 2SbCl3
2Sb + 5Cl2 = 2SbCl5
Слайд 115
галогены
В парах хлора сгорает раскаленная медная проволока,
образуя хлорид меди (II)
Слайд 116
галогены
В парах хлора сгорает раскаленная медная проволока,
образуя хлорид меди (II)
Cu + Cl2 = CuCl2
Слайд 117
галогены
Горение красного фосфора в хлоре
Слайд 118
галогены
Горение красного фосфора в хлоре
2P + 5Cl2
=2PCl5
Слайд 119
галогены
Горение парафиновой свечи в хлоре
Слайд 120
галогены
Поглощение брома активированным углем
Слайд 121
галогены
Хлор реагирует с водой на холоде с
образованием
соляной и хлорноватистой кислот.
Cl2 + Н2О ⇄ HCl
+ НОСl
Слайд 123
галогены
Вода горит в струе фтора
2Н2О + 2F2
= 4HF + О2
Слайд 124
галогены
Фтор –
Энергично реагирует со всеми простыми веществами
(за исключением О2, N2, Не,
Ne, Ar) с образованием фторидов.
Реагирует со всеми металлами при обычных условиях, а при нагревании и с золотом, серебром, платиной.
Криптон взаимодействует с фтором под действием электрического разряда.
Ксенон горит в атмосфере фтора ярким пламенем.
В атмосфере фтора горят даже негорючие асбест и вода.
В соединении с фтором элементы часто проявляют высшие степени окисления.
Н2 + F2 = 2HF 2Н2О + 2F2 = 4HF + О2
Zn + F2 = ZnF2
2NH3 +3 F2 = 6HF + N2 (при высокой температуре)
Слайд 125
галогены
Хлор –
Непосредственно реагирует с металлами и неметаллами
в основном при нагревании:
2Na + Cl2 = 2NaCl
2P +
3Cl2 = 2PCl3
2P + 5Cl2 = 2PCl5 (с избытком хлора)
H2 + Cl2= 2HCl
(при обычных условиях реакция идет медленно, при нагревании или освещении происходит взрыв)
Не соединяется непосредственно с углеродом, азотом, кислородом
С серой образует на холоде дихлорид дисеры
2S + Cl2 = S2Cl2
Вытесняет бром и йод из растворов их солей:
Сl2 + 2NaBr = 2NaCl + Br2
Слайд 126
галогены
Бром –
Непосредственно реагирует со многими элементами,
наиболее энергично – с алюминием:
2Аl + 3Вr2= 2АlBr3
В парах
брома сгорает раскаленная медная проволока:
Сu + Вr2 = СuBr2
Реакция с водородом идет медленно:
Н2 + Вr2 ⇄ 2НВr
Свободный бром вытесняет йод из солей:
Br2 + 2KI = 2KBr + I2
Слайд 127
галогены
Йод –
С крахмалом йод дает соединение
ярко синего цвета, его образование является качественной реакцией на
йод
Йод способен при нагревании и нормальном давлении переходить в газообразное состояние, минуя жидкую фазу. Этот процесс называется возгонкой.
Окисляет металлы медленнее, но в присутствии воды (как катализатора) реакция протекает очень бурно
2Al + 3I2 = 2AlI3
Реакция с водородом слабо эндотермическая, протекает медленно даже при нагревании.
Н2 + I2 = 2Нl
Слайд 129
Хоть я уже писал про инертные газы, но
я напишу про Радон
Радон
Слайд 130
Осенью 1969 г. редакция журнала «Химия и жизнь»
получила такое письмо:
«Работая над рефератом об элементе радоне, я
столкнулась с противоречивыми объяснениями по поводу открытия этого элемента. В Детской энциклопедии (издание 1966 г.) говорится, что радон открыл в 1900 г. английский ученый Резерфорд. Малая Советская Энциклопедия утверждает, что радон открыл французский ученый Дебьерн, а в некоторых учебниках по химии честь открытия этого элемента приписывается Рамзаю. Кому же верить?»
Письмо было опубликовано в журнале вместе с подробным ответом-консультацией, суть которого можно свести к казуистической формулировке: оба правы... Не оба даже, а многие.
Слайд 131
Открывали изотопы...
Радон действительно открывали неоднократно, и в отличие

от других подобных историй каждое новое открытие не опровергало,
а лишь дополняло предыдущие. Дело в том, что никто из ученых не имел дела с элементом радоном – элементом в обычном для нас понимании этого слова. Одно из нынешних определений элемента – «совокупность атомов с общим числом протонов в ядре», т.е. разница может быть лишь в числе нейтронов. По существу элемент – совокупность изотопов.
Но в первые годы нашего века еще не были открыты протон и нейтрон, не существовало самого понятия об изотопии.
Резерфорд и Оуэнс, Рамзай и Содди, Дорн, Дебьерн независимо друг от друга и практически одновременно (1900...1904 гг.) находили изотопы одного и того же элемента – элемента №86. Все эти открытия были продолжением пионерских работ супругов Кюри в области радиоактивности. В каждом из этих исследований, как считали их авторы, был обнаружен свой, новый радиоактивный газ, новый элемент. Да и не могли они считать иначе: происхождение вновь открытых газов, их главная радиоактивная характеристика – период полураспада – были далеко не одинаковыми. Резерфордовскую эманацию (название происходит от латинского emanatio – «истечение») порождал торий. Дебьерновский актинон получался из актиния. Дорновский радон и рамзаевский нитон (от латинского nitens – «блестящий, светящийся») были дочерним продуктом радия...
Слайд 132
Дорн открыл радон раньше Рамзая и Содди, тем
не менее имена последних помещены в список первооткрывателей элемента
№86 заслуженно. Именно Рамзай первым исследовал свой нитон как химический элемент, выяснил характерные для него спектральные линии, определил атомную массу, объяснил химическую индифферентность и нашел место для этого элемента в периодической системе.
А хронологически первой из этих работ была работа Резерфорда и Оуэнса, проведенная в Канаде. Вот что рассказывал об этом в 1936 г. сам Резерфорд, ставший одним из корифеев новой физики. (Это фрагмент последнего публичного выступления Резерфорда, его доклада «Сорок лет развития физики»).
Слайд 133
Свидетельствует физик
«... В 1898 г. я приехал в

Мак-Гиллский университет в Монреале и там встретился с Р.
Оуэнсом, новым профессором электротехники, который прибыл одновременно со мной. Оуэнс имел стипендию, которая обязывала его проводить некоторые физические исследования; он спросил, не могу ли я ему предложить тему, которую он мог бы исследовать для оправдания этой стипендии. Я предложил ему исследовать с помощью электроскопа торий, радиоактивность которого была тем временем открыта... Я помогал ему в проведении экспериментов, и мы обнаружили некоторые очень странные явления. Оказалось, что радиоактивное воздействие окиси тория может проходить сквозь дюжину листков бумаги, положенных поверх этой окиси, но задерживается тончайшей пластинкой слюды, как будто излучается что-то, способное диффундировать сквозь поры бумаги. Тот факт, что прибор был очень чувствителен к движению воздуха, поддерживал эту диффузионную гипотезу. Затем мы провели эксперименты, в которых воздух проходил над окисью тория, а потом попадал в ионизационную камеру. Эти опыты показали, что активность может переноситься воздухом. Однако когда поток воздуха прекращался, активность в ионизационной камере не сразу исчезала, а уменьшалась постепенно по экспоненциальному закону. Я назвал это газообразное вещество, которое может диффундировать сквозь бумагу, переноситься воздухом и в течение некоторого времени сохранять свою активность, исчезающую по характерному закону, «эманацией тория».
Слайд 134
Я установил, что эта эманация обладает чрезвычайно своеобразным
свойством делать радиоактивными тела, над которыми она проходит. Казалось,
что это свойство скорее всего обусловлено осаждением некой материальной субстанции, а не какой-либо активностью, возникшей в самих телах под действием излучения, так как тогда количество осажденного вещества должно увеличиваться при приложении электрического поля. В те времена многие получали неповторяющиеся и странные результаты, помещая предметы вблизи радиоактивных веществ; по-видимому, все это могло объясняться наличием таких же эманации, как обнаруженная нами у тория.
Слайд 135
Прежде чем считать такое объяснение правильным, необходимо было
выяснить истинную природу эманации. Это было очень трудно, так
как доступное количество ее всегда было очень мало. С самого начала Содди и я предположили, что это, должно быть, инертный газ вроде гелия, неона или аргона, так как нам не удавалось заставить его соединиться с каким-либо химическим веществом...»
Слайд 136
Дальше предположений, однако, Резерфорд не пошел – вероятно
потому, что был не химиком, а физиком...
Слайд 137
Свидетельствует химик
Справедливости ради теперь следовало бы предоставить слово
химику. Сделаем это. Статья «Эманация», воспроизведенная здесь с сокращениями,
написана в 1910 г. (можно сказать по горячим следам) выдающимся русским химиком профессором Львом Александровичем Чугаевым.
Слайд 138
«Если какую-либо соль радия растворить в воде или
нагреть в пустоте, то из нее освобождается радиоактивный газ,
получивший название эманации. Этот газ обладает удивительнейшими свойствами. С одной стороны, он абсолютно инертен: все попытки ввести его в соединение с другими телами окончились неудачей... Но, с другой стороны, эманация принадлежит к самым активным и изменчивым телам, какие только можно себе представить. Она быстро разрушается, выбрасывая из себя альфа-частицы и теряя при этом свои радиоактивные свойства. Процесс этот, подобно другим превращениям радиоактивных веществ, совершается согласно рассмотренному нами выше закону мономолекулярных реакций*. Константа λ для эманации равна 0,000002, если в качестве единицы времени избрать секунду. Это значит, что в одну секунду из всего наличного количества эманации подвергается превращению 0,000002, или 1/500 000 часть.
Слайд 139
* Выше Чугаев так объясняет суть закона радиоактивных
превращений: «Если активность препарата в начале опыта есть J,
а по истечении времени t она обращается J1, то lg J/J1 = λt, где λ есть так называемая радиоактивная постоянная – величина, по своему значению вполне аналогичная константе скорости обыкновенной мономолекулярной реакции. Другими словами, это постоянная доля наличного количества радиоактивного вещества, которая превращается в единицу времени. Полагая J/J1 = 2, мы получим lg2 = λt, t = 1/λ · lg2. В этом случае величина t будет выражать так называемую половинную продолжительность жизни или полупериод существования данного радиоактивного продукта, т.е. время, в течение которого половина этого продукта подвергнется разрушению».
С помощью несложных математических выкладок Чугаев подводил читателей того времени к пониманию физического смысла величины, которую мы теперь называем периодом полураспада, – одной из главных характеристик любого радиоактивного изотопа.
Слайд 140
Отсюда легко вычислить, что половина эманации разрушается в
течение около четырех (точнее 3,86) дней.
Слайд 141
Около –65°C при атмосферном давлении эманация сгущается в
жидкость, малейшая капелька которой ярко флуоресцирует голубым или фиолетовым
светом, который сравнивают с электрическим. При –71°C она застывает в твердую непрозрачную массу. Для этих опытов Резерфорд имел в своем распоряжении 0,14 г радия (давшие 0,082 мм3 эманации), Рамзай – 0,39 г кристаллического бромистого радия, что соответствует 0,21 г металлического радия. При столь ничтожных количествах эманации ее приходилось собирать и наблюдать в тончайших капиллярных трубочках (диаметром 0,1...0,2 мм) под микроскопом. Определяя скорость, с которой эманация вытекает через тонкие отверстия, можно было найти (приблизительно, конечно) ее плотность, а отсюда вес молекулы, который (в наиболее надежных опытах) оказался близким к 220.
Слайд 142
За последнее время (напоминаем, что статья написана в
1910 г. – Ред.) Рамзай и Грей пришли почти
к тому же результату путем прямого взвешивания определенного объема эманации, заключенного в капиллярную кварцевую трубочку. Любопытен по своей тонкости экспериментальный прием, избранный ими для этой цели. Для взвешивания служили особые микровесы, целиком изготовленные из кварца. Чувствительность их достигала 1/500 000 мг, а наибольшее количество взвешиваемой эманации занимало объем не более 0,1 мм3. Самое взвешивание происходило без помощи разновесок.
Слайд 143
Взвешиваемое тело (кварцевый капилляр, содержащий эманацию) уравновешивалось одним
и тем же полым кварцевым шариком, в котором было
заключено некоторое количество воздуха. Вес этого шарика (кажущийся) менялся в зависимости о г давления воздуха в приборе... Плотность эманации в среднем из ряда опытов была найдена равной 111,5, что соответствует молекулярному весу 223. Принимая во внимание, что эманация по своим свойствам должна быть причислена к индифферентным (в оригинале – «идеальным»; видимо, опечатка. – Ред.) газам нулевой группы, молекула которых всегда состоит из одного только атома, заключаем, что и атомный вес ее должен быть близок 223... И так как ныне уже нельзя сомневаться в ее элементарной природе, то Рамзай и предложил для нее особое название – нитон.
Слайд 144
Процесс образования нитона из радия сопровождается выделением альфа-частиц,
которые, как мы сейчас увидим, представляют из себя атомы
гелия, заряженные положительным электричеством. Поэтому Резерфорд и Содди предположили, что первая фаза превращения радия выражается такой схемой: Ra = эманация + гелий (или Ra = Nt + He), т.е. 226,4 – 4 = 222,4. На этом основании атомный вес нитона должен быть близок к 222,4.
Принимая во внимание трудность соответствующих экспериментальных определений, нельзя не признать совпадение прямо блестящим».
Слайд 145
Что к этому следовало бы добавить?
Прежде всего, что
за годы, прошедшие со дня открытия радона, его основные
константы почти не уточнялись и не пересматривались. Это свидетельство высокого экспериментального мастерства тех, кто определил их впервые. Лишь температуру кипения (или перехода в жидкое состояние из газообразного) уточнили. В современных справочниках она указана совершенно определенно – минус 62°C.
Слайд 146
Еще надо добавить, что ушло в прошлое представление
об абсолютной химической инертности радона, как, впрочем, и других
тяжелых благородных газов. Еще до войны член-корреспондент Академии наук СССР Б.А. Никитин в ленинградском Радиевом институте получил и исследовал первые комплексные соединения радона – с водой, фенолом и некоторыми другими веществами. Уже из формул этих соединений: Rn · 6 H2O, Rn · 2С6H5OH, Rn · 2CH3C6H5 – видно, что это так называемые соединения включения, что радон в них связан с молекулами воды или органического вещества лишь силами Ван-дер-Ваальса... Позже, в 60-х годах, были получены и истинные соединения радона. По сложившимся к этому времени теоретическим представлениям о галогенидах благородных газов, достаточной химической стойкостью должны обладать соединения радона RnF2, RnF4, RnCl4, RnF6.
Слайд 147
Фториды радона были получены сразу же после первых
фторидов ксенона, однако точно идентифицировать их не удалось. Скорее
всего, полученное малолетучее вещество представляет собой смесь фторидов радона. В отличие от довольно летучих фторидов ксенона, это вещество не возгоняется до температуры 250°C. Водород восстанавливает его при 500°C.
Слайд 148
И наконец, заканчивая рассказ о химии радона, следует
упомянуть об одном неудачном опыте, проделанном в начале века
Резерфордом. Зная, что распад радия приводит к образованию гелия и радона, Резерфорд (не надеясь в общем-то на успех) попытался провести обратную реакцию: Rn + He → Ra. Естественно, ничего из этого не получилось.
Слайд 149
Что есть что???
Радон, открытый Дорном, это самый долгоживущий
изотоп элемента №86. Образуется при альфа-распаде радия-226. Массовое число
этого изотопа – 222, период полураспада – 3,82 суток. Существует в природе как одно из промежуточных звеньев в цепи распада урана-238.
Слайд 150
Эманация тория (торон), открытая Резерфордом и Оуэнсом, член
другого естественного радиоактивного семейства – семейства тория. Это изотоп
с массовым числом 220 и периодом полураспада 54,5 секунды.
Актинон, открытый Дебьерном, тоже член радиоактивного семейства тория. Это третий природный изотоп радона и из природных – самый короткоживущий. Его период полураспада меньше 4 секунд (точнее, 3,92 секунды), массовое число 219.
Слайд 151
Нитон – то же самое, что радон.
Всего сейчас
известно 19 изотопов радона с массовыми числами 204 и
от 206 до 224. Искусственным путем получено 16 изотопов. Нейтронодефицитные изотопы с массовыми числами до 212 получают в реакциях глубокого расщепления ядер урана и тория высокоэнергичными протонами. Эти изотопы нужны для получения и исследования искусственного элемента астата. Эффективный метод разделения нейтронодефицитных изотопов радона разработан в Объединенном институте ядерных исследований.
Слайд 152
Долгое время «суммарным» названием элемента №86 было слово
«эманация». Собственно, до 1918 г. не было ни торона,
ни актинона – были эманация тория и эманация актиния. Позже, однако, международные организации, ведающие химической номенклатурой, сделали общепринятым нынешнее название элемента №86. С одной стороны, это можно объяснить стремлением к унификации: название «радон» более созвучно названиям прочих элементов, чем «эманация». А с другой стороны, все-таки именно радон оказался самой долгоживущей и самой полезной из всех эманации...
Слайд 153
Польза и вред радона
Бесспорная польза и бесспорный вред.
Сначала – о худшем: среди радиоактивных ядов радон –
один из самых опасных. Не случайно допустимая для человека доза радона в 10 раз меньше допустимой дозы бета- и гамма-излучений.
Уже через час после введения в кровь кролику сравнительно небольшой дозы радона, 10 микрокюри, количество лейкоцитов в крови резко сокращается. Затем поражаются лимфатические узлы, селезенка, костный мозг...
Слайд 154
Не столько сам радон задерживается в живом организме,
сколько радиоактивные продукты его распада. Все исследователи, работавшие с
твердым радоном, подчеркивают непрозрачность этого вещества. А причина непрозрачности одна: моментальное оседание твердых продуктов распада. Эти продукты «выдают» весь комплекс излучений: альфа-лучи – малопроникающие, но очень энергичные; бета-лучи; жесткое гамма-излучение...
Слайд 155
Несмотря на это, радоновые ванны издавна занимают заметное
место в арсенале курортологии и физиотерапии. Растворенный в воде
радон (в ультрамикродозах) оказывает положительное воздействие на центральную нервную систему, на многие функции организма.
Слайд 156
Медики полагают, что роль самого радона-222 здесь минимальна.
Он же испускает лишь альфа-частицы, абсолютное большинство которых задерживается
водой и на кожу не попадает. Зато активный налет продуктов распада радона продолжает действовать на организм и после прекращения процедуры. Радоновые ванны – эффективное средство лечения многих заболеваний – сердечно-сосудистых, кожных, а также нервной системы. Иногда радоновую воду прописывают и внутрь – для воздействия на органы пищеварения. Эффективны также радоновые грязи и вдыхание обогащенного радоном воздуха... Однако, как всякое сильнодействующее средство, радон требует постоянного врачебного контроля и очень точной дозировки. При некоторых заболеваниях радонотерапия абсолютно противопоказана.
Слайд 157
Медицина использует как природные воды, содержащие радон, так
и искусственно приготовленные. Ра дон получают из радия, и
клинике вполне достаточно миллиграммов этого элемента, чтобы в течение долгого (по сути дела, неограниченно долгого) времени ежедневно готовить десятки радоновых ванн.
В природе радона очень мало – его можно отнести к числу наименее распространенных на нашей планете химических элементов. Содержание радона в атмосфере оценивается цифрой 7·10–17% по весу. В земной коре его также очень мало – он же образуется преимущественно из сверхредкого радия. Тем не менее эти немногочисленные атомы очень заметны, с помощью специальных приборов разумеется.
Слайд 158
Эти приборы называют эманометрами. Ими определяют, например, содержание
радона в почвенном воздухе, и по этой характеристике судят
о плотности и газопроницаемости горных пород. Засасывая воздух из буровых скважин с разных горизонтов, по содержанию радона определяют свойства горных пород на больших глубинах. По эманационным аномалиям геофизики судят о содержании радиоактивных руд в различных участках земной коры.
Слайд 159
Эманирование – выделение радона твердыми телами, содержащими материнский
элемент, зависит от температуры, влажности и структуры тела и
меняется в очень широких пределах. Отсюда большие возможности эманационного метода исследования твердых веществ в промышленности и науке. Сравнительно недавно советскими учеными было установлено повышение концентрации радона и некоторых других элементов в подземных водах, находящихся близ эпицентра землетрясения. Это позволило создать метод прогноза землетрясений, который уже не раз оправдал себя на практике.
Слайд 160
Излучение радона помогает исследовать состояние и дефекты различных
материалов. В частности, радоновыми индикаторами пользуются для контроля противогазов
на герметичность. Радон же помогает иногда следить за ходом технологических процессов в производстве таких несходных материалов, как сталь и стекло...
Применительно к радону эпитет «самый» можно повторять многократно: самый тяжелый, самый редкий, самый дорогой из всех существующих на Земле газов.
Слайд 161
Наверно понятно, что газ на картинке изобразить невозможно…
А
если возможно, то я не нашёл…..
Слайд 163
Фтор
Фтор (F) — химический элемент VII а-группы периодической
системы Менделеева, относится к галогенам, атомный номер 9, при
нормальных условиях элемент фтор находится в виде двухатомных молекул F2 — газ бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор.
Слайд 164
История
Первое соединение фтора — флюорит (плавиковый шпат) CaF2
— описано в конце XV века под названием «флюор».
В 1771 году Карл Шееле получил плавиковую кислоту.
Как один из атомов плавиковой кислоты, элемент фтор был предсказан в 1810 году, а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Слайд 165
Происхождение названия
Название «фтор» (от греч. φθόρος — разрушение),
предложенное Андре Ампером в 1810 году, употребляется в русском
и некоторых других языках; во многих странах приняты названия, производные от латинского «Fluor» (которое происходит, в свою очередь, от fluere — «течь», по свойству соединения фтора, флюорита (CaF2), понижать температуру плавления руды и увеличивать текучесть расплава).
Слайд 166
Распространение в природе
Содержание фтора в атомных процентах в
природе показано в таблице:
Слайд 167
В природе значимые скопления фтора содержаться разве что
только в минерале флюорите.
В некоторой степени относительно богаты фтором
растения чечевица и лук
Содержанием в почве фтор обязан вулканическим газам, за счет того, что в его состав обычно входит большое количество фтороводорода.
Слайд 168
Изотопный состав
Фтор является «чистым элементом», то есть в
природе содержится только изотоп фтора F19. Известны 17 радиоактивных
изотопов фтора с массовым числом от 14 до 31. Самым долгоживущим из них является 18F с периодом полураспада 109,8 минуты, важный источник позитронов, использующийся в позитрон-эмиссионной томографии.
Слайд 170
Магнитные свойства ядер
Ядра изотопа 19F имеют полуцелый спин,
поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры
ЯМР-19F являются достаточно характеристичными для фторорганических соединений.
Слайд 171
Электронное строение
Электронная конфигурация атома фтора следующая: 1s22s22p5. Атомы
фтора в соединениях могут проявлять степень окисления равную -1.
Положительные степени окисления в соединениях не реализуются, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — 2P3/2
Слайд 172
Строение молекулы
С точки зрения теории молеклярных орбиталей, строение
двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле
присутствует 4 связывающих орбители и 3 разрыхляющих. Очевидно, что порядок связи в молекуле равен 1.
Слайд 173
Кристаллическая решётка
Кристаллическая структура α-фтора (стабильная при нормальных
условиях)
Кристаллическая решётка фтора в твёрдом состоянии является моноклиной гранецентрированной
со следующими параметрами решётки:
Слайд 174
Получение
Лабораторный метод получения фтора
Источником для производства фтора
служит фтористый водород HF, получающийся в основном либо при
действии серной кислоты H2SO4 на флюорит CaF2, либо при переработке апатитов и фосфоритов.
Слайд 175
Лабораторный метод
В лабораторных условиях фтор можно получать с
помощью показанной установки. В медный сосуд 1, заполненный расплвом
КF·3НF помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, впроцессе электролиза, газообразный фтор выделяется из трубки 3, а водород из трубки 4. Важным требованием является обеспечение герметичности системы для этого исполизуют пробки из фторида кальция со смазкой из оксида свинца (II) и глицерина.
В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C:ссылка?
K2MnF6 + 2SbF5 → 2KSbF6 + MnF3 + ½F2
Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен.
Слайд 176
Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого
фторида калия КF·3НF (часто с добавлениями фторида лития), который
образуется при насыщении расплава КF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100°С в стальных электролизёрах со стальным катодом и угольным анодом.
Слайд 177
Физические свойства
Слабо светло-зеленоватый газ, в малых концентрациях запах
напоминает хлор, очень агрессивен и ядовит.
Слайд 178
Химические свойства
Самый активный неметалл, бурно взаимодействует почти со
всеми веществами (редкие исключения — фторопласты), и с большинством
из них — с горением и взрывом. В атмосфере фтора горят даже вода и платина:
2F2 + 2H2O → 4HF + O2
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
XeF8 → XeF6 + F2
MnF4 → MnF3 + 1/2 F2
Слайд 179
Хранение
Фтор хранят в газообразном состоянии (под
давлением) и в жидком виде (при охлаждении жидким азотом)
в аппаратах из никеля и сплавов на его основе (монель-металл), из меди, алюминия и его сплавов, латуни, нержавеющей стали.
Слайд 180
Применение в химии
Газообразный фтор используется для получения:
гексафторида урана
UF6 из UF4, применяемого для разделения изотопов урана для
ядерной промышленности.
трёхфтористого хлора ClF3 — фторирующий агент и мощный окислитель ракетного топлива
шестифтористой серы SF6 — газообразный изолятор в электротехнической промышленности
фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами
фреонов — хороших хладагентов
тефлонов - химически инертных полимеров
гексафтороалюмината натрия — для последующего получения алюминия электролизом
различных соединений фтора
Слайд 181
Биологическая и физиологическая роль
Фтор является жизненно необходимым для
организма элементом. В организме человека фтор, в основном, содержится
в эмали зубов в составе фторапатита — Ca5F(PO4)3. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариеса и флюорозу (крапчатости эмали) и остеосаркомы, соответственно[2].
Малое содержание фтора разрушает эмаль за счет вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фтора или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1-2% раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30-50%.
Предельно допустимая концентрация связанного фтора[3] в воздухе промышленных помещениях равен 0,0005 мг/литр.
Слайд 183
Без этого элемента вы не проживете и десяти
минут.
Слайд 184
Которое зовут озоном.
И в этом есть большой резон:
В
грозу запахнет над газоном –
От слова «пахнущий» -
озон.
Как по составу различают
Два аллотропных вещества?
О3 озон обозначают,
А кислород – всего О2.
Оно нам хорошо известно:
Газообразный кислород,
Которым дышат, если честно,
И человек, и бегемот.
Из элемента кислорода
(Обозначают буквой О)
Ёще придумала природа
Одно простое вещество,
Слайд 186
1. ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТА «КИСЛОРОД»
Химический знак О
Положение
в ПСХЭ период II, группа VIА, порядковый номер
8
Относительная атомная масса Аr(O)=16
Химическая формула вещества О2
Относительная молекулярная масса Mr(O2)=32
Валентность II
Слайд 187
2. РАСПРОСТРАНЕНИЕ КИСЛОРОДА В ПРИРОДЕ
Первое место по распространенности
в земной коре, т.е. литосфере, занимает кислород – 49%,
далее следуют: кремний 26%, алюминий 7%, железо 5%, кальций 4%, натрий, калий и магний по 2%, водород 1%.
В гидросфере на его долю приходится 89%.
В биосфере около 65% от массы живых организмов приходится на кислород.
Слайд 188
В атмосфере 23% по массе и 21% по
объему.
В виде чего находится кислород в природе?
Слайд 189
Карл Вильгельм Шееле (шведский химик) в 1772 году
получил и детально исследовал «огненный воздух», в котором горит
свеча.
Слайд 190
Антуан Лавуазье в 1774 году провел эксперимент и
доказал, что воздух состоит на 1/5 часть из кислорода
и 4/5 части азота. Он опроверг теорию «флогистона».
Слайд 191
3. ФИЗИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА
Кислород – газ, без цвета
и запаха, мало
растворим в воде (в 100 объемах воды
при
20°C растворяется 3,1 объема
кислорода), кислород немного
тяжелее воздуха (1 л О2 при нормальных
условиях (н.у.) весит 1,43 г; 1 л воздуха
при н.у.-1,29 г),температура кипения
кислорода -183°C, температура
плавления -219°.
Слайд 193
5. СПОСОБЫ ПОЛУЧЕНИЯ КИСЛОРОДА
1. В промышленности кислород получают
из воздуха. Воздух представляет собой смесь различных газов, основные
компоненты в нем – азот и кислород. Для получения кислорода воздух под давлением сжижают. Так как температура кипения жидкого азота (-196°С) ниже температуры кипения жидкого кислорода (-183°C), то азот испаряется раньше кислорода. Жидкий кислород отделяют от испарившегося азота и хранят в стальных баллонах под давлением 15 МПа.
Слайд 194
2. В лаборатории кислород получают из кислородсодержащих веществ
путем их разложения при нагревании.
а) разложение перманганата калия
2KMnO4
= K2MnO4 + MnO2 + O2↑
Слайд 195
б) электролиз воды
2H2O = 2H2↑
+ O2↑
в) разложение пероксида водорода
2H2O2 =
2H2O + O2↑
г) разложение хлората калия
2KClO3 = 2KCl + 3O2↑
д) разложение оксида ртути (II)
2HgO = 2Hg + O2↑
Слайд 196
Джозеф Пристли (английский ученый) в 1774 году разложением
оксида ртути (II) открыл кислород и изучил его свойства.
Слайд 200
1. СТРОЕНИЕ МОЛЕКУЛЫ ВОДЫ.
МОЛЕКУЛА ВОДЫ СОСТОИТ ИЗ 2
АТОМОВ ВОДОРОДА И 1 АТОМА КИСЛОРОДА, КОТОРЫЕ НАХОДЯТСЯ ДРУГ
ОТНОСИТЕЛЬНО ДРУГА ПОД УГЛОМ 105°
Слайд 201
2. ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ.
ЧИСТАЯ (ДИСТИЛЛИРОВАННАЯ) ВОДА –
БЕСЦВЕТНАЯ ЖИДКОСТЬ, БЕЗ ЗАПАХА И ВКУСА
ЕДИНСТВЕННОЕ ВЕЩЕСТВО, КОТОРОЕ НА
ЗЕМЛЕ СУЩЕСТВУЕТ В ТРЕХ АГРЕГАТНЫХ СОСТОЯНИЯХ
ТЕМПЕРАТУРА КИПЕНИЯ 100°С
ТЕМПЕРАТУРА КРИСТАЛЛИЗАЦИИ (ПЛАВЛЕНИЯ) 0°С
Слайд 202
В XVIII ВЕКЕ ВОДА ПОСЛУЖИЛА ЭТАЛОНОМ ДЛЯ
ВЫБОРА ЕДИНИЦЫ МАССЫ: МАССЕ 1 куб. см. БЫЛО ПРИПИСАНО
ЗНАЧЕНИЕ 1г
МАКСИМАЛЬНАЯ ПЛОТНОСТЬ ПРИ 4°С ПРИНЯТА ЗА 1г/мл, ВСЕ ОСТАЛЬНЫЕ ВЕЩЕСТВА СРАВНИВАЮТСЯ ПО ПЛОТНОСТИ И МАССЕ С ВОДОЙ
ПЛОТНОСТЬ ЛЬДА МЕНЬШЕ, ЧЕМ У ЖИДКОЙ ВОДЫ, ЧТО ЯВЛЯЕТСЯ АНОМАЛЬНЫМ СВОЙСТВОМ ВОДЫ
ВОДА ОБЛАДАЕТ САМОЙ БОЛЬШОЙ ТЕПЛОЕМКОСТЬЮ
ОНА НЕ ПРОВОДИТ
ЭЛЕКТРИЧЕСКИЙ ТОК
Слайд 203
3. ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ.
1. С МЕТАЛЛАМИ.
а) очень активные
металлы при взаимодействии с водой образуют гидроксид и водород
2Na
+ 2H2O = 2NaOH + H2
гидроксид натрия
2K + 2H2O = 2KOH + H2
гидроксид калия
Ca + 2H2O = Ca(OH)2 + H2
гидроксид кальция
Слайд 204
б) средние по активности металлы при взаимодействии с
водой при нагревании образуют оксид металла и водород
Zn +
H2O = ZnO + H2
оксид цинка
в) малоактивные металлы с водой
не реагируют
Слайд 205
2. С ОКСИДАМИ.
а) оксиды металлов при взаимодействии с
водой образуют гидроксиды
CaO + H2O = Ca(OH)2
гидроксид кальция
б) оксиды неметаллов при взаимодействии с водой образуют кислоты
SO3 + H2O = H2SO4
серная кислота
Слайд 206
P2O5 + 3H2O = 2H3PO4
фосфорная кислота
Слайд 207
3. РАЗЛОЖЕНИЕ (ЭЛЕКТРОЛИЗ)
2H2O = 2H2 + O2
Слайд 209
СЛОЖНЫЕ ВЕЩЕСТВА БЫВАЮТ:
ОКСИДЫ
ОСНОВАНИЯ
КИСЛОТЫ
АМФОТЕРНЫЕ ГИДРОКСИДЫ
СОЛИ
Слайд 213
ЗНАЧЕНИЕ КИСЛОТ В ЖИЗНИ ЧЕЛОВЕКА
Пищевкусовые добавки
Консервирование
Производство
лекарственных средств,
красителей, полимеров,
взрывчатых веществ, удобрений,
пищевых продуктов.
Слайд 214
Кислоты – это соединения,
состоящие
из кислотных остатков
и атомов водорода,
способных замещаться атомами
металлов
с образованием солей.
Слайд 215
КЛАССИФИКАЦИЯ КИСЛОТ
ПО СОДЕРЖАНИЮ АТОМОВ КИСЛОРОДА В МОЛЕКУЛЕ
КИСЛОТЫ
КИСЛОРОДСОДЕРЖАЩИЕ
БЕСКИСЛОРОДНЫЕ
Слайд 216
КЛАССИФИКАЦИЯ КИСЛОТ
ПО КОЛИЧЕСТВУ АТОМОВ ВОДОРОДАВ МОЛЕКУЛЕ
КИСЛОТЫ
ОДНООСНОВНЫЕ
ТРЕХОСНОВНЫЕ
ДВУХОСНОВНЫЕ
Слайд 217
КЛАССИФИКАЦИЯ КИСЛОТ
ПО РАСТВОРИМОСТИ В ВОДЕ
КИСЛОТЫ
РАСТВОРИМЫЕ
НЕРАСТВОРИМЫЕ
Слайд 218
КЛАССИФИКАЦИЯ КИСЛОТ
ПО ЛЕТУЧЕСТИ
КИСЛОТЫ
ЛЕТУЧИЕ
НЕЛЕТУЧИЕ
Слайд 219
КЛАССИФИКАЦИЯ КИСЛОТ
ПО СТЕПЕНИ ДИССОЦИАЦИИ
КИСЛОТЫ
СИЛЬНЫЕ
СЛАБЫЕ
Слайд 220
КЛАССИФИКАЦИЯ КИСЛОТ
ПО СТАБИЛЬНОСТИ (УСТОЙЧИВОСТИ)
КИСЛОТЫ
СТАБИЛЬНЫЕ
НЕСТАБИЛЬНЫЕ
Слайд 221
НОМЕНКЛАТУРА КИСЛОТ
Бескислородные кислоты:
К названию кислотообразующего элемента
добавляют гласную «о» и слова «водородная кислота»
H2S – сероводородная
кислота
Кислородсодержащие кислоты:
К русскому названию кислотообразующего элемента добавляют суффикс.
+5
Если элемент проявляет высшую СО – «-ная»: HNO3
+3
Если СО элемента ниже высшей – «-истая»: HNO2
Слайд 222
Кислотные свойства кислот, образованных элементами одного периода:
H3BO3
- H2CO3 - H2SO4
усиливаются
Слайд 223
Кислотные свойства кислот, образованных элементами одной подгруппы:
H2SO4
H2SeO3
H6TeO6
ослабевают
Слайд 224
Кислотные свойства кислот, образованных элементом
в различных СО:
+5
+6
HNO3 H2SO4
+3 +4
HNO2 H2SO3
усиливаются
Слайд 225
ОБЩИЕ СВОЙСТВА КИСЛОТ
Кислый вкус
Действие на индикаторы
Электрическая проводимость
Химическое взаимодействие
с металлами, основными и амфотерными оксидами, основаниями, солями, спиртами
Диссоциация
при растворении в воде.
Слайд 226
Настал такой момент, когда в Интернете
уже нечего(да, да!!! Представьте себе!!!) нечего найти!!!
Но поговорим про
получение водорода и др. веществ
Слайд 227
Получение водорода
электр. ток
1) 2Н2О 2Н2↑+О2↑ (промышленный способ)
2) Zn+2HCI → H2↑ + ZnCI2 (лабораторный способ)
НСI
Zn
H2
Слайд 228
Получение кислорода
Фотосинтез
2Н2О → 2Н2↑+О2↑ (пром. способ)
Из жидкого воздуха
(пром. способ)
Из Н2О2 (перекись водорода), КМnO4, КСIO3 (лаб.способ)
Слайд 229
Нахождение в природе Н2
В составе Солнца – 70%
В
атмосфере на высоте 100 км
Звёзды
Вода
Нефть
Слайд 230
Нахождение О2 в природе
Атмосфера – 21% по V
Почва
– 47,2%
Горные породы, руды
Вода – 89%
Организм человека (65%)
и животных
Молекулы.
Подавляющие большинство веществ
состоит из молекул, мельчайших частиц которые сохраняют, все физические свойства вещества.
В природе существует около 100 видов атомов, приведенных в таблице Менделеева, из этих атомов образуется все многообразие существующих в природе веществ.
Слайд 234
1 СТАКАН
С ВОДОЙ
2 АТОМ
КИСЛОРОДА
3 АТОМ
ВОДОРОДА
4МОЛЕКУЛА
ВОДЫ
вода
Слайд 235
МОЛЕКУЛЫ
Молекула вещества может состоять :
из нескольких разных атомов,
из нескольких одинаковых атомов.
Некоторые вещества
состоят просто из
атомов.
Слайд 236
Я Д Р О.
Сильно упрощая, все строение
ядра можно свести к двум основным частицам: нейтрону и
протону.
ПРОТОН
НЕЙТРОН
Слайд 237
Приведем характеристики этих частиц в сравнении с характеристиками
электрона:
Слайд 241
БРОМ (лат. Bromum), Br - химический элемент VII

группы периодической системы Менделеева, относится к галогенам, атомный номер
35, атомная масса 79,904; красно-бурая жидкость с сильным неприятным запахом. Бром впервые был получен в1825г. Левигом - студентом Гейдельбергского университета, работавшим у Гмелина. Левиг выделил бром из воды источника в Крейцнахе, воздействуя на неё хлором. Но пока он приготовлял большее количество препарата для исследования, появилось сообщение Балара (1826). Препаратор из Монпелье описывал тяжелую темно-бурую жидкость, которую он выделил из золы морских водорослей, признал новым элементарным веществом и назвал муридом (от лат. muria - рассол). Однако комиссия Парижской академии наук, проверявшая опыты Балара, нашла это название неудачным, так как соляная кислота называлась тогда Acidum muriaticum (муриевая кислота, от гипотетического элемента мурия), а ее соли - муриатами. Столь похожие названия - мурид и муриаты - могли вызвать недоразумения. Комиссия предложила назвать элемент бромом (Brome) от греческого - зловонный. Это название (с языковыми особенностями) было принято во всех странах. В русской химической литературе XIX в. встречаются названия вром, мурид, вромид, а затем, начиная с Гесса и др., бром. Природный бром состоит из 2 стабильных изотопов 79Br (50,34%) и 81Br (49,46%). Из искусственно полученных радиоактивных изотопов брома наиболее интересен 80Вr, на примере которого И. В. Курчатовым открыто явление изомерии атомных ядер.
БРОМ
Слайд 242
Исходным сырьём для получения брома служат морская вода,

озёрные и подземные рассолы и щелока калийного происхождения, содержащие
бром в виде бромид - иона Вг-. Бром выделяют при помощи хлора и отгоняют из раствора водяным паром или воздухом. Отгонку паром ведут в колоннах, изготовленных из гранита, керамики или иного стойкого к брому материала. Сверху в колонну подают подогретый рассол, а снизу - хлор и водяной пар. Пары брома, выходящие из колонны, конденсируют в керамиковых холодильниках. Далее бром отделяют от воды и очищают от примеси хлора дистилляцией. Отгонка воздухом позволяет использовать для получения брома рассолы с его низким содержанием, выделять бром из которых паровым способом в результате большого расхода пара невыгодно. Из получаемой бромовоздушной смеси бром улавливают химическими поглотителями. Для этого применяют растворы бромистого железа, которое, в свою очередь, получают восстановлением FеВг3 железными стружками, а также растворы гидроокисей или карбонатов натрия или газообразный сернистый ангидрид, реагирующий с бромом в присутствии паров воды с образованием бромисто-водородной и серной кислот. Из полученных полупродуктов бром выделяют действием хлора или кислоты. В случае необходимости полупродукты перерабатывают на бромистые соединения.
ПОЛУЧЕНИЕ БРОМА
Слайд 243
Бром ядовит. Поэтому, работая с ним, нужно быть
осторожным. Предельно допустимая концентрация паров брома в воздухе 0,5 мг/м3.
Большее (порядка 0,001%) содержание брома в воздухе приводит к головокружению, головной боли, раздражению слизистых оболочек, кашлю, удушью, вызывает бронхит, иногда смерть. При легком отравлении парами брома необходимо дать пострадавшему вдыхать аммиак. Если жидкий бром попал на руки, то во избежание ожогов и медленно заживающих язв его необходимо сразу же смыть большим количеством воды, а еще лучше раствором соды. Затем пораженное место нужно смазать мазью, содержащей бикарбонат натрия.
техника безопасности
Слайд 244
Физические и химические свойства брома
При -7,2°С жидкий

бром застывает, превращаясь в красно-коричневые игольчатые кристаллы со слабым
металлическим блеском. Пары брома жёлто-бурого цвета, t кип 58,78°С. Плотность жидкого брома (при 20°С) 3,1 г/см3. В воде бром растворим ограниченно, но лучше других галогенов (3,58 г брома в 100 г Н2О при 20°С). Ниже 5,84°С из воды осаждаются гранатово-красные кристаллы Br2*8H2O. Особенно хорошо растворим бром во многих органических растворителях, чем пользуются для извлечения его из водных растворов. Бром в твердом, жидком и газообразном состоянии состоит из 2-атомных молекул. Заметная диссоциация на атомы начинается при температуре около 800°С; диссоциация наблюдается и при действии света.
Конфигурация внешних электронов атома брома 4s2 4p5. Валентность брома в соединениях переменна, степень окисления равна -1 (в бромидах, напр. КВr), +1 (в гипобромитах, NaBrO), +3 (в бромитах, NaBrO2), +5 (в броматах, КВrО3) и + 7 (в перброматах, NaBrO4). Химически бром весьма активен, занимая по реакционной способности место между хлором и йодом. Взаимодействие брома с серой, селеном, теллуром, фосфором, мышьяком и сурьмой сопровождается сильным разогреванием, иногда даже появлением пламени. Так же энергично бром реагирует с некоторыми металлами, например калием и алюминием. Однако многие металлы реагируют с безводным бромом с трудом из-за образования на их поверхности защитной плёнки бромида, нерастворимого в броме.
Из металлов наиболее устойчивы к действию брома, даже при повышенных температурах и в присутствии влаги, серебро, свинец, платина и тантал (золото, в отличие от платины, энергично реагирует с бромом). С кислородом, азотом и углеродом бром непосредственно не соединяется даже при повышенных температурах. Соединения брома с этими элементами получают косвенным путём. Таковы крайне непрочные окислы Br2O,BrO2 и Вr3О8.
Бром - сильный окислитель. Так, он окисляет сульфиты и тиосульфаты в водных растворах до сульфатов, нитриты до нитратов, аммиак до свободного азота. Бром вытесняет йод из его соединений, но сам вытесняется хлором и фтором. Свободный бром выделяется из водных растворов бромидов также под действием сильных окислителей в кислой среде. При растворении в воде бром частично реагирует с ней с образованием бромисто-водородной кислоты НВr и неустойчивой бромноватистой кислоты НВrО. Раствор брома в воде называют бромной водой. Из реакций брома с органическими соединениями наиболее характерны присоединение по двойной связи С=С, а также замещение водорода (обычно при действии катализаторов или света).
Слайд 245
Бром - постоянная составная часть тканей животных
и растений. Наземные растения содержат в среднем 7*10-4% брома
на сырое вещество, животные 10-4%. Бром найден в различных секретах (слезах, слюне, поте, молоке, желчи). В крови здорового человека содержание брома колеблется от 0,11 до 2,00 мг. С помощью радиоактивного брома (82Br) установлено избирательное поглощение его щитовидной железой, Мозговым слоем почек и гипофизом. Введенные в организм животных и человека бромиды усиливают концентрацию процессов торможения в коре головного мозга, содействуют нормализации состояния нервной системы, пострадавшей от перенапряжения тормозного процесса. Одновременно, задерживаясь в щитовидной железе, бром вступает в конкурентные отношения с йодом, что влияет на деятельность железы, а в связи с этим - и на состояние обмена
бром в организме
Слайд 246
В земле бром присутствует главным образом в виде

ионов, которые путешествуют вместе с грунтовыми водами. Часть земного
брома связана в организмах растений в сложные и большей частью нерастворимые органические соединения. Некоторые растения активно накапливают бром. Это в первую очередь бобовые – горох, фасоль, чечевица – и, конечно, морские водоросли. Ведь именно в море сосредоточена большая часть брома нашей планеты.
Довольно много брома в съедобных грибах. В боровиках, подберезовиках, подосиновиках – примерно 1,4·10–3% элемента №35. Есть он и в воде соленых озер, и в подземных «водохранилищах», сопутствующих месторождениям горючих ископаемых, а также калийных солей и каменной соли.
Есть бром и в атмосфере. Подсчитано, что ежегодно вместе с морской водой в воздух переходит около 4 млн. т брома, причем содержание этого элемента в воздухе приморских районов всегда больше, чем в районах с резко континентальным климатом.
Море – главный поставщик брома. Довольно много брома в организмах рыб. Он всегда присутствует и в организмах земных животных, не исключая человека. Потребность в броме у разных органов и систем разная. В человеческом организме этот элемент обнаружен в крови, почках, печени и больше всего в мозге.
бром всюду
Слайд 247
Бром и серебро сопутствуют друг другу не только

в минералах. Не будет преувеличением сказать, что бромистое серебро
– главная соль химико-фотографической промышленности, потому что AgBr по светочувствительности намного превосходит йодид серебра и другие соли. Современные светочувствительные эмульсии на основе AgBr позволяют снимать с выдержкой в одну десятимиллионную долю секунды. Справедливости ради упомянем, что в фотографии широко применяется еще одна бромистая соль – бромистый калий. Его вводят в состав фотографических реактивов, чтобы на пленке или отпечатке не было вуали.
Бромистый натрий добавляют в дубильные растворы, благодаря чему кожа становится тверже.
Из прозрачных кристаллов бромистого калия делают линзы, великолепно пропускающие инфракрасные лучи. Бактерицидные свойства бромистого калия помогают дольше сохранять овощи и фрукты.
Много «профессий» у бромистого лития. Он предотвращает коррозию в холодильных установках, обезвоживает минеральные масла, помогает кондиционировать воздух.
Текстильщики широко применяют органический краситель броминдиго, с помощью которого получают целую гамму ярких и чистых тонов – от синего до красного. Другое бром органическое соединение – бром хлорметан – отличный огнетушитель, который к тому же не проводит электричества и потому особенно эффективен, когда нужно, например, потушить загоревшуюся проводку. Бром органикой пропитывают древесину, чтобы придать ей большую стойкость к атмосферным воздействиям, грибкам, плесени.
Для получения большинства этих полезных соединений, прежде всего органических, нужен ядовитый, зловонный, агрессивный, крайне неприятный в общении, но тем не менее незаменимый бром.
применение брома
Слайд 248
В 1946 г. в «Трудах Биогеохимической лаборатории АН СССР» была

опубликована статья Л.С. Селиванова, который измерял содержание брома в воздухе
и столкнулся с любопытным фактом. Оказалось, что зимой в московском воздухе было больше брома, чем летом. Казалось бы, очень странное явление! Но объяснилось все просто. В то время большинство московских котельных топили углем, а уголь, как известно, образовался из древних растений. Многие растения концентрируют бром, рассеянный в почве, природных водах и атмосфере. По-видимому, этой способностью обладали и те растения, из которых получился каменный уголь. А если так, то дым котельных должен был «обогащать» воздух этим не очень редким, но рассеянным элементом.
Уже более столетия медики пользуются бромистыми препаратами для лечения нервных болезней, однако, долгое время механизм действия этих препаратов на нервную систему оставался неизвестным.
В 1910 г. один из учеников И.П. Павлова, П.М. Никифоровский, нашел правильное объяснение действию брома на нервную систему.
Был поставлен такой опыт. В течение нескольких дней собаке давали через каждые 5 минут сухой мясной порошок и подсчитывали капли падающей в баллончик слюны. При этом проверяли, как действуют на собаку различные раздражители: телефонный звонок, стук маятника, бульканье воды, вспышка лампочки, – и снова подсчитывали капли слюны. Спустя некоторое время за час до опыта собаку стали подкармливать молоком, смешанным с раствором бромистого натрия. В остальном
условия опыта не меняли. С каждым разом железы животного выделяли все меньше и меньше слюны в ответ на раздражение, а спустя месяц выделение слюны и вовсе прекратилось; собака перестала реагировать и на звонок, и на стук, и на свет. Но как только собаке перестали давать бромистые соли, у нее снова «потекли слюнки» при гудении телефона, стуке маятника, вспышке лампочки.
Из опыта был сделан вывод, что бром не уменьшает возбудимость, а усиливает торможение: в этом и заключается его целительное действие на нервную систему.
Разумеется, злоупотреблять бромными препаратами опасно. Накопление большого количества брома в организме вызывает отравление.
любопытные факты
Слайд 251
На земной поверхности фтор встречается исключительно
в составе солей. Общее его содержание в земной коре
равняется 0,02 %. Основная масса фтора распылена по различным горным породам. Из отдельных форм его природных скоплений наиболее важен минерал флюорит – СаF2.
Нахождение фтора в природе.
Слайд 252
Основная масса фтора земной поверхности обязана своим происхождением
горячим недрам Земли. Человеческий организм содержит фтористые соединения главным
образом в зубах и костях. В вещество зубов входит около 0,01 % фтора, причем большая часть этого количества падает на эмаль. В отдельных костях содержание фтора сильно колеблется. Для растительных организмов накопление фтора не характерно. Из культурных растений относительно богаты им лук и чечевица. Обычное поступление фтора в организм с пищей составляет около 1 мг за сутки.
Слайд 253
В центре атома находится положительное заряженное
ядро. Вокруг вращаются 9 отрицательно заряженных электронов.
Строение атома фтора
Слайд 254
Элементарный фтор получают путем электролиза фтористых
соединений. причем он выделяется на аноде по схеме:
2
F- = 2е + 2 F = 2е + F2
Электролитом обычно служит смесь состава КF·2НF. Процесс проводят при температурах около 100 'С в стальных электролизерах со стальными катодами и угольными анодами.
Электролизу подвергают легкоплавкую смесь состава КF·3НF, помещенную в служащую катодом внешний медный сосуд А. Анод из толстой никелевой проволоки помещается в медном цилиндре Б, нижняя боковая часть которого имеет отверстия. Выделяющийся фтор отводится по трубке В (а водород - через отвод Г).
Получение фтора.
Удобная лабораторная установка для получения фтора
Слайд 255
Соединения фтора находят широкое применение в различных областях
науки и техники.
Наибольшее применение из органических фторсодержащих соединений находят
фреоны. Например, в домашних холодильниках охлаждение достигается испарением в замкнутом пространстве фреона – 12 CF2CL2.
Слайд 256
Свойство фторидов предотвращать образование полостей и разрушение зубов
было открыто в ходе экспериментов доктора Basil Bibby в
начале 1940 года. Доктор обнаружил, что если на хлопковый тампон нанести немного фторида и приложить его к больному зубу, то зуб можно сохранить. Фториды предотвращают разрушение зубов, так как тормозят рост бактерий продуцирующих определенные ферменты. Кроме того, они способствуют реминерализации зубной эмали. Целебное действие фторидов проявляется при прямом контакте с зубом.
Согласно мнению большинства ученых, только местное воздействие фторидов предотвращает разрушение зубов.
Фториды — друзья
Слайд 257
Алюминий – наиболее распространенный металл земной коры, запасы
его огромны, однако производство алюминия начало развиваться лишь в
конце прошлого века. Кислородные соединения алюминия очень прочны, и восстановление их углем не дает чистого металла. А для получения алюминия методом электролиза требуются его галоидные соединения и прежде всего криолит, содержащий и алюминий и фтор.
Слайд 258
C2 F4 – при полимеризации этого вещества образуется
отличающейся чрезвычайной химической стойкостью фторопласт или тефлон (антипригарное покрытие).
Слайд 259
Роль фтора и его соединений в производстве ядерного
горючего исключительна. Можно смело утверждать, что не будь фтора,
в мире до сих пор не было бы ни одной атомной электростанции, а общее число исследовательских реакторов нетрудно было бы сосчитать на пальцах.
Фтор и атомная энергия
Слайд 261
Очистка воды и
определение активного
хлора в
питьевой воде.
Слайд 263
Дезинфекционные свойства хлора
При растворении хлора в воде идут

две параллельные реакции:
CI2 +H2O = H+ + CI-
+ HClO
HClO = H+ + ClO-
Дезинфектами в данном случае являются хлор и хлорноватистая кислота.
При увеличении pH увеличивается концентрация ионов ClO, которые не имеют дезинфекционной способности и, соответственно уменьшаются бактерицидные свойства раствора.
В случае гипохлорида натрия идут следующие реакции:
NaClO + H2O = NaOH + HClO
Дезинфектом в данном случае является только хлорноватистая кислота.
При разборе микробиологического механизма дезинфекции, обращают на себя внимание следующие сообщения:
Отмечено образование ассоциатов микроорганизмов, в которые проникновение хлора затруднено, в следствие чего дезинфекция как процесс увеличивается во времени.
При взаимодействии гипохлорида натрия с палочкой Коха добавочное действие электрического поля УФ – излучение позволяют увеличить дезинфекционный процесс в 100 и даже 1000 раз.
Предполагают что при воздействии указанных реагентов происходит изменение цитоплазмической мембраны, что делает клетку более уязвимой. Оставляя сделанные выводы в компетенции авторов статей следует отметить, что дезинектами такими как Cl2 и HClO и начинается с разрушения цитоплазмической мембраны, окружающей клетку.
Слайд 264
Хлор вызывает опасные заболевания
Хлор является канцерогеном и
способствует возникновению
злокачественных опухолей!!!
Я
Явление местного парообразования, возникающее в жидкости, движущейся с
большой скоростью по поверхности твердого тела, и обусловливаемое падением давления в жидкости до давления, соответствующего в практических условиях давлению парообразования, В физическом понимании кавитация нарушение, разрыв сплошности потока жидкости с образованием в нем пустоты, в которую выделяются пузырьки насыщенного пара и растворенных в жидкости газов. Появление кавитации в авиационных системах (гидравлической, топливной, масляной, жидкостного охлаждения) может наступать с подъемом самолета
предотвращения появления кавитации перед входом в основной
дополнительных насосов подкачки топлива, инжекторов и удаляют пузырьки сепарированием и центрифугированием жидкости.
Слайд 268
Трубы необходимо видоизменить данным образом:
Направление движения воды
Образование в безвоздушном пространстве областей повышенного давления
Слайд 274
Принцип действия кавитации
P = 1000 atm
T = 100 000 o K
Слайд 275
Принцип действия кавитации
Происходит разрыв бактерии
Слайд 276
Понимаю, надоело, но 90% то что вы не
смотрите это слайд……чуть- чуть о сере…..
Слайд 277
Сера.
Ее физические и химические свойства
Слайд 278
«В древней магии присутствую при рождении огня, называют
серой издавна меня"
Слайд 279
1вариант –О2 2вариант-О3
Газ
без запаха
Проявляет окислительные и восстановительные свойства
Используется для очистки воды
Образуется
при фотосинтезе
Вещество задерживающее ультрафиолетовое излучение
Получают при разложение воды электрическим током
Газ с запахом свежести
Лучина в этом веществе горит ярче
Входит в состав гипса
Газ обесцвечивает ткани
Слайд 280
Ромбическая сера - твёрдое кристаллическое вещество желтого цвета,
не растворяется в воде. Хорошо растворяется в сероуглероде и
некоторых органических растворителях. Температура плавления ромбической серы +112,8, при температуре +444,6 сера кипит.
Физические свойства серы
Слайд 281
2AL+3S=AL2 S6
Hg +S=HgS
H2 +S =H2S
S+O2=SO2
3S+6KOH=2K2S+K2SO3+3H2O
S+6HNO3=H2SO4+6NO2 +2H2O
S+2H2SO4=3SO2 +2H2O
Химические свойства
серы
Слайд 282
Тайна черного моря
Трясся Крым двадцать восьмого года.
Ставало
море на дыбы,
Испуская, к ужасу народа,
Огненные серные столбы.
Всё прошло!
Опять гуляет пена,
Но с тех пор всё выше и плотней
Сумрачная серная гиена
Поступает к днищам кораблей
Ю.Кузнецова
Слайд 283
Соединения серы могут служить лекарственными препаратами
Сера- основа мазей
для лечения грибковых заболеваний кожи, для борьбы с чесоткой.
Многие соли серной кислоты содержат кристаллизационную воду- это купоросы. Их применяют как антисептическое средство для опрыскивания растений и протравливания зерна в борьбе с вредителями сельского хозяйства
Железный купорос используют при анемии
Сульфат бария используют при рентгенографическом исследовании желудка и кишечника
Крестоцветные усваивают из почвы столько же серы, столько и фосфора Поэтому при посадке в почву вносят удобрения сульфат кальция
Тысячелистник обладает высокой способностью извлекать из почвы серу и стимулирует поглощение этого элемента другими соседними растениями
Чеснок выделяет вещество- альбуцид- .едкое соединение серы. Это вещество предотвращает развитие раковых клеток, замедляет старение, предупреждает сердечные заболевания
Знаете ли Вы, что...
Слайд 284
Всё ближе и ближе заветная цифра 300………………
Слайд 285
Основные классы неорганических соединений
Слайд 286
Классификация неорганических веществ;
Классификация оксидов;
Получение оксидов;
Получение пероксида водорода;
Химические свойства
пероксида водорода.
Содержание:
Слайд 287
Классификация неорганических веществ
Слайд 289
Нормальные оксиды – оксиды, в которых есть только
связи между кислородом и каким-нибудь элементом. Примеры: MgO, SO3
, SiO2;
Пероксиды – оксиды, в которых есть связи между двумя атомами кислорода. Примеры: Na2O2, H2O2;
Смешанные оксиды – оксиды, которые представляют собой смесь двух одного элемента в разных степенях окисления. Примеры:Pb3O4 = 2PbO + PbO2;Fe3O4 = FeO + Fe2O3
Кислотные оксиды (ангидриды) – оксиды, которые реагируют с водой, образуя кислоты; с основаниями и основными оксидами образуют соли. Примеры: SO3, SO2, Mn2O7;
Классификация оксидов
Слайд 290
Основные оксиды – оксиды, которые реагируют с водой,
образуя основания; с кислотами и кислотными оксидами образуют соли.
Примеры: CaO, Na2O;
Амфотерные оксиды – оксиды, которые в зависимости от условий проявляют свойства и кислотных, и основных оксидов. Примеры: ZnO, Al2O3;
Безразличные (несолеобразующие) оксиды – оксиды, которые не реагируют ни с кислотами, ни с основаниями. Солей не образуют. Примеры: NO, N2O.
Классификация оксидов
Слайд 293
Взаимодействие простых веществ с кислородом. Примеры: S +
O2—› SO2; 4Al + 3O2 —› 2Al2O3;
Термическое разложение оснований,
солей, кислот. Примеры: CaCO3—t› CaO + CO2 ; 2H3BO3 —t› B2O3 + H2O ; Mg(OH)2 —t› MgO + H2O;
Взаимодействие простых веществ и солей с кислотами-окислителями. Примеры: C + 4HNO3(р-р) —› СO2 + 4NO2 + H2O; Cu + 4HNO3(конц.) —› Cu(NO3)2 + 2NO2 + + 2H2O; Na2SO3 + 2H2SO4—› 2NaHSO4 + SO2 + H2O.
Получение оксидов
Слайд 294
Получение оксидов металлов (установка)
Слайд 295
Взаимодействие пероксида бария с разбавленной серной кислотой.
Примеры: BaO2 +H2SO4
—› BaSO4 + H2O2;
Взаимодействие надсерной кислоты с водой. Примеры:H2SO8 + 2H2O—› 2H2SO4 + H2O2;
Взаимодействие азота с водой. Примеры: O3 + H2O—› H2O2 + O2;
Реакция, протекающая при действии электрического разряда на воду. Примеры: H2O —разряд› H2O2 +1/2H2.
Получение пероксида водорода
Слайд 298
Разложение. Пример: H2O —› H2O + 1/2O2;
Окисление.
Пример: PbS + 4H2O2 —›
PbSO4 + 4H2O;
Восстановление. Пример: 2KMnO4 + 5H2O2 + 3H2SO4 —› —› K2SO4 + 2MnSO4 + 5O2 + 8H2O.
Химические свойства пероксида водорода
Слайд 300
Аллотропные Модификации
Белый фосфор – P4 запах чесночный,
Н в воде, Р в органических растворителях, летуч,
Tпл= 440С, молекулярная кристаллическая решётка, активен, на воздухе окисляется, в темноте светится, ЯДОВИТ!!!
Слайд 301
Аллотропные Модификации
Красный фосфор – цвет красно-бурый, не ядовит,
Н в воде и органических растворителях, атомная кристаллическая решётка,
устойчив.
Белый ? Красный, 2600С, без воздуха.
Слайд 302
Аллотропные Модификации
черный фосфор – без запаха, похож на
графит, жирный на ощупь, Н в воде и органических
растворителях, атомная кристаллическая решетка, полупроводник, Ткип= 453°С (возгонка), Тпл = 1000°С (при р=1,8 • 109Па), устойчив.
Слайд 303
5С + 3SiO2 + Са3(РО4)2 = 5СО +
3CaSi03 + 2Р (сплавление в электрической печи)
Получение
Слайд 304
Взаимодействие с кислородом.
4Р°+502 =t 2Р+52O5
белый Т = 40°С красный Т = 260°С черный Т = 400°С
4Р°+ ЗО2 = 2Р+32O3
(недостаток О2)
Фосфор как восстановитель
Слайд 305
2. Взаимодействие с галогенами.
2Р°+ЗСl2 = 2Р+3С13
легко разлагается
водой
РС13 + ЗН2О = Н3РО3 + ЗНС1
Фосфор как восстановитель
Слайд 306
3. Взаимодействие с азотной кислотой.
ЗР°+ 5HNO3 + 2Н2О
= ЗН3Р+5O4 + 5NO
Фосфор как восстановитель
Слайд 307
Фосфор как окислитель
Взаимодействие с металлами:
2P°+3Mg = Mg3P2-3
фосфид магния
легко разлагается водой
Mg3P2 + 6Н2О =
3Mg(OH)2 + 2РН3
фосфин