- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему: Химическая связь и ее признаки
Содержание
- 3. Типы химической связи
- 4. Ковалентная связьКовалентная связь. Химическая связь
- 5. Свойства ковалентной связиЭнергия связи Энергия связи –
- 6. Изображение химической связис помощью электронов в виде
- 7. Ионная химическая связьИонная Ионная или электровалентная связь
- 8. Свойства ионной химической связиНенаправленность. Каждый ион, представляющий
- 9. Полярные молекулы веществаМолекулы при общей нейтральности представляют
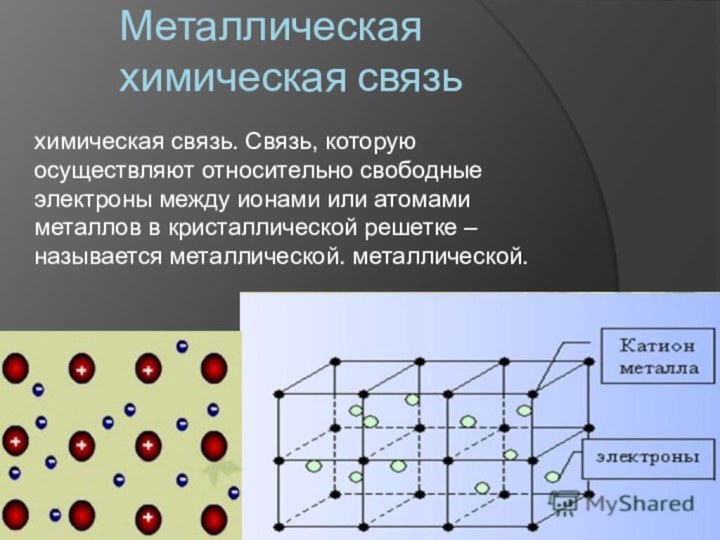
- 10. Металлическая химическая связьхимическая связь. Связь, которую осуществляют
- 11. Особенности металлической связи1. Металлическую связь образуют элементы,
- 12. Водородная химическая связьСвязь между атомом водорода ,
- 13. Скачать презентацию
- 14. Похожие презентации
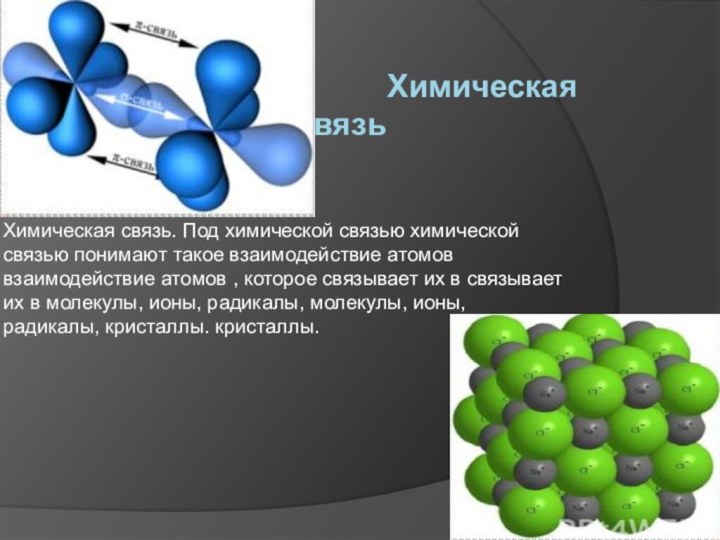
Химическая связь Химическая связь. Под химической связью химической связью понимают такое взаимодействие атомов взаимодействие атомов , которое связывает их в связывает их в молекулы, ионы, радикалы, молекулы, ионы, радикалы,





Слайд 2 Химическая
связь
такое взаимодействие атомов взаимодействие атомов , которое связывает их в связывает их в молекулы, ионы, радикалы, молекулы, ионы, радикалы, кристаллы. кристаллы.
Слайд 3
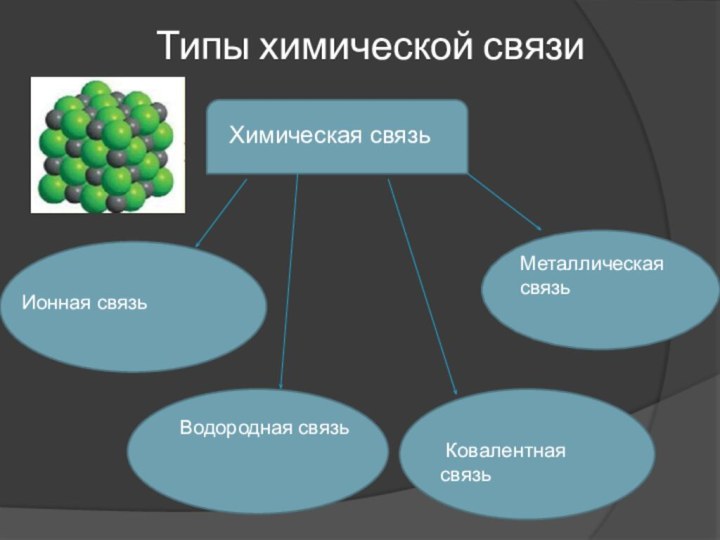
Типы химической связи
Химическая связь
Ионная связь
Водородная связь
Ковалентная
связьМеталлическая связь
Слайд 4
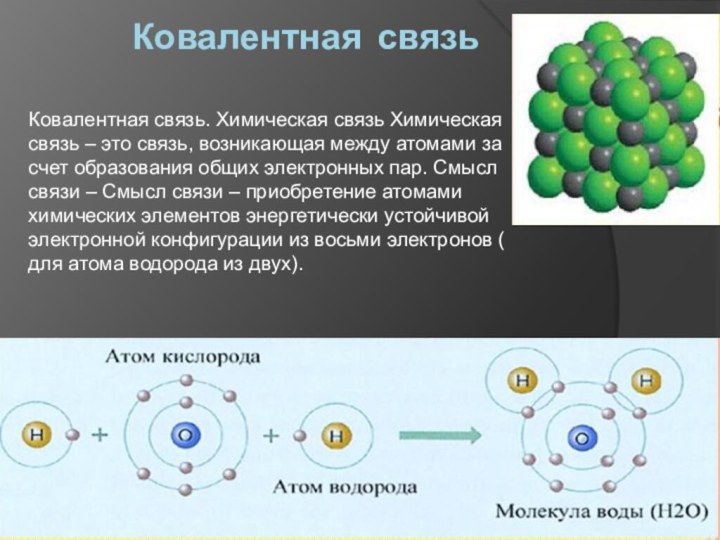
Ковалентная связь
Ковалентная связь. Химическая связь Химическая
связь – это связь, возникающая между атомами за счет
образования общих электронных пар. Смысл связи – Смысл связи – приобретение атомами химических элементов энергетически устойчивой электронной конфигурации из восьми электронов ( для атома водорода из двух).
Слайд 5
Свойства ковалентной связи
Энергия связи Энергия связи – количество
энергии, которое необходимо для разрыва связи; (кДж/моль)
Насыщенность Насыщенность
– способность атомов образовывать ограниченное число ковалентных связейНаправленность Направленность связи обусловливает пространственную структуру молекул, т.е. их геометрию.
Длина связи Длина связи – это межъядерное расстояние (нм).
Слайд 6
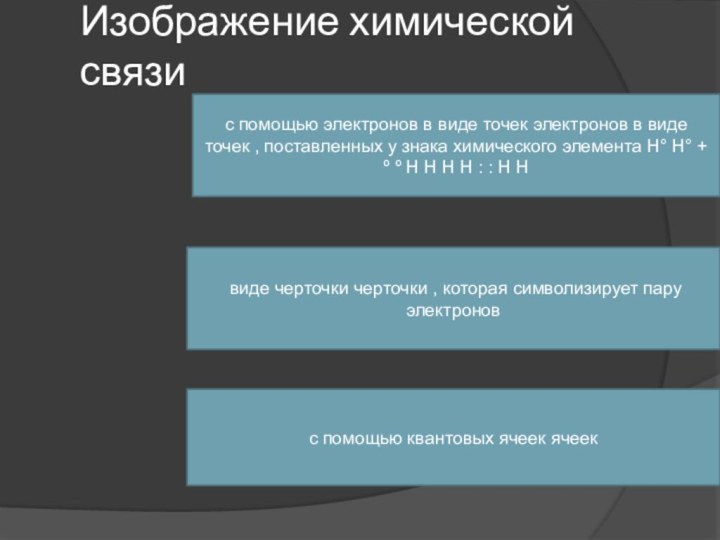
Изображение химической связи
с помощью электронов в виде точек
электронов в виде точек , поставленных у знака химического
элемента Н° Н° + º º Н Н Н Н : : Н Н виде черточки черточки , которая символизирует пару электронов
с помощью квантовых ячеек ячеек
Слайд 7
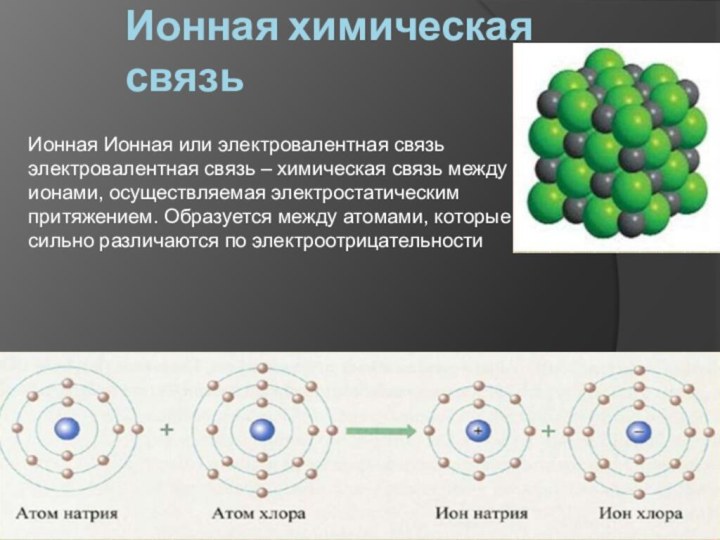
Ионная химическая связь
Ионная Ионная или электровалентная связь электровалентная
связь – химическая связь между ионами, осуществляемая электростатическим притяжением.
Образуется между атомами, которые сильно различаются по электроотрицательности
Слайд 8
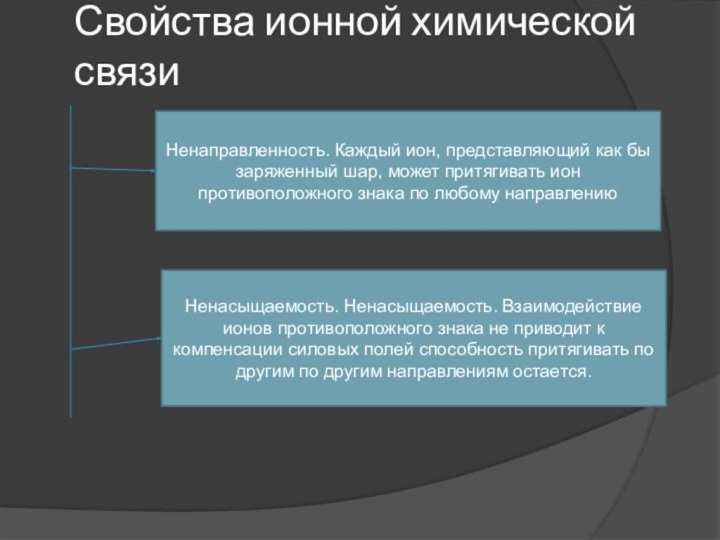
Свойства ионной химической связи
Ненаправленность. Каждый ион, представляющий как
бы заряженный шар, может притягивать ион противоположного знака по
любому направлениюНенасыщаемость. Ненасыщаемость. Взаимодействие ионов противоположного знака не приводит к компенсации силовых полей способность притягивать по другим по другим направлениям остается.