огромная пасть все еще светилась голубоватым пламенем, глубоко сидящие
дикие глаза обведены огненными кругами. Я дотронулся до этой светящейся головы и, подняв руку, увидел, что мои пальцы тоже засветились в темноте.- Фосфор, – сказал я».
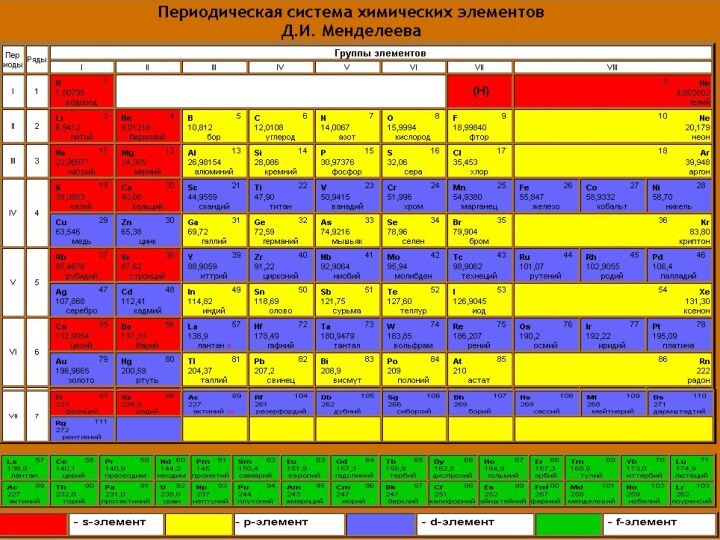
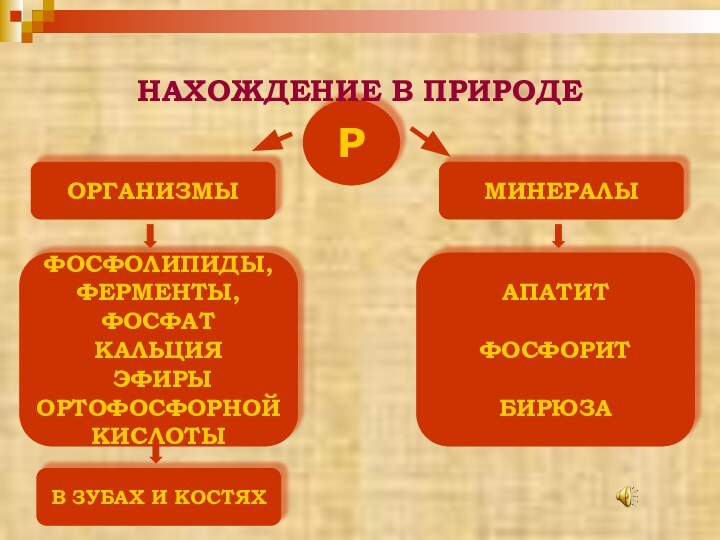
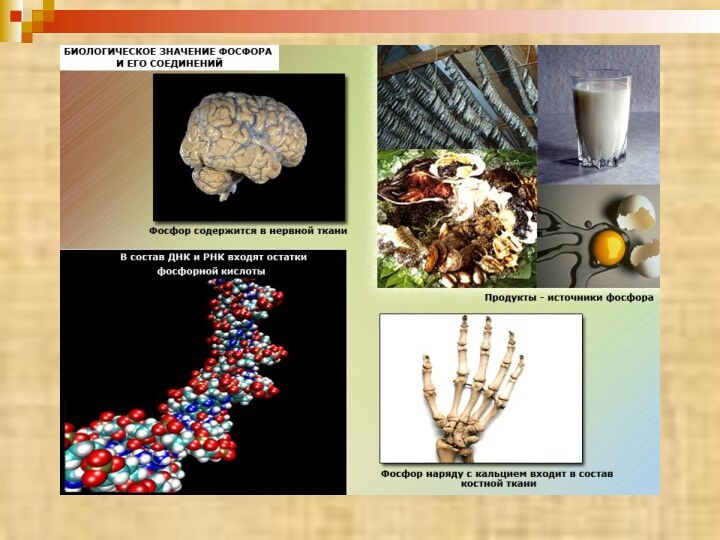
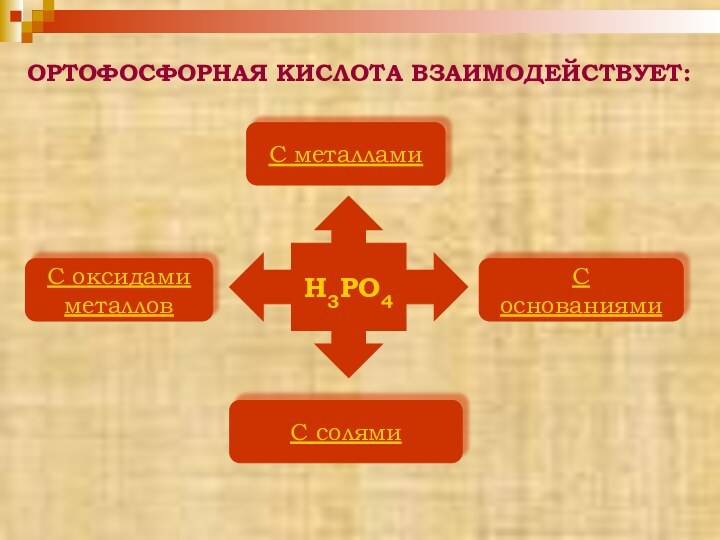
ФОСФОР И ЕГО СОЕДИНЕНИЯ