- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Окислительные свойства азотной кислоты, 9 класс
Содержание
- 2. Цель урока:Рассмотреть окислительные свойства азотной кислоты, отметить
- 3. Составьте уравнения реакций азотной кислоты: 1
- 4. Взаимопроверка1 вариант 2 вариант2HNO3
- 5. Характерным свойством азотной кислоты является ее ярко
- 6. HNO3 + С → СO2 + H2O
- 8. Азотная кислота взаимодействует почти
- 9. концентрированная HNO3 >60%
- 10. 1) HN+5O3(конц.) + Cu0 = Cu+2(NO3)2
- 11. 1) HN+5O3(конц.) + Zn0 = Zn+2(NO3)2
- 12. .
- 15. Скачать презентацию
- 16. Похожие презентации













Слайд 2
Цель урока:
Рассмотреть окислительные свойства азотной кислоты, отметить ее
особенности взаимодействия с металлами и неметаллами.
-восстановительные реакции с участием азотной кислоты методом электронного баланса.
Слайд 3
Составьте уравнения реакций
азотной кислоты:
1 вариант
с оксидом
меди (II), c гидроксидом натрия
2вариант
гидроксидом цинка; силикатом натрия
Рассмотрите реакции
с точки зрения ТЭД.
Слайд 4
Взаимопроверка
1 вариант
2 вариант
2HNO3 +
Zn(OH)2 = Zn(NO3)2 + 2H2O
2H+ + 2NO3– + Zn(OH)2
= Zn2+ +2NO3– + +2H2O
2H+ + Zn(OH)2 = Zn2+ + 2H2O
2HNO3 + Na2SiO3 = ↓H2SiO3 + 2NaNO3
2H+ + 2NO3– + 2Na+ + SiO32– = ↓H2SiO3 +
+2Na+ + 2NO3–
2H+ + SiO32– = ↓H2SiO3
2HNO3 + CuO = Cu(NO3)2 + H2O
2H+ + 2NO3– + CuO = Cu2+ + 2NO3– + H2O
2H+ + CuO = Cu2+ + H2O
HNO3 + NaOH = NaNO3 + H2O
H+ + NO3– + Na+ + OH– = Na+ + NO3– + H2O
H+ + OH– = H2O
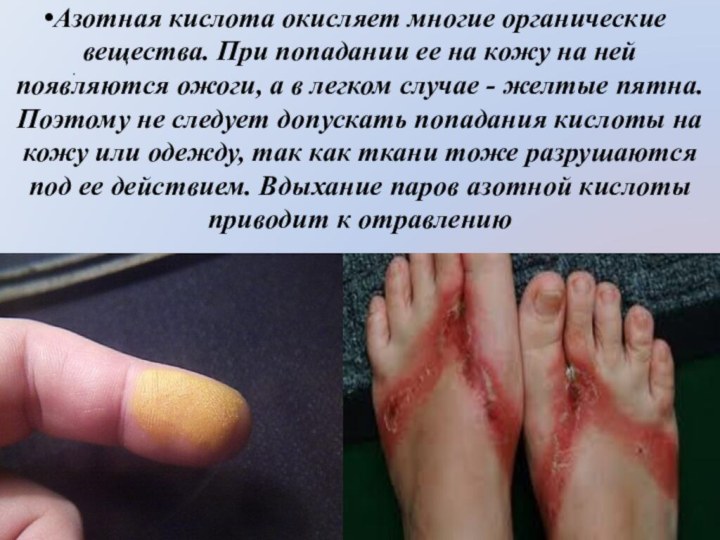
Слайд 5 Характерным свойством азотной кислоты является ее ярко выраженная
окислительная способность. Азотная кислота—один из энергичнейших окислителей. Многие неметаллы
легко окисляются ею, превращаясь в соответствующие кислоты. Концентрированная (более 60%) азотная кислота восстанавливается при этом до NO2 , а если концентрация кислоты (15 – 20%), то до NO.Слайд 6 HNO3 + С → СO2 + H2O +
NO2
N+5 + 1e → N+4 1
С0 – 4e
→ С+4 4
HNO3 + P → H3PO4 + NO2 + H2O
N+5 + 1e → N+4
P0 – 5e → P+5
5
Запишем уравнение реакции и расставим коэффициенты методом электронного баланса.
HNO3 (за счет N+5) – окислитель, пр. восстановления
C – восстановитель, процесс окисления
HNO3 (за счет N+5) – окислитель, пр. восстановления
P – восстановитель, процесс окисления
Посмотрим опыт 1 Взаимодействие
азотной кислоты с углеродом
Посмотрим опыт 2 Взаимодействие
азотной кислоты с фосфором
Запишем уравнение реакции и расставим коэффициенты методом электронного баланса.
4
4
1
4
2
4
1
5
5
1
5
5
Слайд 8
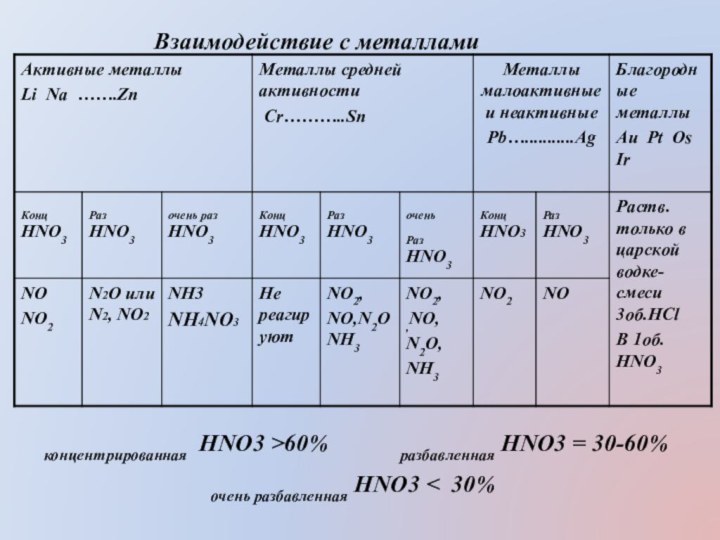
Азотная кислота взаимодействует почти со всеми
металлами, в том числе стоящими в ряду активности после
Н.Глубина восстановления азота в таких реакциях зависит от концентрации кислоты, от активности металла, от температуры. Понижение температуры способствует более глубокому восстановлению азота. Водород в реакциях кислоты с металлами не выделяется потому, что азотная кислота проявляет свои окислительные свойства не за счет Н+, а за счет N+5.
Концентрированная холодная азотная кислота пассивирует металлы:
Al, Fe, Be, Cr, Ni, Pb и другие (за счет образования плотной оксидной пленки). При нагревании и при разбавлении азотной кислоты данные металлы в ней растворяются
Слайд 9
концентрированная HNO3 >60%
разбавленная HNO3 = 30-60%
очень разбавленная
HNO3 < 30%
Взаимодействие с металлами
Слайд 10 1) HN+5O3(конц.) + Cu0 = Cu+2(NO3)2 +
N+4O2 + H2O
2
2
N+5 + 1e →
N+4Cu0 – 2e → Cu+2
2) HN+5O3(разб.) + Cu0 = Cu+2(NO3)2 + N+2O + H2O
3
3
4
2
8
N+5 + 3e → N+2
Cu0 – 2e → Cu+2
окислитель (процесс восстановления)
Восстановитель
(процесс окисления)
4
Посмотрим опыт 3 «Взаимодействие азотной кислоты с некоторыми металлами»
Запишем уравнения этих реакций.
1
2
2
2
1
3
2
6
2
3
окислитель (процесс восстановления)
востановитель (процесс окисления)
Слайд 11 1) HN+5O3(конц.) + Zn0 = Zn+2(NO3)2 +
N+4O2 + H2O
2
2
N+5 + 1e →
N+4
2) HN+5O3(разб.) + Zn0 = Zn+2(NO3)2 + N-3 H3 + H2O
4
4
3
9
N+5 + 3e → N+2
окислитель (процесс восстановления)
восстановитель (процесс окисления)
4
окислитель (процесс восстановления)
восстановитель (процесс окисления)
Zn0 – 2e → Zn+2
1
2
2
2
1
Zn0 – 2e → Zn+2
3
2
6
2
3





























