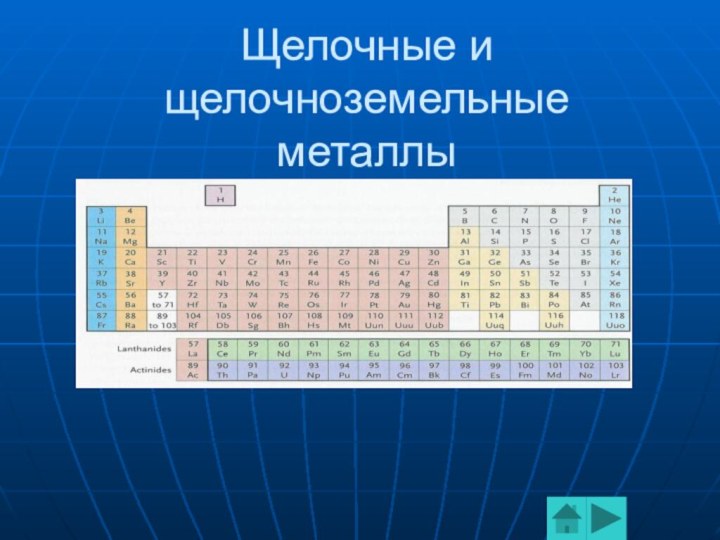
простые вещества
1.2) Физические свойства щелочных металлов
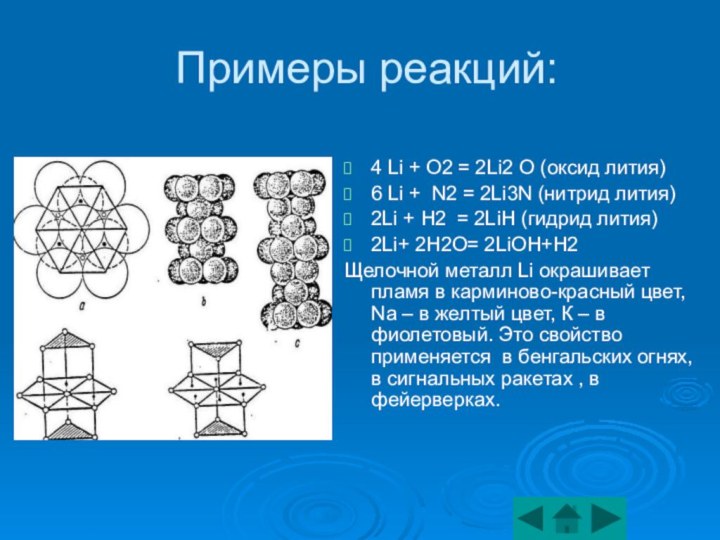
1.3) Химические свойства щелочных металлов 2) Щелочноземельные металлы
2.1) Примеры
2.2) Щелочноземельные металлы на практике