- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Теория электролитической диссоциации (9 класс)
Содержание
- 2. План работы1. Определение. 2. Электролиты, неэлектролиты. 3.
- 3. Диссоциация Электролитами называются вещества, растворы или расплавы
- 4. Диссоциация Неэлектролитами называются вещества, растворы или расплавы
- 5. Степень диссоциация Число, показывающее, какая часть молекул
- 6. Сильные электролитыСильные электролиты –это такие электролиты, которые
- 7. Слабые электролитыСлабые электролиты –это такие электролиты, которые
- 8. - +-
- 9. Na+Cl-- +-
- 10. Диссоциация щелочей NaOH = Na+ + OH-
- 11. Диссоциация солей NaСl = Na+ + Cl-
- 12. Кислоты Кислоты-электролиты, при диссоциации которых образуются катионы водорода. Пример: Одноосновная кислотаТрехосновная кислота
- 13. Проверь себя HClO4 = H+ + ClO4-
- 14. Реакции ионного обменаМолекулярное уравнениеПолное ионное уравнениеСокращенное ионное уравнениеFeCl3NaOHFe(OH)3NaCl++=33Fe3++3Cl-+3Na++3OH-=Fe(OH)3+3Na++3Cl-Fe3++3Cl-+3Na++3OH-=Fe(OH)3+3Na++3Cl-Fe3++3OH-=Fe(OH)3
- 15. Ионные уравнения
- 16. Ионные уравнения
- 17. Ионные уравнения
- 18. Ионные уравнения
- 19. Ионные уравнения
- 20. Ионные уравнения
- 21. Ионные уравнения
- 22. Ионные уравнения
- 23. Скачать презентацию
- 24. Похожие презентации






















Слайд 3
Диссоциация
Электролитами называются вещества, растворы или расплавы которых
проводят электрический ток.
Электролиты:
соли;
кислоты;
основания.
Тип связи: ионные или ковалентные полярные.
Слайд 4
Диссоциация
Неэлектролитами называются вещества, растворы или расплавы которых
не проводят электрический ток.
Неэлектролиты:
кислород;
водород;
многие органические вещества (сахар, эфир, бензол).
Тип
связи: ковалентные неполярные или малополярные.
Слайд 5
Степень диссоциация
Число, показывающее, какая часть молекул распалась
на ионы, называется степенью электролитической диссоциации.
Степень диссоциации равна отношению
числа молекул, которые распались на ионы, к общему числу молекул в растворе.n - число молекул, распавшихся на ионы; N - общее число растворенных молекул.
Слайд 6
Сильные электролиты
Сильные электролиты –это такие электролиты, которые в
водных растворах полностью диссоциируют на ионы, степень диссоциации равна
1 (100 %).Соли.
Сильные
кислоты.
Щелочи.
NaCl, KNO3, AlCl3
HClO4, HClO3, HNO3, H2SO4, HCl, HI, HBr
NaOH, KOH, CsOH, RbOH, Sr(OH)2, LiOH, Ba(OH)2, Ca(OH)2.
Слайд 7
Слабые электролиты
Слабые электролиты –это такие электролиты, которые в
водных растворах не полностью диссоциируют на ионы, степень диссоциации
меньше 1 (100 %).Слабые кислоты:
HClO2, HClO, HNO2, H2SO3,H2CO3, H2SiO3, H3PO4, H3PO3, H3BO3, CH3COOH, H2S, HCN, HF
Слабые нерастворимые в воде основания:
Fe(OH)2, Cu(OH)2, Pb(OH)2
Гидроксид аммония:
NH4OH.
Слайд 10
Диссоциация щелочей
NaOH = Na+ + OH-
KOH
= …+ + …-
Ca(OH)2 = …2+ + 2…-
Вывод: щелочь диссоциирует на катионы металла и гидроксид-анионы.
Слайд 11
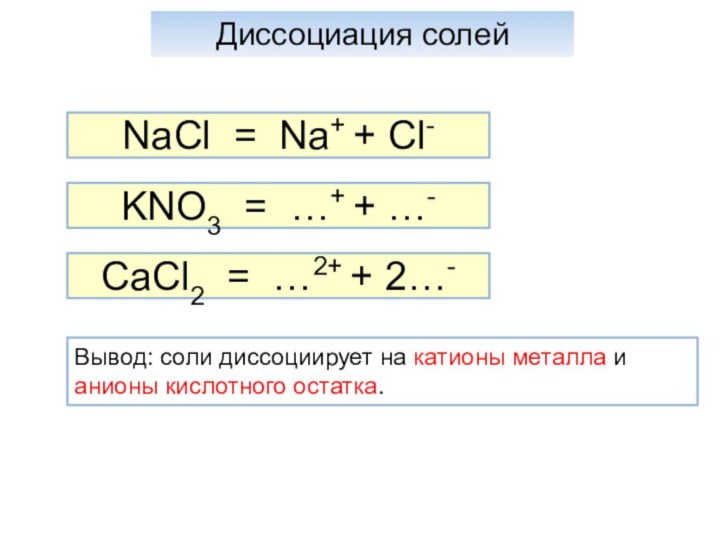
Диссоциация солей
NaСl = Na+ + Cl-
KNO3
= …+ + …-
CaCl2 = …2+ + 2…-
Вывод: соли диссоциирует на катионы металла и анионы кислотного остатка.
Слайд 12
Кислоты
Кислоты-электролиты, при диссоциации которых образуются катионы водорода.
Пример:
Одноосновная кислота
Трехосновная кислота
Слайд 13
Проверь себя
HClO4 = H+ + ClO4-
HNO3
= H+ + …-
NaCl =…+ + Cl-
H2SO4
=...H+ + SO4… LiOH =…+ + OH-





























