- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Строение атома
Содержание
- 3. Строение атомаЛекция 1Национальный исследовательский университет МЭИ Кафедра Химии и электрохимической энергетикиГригорьева Оксана Юрьевна
- 4. Химия – дисциплина в МЭИ.Строение атома.Квантово-механические представления.Квантовые числа.План лекции
- 5. В энергетическом институте – фундаментальная, общетеоретическая дисциплинаХимияЕстественная
- 7. Особенности химии как науки Многообразие изучаемых объектов.Создание
- 9. Масштабы химии и физики
- 10. Электронное строение атомаДжозеф-Джон Томсон 1897г - открытие
- 11. Электронное строение атомасложная электромагнитная микросистема, являющаяся носителем свойств химического элемента. ЯДРОЭЛЕКТРОНЫ (e-)ПРОТОНЫ (p,p+)НЕЙТРОНЫ (n, n0)
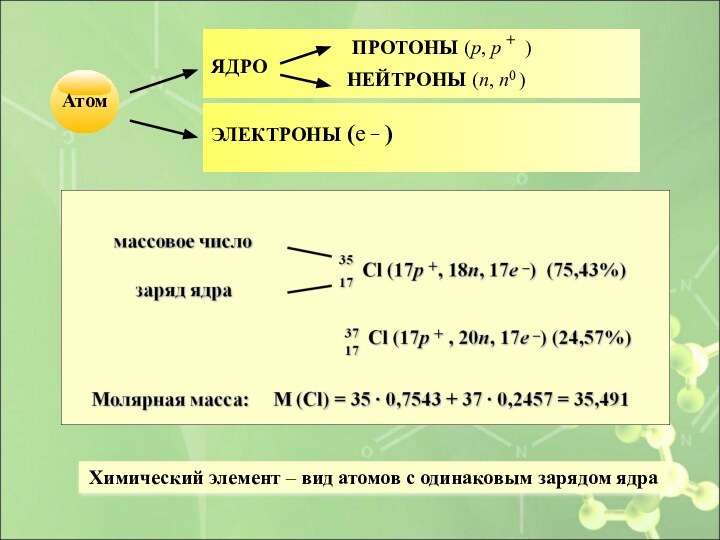
- 12. Химический элемент – вид атомов с одинаковым зарядом ядра
- 13. основана на представлении о квантовании энергии, волновом
- 14. ЧастицаА. Эйнштейн (1905 г.) m – масса
- 15. Луи де Бройль (1924 г.) Поведение
- 16. Точное нахождение частицы (электрона) заменяется понятием статистической вероятности нахождения ее в определенном объеме (околоядерного) пространства.
- 17. Движение е- → волновой характер → волновая
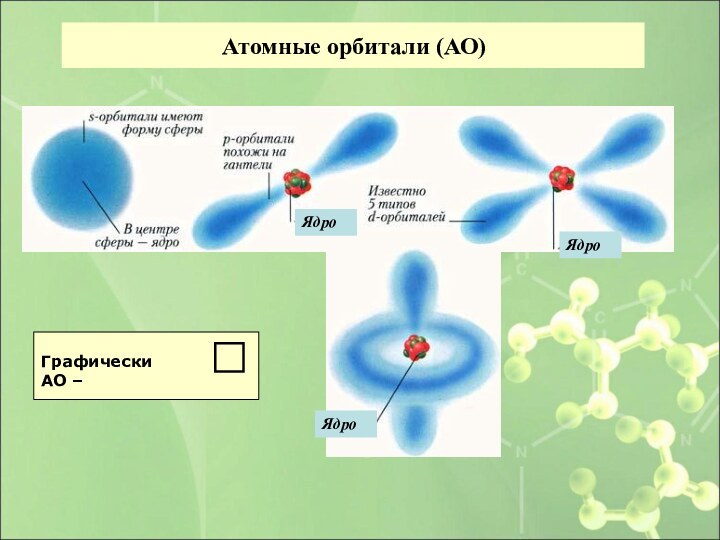
- 18. Атомные орбитали (АО)
- 19. 1. Определяет – энергию электрона – энергетический
- 21. 1. Определяет – орбитальный момент количества движения
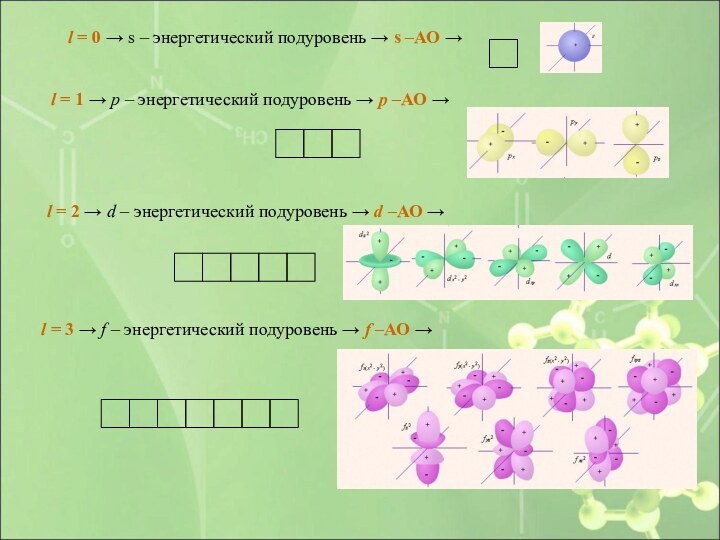
- 22. l = 0 → s –
- 23. Каждому n соответствует определенное число значений l
- 24. III. Магнитное квантовое число ml 1. Определяет
- 25. Любому значению l соответствует
- 26. Все орбитали, принадлежащие одному подуровню, имеют одинаковую
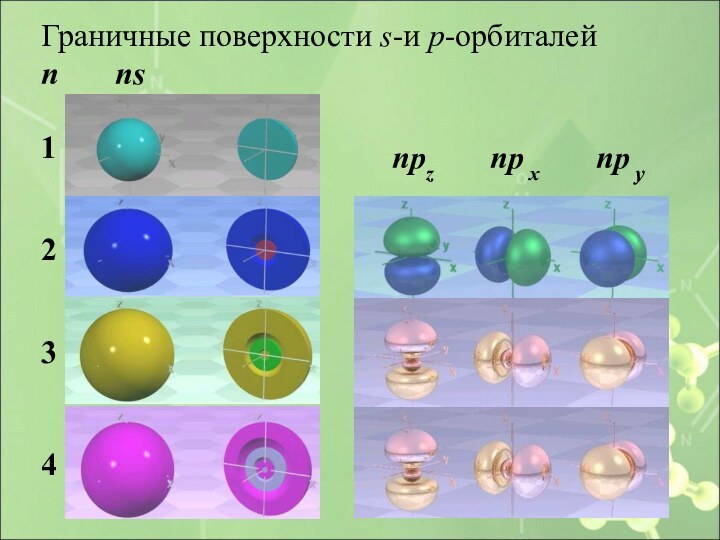
- 27. Граничные поверхности s-и p-орбиталей n
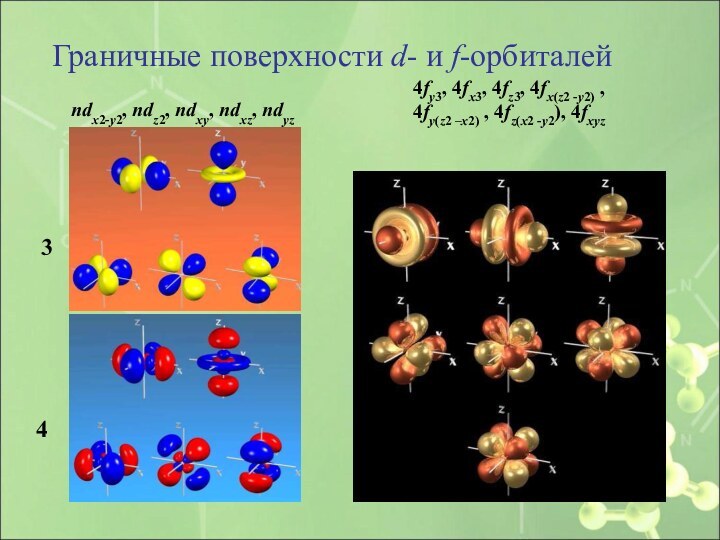
- 28. Граничные поверхности d- и f-орбиталей
- 29. IV. Cпиновое квантовое число ms1. Определяет –
- 30. Состояние любого электрона в атоме может быть
- 31. Принцип Паули:в атоме не может быть двух
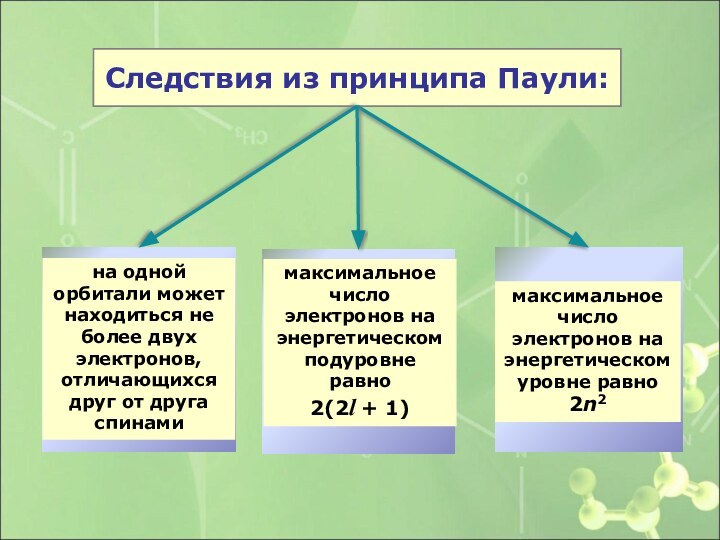
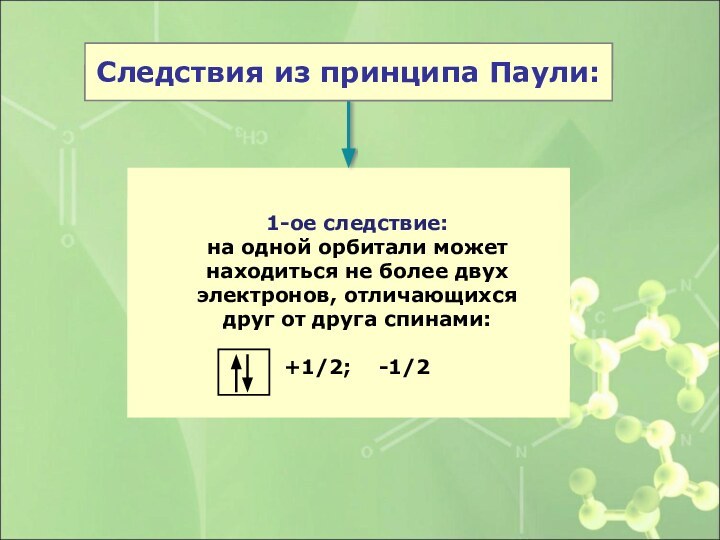
- 32. Следствия из принципа Паули:на одной орбитали может
- 33. 1-ое следствие:на одной орбитали может находиться не
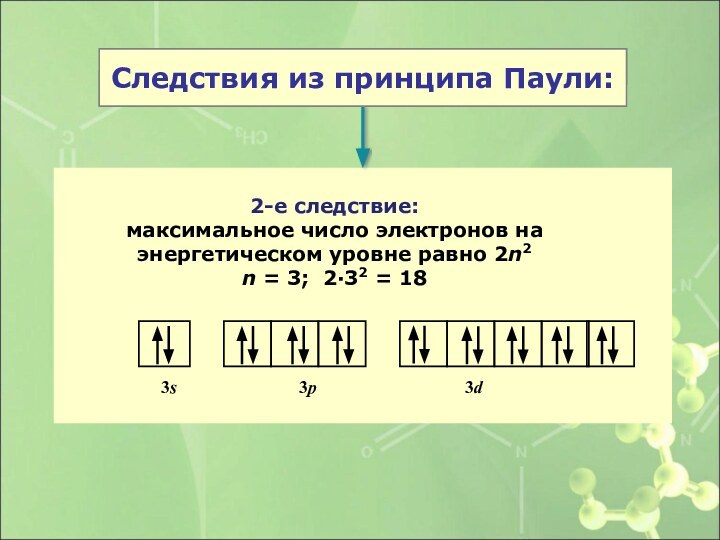
- 34. 2-е следствие:максимальное число электронов на энергетическом уровне
- 35. 3-ое следствие:максимальное число электронов на энергетическом подуровне
- 36. Электроны в атоме (основное состояние) распределяются в соответствии с принципом минимальной энергии.Распределение электронов в атоме 2
- 37. Правило Клечковского (частный случай принципа наименьшей
- 38. Значения суммы (n+l) для различных орбиталейномер энергетического уровняколичество электроновна подуровне
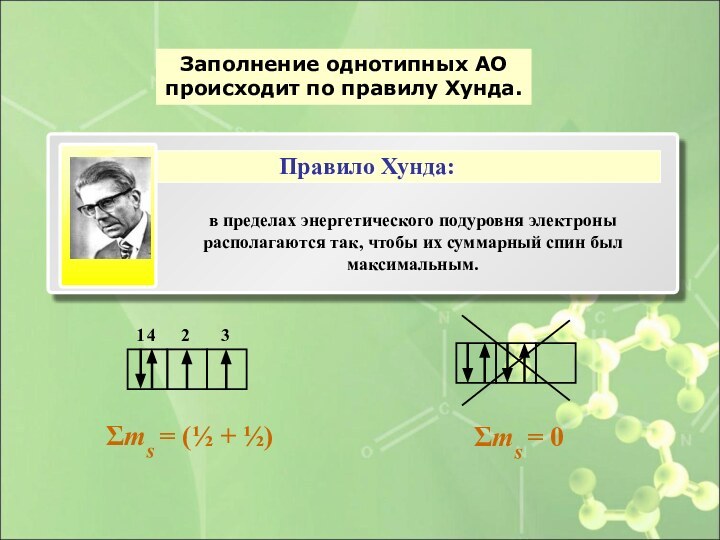
- 39. Заполнение однотипных АО происходит по правилу Хунда.Σms = (½ + ½)Правило Хунда:1234
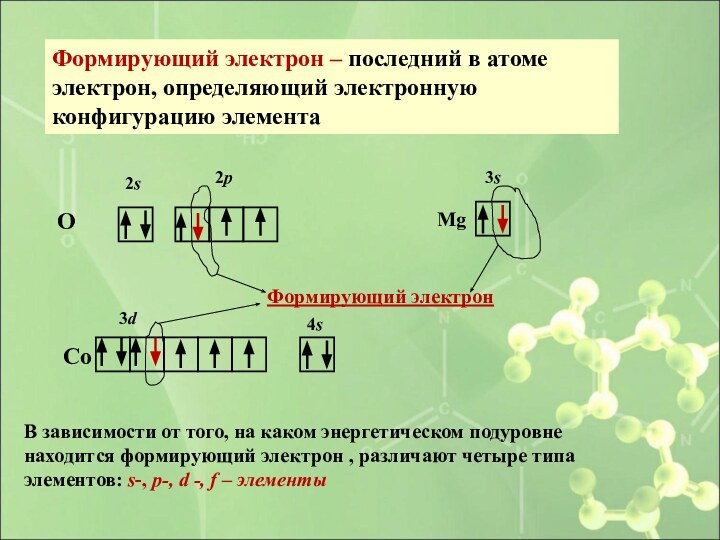
- 40. Способы составления схем распределения электронов в
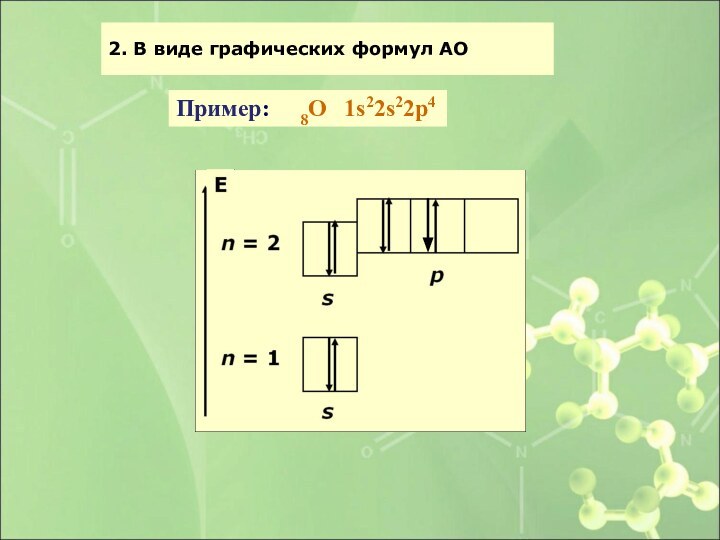
- 41. 2. В виде графических формул АО Пример: 8О 1s22s22p4
- 42. Скачать презентацию
- 43. Похожие презентации






















Слайд 3
Строение атома
Лекция 1
Национальный исследовательский университет МЭИ Кафедра Химии
и электрохимической энергетики
Слайд 4
Химия – дисциплина в МЭИ.
Строение атома.
Квантово-механические представления.
Квантовые числа.
План
лекции
Слайд 5
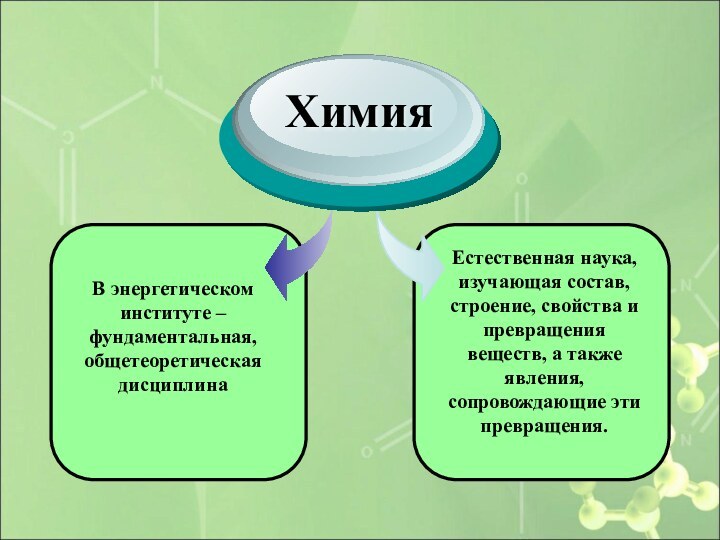
В энергетическом институте – фундаментальная, общетеоретическая дисциплина
Химия
Естественная наука,
изучающая состав, строение, свойства и превращения веществ, а также
явления, сопровождающие эти превращения.
Слайд 7
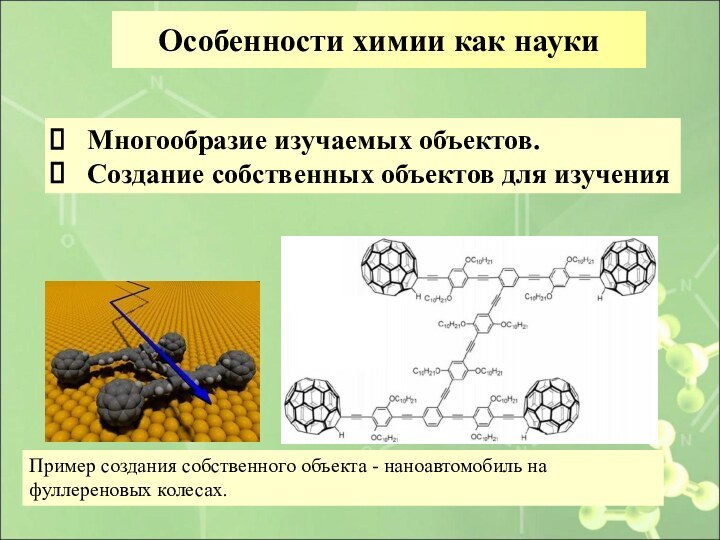
Особенности химии как науки
Многообразие изучаемых объектов.
Создание собственных
объектов для изучения
Пример создания собственного объекта - наноавтомобиль
на фуллереновых колесах.
Слайд 10
Электронное строение атома
Джозеф-Джон Томсон
1897г - открытие электрона
1904г - модель строения атома (пудинг с изюмом)
Эрнест Резерфорд
1910г – ядерная планетарная модель атома
Нильс Бор
1910г – модель атома водорода.
Д. Д. Иваненко, Е. Н. Гапон, В. Гейзенберг
1932 протонно-нейтронная теория
Слайд 11
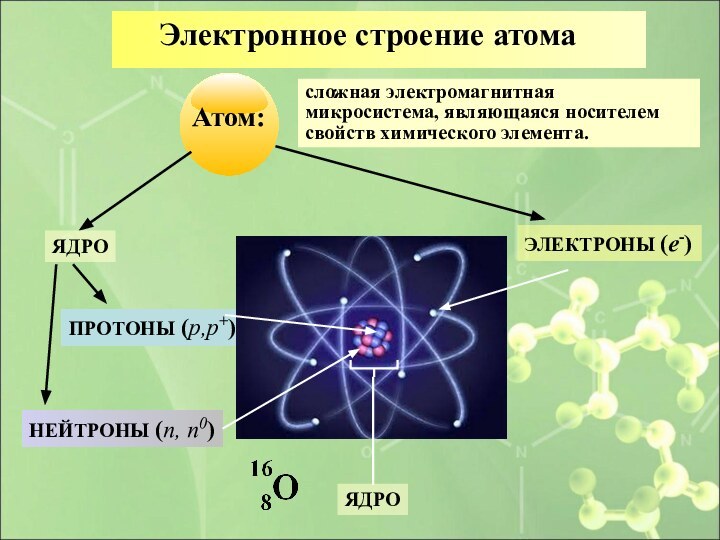
Электронное строение атома
сложная электромагнитная микросистема, являющаяся носителем свойств
химического элемента.
ЯДРО
ЭЛЕКТРОНЫ (e-)
ПРОТОНЫ (p,p+)
НЕЙТРОНЫ (n, n0)
Слайд 13 основана на представлении о квантовании энергии, волновом характере
движения микрообъектов и вероятностном методе описания их движения.
Почему
атом – устойчивая, стабильная система? Почему электрон не излучает энергии при движении?
?
Квантовая механика
Слайд 14
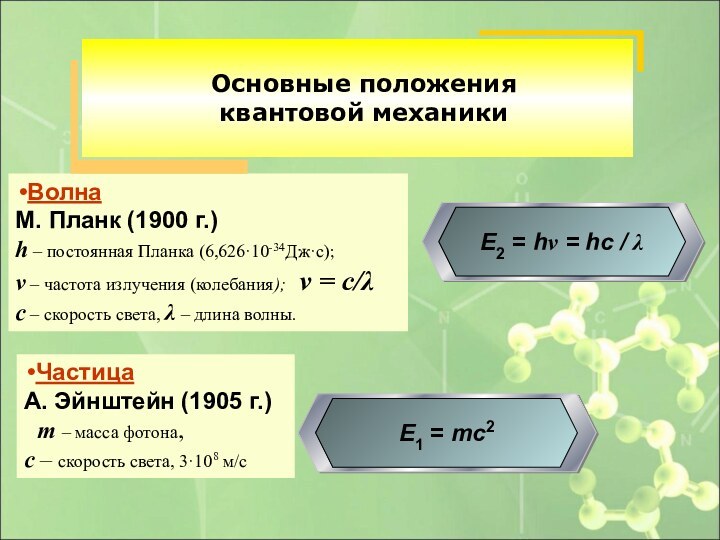
Частица
А. Эйнштейн (1905 г.)
m – масса фотона,
с – скорость света, 3·108 м/с
Волна
М. Планк (1900 г.)
h – постоянная Планка (6,626·10-34Дж·с);
ν – частота излучения (колебания); ν = с/λ
с – скорость света, λ – длина волны.
Основные положения
квантовой механики
Слайд 15
Луи де Бройль (1924 г.)
Поведение движущихся
микрообъектов (в том числе и электронов) – одновременное проявление,
как свойств частиц так и свойств волн.λе = (6,626·10-34 )/9,1·10-31 ·3·108=2,4·10-11м
частица ЭЛЕКТРОН волна
E 1 = E2
E2 = h v / λe
E1 = me v 2
mе – масса электрона (9,1 · 10-31кг);
v – скорость движения электрона (3·108 м/с).
h – постоянная Планка (6,626 ·10-34 Дж ·с)
Слайд 16 Точное нахождение частицы (электрона) заменяется понятием статистической вероятности
нахождения ее в определенном объеме (околоядерного) пространства.
Слайд 17
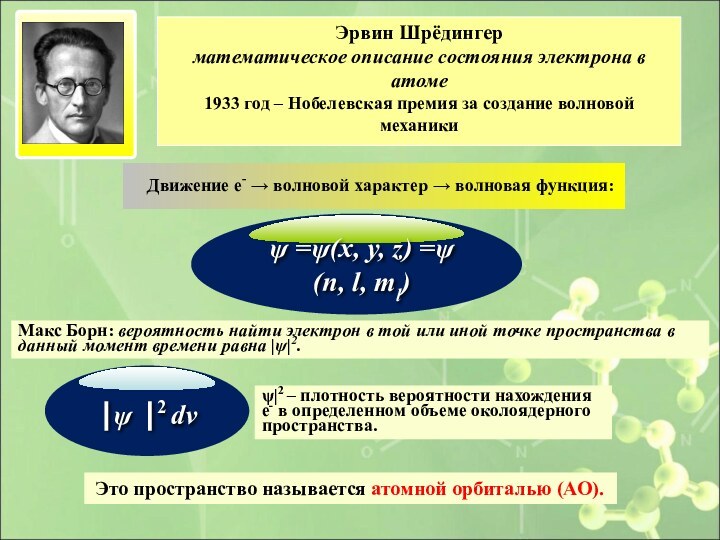
Движение е- → волновой характер → волновая функция:
Это пространство называется атомной орбиталью (АО).
Эрвин Шрёдингер
математическое описание
состояния электрона в атоме 1933 год – Нобелевская премия за создание волновой механики
Макс Борн: вероятность найти электрон в той или иной точке пространства в данный момент времени равна |ψ|2.
Слайд 19
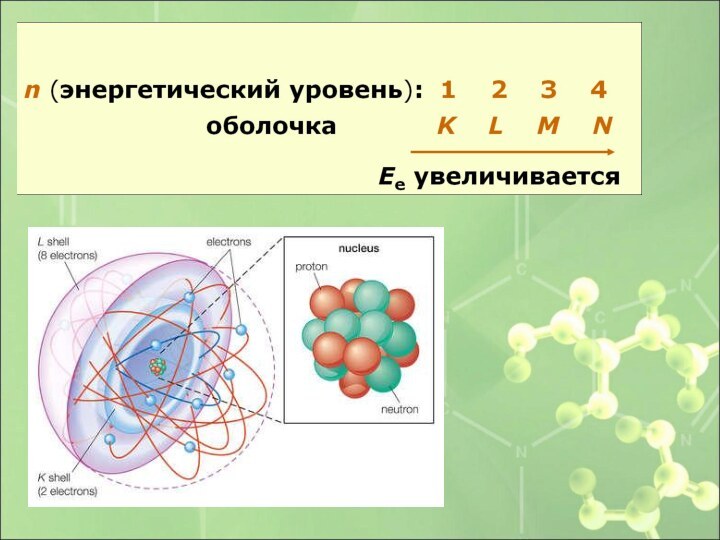
1. Определяет – энергию электрона – энергетический уровень
2.
Показывает – размер электронного облака (орбитали)
3. Принимает значения
– от 1 до ∞
Характеристики АО
I. Главное квантовое число - n
Квантовые числа (n, l, ml )
Слайд 21
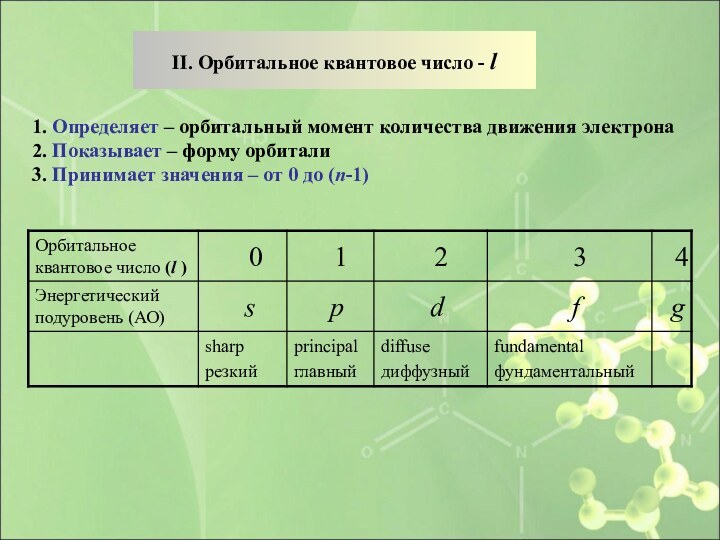
1. Определяет – орбитальный момент количества движения электрона
2.
Показывает – форму орбитали
3. Принимает значения – от 0
до (n-1)II. Орбитальное квантовое число - l
Слайд 22 l = 0 → s – энергетический
подуровень → s –АО →
l = 1
→ p – энергетический подуровень → p –АО → l = 2 → d – энергетический подуровень → d –АО →
l = 3 → f – энергетический подуровень → f –АО →
Слайд 23
Каждому n соответствует определенное число значений l →
→ каждый энергетический уровень расщепляется на энергетические подуровни.
Число
подуровней равно номеруэнергетического уровня
Пример: 1-ый энергетический уровень → 1 подуровень → 1s
2-ой энергетический уровень → 2 подуровня → 2s2p
3-ий энергетический уровень → 3 подуровня → 3s3p3d
4-ый энергетический уровень → 4 подуровня → 4s4p4d4f
Слайд 24
III. Магнитное квантовое число ml
1. Определяет –
значение проекции орбитального момента количества движения электрона на произвольно
выделенную ось.2. Показывает – пространственную ориентацию АО
3. Принимает значения – от –l до +l
Слайд 25 Любому значению l соответствует (2l
+ 1) значений ml , т. е.
(2l +
1) возможных расположений электронного облака данного типа в околоядерном пространстве – число орбиталей.
Пример: s-состояние ( l = 0) – одна орбиталь: 2 ⋅ 0 + 1 = 1; ml = 0
p-состояние (l = 1) – три орбитали: 2 ⋅ 1 + 1 = 3; ml = -1, 0,+1
Слайд 26 Все орбитали, принадлежащие одному подуровню, имеют одинаковую энергию
и называются вырожденными.
Вывод:
АО характеризуется определенным набором квантовых чисел
(n, l и ml ) , т. е. определенными размером, формой и ориентацией в околоядерном пространстве.
Слайд 28
Граничные поверхности d- и f-орбиталей
ndx2-y2, ndz2, ndxy, ndxz, ndyz
3
4
4fy3, 4fx3, 4fz3, 4fx(z2 -y2) ,
4fy(z2 –x2) , 4fz(x2 -y2), 4fxyz
Слайд 29
IV. Cпиновое квантовое число ms
1. Определяет – собственный
угловой момент количества движения электрона, связанный с вращением
вокруг своей оси2. Спин принимает значения: +1/2 или –1/2
1926 г. Д. Уленбек и С. Гоудсмит предложили понятие
«спин» – «вращающийся волчок»
Слайд 30 Состояние любого электрона в атоме может быть полностью
охарактеризовано определенным набором из четырех рассмотренных квантовых чисел.
!
При
этом в атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел.
Слайд 31
Принцип Паули:
в атоме не может быть двух электронов,
у которых все четыре квантовых числа были бы одинаковы
Распределение
электронов в атоме 1
Слайд 32
Следствия из принципа Паули:
на одной орбитали может находиться
не более двух электронов, отличающихся друг от друга спинами
максимальное
число электронов на энергетическом подуровне равно2(2l + 1)
максимальное число электронов на энергетическом уровне равно
2n2
Слайд 33
1-ое следствие:
на одной орбитали может находиться не более
двух электронов, отличающихся друг от друга спинами:
+1/2; -1/2
Следствия
из принципа Паули:
Слайд 34
2-е следствие:
максимальное число электронов на энергетическом уровне равно
2n2
n = 3; 2·32 = 18
3s 3p 3dСледствия из принципа Паули:
Слайд 35
3-ое следствие:
максимальное число электронов на энергетическом подуровне равно
2(2l
+ 1).
р-подуровень: l = 1; 2(2·1 + 1)
= 6Следствия из принципа Паули:
Слайд 36 Электроны в атоме (основное состояние) распределяются в соответствии
с принципом минимальной энергии.
Распределение электронов в атоме
2
Слайд 37 Правило Клечковского (частный случай принципа наименьшей энергии)
:
– электроны размещаются последовательно на орбиталях, характеризуемых возрастанием суммы
главного и орбитального квантовых чисел (n + l );– при одинаковых значениях этой суммы раньше заполняется орбиталь с меньшим значением главного квантового числа n
Слайд 38
Значения суммы (n+l) для различных орбиталей
номер энергетического уровня
количество
электронов
на подуровне
Слайд 40
Способы составления схем
распределения электронов в атоме:
В виде формул электронных конфигураций:
Пример1: 19K 1s22s22p63s23p64s1
Arс учетом электронной конфигурации элемента 8А группы:
[Ar]4s1
Пример 2: 26Fe 1s22s22p63s23p6 3d6 4s2 или [Ar]3d64s2
Ar