- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему 11 класс химия базовый уровень
Содержание
- 2. Химическая связьИонная Ковалентная МеталлическаяВодородная
- 3. Ионная химическая связьИоны - это заряженные частицы, в
- 4. Классификация ионов1)простые – Na^+, Cl^-, Ca^2+2)сложные –
- 5. Анион — отрицательно заряженный ион. Характеризуется величиной
- 6. Кристаллическая решеткаИонными называют кристаллические решетки, в узлах
- 7. Ковалентная химическая связьКовалентная связь — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков.
- 8. ЭлектроотрицательностьЭлектроотрицательность - это способность атома притягивать электронную плотность от других атомов.
- 9. Классификация ковалентной связиПо механизму образования – обменный
- 10. По механизму образования1) Обменный механизм. Каждый атом дает
- 11. По полярности связи1) Если электронная плотность расположена симметрично между атомами, ковалентная связь называется неполярной.
- 12. 2) Если электронная плотность смещена в сторону одного из атомов, то ковалентная связь называется полярной.
- 13. Два атома могут обобществлять несколько пар электронов. В этом случае говорят о кратных связях:
- 14. Кристаллическая решетка Молекулярная. Молекулярными называют кристаллические
- 15. Атомная. Атомными называют кристаллические решётки, в
- 16. Металлическая химическая связьМеталлическая связь - это связь в
- 17. Кристаллическая решетка Металлическими называют решётки, в узлах
- 18. Свойства 1) Пластичность. – это способность металла
- 19. 2) Электропроводность. Электрическая проводимость металлов - это
- 20. 3) Теплопроводность. Теплопроводность металла - это способность передачи
- 21. 4) Металлический блеск. Способность поверхности металла отражать световые лучи.
- 22. 5) Ковкость. Ковкость — способность металлов и сплавов подвергаться ковке и другим видам обработки давлением (прокатка, волочение, прессование,
- 23. Сплавы СПЛАВЫ, материалы, имеющие металлические свойства и состоящие
- 24. Сплавы различают по назначению: конструкционные, инструментальные и
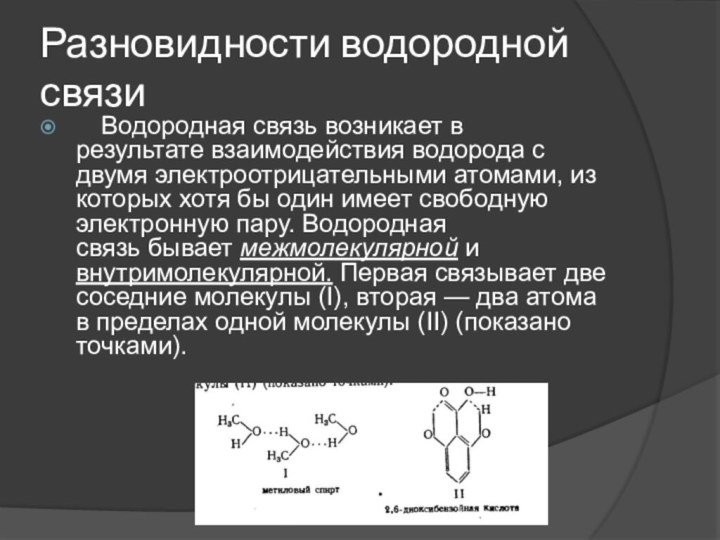
- 25. Водородная химическая связь Водородная связь - это
- 26. Разновидности водородной связи Водородная связь возникает в результате взаимодействия
- 27. Взаимодействия с…1) Водой.Водородные связи повышают температуру кипения, вязкость и поверхностное натяжение жидкостей.
- 28. 2) Нуклеиновыми кислотами и белками.Водородная связь в
- 29. 3) Полимеры.Многие полимеры усилены водородными связями в
- 30. Скачать презентацию
- 31. Похожие презентации
Химическая связьИонная Ковалентная МеталлическаяВодородная





























Слайд 3
Ионная химическая связь
Ионы - это заряженные частицы, в которые
превращаются атомы в результате отдачи или присоединения электронов.
это химическая связь, образованная за счет электростатического притяжения между катионами и анионами.
Слайд 4
Классификация ионов
1)простые – Na^+, Cl^-, Ca^2+
2)сложные – OH^-,
SO4^2-
3)положительные ионы (катионы) – NH4^+
4)отрицательные ионы (анионы) -
Cl^− Слайд 5 Анион — отрицательно заряженный ион. Характеризуется величиной отрицательного
заряда; например, Cl^− — однозарядный анион, а SO4^2− —
двухзарядный анион. Анионы имеются в растворах большинства солей, кислот и оснований, а также в кристаллических решетках соединений с ионной связью и в расплавах. Катион — положительно заряженный ион. Характеризуется величиной положительного электрического заряда: например, NH4^+ — однозарядный катион, Ca^2+ — двухзарядный катион.
Слайд 6
Кристаллическая решетка
Ионными называют кристаллические решетки, в узлах которых
находятся ионы. Их образуют вещества с ионной связью. Ионные
кристаллические решётки имеют соли, некоторые оксиды и гидроксилы металлов. Связи между ионами в кристалле очень прочные и устойчивые. Поэтому вещества с ионной решёткой обладают высокой твёрдостью и прочностью, тугоплавки и нелетучие.
Слайд 7
Ковалентная химическая связь
Ковалентная связь — химическая связь, образованная перекрытием (обобществлением)
пары валентных электронных облаков.
Слайд 8
Электроотрицательность
Электроотрицательность - это способность атома притягивать электронную плотность от
других атомов.
Слайд 9
Классификация ковалентной связи
По механизму образования – обменный и
донорно – акцепторный.
По полярности связи – ковалентные неполярные и
ковалентные полярные связи.По кратности – одинарные, двойные и тройные ковалентные связи.
Слайд 10
По механизму образования
1) Обменный механизм. Каждый атом дает по
одному неспаренному электрону в общую электронную пару.
2) Донорно-акцепторный механизм. Один
атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь.
Слайд 11
По полярности связи
1) Если электронная плотность расположена симметрично
между атомами, ковалентная связь называется неполярной.
Слайд 12 2) Если электронная плотность смещена в сторону одного
из атомов, то ковалентная связь называется полярной.
Слайд 13 Два атома могут обобществлять несколько пар электронов. В
этом случае говорят о кратных связях:
Слайд 14
Кристаллическая решетка
Молекулярная.
Молекулярными называют кристаллические решётки,
в узлах которых располагаются молекулы. Химические связи в них
ковалентные, как полярные, так и неполярные. Связи в молекулах прочные, но между молекулами связи не прочные. Вещества с МКР имеют малую твёрдость, плавятся при низкой температуре, летучие, при обычных условиях находятся в газообразном или жидком состоянии
Слайд 15
Атомная.
Атомными называют кристаллические решётки, в узлах
которых находятся отдельные атомы, которые соединены очень прочными ковалентными
связями. В природе встречается немного веществ с атомной кристаллической решёткой. К ним относятся бор, кремний, германий, кварц, алмаз. Вещества с АКР имеют высокие температуры плавления, обладают повышенной твёрдостью. Алмаз - самый твёрдый природный материал.
Слайд 16
Металлическая химическая связь
Металлическая связь - это связь в металлах
между атомами и ионами, образованная за счет обобществления электронов.
Слайд 17
Кристаллическая решетка
Металлическими называют решётки, в узлах которых
находятся атомы и ионы металла. Для металлов характерны физические
свойства: пластичность, ковкость, металлический блеск, высокая электро- и теплопроводность
Слайд 18
Свойства
1) Пластичность. – это способность металла принимать
под действием нагрузки новую форму не разрушаясь.
Пластичность металлов определяется
также при испытании на растяжение. Это свойство обнаруживается в том, что под действием нагрузки образцы разных металлов в различной степени удлиняются, а их поперечное сечение уменьшается. Чем больше способен образец удлиняться, а его поперечное сечение сужаться, тем пластичнее металл образца.Слайд 19 2) Электропроводность. Электрическая проводимость металлов - это способность
элементов и тел проводить через себя определенное количество негативно
заряженных частиц.Слайд 20 3) Теплопроводность. Теплопроводность металла - это способность передачи тепла
от более нагретых его частей к менее нагретым, не
связанная с их перемещением.Слайд 22 5) Ковкость. Ковкость — способность металлов и сплавов подвергаться ковке и другим видам обработки давлением (прокатка, волочение, прессование, штамповка).
Ковкость характеризуется двумя показателями —пластичностью, то есть способностью металла подвергаться
деформации под давлением без разрушения, и сопротивлением деформации.
Слайд 23
Сплавы
СПЛАВЫ, материалы, имеющие металлические свойства и состоящие из
двух или большего числа химических элементов, из которых хотя
бы один является металлом. Многие металлические сплавы имеют один металл в качестве основы с малыми добавками других элементов.По способу изготовления сплавов различают литые и порошковые сплавы. Литые сплавы получают кристаллизацией расплава смешанных компонентов. Порошковые — прессованием смеси порошков с последующим спеканием при высокой температуре.
Слайд 24
Сплавы различают по назначению: конструкционные, инструментальные и специальные.
Конструкционные
сплавы:
Сталь, чугун
Конструкционные со специальными свойствами (например, искробезопасность, антифрикционные свойства):
Бронза, латунь
Для заливки
подшипников:Баббит (антифрикционный сплав на основе олова или свинца)
Для измерительной и электронагревательной аппаратуры:
Манганин (термостабильный сплав на основе меди (Cu) с добавкой марганца (Mn) и никеля (Ni)),
Нихром (общее название группы сплавов, состоящих, в зависимости от марки сплава никеля, хрома, с добавками марганца, кремния, железа, алюминия.)
Для изготовления режущих инструментов:
Победит ( твёрдый сплав карбида вольфрама и кобальта )
В промышленности также используются жаропрочные, легкоплавкие и коррозионностойкие сплавы, термоэлектрические и магнитные материалы, а также аморфные сплавы.