- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему к уроку-проекту Аллотропные модификации углерода
Содержание
- 2. УГЛЕРОД.ПОЛОЖЕНИЕ В ТАБЛИЦЕ МЕНДЕЛЕЕВАУглерод Carbogenium - 6ой
- 3. НАХОЖДЕНИЕ В ПРИРОДЕВ настоящее время известно более
- 4. НАХОЖДЕНИЕ В ПРИРОДЕУглерод занимает 17-е место по
- 5. НАХОЖДЕНИЕ В ПРИРОДЕУглерод входит в состав органических
- 6. СВОБОДНЫЙ УГЛЕРОДВ свободном виде углерод встречается в
- 7. АЛМАЗ (ГРЕЧ. «АДАМАС» ТВЁРДЫЙ, НЕПРЕКЛОННЫЙ )как аллотропное видоизменение углерода
- 8. Алмаз
- 9. КРИСТАЛЛИЧЕСКАЯ РЕШЁТКА - АТОМНАЯКристаллизуется в кубической кристаллической
- 10. СУЩЕСТВУЮТ РАЗНОВИДНОСТИ КРИСТАЛЛИЧЕСКИХ РЕШЁТОК АЛМАЗА: РИС. 1 ГЕКСАГОНАЛЬНЫЙ АЛМАЗ (ЛОНГСДЕЙЛИТ). РИС. 2 КУБИЧЕСКИЙ АЛМАЗ
- 11. ФИЗИЧЕСКИЕ СВОЙСТВАОдин из самых твёрдых и тугоплавких
- 12. ШКАЛА МООСАВсе минералы имеют различную твёрдость. Твёрдость
- 13. АЛМАЗЫ ИМЕЮТ РАЗНЫЙ ЦВЕТИзвестны алмазы оранжевого, голубого,
- 14. ПРИМЕНЕНИЕ ОСНОВАНО НА ФИЗИЧЕСКИХ СВОЙСТВАХИзготовление бриллиантов –
- 15. ГРАФИТкристаллическое аллотропное видоизменение углерода, в древности считалось минералом свинца
- 16. Графит
- 17. КРИСТАЛЛИЧЕСКАЯ РЕШЁТКА - АТОМНАЯАтомы связаны в плоские
- 18. ФИЗИЧЕСКИЕ СВОЙСТВАМягкое вещество серого цвета, малая механическая
- 19. ПРИМЕНЕНИЕ ГРАФИТАГрафитовый порошок – изготовление минеральных красок.Смазочный
- 20. МАТЕРИАЛЫ НА ОСНОВЕ ГРАФИТАГрафлекс или пенографит –
- 21. КАРАНДАШИПервые графитовые карандаши появились в XVIII веке.
- 22. НА ОСНОВЕ ГРАФИТА СОЗДАН ГРАФИНВ конце XX
- 23. АМОРФНЫЙ УГЛЕРОД: ДРЕВЕСНЫЙ УГОЛЬ, КОКС, САЖАКак было
- 24. Получен синтетическиКАРБИН
- 25. СТРОЕНИЕ КАРБИНА И ПОЛИКУМУЛЕНА (ЕГО РАЗНОВИДНОСТИ)Белые кристаллыСостоит
- 26. СВОЙСТВАОбладает полупроводниковыми свойствамиПри сильном нагревании без доступа воздуха превращается в графит.
- 27. КАРБИНОн имеет вид черного мелкокристаллического порошка, однако
- 28. КАРБИНЗа счет существования различных типов связи и
- 29. ФУЛЛЕРЕНЫ – МОЛЕКУЛЯРНАЯ ФОРМА УГЛЕРОДАПо имени американского
- 30. ФУЛЛЕРЕНЫФуллерены – класс химических соединений, молекулы которых
- 31. ФУЛЛЕРЕНЫ – МОЛЕКУЛЫ БУДУЩЕГОНанотрубки из углерода являются сверхпроводниками. Изучение этих интересных объектов только начинается(«нано» - 10¯9)
- 32. ФУЛЛЕРЕНЫПроисхождение термина "фуллерен" связано с именем американского
- 33. ФУЛЛЕРЕНЫВ противоположность первым двум, графиту и алмазу,
- 34. ДРУГИЕ ФОРМЫ УГЛЕРОДАИзвестны и другие формы углерода,
- 35. НАНОТРУБКИ, НАНОЧАСТИЦЫ, ГРАФЕН
- 36. НАНОТРУБКИНаряду со сфероидальными углеродными структурами, могут образовываться
- 37. НАНОТРУБКИНа рисунке представлена идеализированная модель однослойной нанотрубки.
- 38. НАНОЧАСТИЦЫВ процессе образования фуллеренов из графита образуются
- 39. ГРАФЕНГрафе́н— двумерная аллотропная модификация углерода, образованная слоем
- 40. ГРАФЕНОсновной из существующих в настоящее время способов
- 41. Скачать презентацию
- 42. Похожие презентации
УГЛЕРОД.ПОЛОЖЕНИЕ В ТАБЛИЦЕ МЕНДЕЛЕЕВАУглерод Carbogenium - 6ой элемент в таблице Менделеева. Он располагается в главной подгруппе четвертой группы, втором периоде. Углерод-типичный неметалл.


































Слайд 3
НАХОЖДЕНИЕ В ПРИРОДЕ
В настоящее время известно более миллиона
соединений углерода с другими элементами. Их изучение составляет целую
науку – органическую химию. В тоже время за изучение свойств чистого углерода ученые взялись сравнительно недавно - около 20 лет назад.
Слайд 4
НАХОЖДЕНИЕ В ПРИРОДЕ
Углерод занимает 17-е место по распространенности
в земной коре – 0,048%. Но несмотря на это,
он играет огромную роль в живой и неживой природе.
Слайд 5
НАХОЖДЕНИЕ В ПРИРОДЕ
Углерод входит в состав органических веществ
в растительных и живых организмах, в состав ДНК. Содержится
в мышечной ткани – 67%, костной ткани – 36% и крови человека (в человеческом организме массой 70 кг в среднем содержится 16 кг связанного углерода).
Слайд 6
СВОБОДНЫЙ УГЛЕРОД
В свободном виде углерод встречается в нескольких
аллотропных модификациях – алмаз, графит, карбин, крайне редко фуллерены.
В лабораториях также были синтезированы многие другие модификации: новые фуллерены, нанотрубки, наночастицы и др.
Слайд 9
КРИСТАЛЛИЧЕСКАЯ РЕШЁТКА - АТОМНАЯ
Кристаллизуется в кубической кристаллической решётке:
половина атомов располагается в вершинах и центрах граней одного
куба, а другая – в вершинах и центрах другого, смещённого относительно первого в направлении его пространственной диагонали.Каждый атом окружен четырьмя такими же атомами, располагающимися по вершинам тетраэдра. Расположение атомов таково, что каждый из них окружен четырьмя равноотстоящими ближайшими атомами — тетраэдр. На одну ячейку приходится восемь атомов. Все атомы относятся к одной правильной системе точек. Междоузлия представляют собой тетраэдрические пустоты.
Из всех простых веществ алмаз имеет максимальное число атомов, приходящихся на единицу объёма – атомы упакованы очень плотно
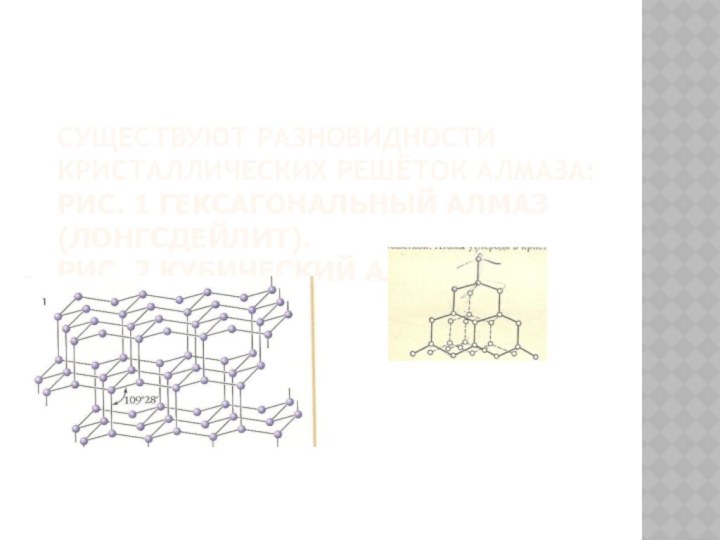
Слайд 10 СУЩЕСТВУЮТ РАЗНОВИДНОСТИ КРИСТАЛЛИЧЕСКИХ РЕШЁТОК АЛМАЗА: РИС. 1 ГЕКСАГОНАЛЬНЫЙ АЛМАЗ
(ЛОНГСДЕЙЛИТ).
РИС. 2 КУБИЧЕСКИЙ АЛМАЗ
Слайд 11
ФИЗИЧЕСКИЕ СВОЙСТВА
Один из самых твёрдых и тугоплавких веществ
(плотная упаковка и прочность связей).
Хрупок – довольно легко расколоть
на части.Очень высокая теплопроводность – проводит тепло в несколько раз лучше, чем многие металлы (в 4 раза лучше меди).
Не проводит электрический ток.
Слайд 12
ШКАЛА МООСА
Все минералы имеют различную твёрдость. Твёрдость испытуемого
минерала проверяется царапанием его «эталонным карандашом твёрдости». Немецкий минералог
Ф.Моос создал шкалу твёрдости минералов. В ней в порядке возрастания твёрдости расположены 10 минералов: 1 — тальк, 2 — гипс, 3 — кальцит, 4 — флюорит, 5 — апатит, 6 — ортоклаз, 7 — кварц, 8 — топаз, 9 — корунд, 10 — алмаз.
Слайд 13
АЛМАЗЫ ИМЕЮТ РАЗНЫЙ ЦВЕТ
Известны алмазы оранжевого, голубого, розового,
жёлтого, коричневого, молочно-белого, синего, зелёного, серого и даже чёрного
цвета. Окраска связана с дефектами в кристаллической решётке и замещением части атомов углерода на атомы бора, азота и даже алюминия. Серая и чёрная окраска алмазов обусловлена включениями графита.
Слайд 14
ПРИМЕНЕНИЕ ОСНОВАНО НА ФИЗИЧЕСКИХ СВОЙСТВАХ
Изготовление бриллиантов – огранённые
алмазы сильно преломляют свет.
Для резки стекла, металлов, наконечники свёрл
(«алмазные жала»), буров и резцов – благодаря твёрдости.Алмазный порошок – для полировки и огранки драгоценных камней (рубинов) – твёрдость.
Слайд 15
ГРАФИТ
кристаллическое аллотропное видоизменение углерода, в древности считалось минералом
свинца
Слайд 17
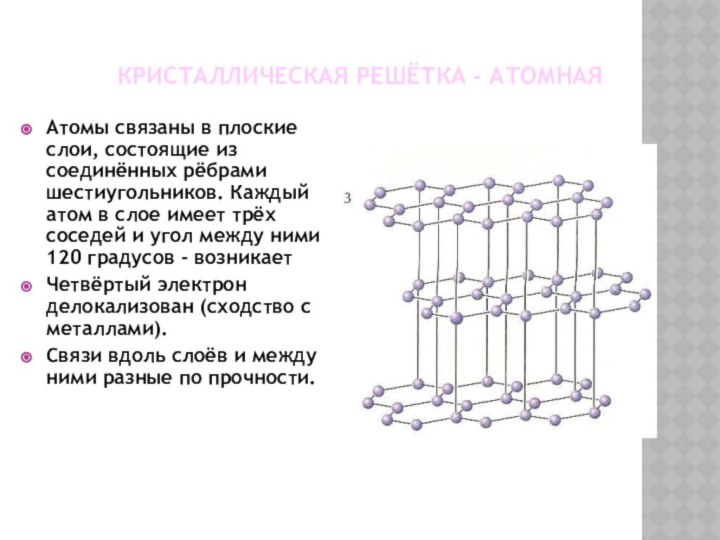
КРИСТАЛЛИЧЕСКАЯ РЕШЁТКА - АТОМНАЯ
Атомы связаны в плоские слои,
состоящие из соединённых рёбрами шестиугольников. Каждый атом в слое
имеет трёх соседей и угол между ними 120 градусов - возникаетЧетвёртый электрон делокализован (сходство с металлами).
Связи вдоль слоёв и между ними разные по прочности.
Слайд 18
ФИЗИЧЕСКИЕ СВОЙСТВА
Мягкое вещество серого цвета, малая механическая прочность
(неравноценные по прочности связи).
Электропроводен и имеет металлический блеск (электроны
блуждают, как у металлов).Вещество жирное на ощупь
Теплопроводность в направлении плоскости слоёв больше, чем в перпендикулярном направлении.
Электрическое сопротивление в направлении слоёв меньше, чем в перпендикулярном направлении наблюдается анизотропия (зависимость свойств вещества от направления)
Слайд 19
ПРИМЕНЕНИЕ ГРАФИТА
Графитовый порошок – изготовление минеральных красок.
Смазочный материал
(в смеси с маслом) – между отдельными слоями графита
взаимодействие настолько слабо, что возникает скольжение. Чешуйки графита заполняя неровности поверхности создают гладкую поверхность.Графитовые стержни – электроды – электропроводность.
Тигли, блоки для атомных реакторов – тугоплавкость.
Теплозащитный материал для головных частей ракет – термостойкость.
Получение карбидов – легко реагирует с металлами.
Слайд 20
МАТЕРИАЛЫ НА ОСНОВЕ ГРАФИТА
Графлекс или пенографит – высокопористый
материал заменяет резину и металл.
Стеклоуглерод – химически стоек, заменяет
платиновую химическую посуду.Пирографит – для изготовления искусственных клапанов сердца
Углеродное волокно как наполнитель в пластики для придания большей прочности и электропроводности, лёгкие эластичные электронагреватели
Рис. Углеродная ткань и углеродное волокно, стаканчик из стеклоуглерода
Слайд 21
КАРАНДАШИ
Первые графитовые карандаши появились в XVIII веке. Это
было связано с открытием графитового месторождения в Камберленде (Англия).
В
1795 г. в Париже по способу Конта изготовлялись карандаши из смеси графита и глины, обожжённые в печи. Эта технология используется и по сей день. Чем больше глины – тем твёрже карандаш. В особые мягкие карандаши добавляют воск и сало – ими можно писать на стекле. Особый сорт рыхлых карандашей служит для пастельной живописи.
Слайд 22
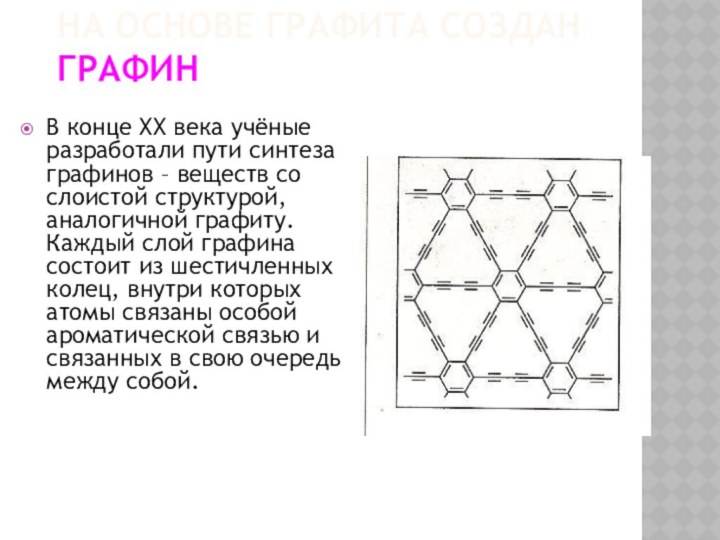
НА ОСНОВЕ ГРАФИТА СОЗДАН ГРАФИН
В конце XX века
учёные разработали пути синтеза графинов – веществ со слоистой
структурой, аналогичной графиту. Каждый слой графина состоит из шестичленных колец, внутри которых атомы связаны особой ароматической связью и связанных в свою очередь между собой.
Слайд 23
АМОРФНЫЙ УГЛЕРОД: ДРЕВЕСНЫЙ УГОЛЬ, КОКС, САЖА
Как было установлено
исследованиями – эти три разновидности – мелкокристаллический графит, а
не отдельные аллотропные модификации.Сажа получается при разложении метан
Кокс образуется при разложении угля без доступа воздуха
Древесный уголь образуется при разложении древесины без доступа воздуха. Обладает способностью к адсорбции – способностью поглощать различные вещества. Это явление используется для очистки сахара, спирта, в фильтре противогаза. Активированный уголь прокаливают на перегретом пару, число пор при этом увеличивается, что улучшает адсорбцию.
Слайд 25
СТРОЕНИЕ КАРБИНА И ПОЛИКУМУЛЕНА (ЕГО РАЗНОВИДНОСТИ)
Белые кристаллы
Состоит из
цепей, образованных участками: -С≡ С-С≡ С- (карбин) или =С=С=С=С=
(поликумулен)
Слайд 26
СВОЙСТВА
Обладает полупроводниковыми свойствами
При сильном нагревании без доступа воздуха
превращается в графит.
Слайд 27
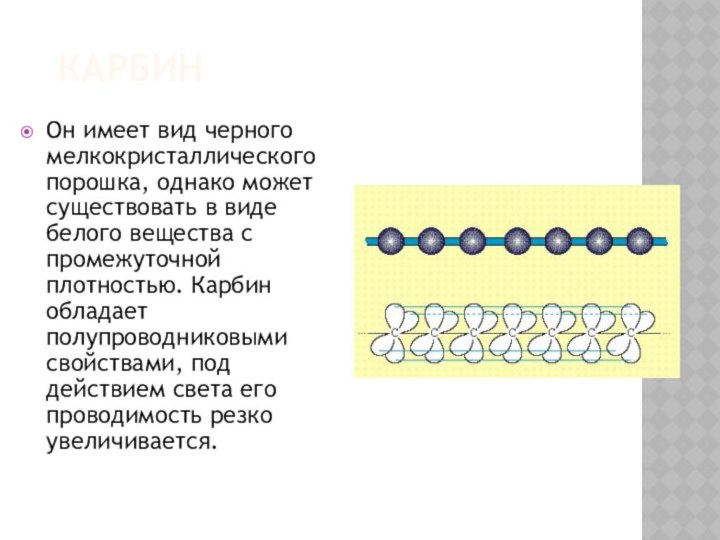
КАРБИН
Он имеет вид черного мелкокристаллического порошка, однако может
существовать в виде белого вещества с промежуточной плотностью. Карбин
обладает полупроводниковыми свойствами, под действием света его проводимость резко увеличивается.
Слайд 28
КАРБИН
За счет существования различных типов связи и разных
способов укладки цепей из углеродных атомов в кристаллической решетке,
физические свойства карбина могут меняться в широких пределах. Позднее карбин был найден в природе в виде вкраплений в природном графите, содержащемся в минерале чаоит, а также в метеоритном веществе.Метеорит содержащий вкрапления карбина
Слайд 29
ФУЛЛЕРЕНЫ – МОЛЕКУЛЯРНАЯ ФОРМА УГЛЕРОДА
По имени американского инженера
и архитектора Ричарда Бакминстера Фуллера, который построил конструкцию купола
из сочленённых пяти- и шестиугольников.
Слайд 30
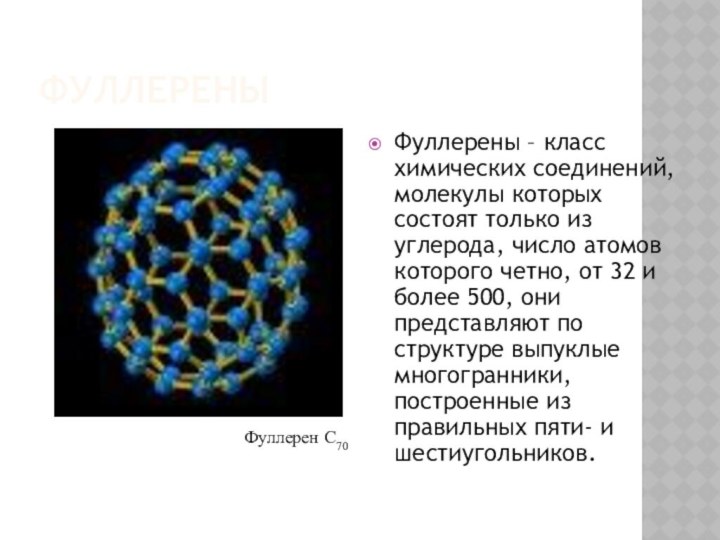
ФУЛЛЕРЕНЫ
Фуллерены – класс химических соединений, молекулы которых состоят
только из углерода, число атомов которого четно, от 32
и более 500, они представляют по структуре выпуклые многогранники, построенные из правильных пяти- и шестиугольников.Фуллерен С70
Слайд 31
ФУЛЛЕРЕНЫ – МОЛЕКУЛЫ БУДУЩЕГО
Нанотрубки из углерода являются сверхпроводниками.
Изучение этих интересных объектов только начинается
(«нано» - 10¯9)
Слайд 32
ФУЛЛЕРЕНЫ
Происхождение термина "фуллерен" связано с именем американского архитектора
Ричарда Букминстера Фуллера, конструировавшего полусферические архитектурные конструкции, состоящие из
шестиугольников и пятиугольников.Купол Фуллера
Слайд 33
ФУЛЛЕРЕНЫ
В противоположность первым двум, графиту и алмазу, структура
которых представляет собой периодическую решетку атомов, третья форма чистого
углерода является молекулярной. Это означает, что минимальным элементом ее структуры является не атом, а молекула углерода, представляющая собой замкнутую поверхность, которая имеет форму сферы.Модель фуллерена С60
Слайд 34
ДРУГИЕ ФОРМЫ УГЛЕРОДА
Известны и другие формы углерода, такие
как уголь, кокс и сажа. Но все эти формы
являются композитами, то есть смесью малых фрагментов графита и алмаза.Сажа
Слайд 36
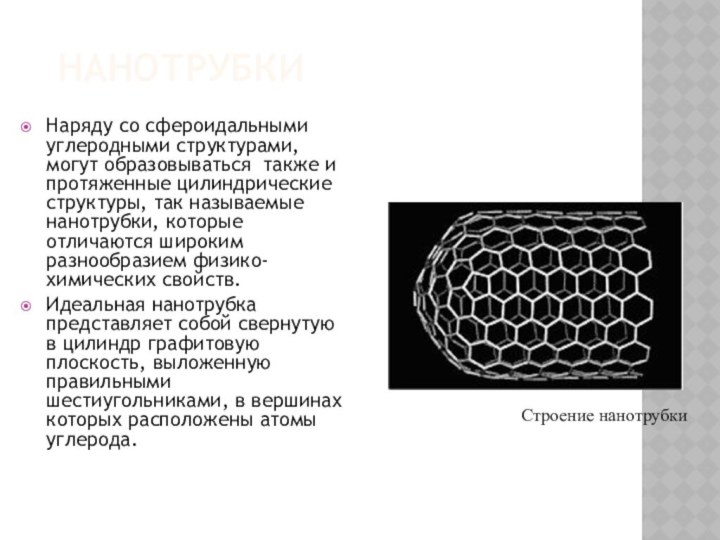
НАНОТРУБКИ
Наряду со сфероидальными углеродными структурами, могут образовываться также
и протяженные цилиндрические структуры, так называемые нанотрубки, которые отличаются
широким разнообразием физико-химических свойств.Идеальная нанотрубка представляет собой свернутую в цилиндр графитовую плоскость, выложенную правильными шестиугольниками, в вершинах которых расположены атомы углерода.
Строение нанотрубки