- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Путешествие в Страну 17 элемента
Содержание
- 3. ХлорClХлор в веществахИсторияСхема получения хлораФизические свойстваХранение хлораВ довершение…Некоторые применения хлораХим.свойстваХлорная водаДепо
- 5. ClХлор (от греч. χλωρός — «зелёный») —
- 7. Станция «в
- 9. Станция «Хлор в земной коре»КарналлитСильвинитТакже содержится в каините, бишофите, тахгидрите. назад
- 11. Станция «Историческая»ХЛОР (от греч. chloros - желто-зеленый;
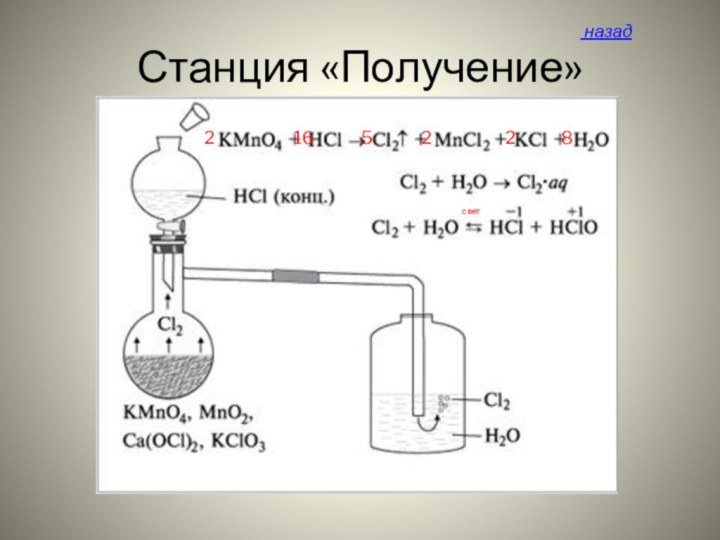
- 13. Станция «Получение» назадсвет
- 15. Станция «Свойства Хлора.»Платформа 1 – физические свойства.Температура
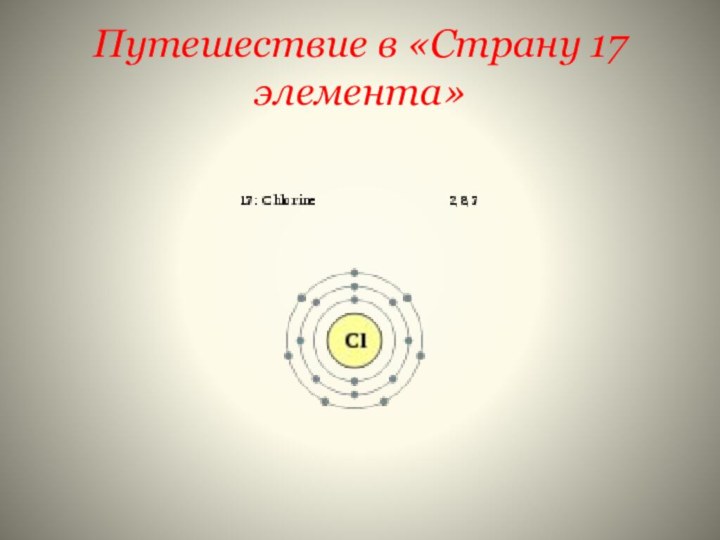
- 17. Качество? Признак? Особенность? Свойства?У хлора распределение электронов 2е)8е)7е) Какими свойствами он обладает???
- 19. Станция «Свойства хлора» платформа 2 - ХимическиеКак
- 21. Станция «Водная»Хлорная вода — водный раствор хлора.
- 23. Станция «им.Хранения»Производимый хлор хранится в специальных «танках»
- 25. Станция «СЕРЬЕЗНО Й ОПАСНОСТИ»Отравления хлором возможны в химической,
- 27. Станция «Примениние.Конечная. Платформа справа.»Отбеливающие свойства хлора известны
- 29. Скачать презентацию
- 30. Похожие презентации
ХлорClХлор в веществахИсторияСхема получения хлораФизические свойстваХранение хлораВ довершение…Некоторые применения хлораХим.свойстваХлорная водаДепо



























Слайд 3
Хлор
Cl
Хлор в веществах
История
Схема получения хлора
Физические свойства
Хранение хлора
В довершение…
Некоторые
применения хлора
Слайд 5
Cl
Хлор (от греч. χλωρός — «зелёный») — элемент
главной подгруппы седьмой группы, третьего периода периодической системы химических
элементов Д. И. Менделеева, с атомным номером 17. Обозначается символом Cl (лат. Chlorum). Химически активный неметалл. Входит в группу галогенов17
35,4527
степени окисления -1 ;+1 ;+3 ; +5 ; +7 ;
назад
)2е)8е)7е
Слайд 7 Станция «в веществах»
Содержание хлора :
В человческом теле содержится 0.25%
в плазме
крови 0,32-0,37%табак содержит 2,3% хлора
морковь - 1,5%
зерно - 0,05%,
картофель - 0,03%
Назад
Слайд 9
Станция «Хлор в земной коре»
Карналлит
Сильвинит
Также содержится в каините,
бишофите, тахгидрите.
назад
Слайд 11
Станция «Историческая»
ХЛОР (от греч. chloros - желто-зеленый; лат.
Chlorum)
Первоначально название «галоген» использовал немецкий химик Швейгер для
хлора ,но оно не прижилось, и впоследствии стало общим для VII группы элементов, в которую входит и хлор. Впервые хлор был получен в 1774 г. Шееле, описавшим его выделение при взаимодействии пиролюзита с соляной кислотой в своём трактате о пиролюзите:
4HCl + MnO2 = Cl2 + MnCl2 +2H2O
Шееле отметил запах хлора, схожий с запахом царской водки, его способность взаимодействовать с золотом и киноварью, а также его отбеливающие свойств
Однако, только в 1810 Г. Дэви установил, что хлор - элемент и назвал его chlorine (от греческого chloros - жёлто-зелёный). В 1813 Ж.Л. Гей-Люссак предложил для этого элемента название хлор.
назад
Слайд 15
Станция «Свойства Хлора.»Платформа 1 – физические свойства.
Температура кипения −34
°C
Температура плавления −101 °C
Температура разложения
(диссоциации на атомы) ~1400°С
Теплоемкость (298
К, газ) 34,94 (Дж/моль·K)Критическая температура 144 °C
Критическое давление 76 атм
Теплота плавления 90,3 кдж/кг
Порог восприятия запаха в воздухе равен 0,003 (мг/л).
По электропроводности жидкий хлор занимает место среди самых сильных изоляторов: он проводит ток почти в миллиард раз хуже, чем дистиллированная вода, и в 1022 раз хуже серебра. Скорость звука в хлоре примерно в полтора раза меньше, чем в воздухе.
назад
Слайд 17
Качество? Признак? Особенность? Свойства?
У хлора распределение электронов
2е)8е)7е)
Какими свойствами он обладает???
Слайд 19
Станция «Свойства хлора» платформа 2 - Химические
Как ОКИСЛИТЕЛЬ
Как восстановитель
C неметаллами Cl2 + 2NaBr= 2NaCl + Br2
Cl2 + H2 = 2HCl
5Cl2 +2P = 2PCl5
Вытесняет Бром и Иод из их водород.соединений
Cl2 +2HBr = 2HCl + Br2
Хлор непосредственно реагирует почти со всеми металлами
Cl2 + 2Na= 2NaCl
назад
Слайд 21
Станция «Водная»
Хлорная вода — водный раствор хлора. Содержит,
помимо молекул Cl2, HClO и HCl, образующиеся по реакции
диспропорцинирования: 2Cl2 + 2H2O → 4HCl +O2Влияние на здоровье человека:
Хлорамины раздражают кожу и глаза.
Хлорированная вода способна усилить угревую сыпь, также хлор сушит кожу.
Слайд 23
Станция «им.Хранения»
Производимый хлор хранится в специальных «танках» или
закачивается в стальные баллоны высокого давления. Баллоны с жидким
хлором под давлением имеют специальную окраску — болотный цвет. Следует отметить что при длительной эксплуатации баллонов с хлором в них накапливается чрезвычайно взрывчатый треххлористый азот, и поэтому время от времени баллоны с хлором должны проходить плановую промывку и очистку от хлорида азота.назад
Слайд 25
Станция «СЕРЬЕЗНО Й ОПАСНОСТИ»
Отравления хлором возможны в химической, целлюлозно-бумажной,
текстильной, фармацевтичой промышленности. Xлор раздражает слизистые оболочки глаз и
дыхательных путей. К первичным воспалительным изменениям обычно присоединяется вторичная инфекция. Острое отравление развивается почти немедленно. При вдыхании средних и низких концентраций хлора отмечаются стеснение и боль в груди, сухой кашель, учащённое дыхание, резь в глазах, слезотечение, повышение содержания лейкоцитов в крови, температуры тела и т. п. Возможны бронхопневмония, токсический отёк лёгких, депрессивные состояния, судороги. В лёгких случаях выздоровление наступает через 3 - 7 суток. Как отдалённые последствия наблюдаются катары верхних дыхательных путей, рецидивирующий броихит, пневмосклероз; возможна активизация туберкулёза лёгких. При длительном вдыхании небольших концентраций хлора наблюдаются аналогичные, но медленно развивающиеся формы заболевания. Профилактика отравлений, герметизация производств, оборудования, эффективная вентиляция, при необходимости использование противогаза. Предельно допустимая концентрация хлора в воздухе производств, помещений 1 мг/м3. Производство хлора, хлорной извести и других хлорсодержащих соединений относится к производствам с вредными условиями труда.назад
Слайд 27
Станция «Примениние.Конечная. Платформа справа.»
Отбеливающие свойства хлора известны с
давних времен, хотя не сам хлор «отбеливает», а атомарный
кислород, который образуется при распаде хлорноватистой кислоты: 2Cl2 + 2H2O → 4HCl +O2Этот способ отбеливания тканей, бумаги, картона используется уже несколько веков
Использовался как боевое отравляющее вещество, а так же для производства других боевых отравляющих веществ: иприт, фосген
В пищевой промышленности зарегистрирован в качестве пищевой добавки E925.
В химическом производстве соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов, ядов, лекарств, удобрений.
В металлургии для производства чистых металлов: титана, олова, тантала, ниобия.
назад