- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Ионные уравнения
Содержание
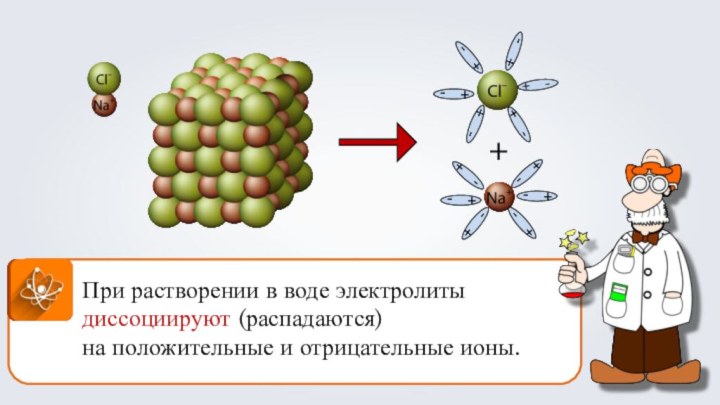
- 2. +При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы.
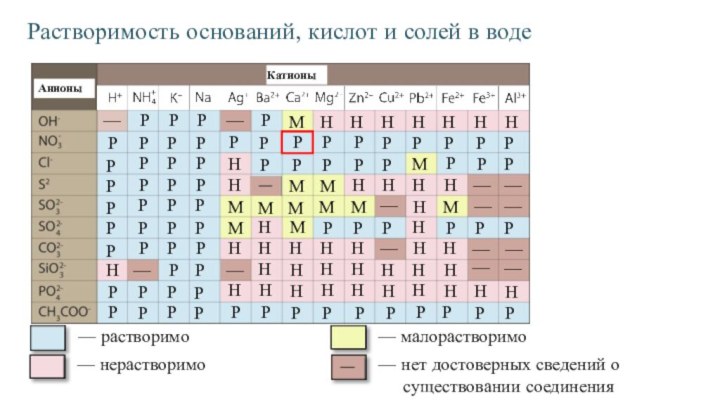
- 3. РКатионыАнионы
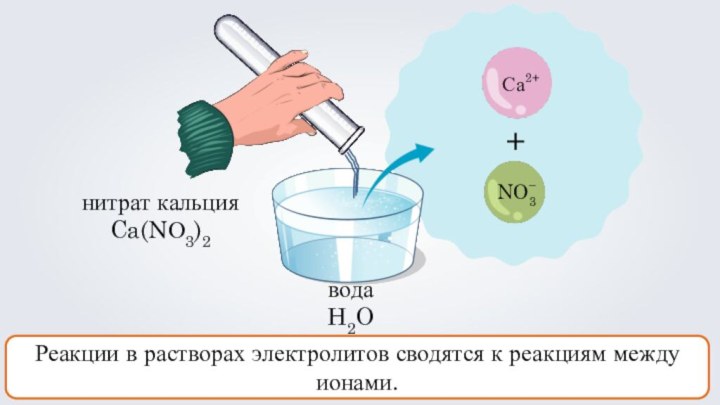
- 4. нитрат кальцияCa(NО3)2 +СаNO3водаH2O 2+–Реакции в растворах электролитов сводятся к реакциям между ионами.
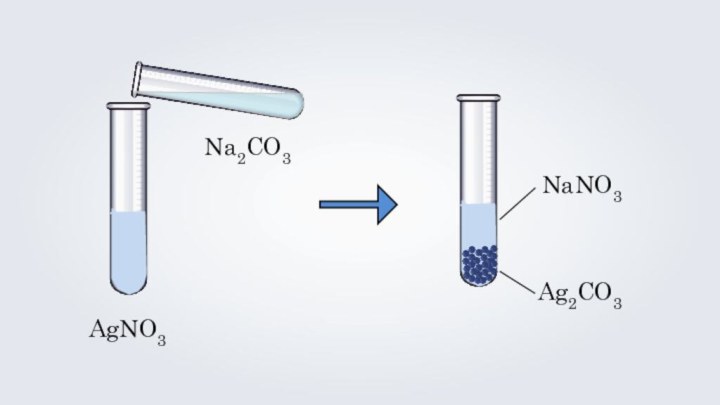
- 5. AgNO3Na2CO3NaNO3Ag2CO32AgNO3 + Na2CO3 = Ag2CO3↓ + 2NaNO3
- 6. Ионные реакции — это реакции между ионами.
- 7. AgNO3Na2CO3NaNO3Ag2CO3
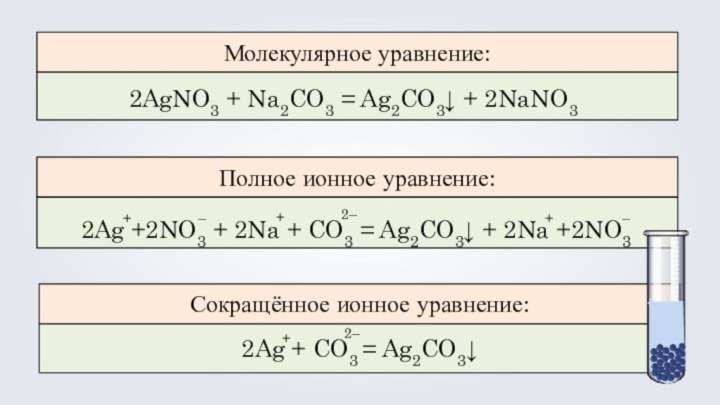
- 8. 2AgNO3 + Na2CO3 = Ag2CO3↓ + 2NaNO3
- 9. Условия протекания реакций ионного обмена до концаОбразование
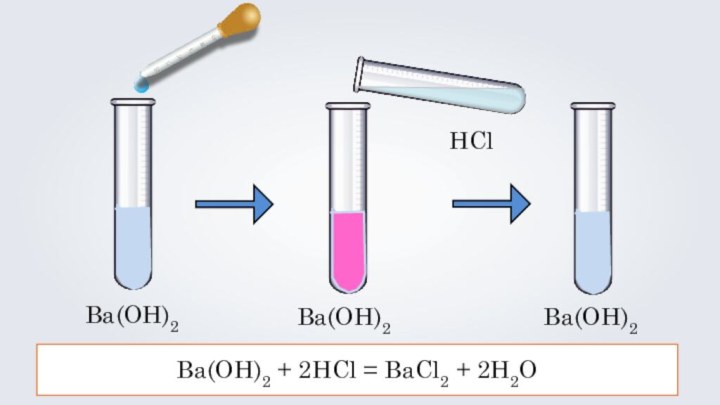
- 10. Ba(OH)2Ba(OH)2HClBa(OH)2Ba(OH)2 + 2HCl = BaCl2 + 2H2O
- 11. Ba(OH)2 + 2HCl = BaCl2 + 2H2O
- 12. Ba(OH)2Ba(OH)2HClBa(OH)2H + OH = H2O +–
- 13. Реакции нейтрализации — это реакции взаимодействия сильной
- 14. KHCO3HClCO2KHCO3 + HCl = KCl + H2O + CO2↑
- 15. KHCO3 + HCl = KCl + H2O
- 16. Скачать презентацию
- 17. Похожие презентации
+При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы.









Слайд 2
+
При растворении в воде электролиты диссоциируют (распадаются)
на
положительные и отрицательные ионы.
Слайд 4
нитрат кальция
Ca(NО3)2
+
Са
NO3
вода
H2O
2+
–
Реакции в растворах электролитов сводятся
к реакциям между ионами.
Слайд 5
AgNO3
Na2CO3
NaNO3
Ag2CO3
2AgNO3 + Na2CO3 = Ag2CO3↓ + 2NaNO3
2Ag
+2NO3 + 2Na + CO3 = Ag2CO3↓ + 2Na
+ 2NO3+
+
+
–
–
2–
Слайд 6
Ионные реакции — это реакции между ионами. Уравнения
таких реакций называются ионными уравнениями.
2Ag +2NO3 + 2Na +
CO3 = Ag2CO3↓ + 2Na +2NO3 +
+
+
–
–
2–
2Ag + CO3 = Ag2CO3↓
+
2–
Слайд 8
2AgNO3 + Na2CO3 = Ag2CO3↓ + 2NaNO3
2Ag
+2NO3 + 2Na + CO3 = Ag2CO3↓ + 2Na
+2NO3+
+
+
–
–
2–
2Ag + CO3 = Ag2CO3↓
+
2–
Молекулярное уравнение:
Полное ионное уравнение:
Сокращённое ионное уравнение:
Слайд 9
Условия протекания реакций
ионного обмена до конца
Образование в
результате реакции нерастворимого в воде вещества.
2. Образование в результате
реакции газообразного вещества.
3. Образование в результате реакции
малодиссоциирующего вещества.
Слайд 11
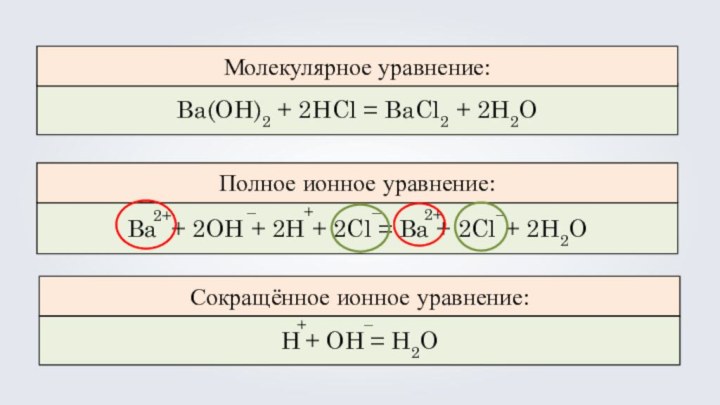
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
Ba
+ 2OH + 2H + 2Cl = Ba +
2Cl + 2H2OH + OH = H2O
Молекулярное уравнение:
Полное ионное уравнение:
Сокращённое ионное уравнение:
2+
+
2+
–
–
–
+
–
Слайд 13
Реакции нейтрализации — это реакции взаимодействия сильной кислоты
со
щёлочью, в результате которых образуется малодиссоциирующее вещество — вода
—и соль.
Слайд 15 KHCO3 + HCl = KCl + H2O +
CO2↑
K + HCO3 + H + Cl =
K + Cl + H2O + CO2↑HCO3 + H = H2O + CO2↑
Молекулярное уравнение:
Полное ионное уравнение:
Сокращённое ионное уравнение:
+
+
–
–
–
+
+
–