- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Гетероциклические соединения
Содержание
- 2. План:Классификация.Пятичленные азотсодержащие гетероциклы с одним гетероатомом.Шестичленные азотсодержащие
- 3. Пятичленные азотсодержащие гетероциклы с одним гетероатомом.Гетероциклическими называют
- 4. Гетероциклы классифицируют по следующим основным признакам:Гетероциклы классифицируют
- 5. По степени ненасыщенности различают насыщенные, ненасыщенные и
- 6. ПИРРОЛПиррол — ароматический пятичленный азотистый гетероцикл, обладает слабыми кислотными
- 7. Химические свойства пиррола:Химические свойства пиррола определяются наличием
- 8. В то же время, наличие полярной связи N-H обуславливает слабые кислотные свойства пиррола (pKa=16,5).
- 9. Биологически активные производные индола:Триптофан – незаменимая (не
- 10. Реакции электрофильного замещения:Пиррол, как p -избыточный гетероцикл, легко вступает
- 11. Биологически активные производные пиррола:Тетрапиррольные соединения содержат ароматический макроцикл порфин,
- 12. ИНДОЛИндол — бесцветные кристаллы с запахом, напоминающим нафталин. Является
- 13. Химические свойства индола:Химические свойства индола аналогичны свойствам
- 14. Триптофан – незаменимая (не синтезируется в организме человека) аминокислота,
- 15. Триптамин – токсичный биогенный амин, продукт декарбоксилирования триптофана.Индольные
- 16. Шестичленные азотсодержащие гетероциклы с одним гетероатомами.ПИРИДИН Пиридин – 6-членный ароматический гетероцикл с одним атомом азота.
- 17. Химические свойства пиридина:Химические свойства пиридина определяются наличием
- 18. Реакции электрофильного замещения:Реакции электрофильного замещения для пиридина
- 19. Реакции нуклеофильного замещения:Наиболее характерными для пиридина являются
- 20. Реакция Чичибабина:Чичибабина реакция, взаимодействие азотсодержащих гетероциклических соединений (главным
- 21. Окисление и восстановление:Цикл пиридина устойчив к действию
- 22. Биологически активные производные пиридина:Никотиновая кислота и ее
- 23. Никотинамиадениндинуклеотид – кофермент, участвующий в процессах окисления и восстановления,
- 24. Хинолин и изохинолинХинолин и изохинолин – ароматические
- 25. Химические свойства хинолина и изохинолина:Химические свойства хинолина
- 26. При каталитическом гидрировании хинолина в первую очередь
- 27. Биологически активные производные хинолина и изохинолина:8-Гидроксихинолин и его
- 28. Действие этих препаратов основано на образование прочных
- 29. Пяти- и шестичленные гетероциклы с двумя атомами
- 30. Ароматические системы имидазола и пиразола включают по
- 31. В результате присутствия в молекуле одновременно кислотного
- 32. Таутомерные формы быстро превращаются друг в друга
- 33. Биологически активные производные имидазола и пиразола.Гистидин - a -аминокислота, входящая
- 34. Производные пиразолона-5 - антипирин, амидопирин, анальгин – ненаркотические анальгетики, жаропонижающие и противовоспалительные средства.
- 35. ПиримидинПиримидин – 6-членный ароматический гетероцикл с двумя
- 36. Биологически активные производные пиримидина:Важную биологическую роль играют
- 37. Наиболее стабильными являются оксо-форма для цитозина и
- 38. ПуринПурин – ароматическое гетероциклическое соединение, содержащее конденсированные
- 39. Биологически активные производные пурина:Важную биологическую роль играют
- 40. Для аденина известны две таутомерные формы, являющиеся
- 41. Для них, как и для гуанина, характерны
- 42. Такие превращения пуриновых оснований в составе нуклеиновых
- 43. Скачать презентацию
- 44. Похожие презентации
План:Классификация.Пятичленные азотсодержащие гетероциклы с одним гетероатомом.Шестичленные азотсодержащие гетероциклы с одним гетероатомами.Пяти- и шестичленные гетероциклы с двумя атомами азота.





































Слайд 2
План:
Классификация.
Пятичленные азотсодержащие гетероциклы с одним гетероатомом.
Шестичленные азотсодержащие гетероциклы
с одним гетероатомами.
азота.
Слайд 3
Пятичленные азотсодержащие гетероциклы с одним гетероатомом.
Гетероциклическими называют соединения,
молекулы которых содержат циклы, включающие наряду с атомами углерода
один или несколько гетероатомов. Гетероциклы – самый многочисленный класс органических соединений, включающий около 2/3 всех известных природных и синтетических органических веществ. К гетероциклам относятся многие алкалоиды, витамины, природные пигменты. Они являются структурными фрагментами молекул нуклеиновых кислот и белков. Более 60% наиболее известных и широко употребляемых лекарственных препаратов являются гетероциклическими соединениями.
Слайд 4
Гетероциклы классифицируют по следующим основным признакам:
Гетероциклы классифицируют по
следующим основным признакам:
по природе и числу гетероатомов;
по размеру цикла;
по
степени ненасыщенности.Наибольшее распространение в природе имеют пяти- и шестичленные гетероциклы, содержащие в качестве гетероатомов азот, а также кислород и серу.По степени ненасыщенности различают насыщенные, ненасыщенные и ароматические гетероциклы. Гетероциклы неароматического характера по своим свойствам сходны с соответствующими ациклическими соединениями (аминами, амидами, простыми и сложными эфирами и т.д.). 5- и 6-членные гетероциклы, замкнутая сопряженная система которых включает (4n + 2) электрона, обладают ароматическим характером (см. лек. №2). Такие соединения по свойствам родственны бензолу и относятся к ароматическим гетероциклическим соединениям. Для них, как и для бензоидных систем, наиболее характерны реакции замещения. При этом гетероатом выполняет роль “внутренней” функции, определяющей скорость и направление реакций замещения.
Именно ароматические гетероциклические соединения широко распространены в природе. Далее будут рассмотрены азотсодержащие ароматические гетероциклы.
Слайд 5 По степени ненасыщенности различают насыщенные, ненасыщенные и ароматические
гетероциклы. Гетероциклы неароматического характера по своим свойствам сходны с
соответствующими ациклическими соединениями (аминами, амидами, простыми и сложными эфирами и т.д.). 5- и 6-членные гетероциклы, замкнутая сопряженная система которых включает (4n + 2) электрона, обладают ароматическим характером (см. лек. №2). Такие соединения по свойствам родственны бензолу и относятся к ароматическим гетероциклическим соединениям. Для них, как и для бензоидных систем, наиболее характерны реакции замещения. При этом гетероатом выполняет роль “внутренней” функции, определяющей скорость и направление реакций замещения.
Слайд 6
ПИРРОЛ
Пиррол — ароматический пятичленный азотистый гетероцикл, обладает слабыми кислотными свойствами.
Содержится в костном масле (которое получают при сухой перегонке костей), а
также в каменноугольной смоле. Пиррольные кольца входят в состав порфиринов — хлорофилла растений, гема гемоглобинов и цитохромов и ряда других биологически важных соединений.
Слайд 7
Химические свойства пиррола:
Химические свойства пиррола определяются наличием ароматической
системы и полярной связи N-H.
Кислотно-основные свойства
Неподеленная пара электронов азота
является частью ароматического секстета электронов, поэтому пиррол практически лишен основных свойств. Сила пиррола как основания не может быть точно определена, так как он является ацидофобным соединением и полимеризуется под действием кислот.
Слайд 8
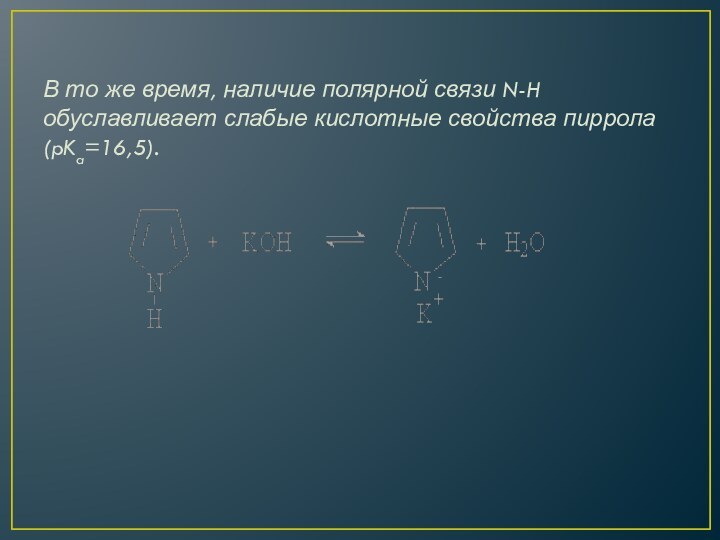
В то же время, наличие полярной связи N-H
обуславливает слабые кислотные свойства пиррола (pKa=16,5).
Слайд 9
Биологически активные производные индола:
Триптофан – незаменимая (не синтезируется в организме
человека) аминокислота, входящая в состав животных и растительных белков.
Слайд 10
Реакции электрофильного замещения:
Пиррол, как p -избыточный гетероцикл, легко вступает в
реакции электрофильного замещения. Активность пиррола по отношению к электрофилам
выше, чем у бензола, и близка к активности анилина и фенола. Электрофильное замещение направляется преимущественно в положение 2. Из-за ацидофобности пиррола SE-реакции проводятся в отсутствии кислот.
Слайд 11
Биологически активные производные пиррола:
Тетрапиррольные соединения содержат ароматический макроцикл порфин, включающий
четыре пиррольных кольца.
Замещенные порфины называют порфиринами. В виде комплексов с
металлами порфирины и частично гидрированные порфирины входят в состав важных природных соединений – гема (простетической группы гемоглобина – содержащегося в эритроцитах основного белка дыхательного цикла, переносчика кислорода от органов дыхания к тканям), зеленого пигмента растений хлорофилла, витамина В12.
Слайд 12
ИНДОЛ
Индол — бесцветные кристаллы с запахом, напоминающим нафталин. Является родоначальником
широкого класса природных соединений. Содержится в каменноугольной смоле, в
некоторых эфирных маслах (например, в масле жасмина).
Слайд 13
Химические свойства индола:
Химические свойства индола аналогичны свойствам пиррола.
Он практически не обладает основными свойствами, ацидофобен, является слабой
NH-кислотой. Активно вступает в реакции электрофильного замещения, при этом заместитель вступает в положение 3 пиррольного кольца.
Слайд 14
Триптофан – незаменимая (не синтезируется в организме человека) аминокислота, входящая
в состав животных и растительных белков.
Серотонин – биогенный амин, продукт метаболизма
триптофана. Обладает высокой биологической активностью, является нейромедиатором головного мозга.Биологически активные производные индола:
Слайд 15
Триптамин – токсичный биогенный амин, продукт декарбоксилирования триптофана.
Индольные алкалоиды. Алкалоиды
– гетероциклические азотсодержащие основания растительного происхождения, обладающие ярко выраженным
физиологическим действием. Индольное кольцо входит в состав многих алкалоидов – резерпина (содержится в растениях рода раувольфия; используется как успокаивающее и понижающее кровяное давление средство), стрихнина (содержится в семенах растения чилибухи; используется как тонизирующее средство), лизергиновой кислоты (алкалоид спорыньи; диэтиламид лизергиновой кислоты - ЛСД - сильное галлюциногенное средство).
Слайд 16
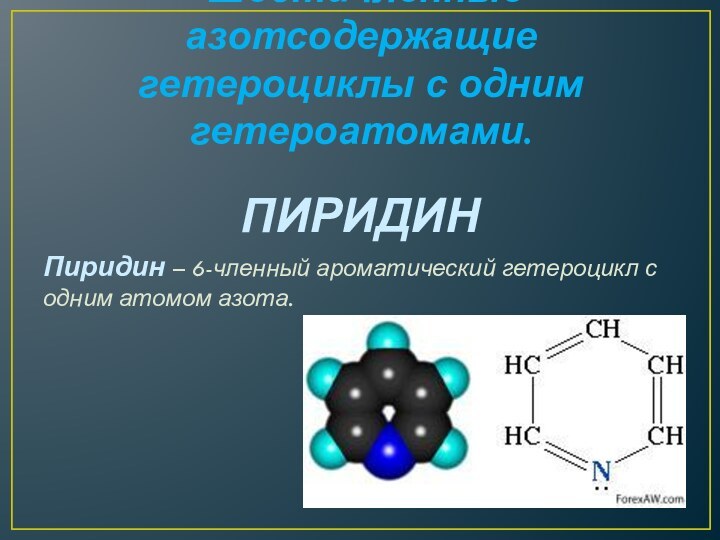
Шестичленные азотсодержащие гетероциклы с одним гетероатомами.
ПИРИДИН
Пиридин –
6-членный ароматический гетероцикл с одним атомом азота.
Слайд 17
Химические свойства пиридина:
Химические свойства пиридина определяются наличием ароматической
системы и основного атома азота.
Основные и нуклеофильные свойства.
Пиридин проявляет
слабые основные свойства ( =5,23) за счет неподеленной пары электронов азота и с кислотами образует соли пиридиния.Атом азота пиридина проявляет также нуклеофильные свойства и алкилируется алкилгалогенидами с образованием солей алкилпиридиния.
Слайд 18
Реакции электрофильного замещения:
Реакции электрофильного замещения для пиридина идут
с большим трудом, что обусловлено p -дефицитностью ядра и способностью атома
азота образовывать соли с протонными кислотами и комплексы с кислотами Льюиса, что еще больше уменьшает нуклеофильность ядра. По способности к электрофильному замещению пиридин напоминает нитробензол. Атака электрофилами идет по положению 3.
Слайд 19
Реакции нуклеофильного замещения:
Наиболее характерными для пиридина являются реакции
нуклеофильного замещения, которые идут по положениям 2 и 4.
Примерами таких реакций является взаимодействие пиридина с амидом натрия (реакция Чичибабаина) и со щелочами.
Слайд 20
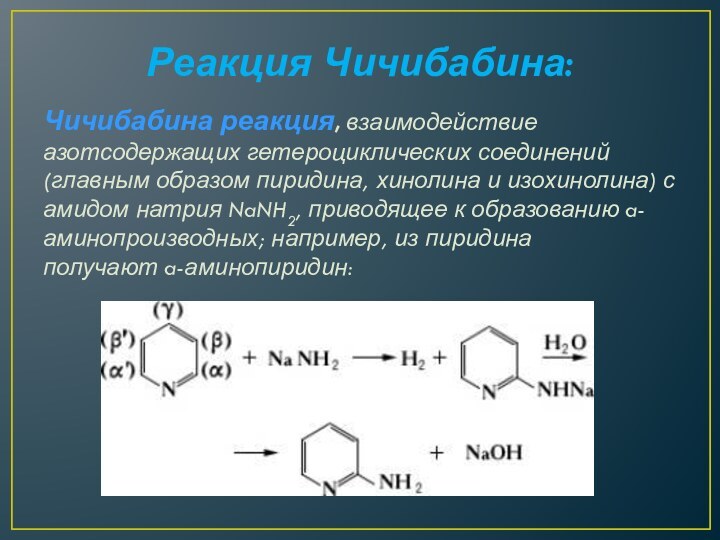
Реакция Чичибабина:
Чичибабина реакция, взаимодействие азотсодержащих гетероциклических соединений (главным образом
пиридина, хинолина и изохинолина) с амидом натрия NaNH2, приводящее
к образованию a-аминопроизводных; например, из пиридина получают a-аминопиридин:
Слайд 21
Окисление и восстановление:
Цикл пиридина устойчив к действию окислителей.
Алкилпиридины окисляются с образованием пиридинкарбоновых кислот.
Пиридин гидрируется в жестких
условиях с образованием насыщенного гетероцикла – пиперидина.
Слайд 22
Биологически активные производные пиридина:
Никотиновая кислота и ее амид
- никотинамид - две формы витамина РР. Никотинамид является составной частью
ферментативных систем, ответственных за окислительно-восстановительные процессы в организме. Диэтиламид никотиновой кислоты – кордиамин – эффективный стимулятор центральной нервной системы.Пиридоксин и пиридоксаль – различные формы витамина В6, предшественники кофермента пиридоксальфосфата, участвующего в процессах синтеза аминокислот из кетокислот путем трансаминирования
Слайд 23 Никотинамиадениндинуклеотид – кофермент, участвующий в процессах окисления и восстановления, связанных
с переносом гидрид-аниона
Пиридиновые алкалоиды. Ядро пиридина и пиперидина входит
в состав многих алкалоидов – никотина и анабазина (алкалоиды, содержащиеся в листьях табака; чрезвычайно токсичны, используются как инсектициды), атропина (содержится в растениях семейства пасленовых; высокотоксичен; применяется в медицине как средство, вызывающие расширение зрачка), кокаина (содержится в листьях коки; стимулирует и возбуждает нервную систему, известен как одно из первых местноанестезирующих и наркотических средств).
Слайд 24
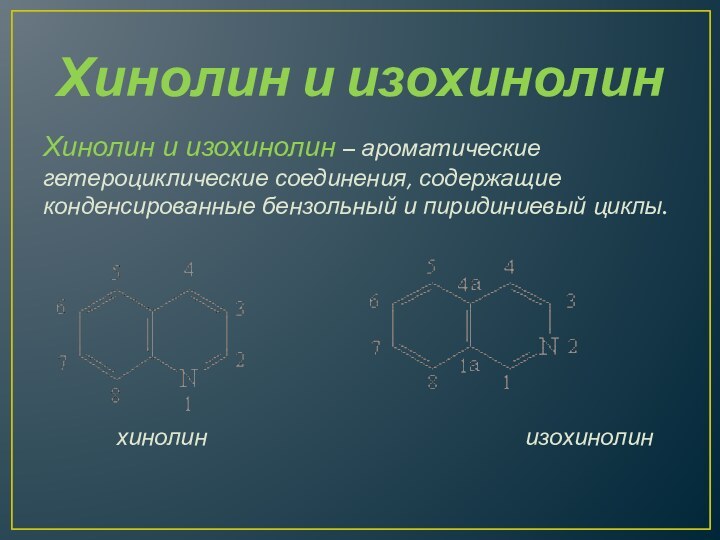
Хинолин и изохинолин
Хинолин и изохинолин – ароматические гетероциклические
соединения, содержащие конденсированные бензольный и пиридиниевый циклы.
хинолин изохинолин
Слайд 25
Химические свойства хинолина и изохинолина:
Химические свойства хинолина и
изохинолина аналогичны свойствам пиридина. Они обладают основными и нуклеофильными
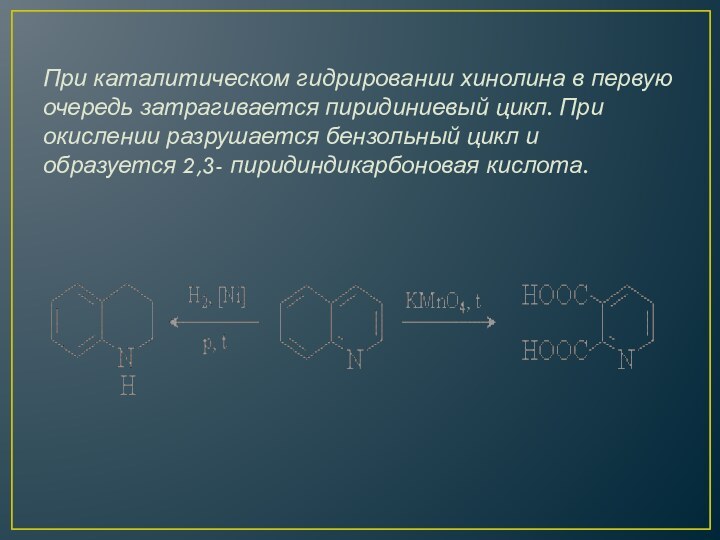
свойствами и образуют соли при протонировании сильными кислотами и при алкилировании алкилгалогенидами. Реакции электрофильного замещения протекают по наименее электронодефицитному бензольному кольцу и направляются в хинолине в положения 6 и 8. Нуклеофильные реагенты атакуют пиридиниевый цикл хинолина в положение 2.Слайд 26 При каталитическом гидрировании хинолина в первую очередь затрагивается
пиридиниевый цикл. При окислении разрушается бензольный цикл и образуется
2,3- пиридиндикарбоновая кислота.
Слайд 27
Биологически активные производные хинолина и изохинолина:
8-Гидроксихинолин и его производные
– 8-гидрокси-5-нитрохинолин (5-НОК) и 8-гидрокси-7-иод-5-хлорхинолин (энтеросептол) – обладают сильным бактерицидным действием и
используются как противовоспалительные и антисептические средства.Слайд 28 Действие этих препаратов основано на образование прочных хелатных
комплексов с ионами металлов. Таким образом происходит связывание микроэлементов,
необходимых для жизнедеятельности бактерий.Хинин - алкалоид коры хинного дерева, эффективное противомалярийное средство.
Алкалоиды опия: морфин - сильнейшее болеутоляющее средство, наркотик; папаверин - спазмолитическе и сосудорасширяющее средство.
Слайд 29 Пяти- и шестичленные гетероциклы с двумя атомами азота. Имидазол
и Пиразол
Имидазол и пиразол – 5-членные ароматические гетероциклы, содержащие
два атома азота.Слайд 30 Ароматические системы имидазола и пиразола включают по 6 p -электронов.
При этом один из атомов азота цикла подает в
ароматическую систему один р-электрон (пиридиниевый атом азота), другой атом азота – неподеленную пару электронов (пиррольный атом азота).Имидазол и пиразол содержат в молекуле кислотный центр (связь N-H) и основный центр (пиридиниевый атом азота) и являются амфотерными соединениями. При этом основные свойства преобладают над кислотными.
Слайд 31 В результате присутствия в молекуле одновременно кислотного и
основного центров имидазол и пиразол ассоциированы за счет образования
межмолекулярных водородных связей.Следствием такой ассоциации являются высокие температуры кипения и быстрый водородный межмолекулярный обмен между пиррольным и пиридиниевым атомами азота, который в случае замещенных гетероциклов приводит к существованию таутомеров.
Слайд 32 Таутомерные формы быстро превращаются друг в друга и
не могут быть выделены в индивидуальном состоянии.
Особый вид таутомерии
характерен для 5-гидроксипиразолов (пиразолонов-5). В растворе они существуют в виде равновесной смеси гидроки-(I) и оксо-(II,III) таутомерных форм. В кристаллическом состоянии наиболее устойчива форма II.
Слайд 33
Биологически активные производные имидазола и пиразола.
Гистидин - a -аминокислота, входящая в
состав многих белков, в том числе гемоглобина; в составе
ферментов осуществляет кислотный и основной катализ за счет амфотерных свойств имидазольного цикла.Гистамин – биогенный амин, продукт декарбоксилирования гистидина; обеспечивает аллергические реакции организма.
Слайд 34
Производные пиразолона-5 - антипирин, амидопирин, анальгин – ненаркотические анальгетики, жаропонижающие
и противовоспалительные средства.
Слайд 35
Пиримидин
Пиримидин – 6-членный ароматический гетероцикл с двумя атомами
азота.
Ароматическая система пиримидина включает 6 p -электронов и подобна ароматической системе
пиридина: каждый атом цикла, в том числе и оба атома азота, подают в ароматический секстет один р-электрон.Химические свойства пиримидина подобны свойствам пиридина. Пиримидин является более слабым основанием, чем пиридин, за счет электроноакцепторного влияния второго атома азота (=1,3). Снижение, по сравнению с пиридином, электронной плотности на атомах углерода кольца приводит к инертности пиримидина по отношению к электрофильным реагентам и окислителям. Реакции нуклеофильного замещении и восстановления в ядре пиримидина, напротив, протекают легче, чем в пиридине.
Слайд 36
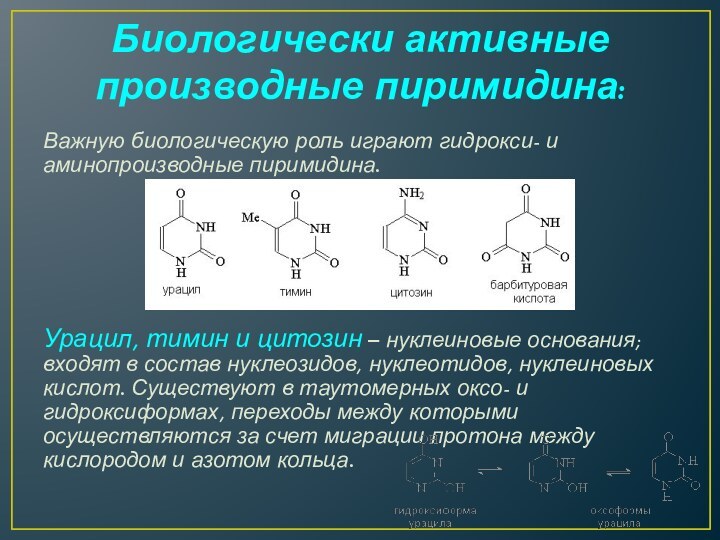
Биологически активные производные пиримидина:
Важную биологическую роль играют гидрокси-
и аминопроизводные пиримидина.
Урацил, тимин и цитозин – нуклеиновые основания; входят в
состав нуклеозидов, нуклеотидов, нуклеиновых кислот. Существуют в таутомерных оксо- и гидроксиформах, переходы между которыми осуществляются за счет миграции протона между кислородом и азотом кольца.Слайд 37 Наиболее стабильными являются оксо-форма для цитозина и диоксо-формы
для урацила и тимина.
Оксо-формы нуклеиновых оснований образуют прочные межмолекулярные
водородные связи.Ассоциация такого типа играет
важную роль в формировании
структуры ДНК.
Барбитуровая кислота и ее производные – барбитураты (веронал, люминал) – снотворные и противосудорожные средства.
Тиамин (витамин В1) содержит два гетероцикла – пиримидин и тиазол.
Тиамин является предшественником кофермента кокарбоксилазы, принимающего участие в декарбоксилировании
a -кетокислот и синтезе кофермента А.
Слайд 38
Пурин
Пурин – ароматическое гетероциклическое соединение, содержащее конденсированные пиримидиновый
и имидазольный циклы.
Пурин, подобно имидазолу, существует в виде двух
таутомерных форм. Более стабильной является форма с атомом водорода в положении 7.Пурин является амфотерным соединением и образует соли с сильными кислотами (по атому азота имидазольного цикла) и щелочными металлами (по NH-группе). При действии алкилирующих реагентов (метилиодид, диметилсульфат) дает 9-N-алкилпроизводные. Реакции замещения у атомов углерода ароматического кольца характерны только для замещенных пуринов.
Слайд 39
Биологически активные производные пурина:
Важную биологическую роль играют гидрокси-
и аминопроизводные пурина.
Аденин и гуанин - нуклеиновые основания; входят в
состав нуклеозидов, нуклеотидов, в том числе нуклеотидных коферментов, нуклеиновых кислот.Слайд 40 Для аденина известны две таутомерные формы, являющиеся результатом
миграции протона между атомами азота имидазольного цикла. У гуанина,
кроме того, существуют таутомерные гидрокси- и оксоформы.Стабильными таутомерными формами гуанина являются оксо-формы.
Гидроксипурины – гипоксантин, ксантин, мочевая кислота – продукты метаболизма пуриновых оснований.
Слайд 41 Для них, как и для гуанина, характерны таутомерные
превращения между гидрокси- и оксо-формами. Наиболее стабильными являются оксо-формы.
Мочевая
кислота – конечный продукт метаболизма пуриновых соединений в организме. Она выделяется с мочой. Соли мочевой кислоты – ураты – откладываются в суставах при подагре, а также в виде почечных камней.In vitro аденин и гуанин могут быть превращены соответственно в гипоксантин и ксантин дезаминированием под действием азотистой кислоты.
Слайд 42 Такие превращения пуриновых оснований в составе нуклеиновых кислот
приводят к мутациям.
Пуриновые алкалоиды – кофеин, теофиллин, теобромин – метилированные по
азоту производные ксантина; содержатся в чае, кофе, какао-бобах.Кофеин – эффективное средство, возбуждающее центральную нервную систему и стимулирующее работу сердца. Теофиллин и теобромин менее эффективны, однако обладают сильными мочегонными свойствами.





























