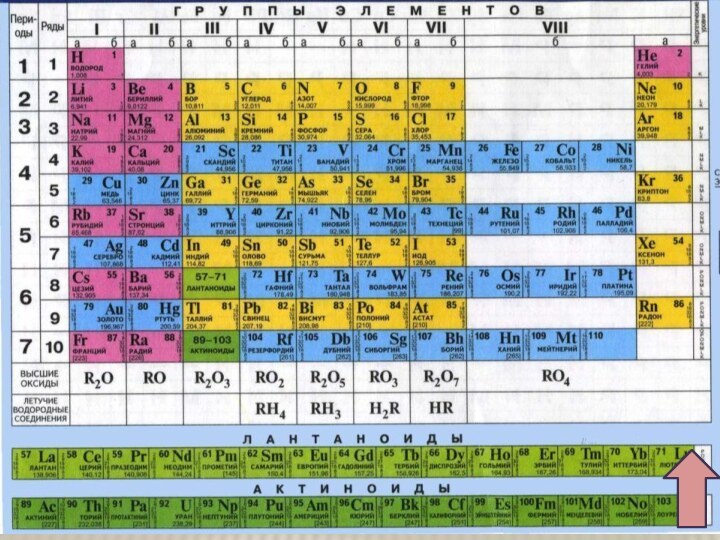
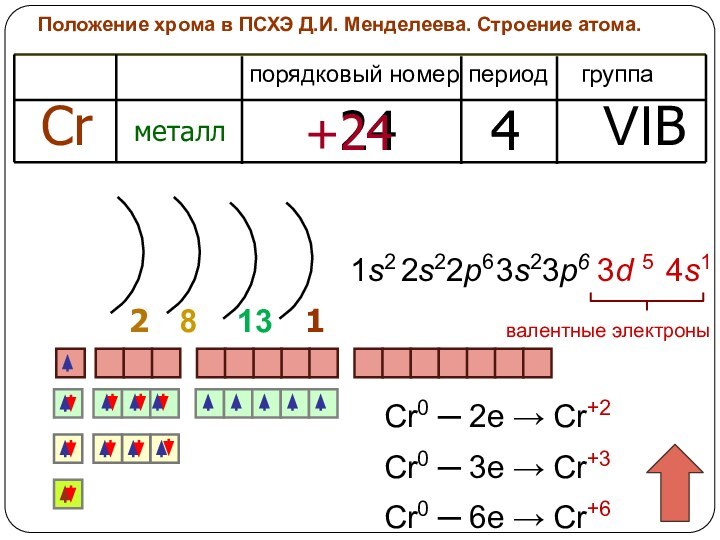
хрома в периодической системе
химических элементов Д.И.Менделеева
2. Строение атома.
III.Хром
– простое вещество3. Нахождение в природе
1. Состав. Физические свойства.
2. Получение.
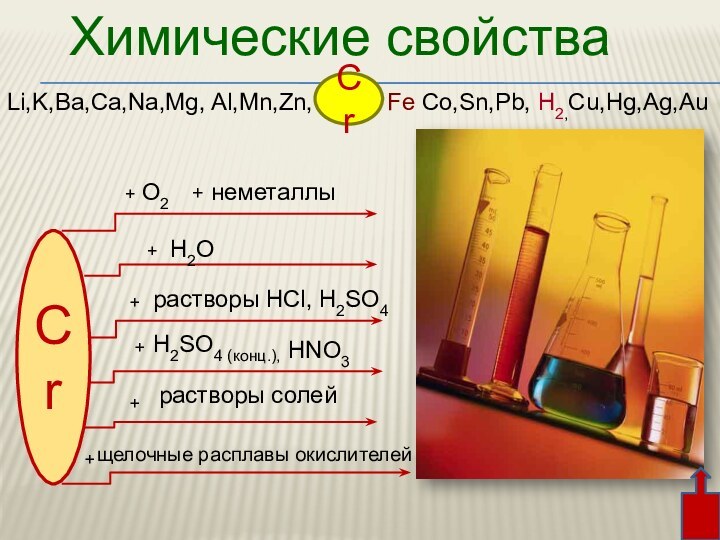
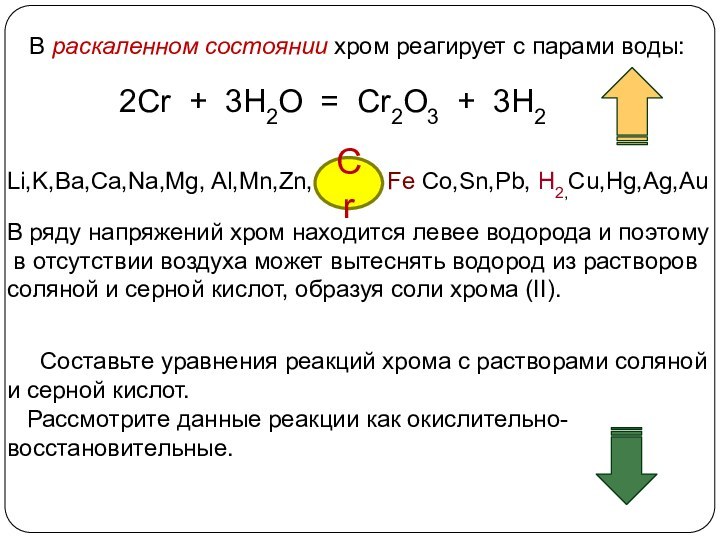
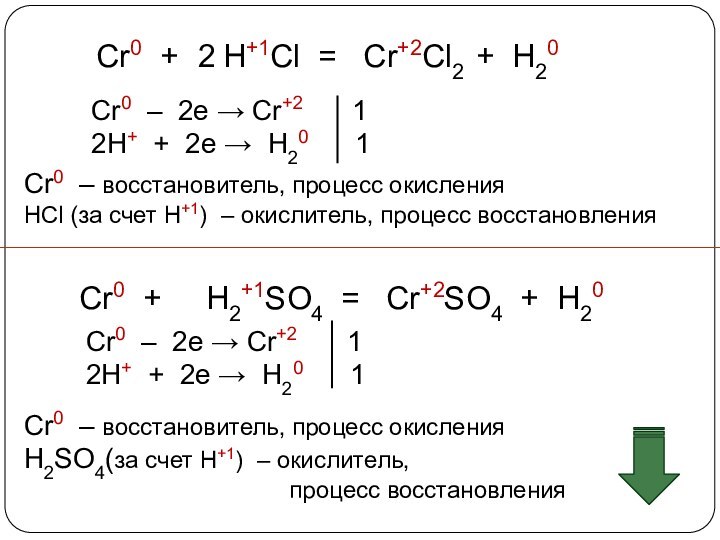
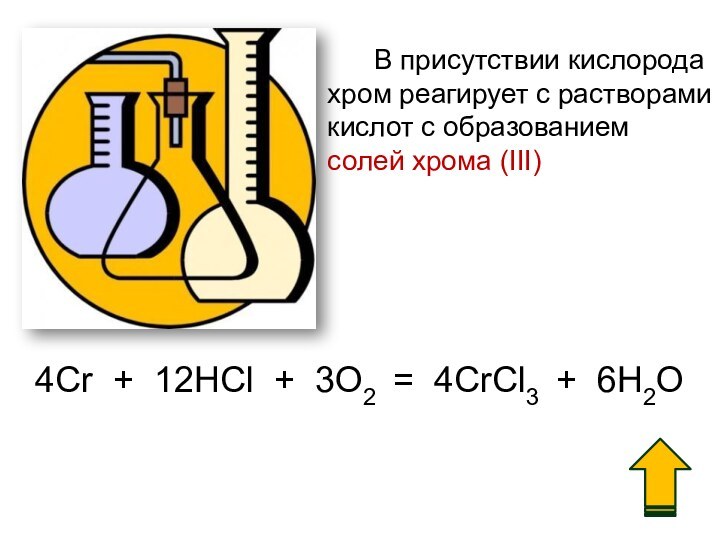
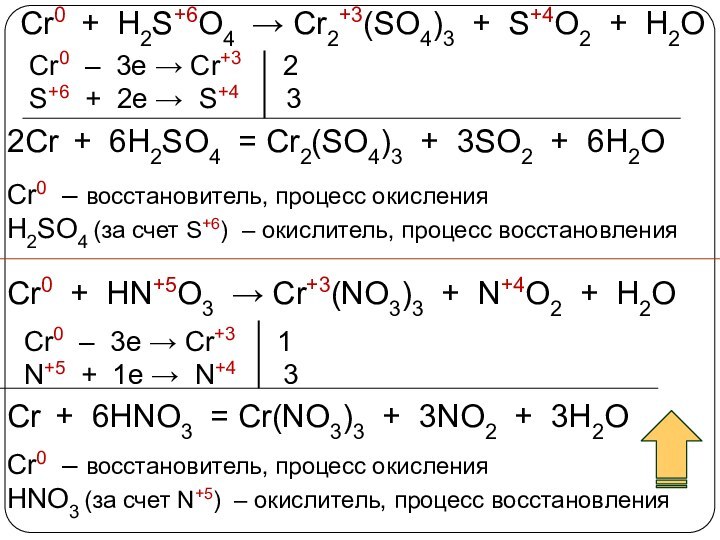
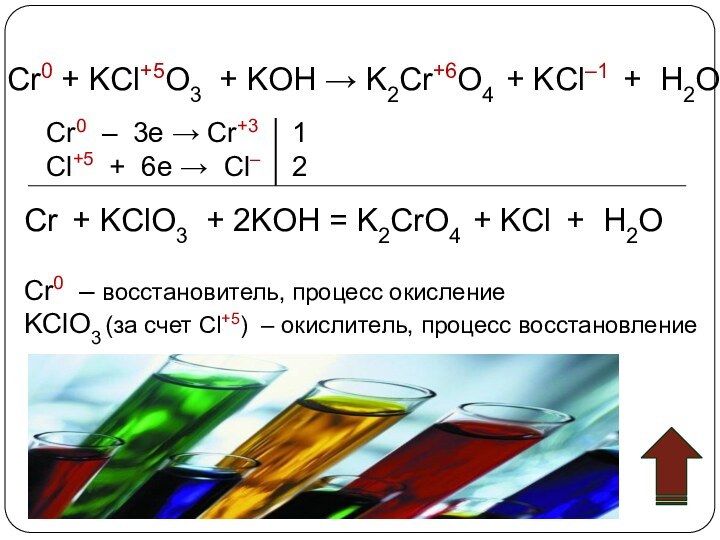
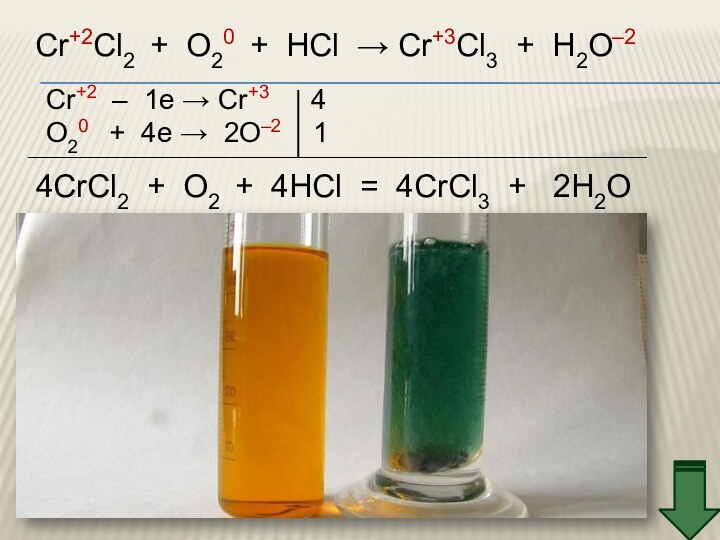
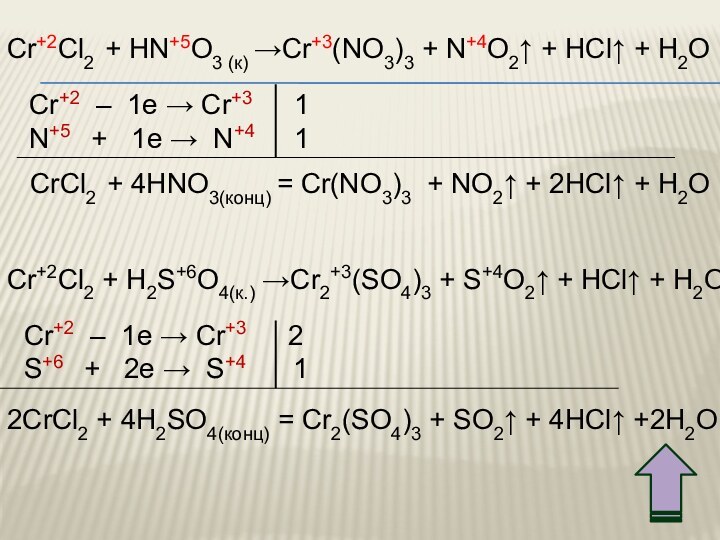
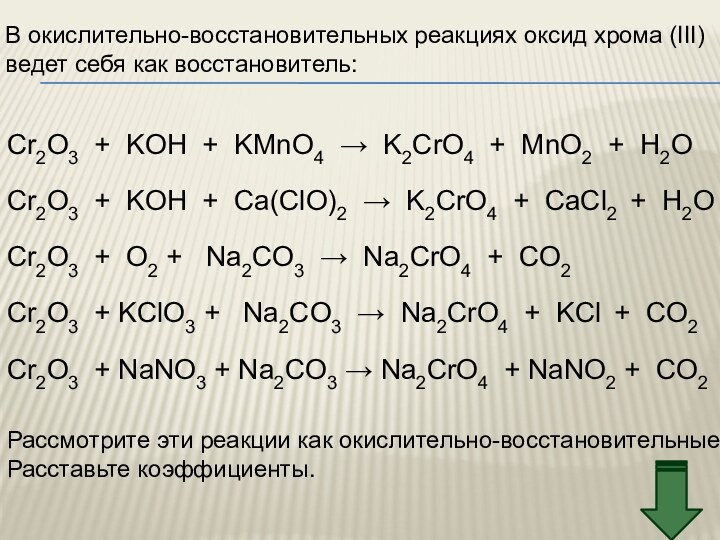
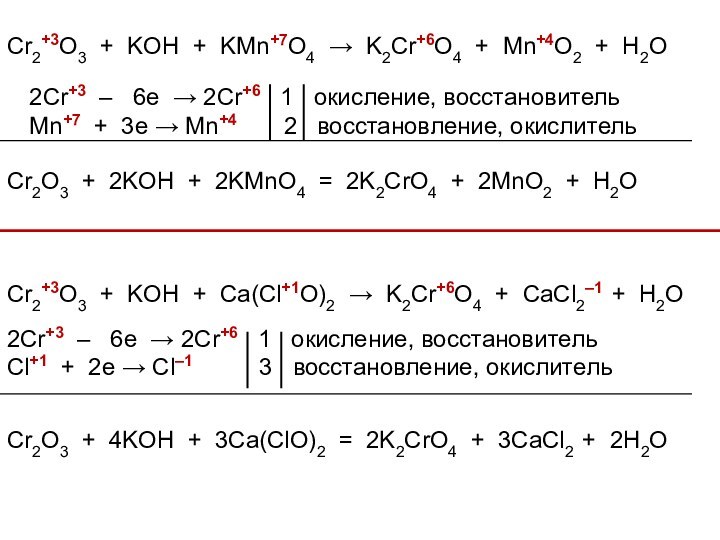
3. Химические свойства
4. Биологическая роль и физиологическое действие.
5. Применение
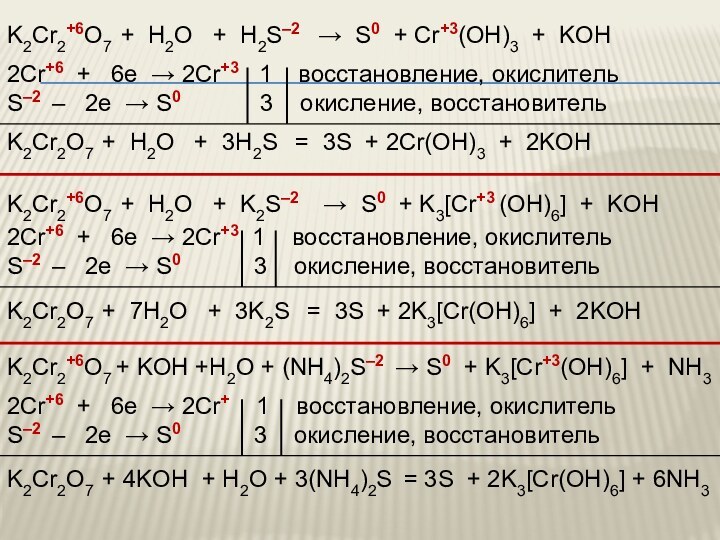
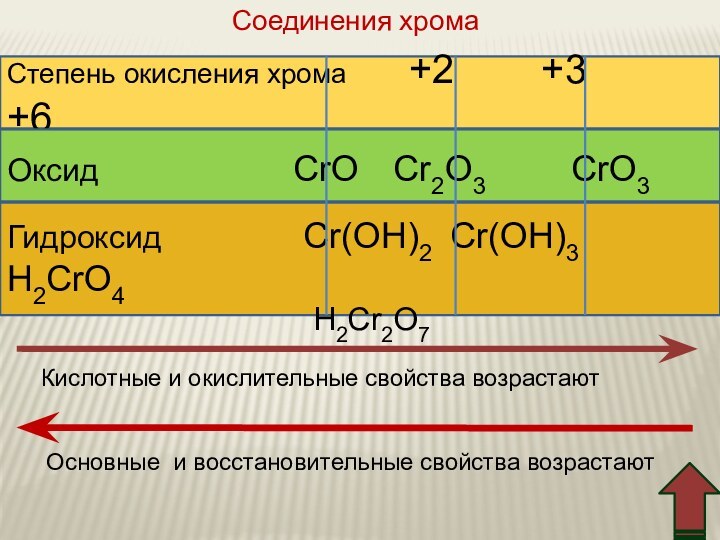
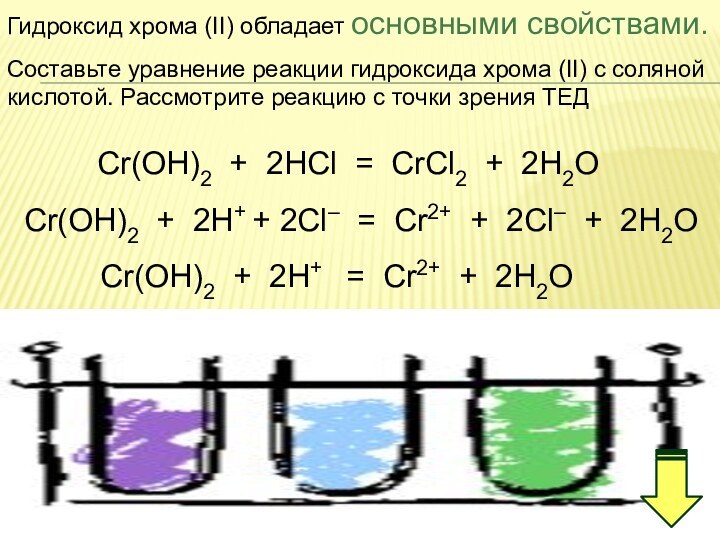
IV. Соединения хрома

































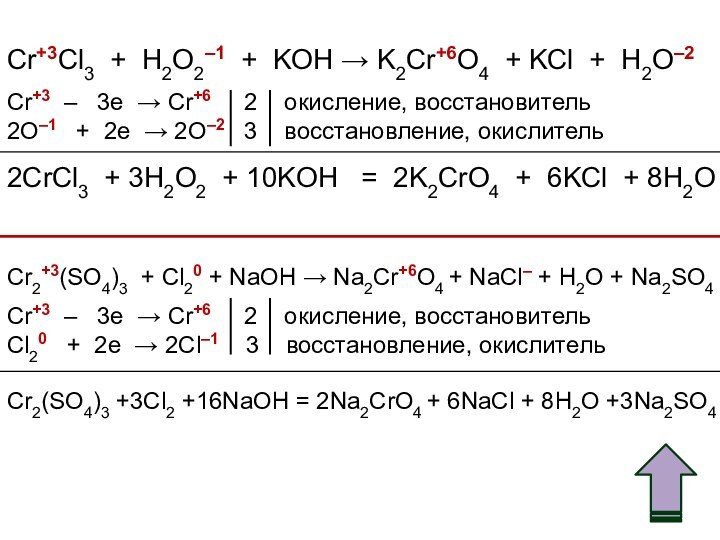
![Хром (Cr) Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]Cr(OH)3 + 3Na+ + 3OH– = 3Na+ +](/img/tmb/11/1074006/354b44c02eca6f84eabdc8b3d5056cfa-720x.jpg)



![Хром (Cr) K3[Cr+3(OH)6] + Br20 + KOH → K2Cr+6O4 + KBr– + H2O Cr+3](/img/tmb/11/1074006/c34ec794630a0a42005872b0fe43cc2f-720x.jpg)



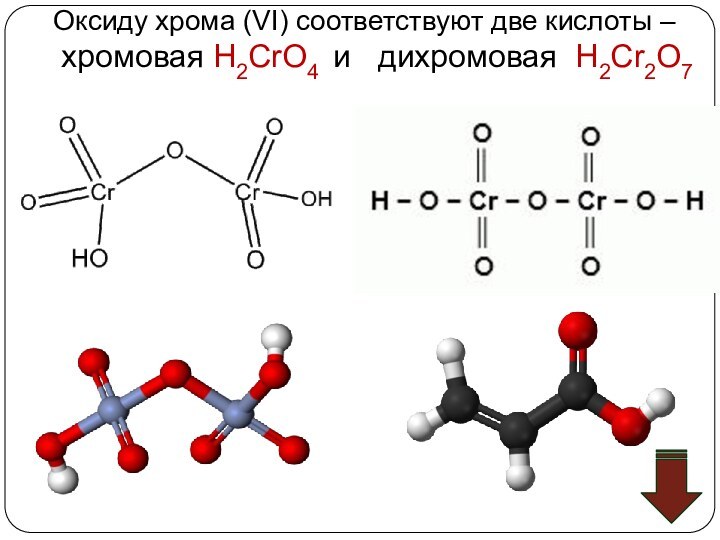

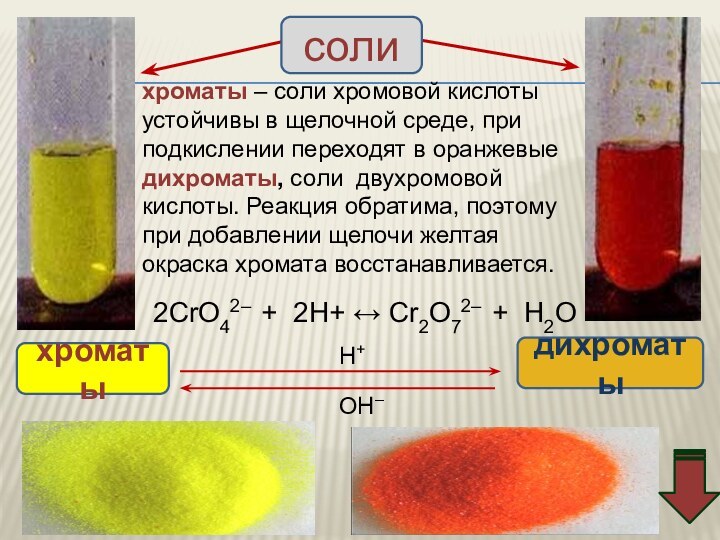



![Хром (Cr) Соединения хрома (VI) – сильные окислители Cr2O72–Cr3+Cr(OH)3[Cr(OH)6]3–H+H2OOH–Cr2O72– + 14H+ +](/img/tmb/11/1074006/ad7f9f0c67e33ce32619548a9d839a48-720x.jpg)