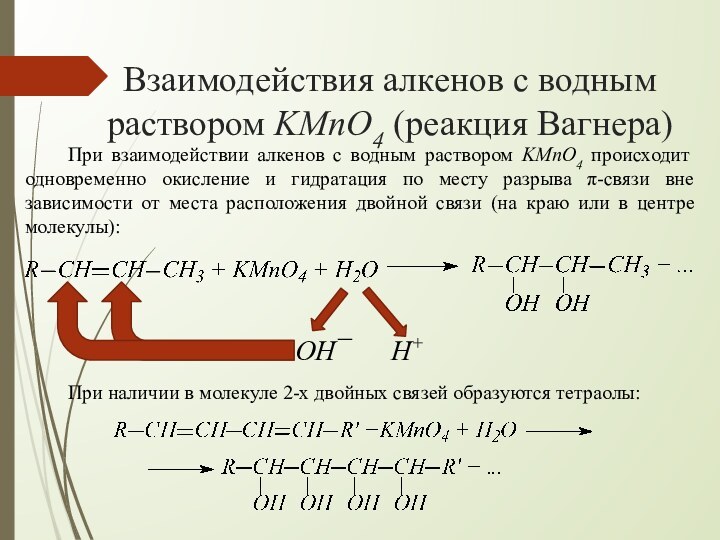
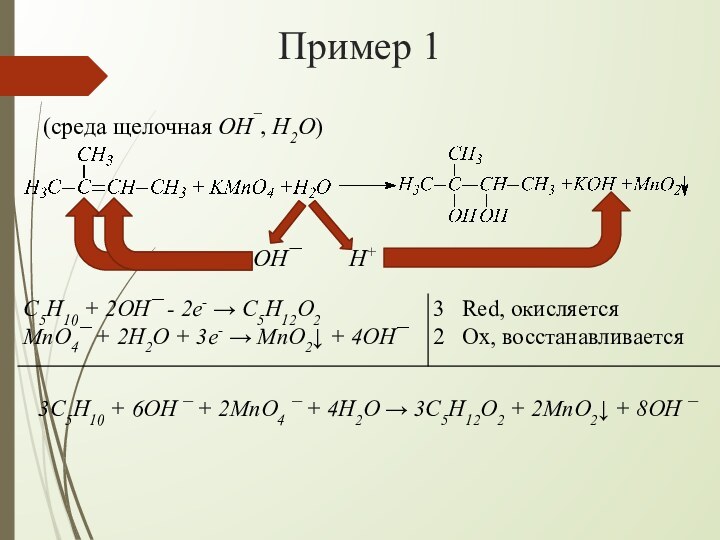
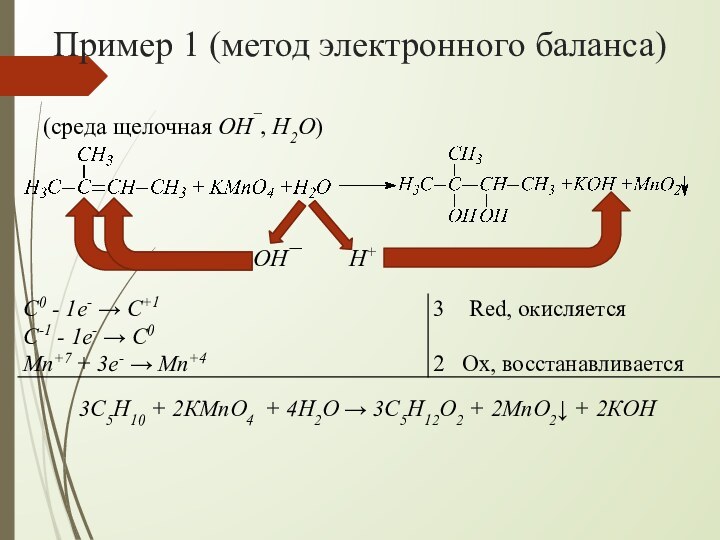
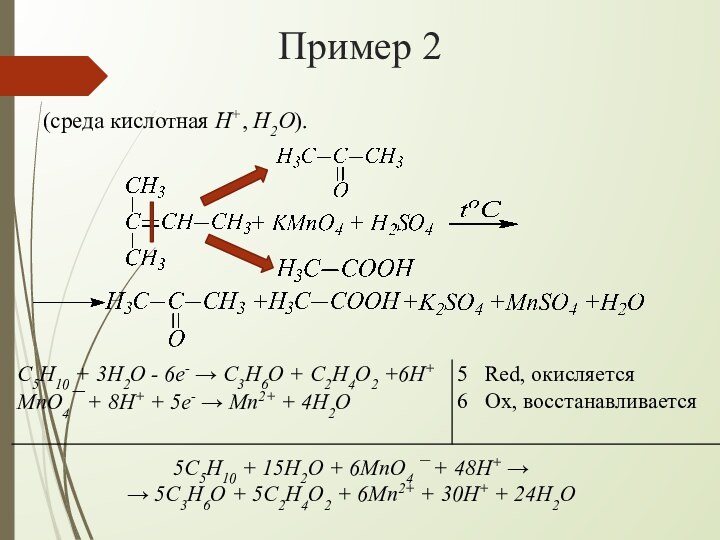
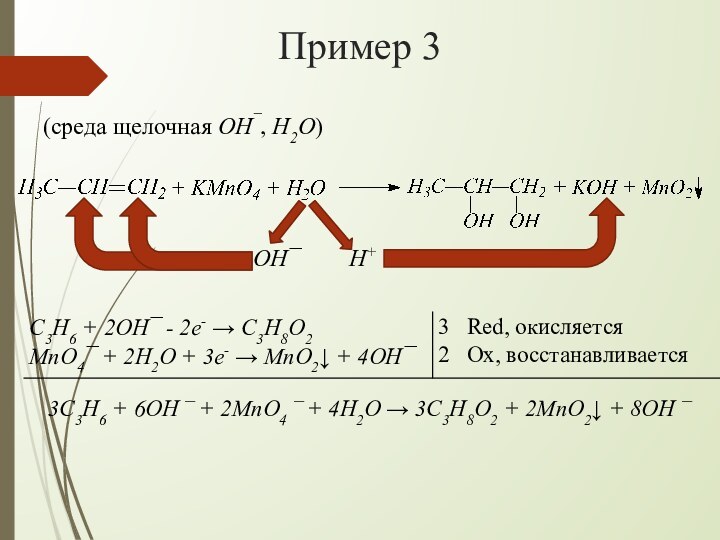
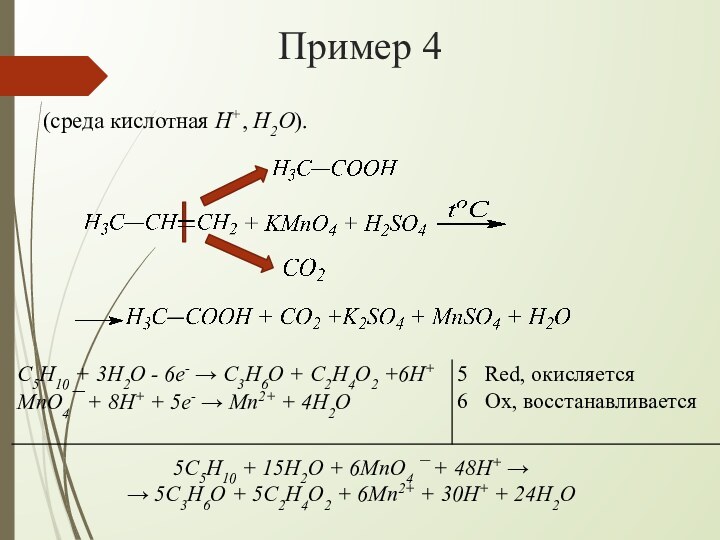
взаимодействии алкенов с водным раствором KMnO4 происходит одновременно окисление
и гидратация по месту разрыва π-связи вне зависимости от места расположения двойной связи (на краю или в центре молекулы):При наличии в молекуле 2-х двойных связей образуются тетраолы:
H+
OH¯