- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
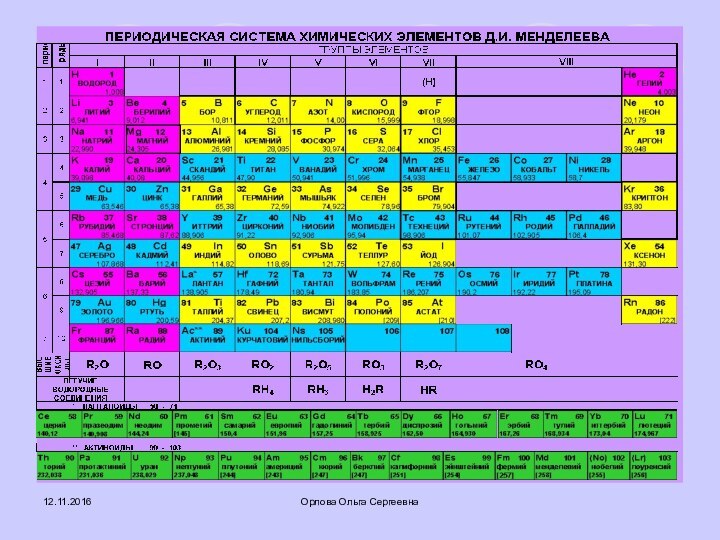
Презентация на тему Периодическая система химических элементов в Power Point
Содержание
- 2. Орлова Ольга Сергеевна
- 3. Орлова Ольга Сергеевна33IIIIIIIVГруппы элементов112VVIVIIVIII2ПериодыРяды456745678910Mg+12240
- 4. Орлова Ольга Сергеевна1. Электронное строение2. Физические свойства3. Химические свойства4. Применение5. Проверка знанийМагний
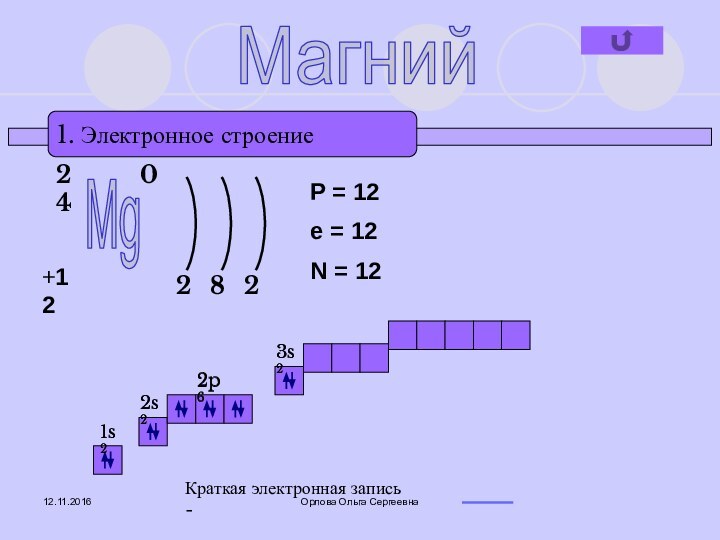
- 5. Орлова Ольга Сергеевна1. Электронное строениеMg+12240282P = 12e = 12N = 121s22s22p63s2Краткая электронная запись -1s22s22p63s2Магний
- 6. Орлова Ольга Сергеевна2.Физические свойстваМагниймягкий пластичный ковкий.В 1,5 раза легче алюминия
- 7. Орлова Ольга Сергеевна2.Физические свойстваМагнийМагний – серебристо-белый блестящий
- 8. Орлова Ольга Сергеевна3.Химические свойстваМагний2Mg(к) + O2(г) =
- 9. Орлова Ольга Сергеевна3.Химические свойстваМагнийВ обычных условиях магний
- 10. Орлова Ольга Сергеевна3.Химические свойстваМагнийПри действии водорода под
- 11. Орлова Ольга Сергеевна3.Химические свойстваМагнийОксидная пленка на поверхности
- 12. Орлова Ольга Сергеевна3.Химические свойстваМагнийХолодные концентрированные азотная и
- 13. Орлова Ольга Сергеевна4.ПрименениеМагнийОсобенно широко применяют сплавы магния
- 14. Скачать презентацию
- 15. Похожие презентации
Орлова Ольга Сергеевна











Слайд 3
Орлова Ольга Сергеевна
3
3
I
II
III
IV
Группы элементов
1
1
2
V
VI
VII
VIII
2
Периоды
Ряды
4
5
6
7
4
5
6
7
8
9
10
Mg
+12
24
0
Слайд 5
Орлова Ольга Сергеевна
1. Электронное строение
Mg
+12
24
0
2
8
2
P = 12
e =
12
N = 12
1s2
2s2
2p6
3s2
Краткая электронная запись -
1s2
2s2
2p6
3s2
Магний
Слайд 6
Орлова Ольга Сергеевна
2.Физические свойства
Магний
мягкий
пластичный
ковкий.
В 1,5 раза
легче алюминия
Слайд 7
Орлова Ольга Сергеевна
2.Физические свойства
Магний
Магний – серебристо-белый блестящий металл,
сравнительно мягкий, пластичный и ковкий. Его прочность и твердость
минимальны по распространенности для литых образцов, выше – для прессованных. Он почти в 5 раз легче меди, в 4,5 раза легче железа; даже «крылатый» алюминий в 1,5 раза тяжелее магния. Температура плавления магния сравнительно невысока— всего 650°С, но в обычных условиях расплавить магний довольно трудно: нагретый на воздухе до 550 °С, он вспыхивает и мгновенно сгорает ослепительно ярким пламенем (это свойство магния широко используют в пиротехнике).
Слайд 8
Орлова Ольга Сергеевна
3.Химические свойства
Магний
2Mg(к) + O2(г) = 2MgO(к)
3Mg(к)
+ N2(т) = Mg3N2(к)
Mg + 2H2O = Mg(OH)2 +
H22Mg + CO2 = 2MgO + C
Mg + 2NH4Cl = MgCl2 + 2NH3– + H2
Mg + 2H3O+ = Mg2+ + H2 + 2H2O
Mg + Br2 = MgBr2
Mg + S = MgS
Слайд 9
Орлова Ольга Сергеевна
3.Химические свойства
Магний
В обычных условиях магний устойчив
к окислению за счет образования прочной оксидной пленки. Вместе
с тем он активно реагирует с большинством неметаллов, особенно при нагревании. Магний воспламеняется в присутствии галогенов (при наличии влаги), образуя соответствующие галогениды, и горит ослепительно ярким пламенем на воздухе, превращаясь в оксид MgO и нитрид Mg3N2:2Mg(к) + O2(г) = 2MgO(к)
3Mg(к) + N2(т) = Mg3N2(к)
Слайд 10
Орлова Ольга Сергеевна
3.Химические свойства
Магний
При действии водорода под давлением
200 атм при 150° С магний образует гидрид MgH2
. С холодной водой магний не реагирует, но из кипящей воды вытесняет водород и образует гидроксид Mg(OH)2:Mg + 2H2O = Mg(OH)2 + H2
Если ленту магния поджечь и опустить в стакан с водой, то горение металла продолжается. При этом выделяющийся при взаимодействии магния с водой водород немедленно загорается на воздухе. Горение магния продолжается и в атмосфере углекислого газа:
2Mg + CO2 = 2MgO + C
Слайд 11
Орлова Ольга Сергеевна
3.Химические свойства
Магний
Оксидная пленка на поверхности магния
не устойчива в слабокислотной среде, поэтому магний разрушается под
действием горячего концентрированного раствора хлорида аммония:Mg + 2NH4Cl = MgCl2 + 2NH3– + H2
При действии водяного пара продуктами являются оксид или гидроксид магния и водород.
Магний легко реагирует с кислотами, давая соответствующие соли:
Mg + 2H3O+ = Mg2+ + H2 + 2H2O
Слайд 12
Орлова Ольга Сергеевна
3.Химические свойства
Магний
Холодные концентрированные азотная и серная
кислоты пассивируют магний. Он устойчив также к действию фтороводорода
и фтороводородной кислоты благодаря образованию защитной пленки фторида магния.Аммиак взаимодействует с магнием при повышенной температуре с образованием нитрида магния. Метанол реагирует с магнием при 200° С с образованием метилата магния Mg(OMe)2, а этанол (активированный следовыми количествами иода) взаимодействует подобным образом уже при комнатной температуре. Алкил- и арилгалогениды RX вступают в реакцию с магнием с образованием реактивов Гриньяра RMgX.Металлический магний при комнатной температуре реагирует с галогенами, например, с бромом:Mg + Br2 = MgBr2
При нагревании магний вступает во взаимодействие с серой, давая сульфид магния:
Mg + S = MgS