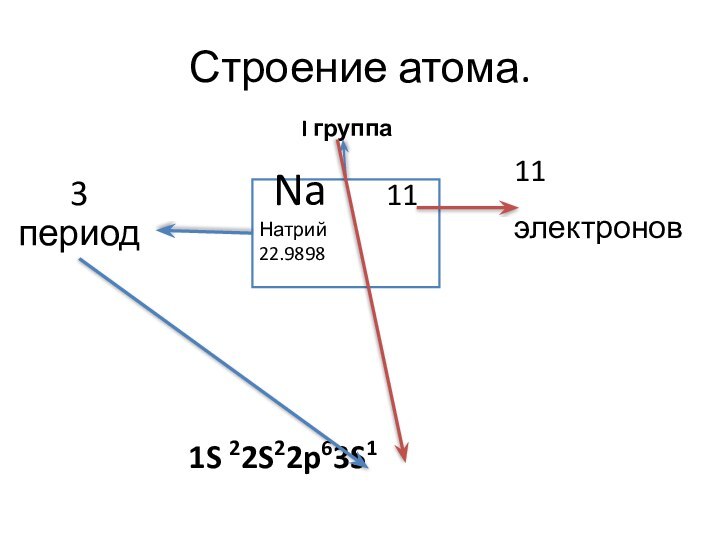
I группа
Na
11Натрий 22.9898
3 период
11 электронов
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть

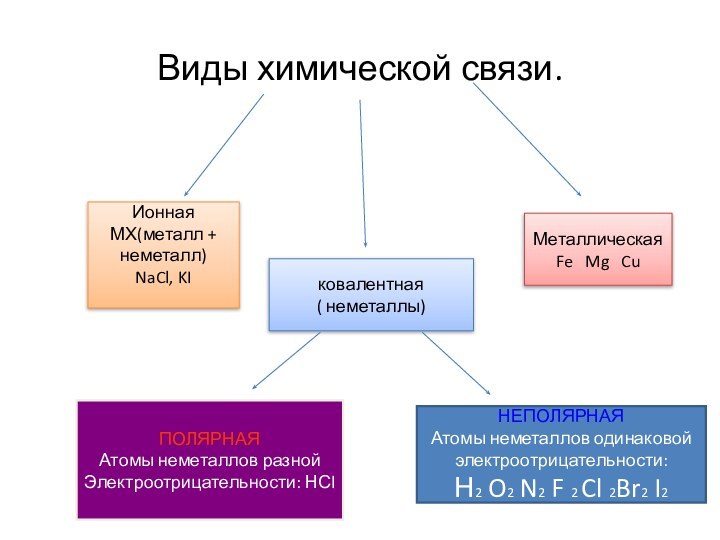

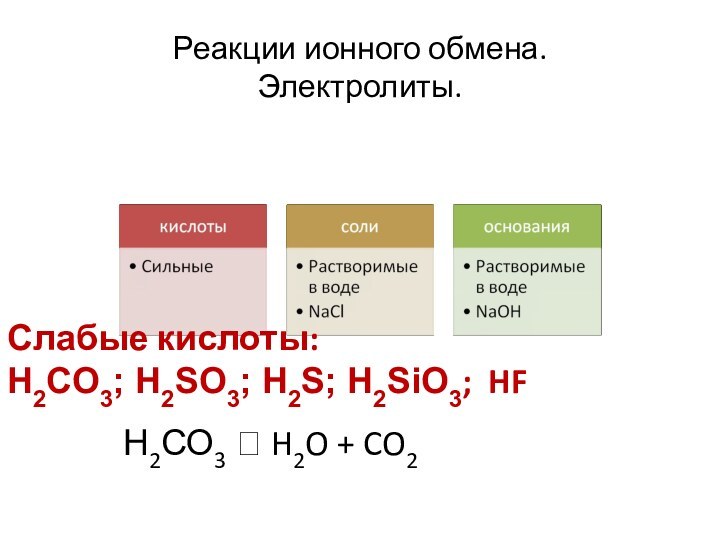
Металлическая
Fe Mg Cu
2. Разложение.
2HgO ? Hg + O2 – ОВР
Cu(OH)2 ? CuO + H2O
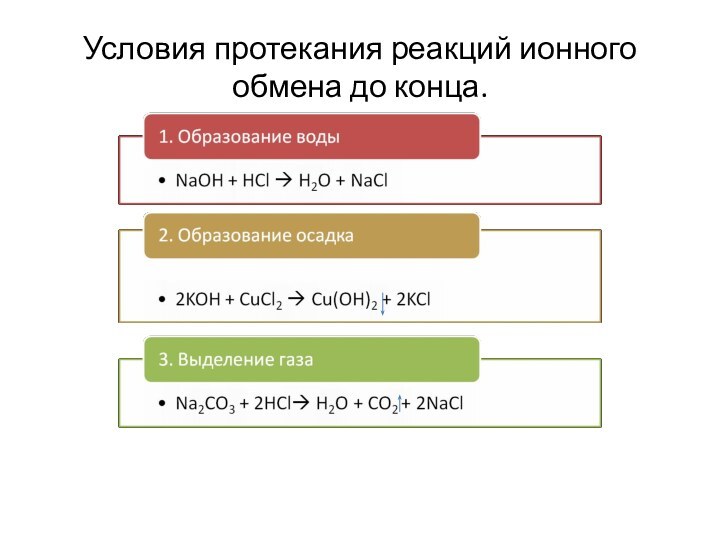
4. Обмен.
НCl + NaOH ? NaCl +H2O- нейтрализация