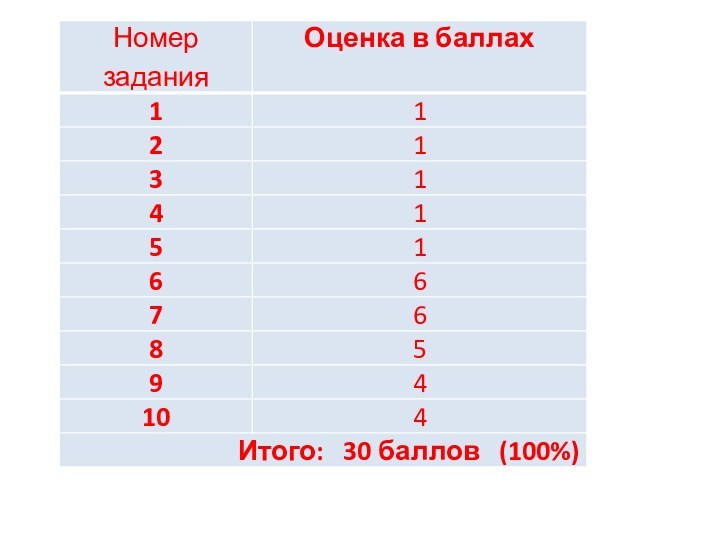
Слайд 2
20.01.2016. Начало экзамена – 10:00
143 гр. – 338
каб.
146 гр. -- 340 каб.
144 гр. – 339а каб.
147
гр. – 343 каб.
145 гр. – 339б каб.
Слайд 3
21.01.2016. начало экзамена – 10:00
148 гр. – 338
каб.
151 гр. -- 340 каб.
149 гр. – 339а каб.
152
гр. – 343 каб.
150 гр. – 339б каб.
Слайд 6
1. Согласно протонной теории Бренстеда -Лоури амфолиты- это
протолиты:
не способные отдавать или принимать протон
2. способные только отдавать
протон
3. способные только принимать протон
4. способные как принимать, так и отдавать протон
Слайд 7
2. Потенциал водородного электрода, опущенного в жидкую фазу
раствора НСl с концентрацией 1 моль·дм-3 составляет
0 В
3. 0,48В
2. -0,48В
4. -0,0059В
Слайд 8
3. В соответствии с законом Генри на растворимость
газов в жидкостях оказывает влияние
1. давление
2. присутствие электролитов в растворе
3. Температура
4. природа компонентов
Слайд 9
4. В коллоидном растворе, полученном при взаимодействии хлорида
бария с избытком серной кислоты, потенциалопределяющим ионом является …
1.
сульфат-ион
2. ион водорода
3. силикат-ион
4. ион калия
Слайд 10
5. Определите заряд и назовите комплексное соединение:
[Ni2+(Вr)4 (NH3)2]x
1. -3; диамминотетрабромоникель (II)
2. -2; диамминтетрабромникель (II)
3.
-2; диамминтетрабромоникелат (II)
4. -1; диамминтетрабромоникелат (II)
Слайд 11
6. Задача 1. Какова массовая доля (%) пероксида
водорода в растворе, применяемом наружно как кровоостанавливающее и дезинфицирующее
средство, если молярная концентрация этого раствора составляет 0,89 моль/дм3, плотность раствора 1 г/см3?
Слайд 12
Задача 2. Определите молярную концентрацию эквивалента раствора гептагидрата
сульфата магния MgSO4 · 7Н2О, применяемого внутривенно для снижения
давления крови, если массовая доля соли в растворе составляет 20 %, плотность раствора 1,22 г/см3.
Слайд 13
Задача 3.Рассчитать молярную концентрацию эквивалента раствора нитрита натрия,
содержащего 13,8 г соли в 200 см3 раствора. Какой
объем раствора перманганата калия с молярной концентрацией эквивалента 0,5 моль/дм3 потребуется на титрование 10 см3 исходного раствора нитрита натрия?
Слайд 14
Задача 4. Определите титр раствора натрия гидроксида, если
на тирование 5 см3 его раствора израсходовано 5,4 см3
раствора Н2SO4, с молярной концентрацией эквивалента С(½ Н2SO4) = 0,5 моль/дм3.
Слайд 15
7. Рассчитать калорийность булки хлеба «Бородинский» массой 450
г, если его стограммовый кусочек содержит 7,4 г белков,
57,1 г углеводов и 1,2 г жиров. Коэффициенты калорийности брать по нижней границе.
2. Рассчитать калорийность булки хлеба «Бородинский» массой 450 г:
К = (mб ·16,5 + mу · 16,5 + mж · 37,7) кДж
К = 33,3 · 16,5 + 256,95 · 16,5 + 5,4 · 37,7 = 4992,705 кДж
Ответ: К = 4992,705 кДж.
Слайд 16
Задача 6. Определить изменение энтальпии химической реакции:
2С2Н5ОН(ж) →
С2Н5-О-С2Н5(ж) + Н2О(ж) , используя следующие данные:
ΔН0сгор С2Н5ОН(ж)
= –1370,00 кДж·моль-1
Δ Н0сгор С2Н5ОС2Н(ж) = –2720,04 кДж·моль-1
Δ Н0сгор Н2О(ж) = 0 кДж·моль-1
Решение:
Поскольку даны энтальпии сгорания реагентов и продуктов, то используя 2-ое следствие из закона Гесса, запишем:
Δ Н0р-я = Σ Δ Н0сгор. реагентов – ΣΔ Н0сгор. продуктов
Применительно к этой реакции:
Δ Н0р-я = 2 Δ Н0сгорС2Н5ОН(ж) – ΔН0сгорС2Н5ОС2Н5(ж) = 2 · (–1370,00) – (–2720,04) =
-2740,00 + 2720,04 = –19,96 кДж·моль-1.
Ответ: Δ Н0р-я = –19,96 кДж·моль-1.
Слайд 18
Задача 7. Вычислить осмотическое давление раствора неэлектролита, в
2 дм3 которого содержится 0,25 моль вещества при 200С.
Дано:
Решение:
n(Х)
Vр-ра = 2 дм3 = 2·10-3 м3 π = C(x)·R·T или π = --------- RT
n = 0,25 моль V
T = 293К π = (0,25 ׃ 2·10-3) · 8,314 · 293 = 3,045·105 Па =
R = 8,314 Дж·моль-1·К-1 = 304,5 кПа
π - ? Ответ: π = 3,045 · 105 Па.
Слайд 19
Задача . Вычислить массу рибозы С5Н10О5, содержащуюся в
4 дм3 раствора при 270С, если осмотическое давление раствора
рибозы составляет 84802,8 Па.
Слайд 20
Задача . Рассчитать рН раствора соляной кислоты с
молярной концентрацией вещества в растворе С(НСl) = 0,001 моль·дм-3.
Дано: Решение:
С(HCl)
= 0,001 моль·дм-3 HCl « H+ + Cl-, т.к. a = 1, то
[H+] = [HCl] = 10-3 моль·дм-3
рН - ? pH = -lg [H+]
pH = -lg10-3 = 3
Ответ: pH = 3.
Задача 2. Рассчитать pH раствора гидроксида калия с молярной концентрацией вещества в растворе C(KOH) = 1,5·10-2 моль·дм-3.
Дано: Решение:
С(KOH) = 1,5·10-2 моль·дм-3 KOH « K+ + OH-, т.к. a = 1, то
[OH-] = [KOH] = 1,5·10-2 моль·дм-3
рН -? pOH = –lg[OH-]
pOH = –lg1,5·10-2 = 1,82
pH + pOH = 14 Þ pH = 14 – pOH
pH = 14 – 1,82 = 12,18.
Слайд 21
Задача. pH желудочного сока равен 1,65. Определить концентрации
ионов [H+] и [OH-] в желудочном соке.
Дано: Решение:
pH =
1,65 pH = –lg [H+]
lg [H+] = –pH Þ [H+] = 10–pH
[H+] - ? [H+] = 10–1,65 = 0,0224 моль·дм–3 = 2,24·10–2 моль·дм–3
[OH-] - ? [H+] · [OH-] = 10–14
Ответ:
[H+] = 2,24·10–2 мольˑдм–3; [OH–] = 4,46·10–13 мольˑдм–3 .
Слайд 22
Задача. Рассчитать рН оксалатной буферной системы, состоящей из100
см3 раствора щавелевой кислоты с концентрацией С(1/2 Н2С2О4)=0,5 моль·дм
-3 и 150 см3 растворы оксалата натрия с концентрацией С(1/2 Na2C2O4)=0,25 моль·дм-3,если КД (Н2С2О4)=5,6·10-2.
pH = pKa + lg[соль]/[кислота]
Дано: Решение:
рН=рКД+lgC(1/2H2C2O4)·V(Na2C2O4)/C(1/2H2C2O4)·V(H2C2O4)
V (H2C2O4) = 100см3
С(Na2C2O4) = 0,5 моль·дм– 3 pКд = – lgКд
V(Na2C2O4) = 150 см3 pКд = – lg 5,6·10-2 = 1,25
С(1/2Na2C2O4) = 0,25 моль·дм– 3 рН = 1,25 + lg(0,25·150)/(0,5·100 )= 1,125.
КД (H2C2O4) = 5,6·10– 2
рН-? Ответ: рН = 1,125.
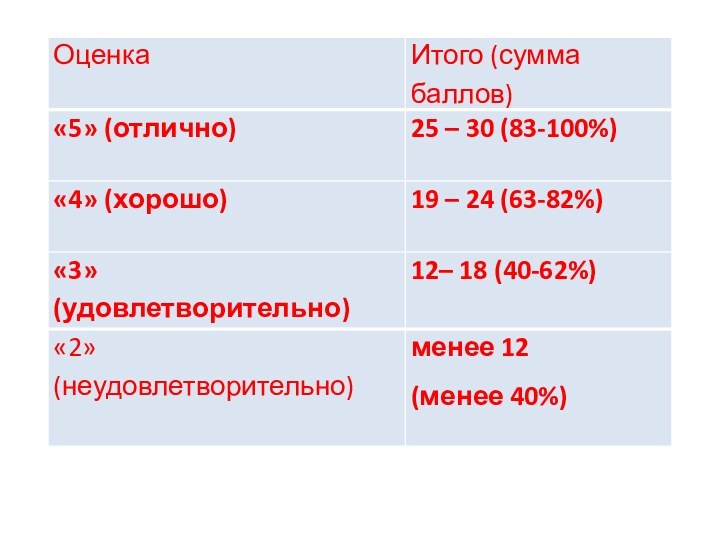
Слайд 23
9. Энтальпия сгорания вещества. Стандартная энтальпия сгорания вещества.
Второе следствие из закона Гесса, формулировка, математическое выражение для
реакции синтеза аммиака.
Слайд 24
10. Оптическая изомерия: энантиомерия. Д,L – система стереохимической
номенклатуры. Написать формулы энанатиомеров 2-гидроксибутаналя, сравнить свойства энантиомеров.
Слайд 25
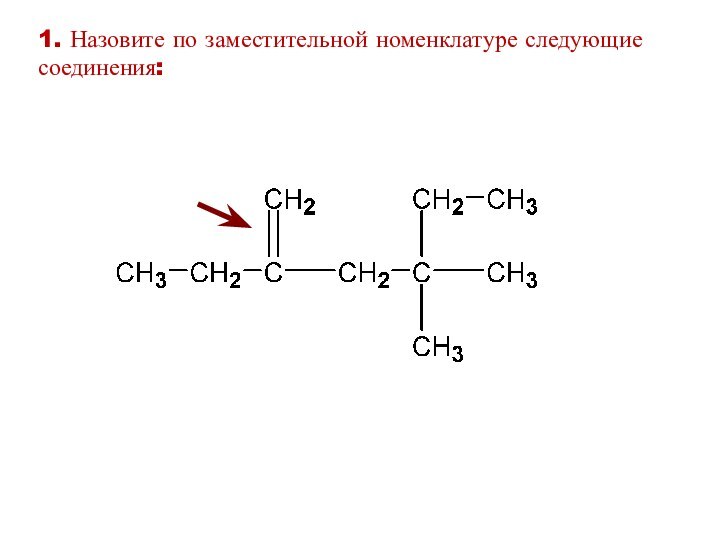
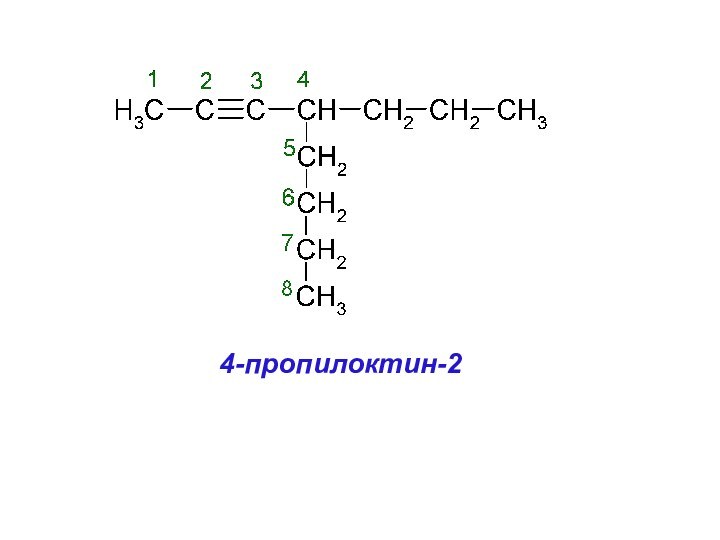
1. Назовите по заместительной номенклатуре следующие соединения:
Слайд 26
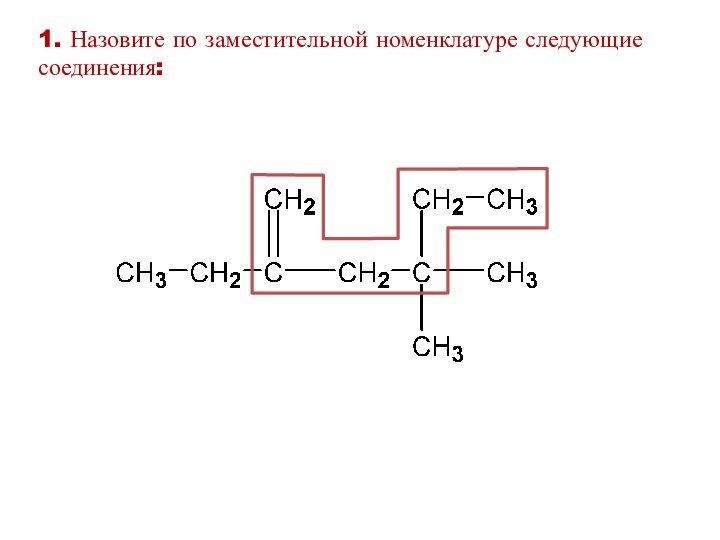
1. Назовите по заместительной номенклатуре следующие соединения:
Слайд 27
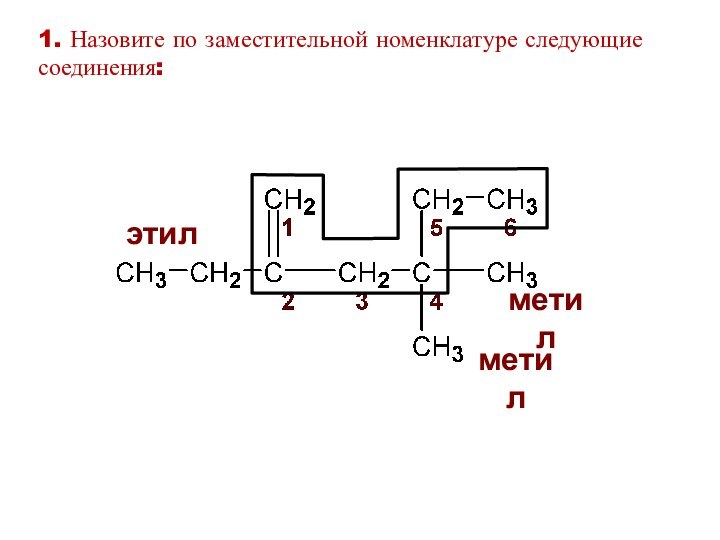
этил
метил
метил
1. Назовите по заместительной номенклатуре следующие соединения:
Слайд 28
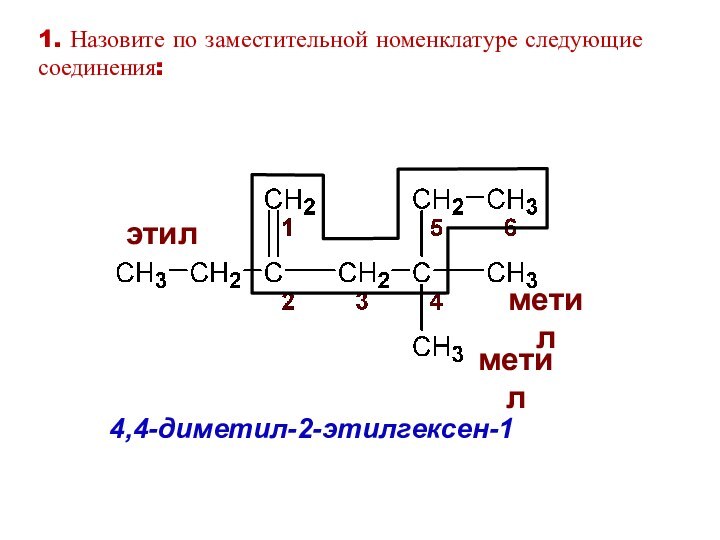
4,4-диметил-2-этилгексен-1
этил
метил
метил
1. Назовите по заместительной номенклатуре следующие соединения:
Слайд 30
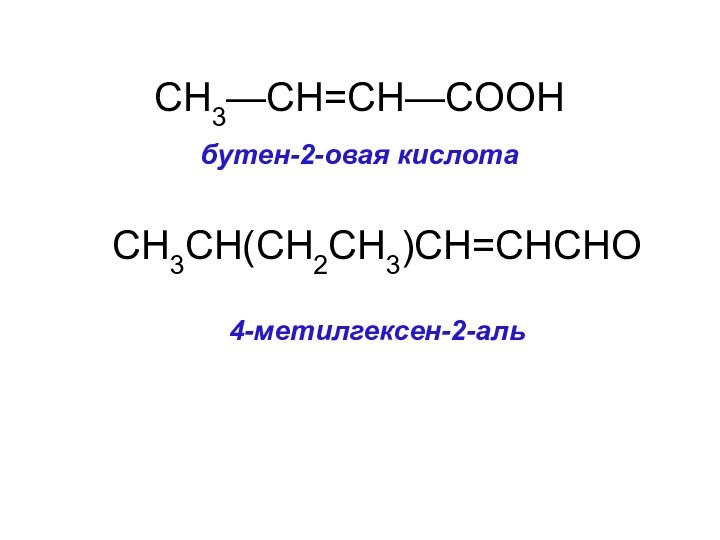
CH3—CH=CH—COOH
бутен-2-овая кислота
CH3CH(CH2CH3)CH=CHCHO
4-метилгексен-2-аль
Слайд 31
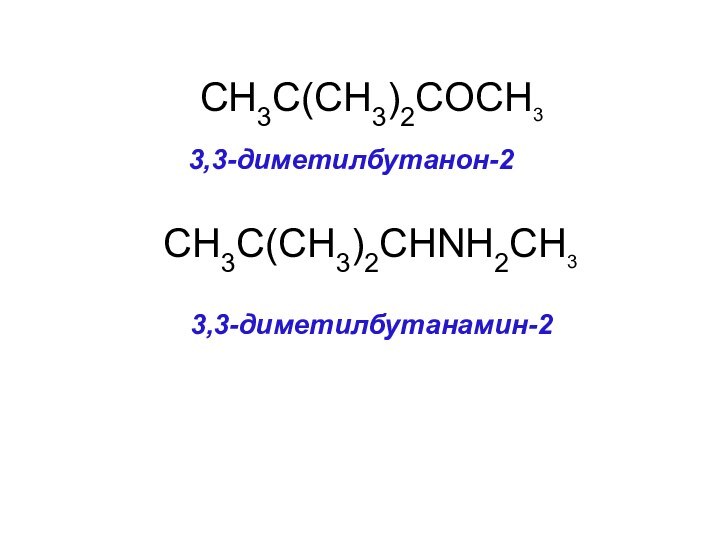
CH3C(CH3)2COCH3
3,3-диметилбутанон-2
CH3C(CH3)2CHNH2CH3
3,3-диметилбутанамин-2
Слайд 32
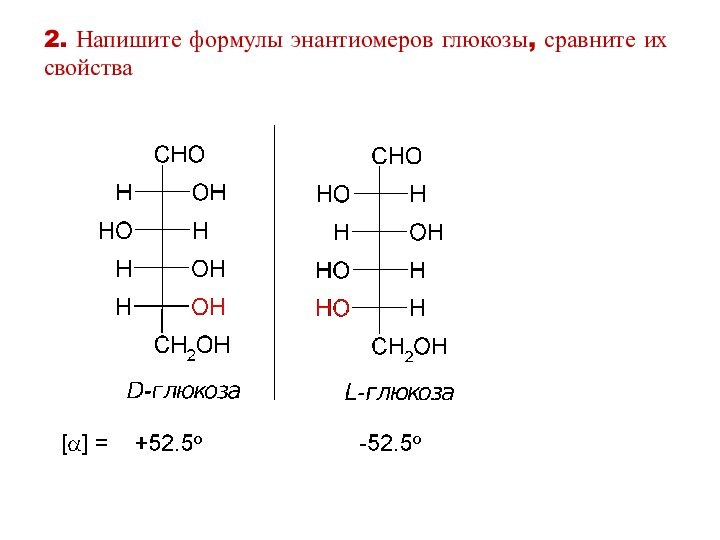
2. Напишите формулы энантиомеров глюкозы, сравните их свойства







![Вопросы и задачи по общей химии и биоорганической химии 5. Определите заряд и назовите комплексное соединение:[Ni2+(Вr)4 (NH3)2]x 1. -3; диамминотетрабромоникель (II)](/img/tmb/14/1398344/5e52038bb0d19c778063ff09f3082300-720x.jpg)










![Вопросы и задачи по общей химии и биоорганической химии Задача. pH желудочного сока равен 1,65. Определить концентрации ионов [H+] и](/img/tmb/14/1398344/020a7043516c6956bbbab9f85666585d-720x.jpg)