- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентации по Химии

Сероводоро́д, сернистый водород Н2S Сероводоро́д, сернистый водород Н2SОбщиеСистематическое наименование сероводород / hydrogen sulphideХимическая формула H2SОтн. молек. МассаОтн. молек. Масса 34.082 а. е. м.Молярная массаМолярная масса34.082 г/мольФизические свойстваСостояниеСостояние (ст. усл.)бесцветный газПлотность1.5392 г/л г/см³Термические свойстваТемпература плавления-82.30 °CТемпература кипения-60.28 °CРастворимость в воде0.25 (40 °C) г/100 мл

Теории кислот и основанийЭлектролитическая теория С.АррениусаПротолитическая теория Бренстеда - Лоури (кислота – донор протона, основание – акцептор протона)Теория Г. Льюиса (кислота -акцептор пары электронов, основание донор пары электронов). Протолитическая теория Бренстеда - ЛоуриНА ↔ Н+ + А-

План1. Протолитическая теория кислот и оснований. Типы протолитов.2. Протолитические равновесия в воде, шкала рН.3. Сила кислот и оснований, константы кислотности и основности.4. Вычисления рН и рОН в водных растворах.5. Протолитическое равновесие в неводных растворителях. Константа автопротолиза.6. Гидролиз.7. Протолитическое равновесие в буферных

Общая характеристика р-элементовК р-блоку относят 30 элементов IIIА – VIIIА-групп периодической системыВ периодах возрастает энергия ионизации, неметаллические и окислительные свойства, электроотрицательностьВ группах усиливаются металлические свойстваВсе р-элементы и в особенности р-элементы 2 и 3 периодов (С, N, P, O, S, Si,

Теплота сгорания топлива Количество теплоты, выделяющееся при полном сгорании 1 кг твердого или жидкого или 1 м3 газообразного топлива. Теплоту сгорания называют также теплотворной способностью топлива. Высшая теплота сгорания топлива – это максимальное количество теплоты, которое можно получить в результате химической

КАРБОНОВІ КИСЛОТИОрганічні речовини, молекули яких містять одну або кілька карбоксильних груп.ООНR-СкарбоксильнагрупаЗАГАЛЬНА ФОРМУЛА КАРБОНОВІ КИСЛОТИОдноосновні карбонові кислоти містять одну карбоксильну групу.ООНR-СООНСН3-СООНСН3-СН2-СООНН-СЗагальна ФОРМУЛАметанова кислота(мурашина)етанова кислота(оцтова)Пропанова кислота(оцтова)
1. Історія вчення про ферменти. 2. Хімічна природа ферментів. 3. Фізико-хімічна характеристика ферментів. 4. Механізм дії ферментів. 5. Класифікація ферментів.План: Розділ біохімії, який вивчає ферменти називається ензимологією. Ензими-ферменти. Розвиток вчення про ферменти можна умовно розбити на кілька етапів.1. Історія вчення

ОСНОВЫ КИНЕТИКИ РЕАКЦИИ ГОРЕНИЯ Это процесс химического взаимодействия топлива и окислителя характеризующийся:интенсивным выделении тепласкачкообразным ростом температуры и концентрации продуктов горенияснижении концентрации окислителяпреобразованием химической энергии топлива в тепловую энергию, идущую на нагрев продуктов сгоранияЧТО ТАКОЕ ГОРЕНИЕ?

Объясните, используя знания о химических свойствах металлов, почему нельзя:а)хранить литий на воздухе?б)использовать для прекращения горения натрия воду.в)хранить кислые щи в алюминиевой кастрюле.г)готовить раствор сульфата меди в ведре, сделанном из оцинкованного железа. «Жизнь учит тех, кто её изучает»Д.

Кальций.Кальций- это жизненно необходимый элемент, без него жизнь человека была бы невозможна. Кальций необходим каждой нашей клетке, включая клетки сердца, нервов и мышц, кальций необходим для обеспечения нормальной жизнедеятельности всех живых организмов. В человеческом организме кальций находится в трех основных местах:1.

Скорость химической реакции – изменение концентрации вещества в единицу времени υ - СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ∆С – изменение концентрации ∆ τ –промежуток времени, за которое произошло изменение концентрации. СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ ЗАВИСИТ: а) от концентрации исходных веществ (закон действующих масс) скорость
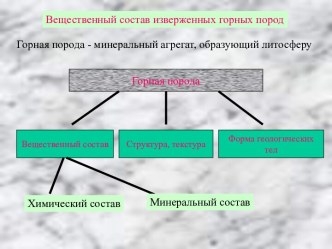
Химический составКлассификация элементов, используемая в петрографии:а) породообразующие: SiO2, TiO2, Al2O3, Fe2O3, FeO, MnO, MgO, CaO, Na2O, K2O LIO(ппп), P2O5 Сумма 100+/-2%;б) второстепенные :по ГольдшмитуСидерофильные - V, Cr, Ni, Co, As, Халькофильные - Cu, Ni, Co, S, Se, Zn, PbЛитофильные - O,

*Лекция 2. Закономерности протекания химических процессов Основы химической термодинамикиП Л А НОсновные понятия и определенияПервый закон термодинамики и его приложение к различным процессамТепловые эффекты химических реакций. Закон Гесса и следствия из него. Термохимические расчеты.Зависимость тепловых эффектов от температуры. Теплоемкости. Закон КирхгофаНаправление
Презентации из раздела Химия. Для просмотра учебных материалов воспользуйтесь проигрывателем. Любую презентацию на заданную тему можно скачать внизу страницы, поделившись ссылкой в социальных сетях. Не забудьте добавить наш сайт презентаций в закладки!