Слайд 2
Развитие техники рекомбинантных ДНК позволяет проводить выделение генов

эукариот и экспрессировать их в гетерологических системах. В настоящее
время методы генетической инженерии позволяют конструировать генетические системы, способные функционировать в клетках прокариот и эукариот. Эти возможности позволяют создавать организмы, обладающие новыми ценными свойствами, например, бактериальные штаммы, способные синтезировать эукариотические белки. Среди белковых продуктов, представляющих большой интерес, выделяются такие биологически активные вещества, как гормоны. Важное место среди них занимают белковые и пептидные гормоны.
Эти гормоны, многие из которых остро необходимы в медицине, до недавнего времени получали экстракцией из тканей животных при условии, что гормон не обладает выраженной видовой специфичностью. Сравнительно короткие пептидные гормоны пытались получать химическим синтезом. Единственным источником гормонов с крайне выраженной видовой специфичностью (гормон роста соматотропин) были органы умерших людей.
Слайд 3
Первые успешные результаты по экспрессии химически синтезированной последовательности

нуклеотидов ДНК, кодирующей 14-звенный пептидный гормон соматостатин, получены в
1977 г. в США компанией «Генетек».
Был сконструирован гибридный ген, часть которого была взята из гена фермента β-галактозидазы кишечной палочки, а остаток представлял собой фрагмент, кодирующий собственно соматостатин (фрагмент синтезировали химически). Введенный в бактериальные клетки гибридный ген направлял синтез белка-химерысостоящего более чем на 90 % из аминокислотной последовательности β-галактозидазы. Остальная часть представляла собой соматостатин. На стыке участка двух исходных генов находился кодон аминокислоты метионина. Последнее позволило обработать гибридный белок бромцианом, разрывающим пептидную связь, образованную метионином; среди продуктов расщепления был обнаружен соматостатин.
Данный подход был использован для получения многих пептидных гормонов (А- и В-цепей инсулина, нейропептида лейэнкефалина, брадикинина, ангиотензина и др.).
Слайд 5
Получение
рекомбинантного
инсулина
Слайд 7
Получение рекомбинантного
соматотропина
Генноинженерный препарат имеет несомненные преимущества:
доступен в больших количествах, гомогенен, не содержит вирусов. Синтез
cоматотропина, состоящего из 191 аминокислотного остатка, был осуществлен в США Гедделем с сотрудниками в 1979 г. (компания «Генентек»)
Слайд 9
Для лечения карликовости необходимая доза составляет 6 мг
в неделю в течение года. Кроме недостатка по массе,
получаемый экстракцией препарат был гетерогенным, против него вырабатывались антитела, которые сводили на нет действие гормона. Более того, существовала опасность, что при получении препарата могло произойти заражение организма медленно развивающими вирусами. Поэтому дети, получавшие данный препарат, нуждались в многолетнем медицинском наблюдении.
В 1980 г. были получены доказательства того, что генноинженерный соматотропин обладает биологической активностью нативного гормона. Клинические испытания препарата также прошли успешно. В 1982 г. гормон был получен также на основе сконструированной кишечной палочки в Институте Пастера в Париже. Стоимость гормона к 1990 г. снизилась до 5 долларов/ед.
Слайд 10
Получение интерферонов
Интерфероны – группа белков, способных продуцироваться в
ядерных клетках позвоночных. Это мощные индуцибельные белки, являющиеся фактором
неспецифической резистентности, поддерживающего гомеостаз организма. Система интерферонов обладает регуляторной функцией в организме, так как способна модифицировать различные биохимические процессы. Интерфероны позвоночных, в том числе человека, разделяют на три группы: α, β, γ, соответственно, лейкоцитарные, фибробластные и иммунные.
Слайд 11
Усилия, направленные на получение генноинженерных интерферонов, по сравнению
с методом культуры клеток позволили снизить затраты более чем
в 100 раз. Были получены различные типы интерферонов на основе генноинженерных клеток бактерий и дрожжей. Это позволило развернуть медико-биологические и клинические испытания препаратов.
Слайд 12
Генотерапия — совокупность генноинженерных— совокупность генноинженерных (биотехнологических) и медицинских—

совокупность генноинженерных (биотехнологических) и медицинских методов, направленных на внесение
изменений в генетический— совокупность генноинженерных (биотехнологических) и медицинских методов, направленных на внесение изменений в генетический аппарат соматических клеток— совокупность генноинженерных (биотехнологических) и медицинских методов, направленных на внесение изменений в генетический аппарат соматических клеток человека— совокупность генноинженерных (биотехнологических) и медицинских методов, направленных на внесение изменений в генетический аппарат соматических клеток человека в целях лечения заболеваний. Это новая и бурно развивающаяся область, ориентированная на исправление дефектов, вызванных мутациями— совокупность генноинженерных (биотехнологических) и медицинских методов, направленных на внесение изменений в генетический аппарат соматических клеток человека в целях лечения заболеваний. Это новая и бурно развивающаяся область, ориентированная на исправление дефектов, вызванных мутациями (изменениями) в структуре ДНК— совокупность генноинженерных (биотехнологических) и медицинских методов, направленных на внесение изменений в генетический аппарат соматических клеток человека в целях лечения заболеваний. Это новая и бурно развивающаяся область, ориентированная на исправление дефектов, вызванных мутациями (изменениями) в структуре ДНК, или придания клеткам новых функций.
Слайд 14
Стратегии генной терапии можно разделить на три крупных
блока:
функцию восстановить
функцию подавить
усилить иммунный ответ
.
Слайд 16
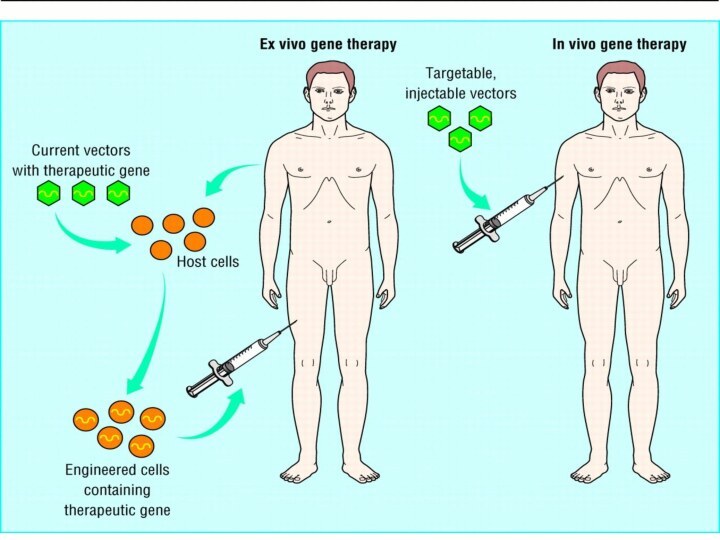
Новые подходы к генной терапии соматических клеток можно
поделить на две большие категории:
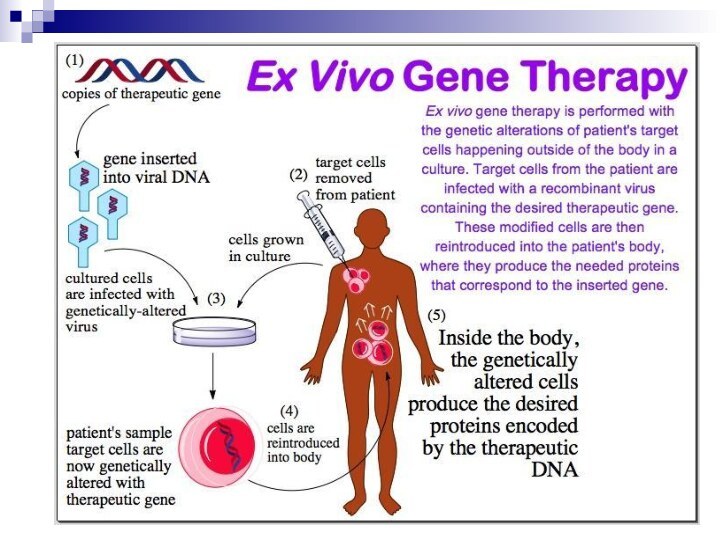
генная терапия ex vivo
(Эта терапия представляет собой развитие методов лечения, основанных на трансплантации органов и тканей).
Генная терапия in vivo.
Существует несколько способов введения новой генетической информации в клетки млекопитающих. Это позволяет разрабатывать прямые методы лечения наследственных болезней — методы генотерапии.
Используют два основных подхода, различающиеся природой клеток-мишеней:
фетальная генотерапия, при которой чужеродную ДНК вводят в зиготу или эмбрион на ранней стадии развития; при этом ожидается, что введенный материал попадет во все клетки реципиента (и даже в половые клетки, обеспечив тем самым передачу следующему поколению);
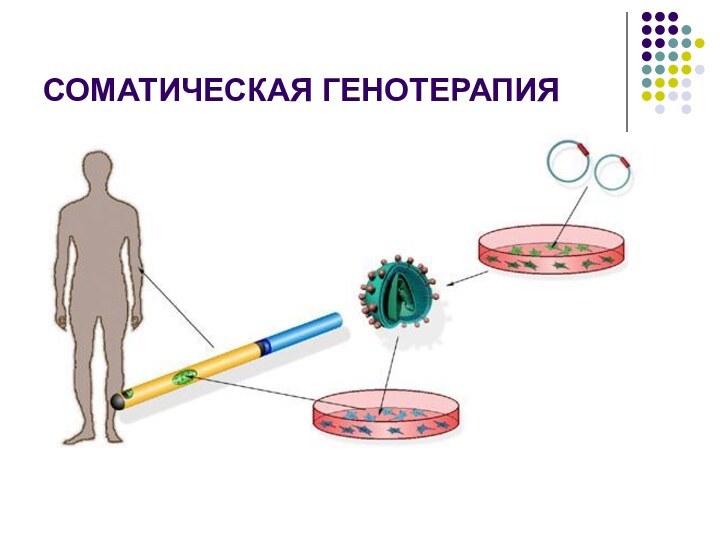
соматическая генотерапия, при которой генетический материал вводят только в соматические клетки и он не передается половым клеткам.
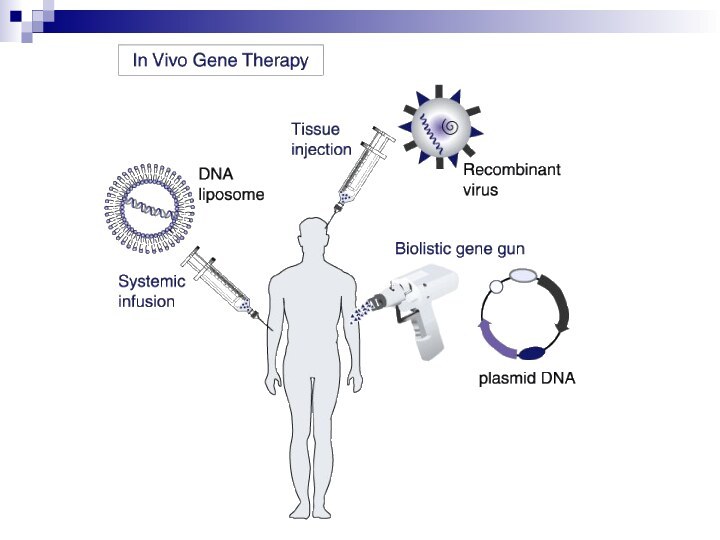
Слайд 22
Вектор - широкое понятие: это общее название “транспортного
средства” для целенаправленной доставки того или иного вещества, и
не только гена, а любых, даже таких традиционных лекарств, как анальгина или аспирина. Лекарственный препарат, попадающий в организм, как правило, традиционным путем, действует почти на все клетки, а надо подействовать или на определенную группу клеток, или даже на участок генома, специфичный для определенной группы клеток. С другой стороны, транспортируемое вещество необходимо “защитить” от повреждений. Сегодня самая большая проблема медицины, которую пытаются решить десятки биотехнологических компаний, - направленная, т.е. векторная доставка и ее эффективность.
Слайд 23
Для генной терапии векторы бывают либо синтетическими (основаны
на полимерных материалах, например липосомах), либо “натуральными”, т.е. природного
происхождения (чаще всего это вирусы или плазмиды). Вирусы, применяемые здесь в качестве векторов, лишены своих вредоносных свойств и практически безопасны для человека.
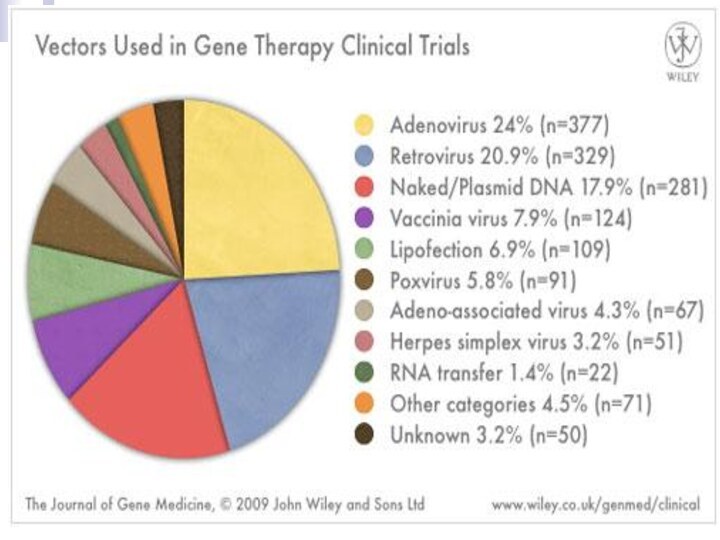
Слайд 25
ВИРУСНЫЕ ВЕКТОРЫ ДЛЯ ГЕННОЙ ТЕРАПИИ
Ретровирусные векторы
аденовирусные векторы
аденоассоциированные векторы
Герпесвирусные
вектора
Слайд 27
РЕТРОВИРУС
клетки-мишени: Фибробластыклетки-мишени: Фибробласты , Эндотелиальные клеткиклетки-мишени: Фибробласты ,
Эндотелиальные клетки , Миобластыклетки-мишени: Фибробласты , Эндотелиальные клетки ,
Миобласты , Гладкомышечные клеткиклетки-мишени: Фибробласты , Эндотелиальные клетки , Миобласты , Гладкомышечные клетки , Гепатоцитыклетки-мишени: Фибробласты , Эндотелиальные клетки , Миобласты , Гладкомышечные клетки , Гепатоциты , Гематопоэтические клетки , Стволовые клетки
ПОЛОЖИТЕЛЬНЫЕ СВОЙСТВА:
Непатогенен,
Интегрирует в геном,
Относительно простое манипулирование,
Биология хорошо изучена
ОТРИЦАТЕЛЬНЫЕ СВОЙСТВА:
Относительно низкие вирусные титры,
Ограниченная емкость для внедрения трансгена ((10 кб),
Не инфицирует неделящиеся клетки,
Экспрессия трансгена м.б. непродолжительной
Не очень хорош для in vivo терапии
Слайд 29
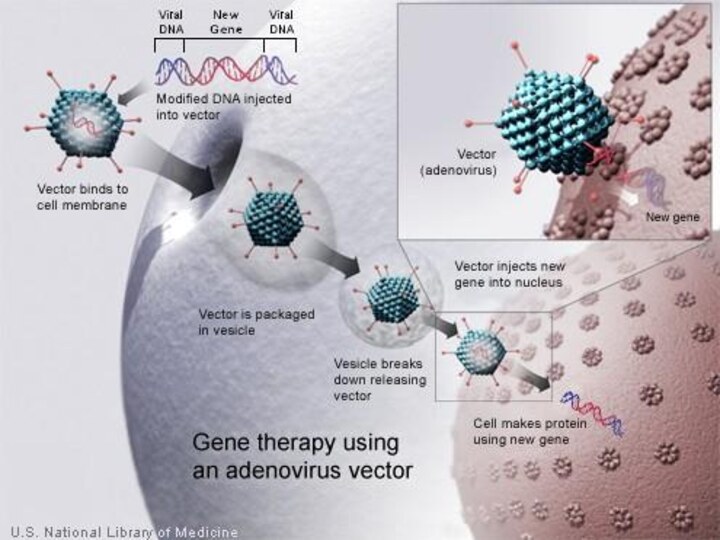
АДЕНОВИРУС
клетки-мишени: Гепатоциты клетки-мишени: Гепатоциты , Эпителий верхних
дыхательных путей клетки-мишени: Гепатоциты , Эпителий верхних дыхательных путей
, Лимфоидные клетки-мишени: Гепатоциты , Эпителий верхних дыхательных путей , Лимфоидные , гематопоэтические клетки-мишени: Гепатоциты , Эпителий верхних дыхательных путей , Лимфоидные , гематопоэтические и миелоидные клетки
ПОЛОЖИТЕЛЬНЫЕ СВОЙСТВА:
Доступны непатогенные дефектные мутанты,
Человек - природный хозяин,
Высокие титры,
Высокая эффективность при in vivo инфекции,
Инфицирует как делящиеся так и неделящиеся клетки, неинфицируемые ретровирусами,
Биология хорошо изучена,
Существуют паковочные клеточные линии
ОТРИЦАТЕЛЬНЫЕ СВОЙСТВА:
Не интегрирует в геном,
Конструкция вектора более сложна, чем у ретровирусов,
Может рекомбинировать с природными аденовирусами.
Слайд 30
АДЕНО-АССОЦИИРОВАННЫЙ ВИРУС
клетки-мишени: Гематопоэтические клетки клетки-мишени: Гематопоэтические
клетки , Фибробласты клетки-мишени: Гематопоэтические клетки , Фибробласты ,
Эпителиальные клетки
ПОЛОЖИТЕЛЬНЫЕ СВОЙСТВА:
Непатогенен,
нецитотоксичен,
Человек - природный хозяин,
Предпочтительный сайт интеграции на хромосоме 19,
Способен устанавливать латентное состояние,
Относительно простое конструирование ветора.
ОТРИЦАТЕЛЬНЫЕ СВОЙСТВА:
Относительно низкие титры,
Малая емкость (4кб),
Инфекционность относительно низка,
Требует аденовирус в качестве помощника для инфекции,
Биология не очень хорошо изучена.
Слайд 31
вектор на основе ГЕРПЕС ВИРУС (HSV)
ПОЛОЖИТЕЛЬНЫЕ СВОЙСТВА:
Доступны
мутанты дефектные по репликации,
Доступны пакующие системы,
Высокие титры,
Широкий спектр клеток-хозяев,
Высокая эффективность инфекции,
Инфицирует клетки, неинфицируемые ретровирусами,
Биология хорошо изучена,
Высокая емкость - до 30кб.
ОТРИЦАТЕЛЬНЫЕ СВОЙСТВА:
Упаковка происходит с низкой эффективностью,
Репликационно-дефектные мутанты цитотоксичны,
С вирусным геномом трудно создавать векторные конструкции,
Сложная регуляция.
Слайд 33
потенциальные стратегии борьбы с раковыми опухолями методами генной

терапии
1. Увеличение иммуногенности опухолевых клеток, например, путем введения генов,
кодирующих чужеродный для этих клеток антиген (цитокиновых генов, генов, кодирующих главный комплекс гистосовместимости, лимфоцитарных лигандов).
2.Поощрение клеток иммунной системы для увеличения их антиопухолевой активности, путем внесения в опухолевые клетки генов цитокинов.
3.Введение в опухолевые клетки генов-убийц, которые синтезируют продукт, приводящий в определенных условиях к гибели опухолевых клеток.
4.Блокирование экспрессии онкогенов с помощью внутриклеточной иммунизации, например, путем введения в клетки конструкций, программирующих синтез антисмысловых РНК или антител к онкобелкам.
5. Введение в опухолевые клетки генов супрессоров, таких как p53.
6. Предохранение стволовых клеток от токсических эффектов хемиотерапии путем введения в них генов устойчивости к лекарствам, например, MDR-1 ,
7. Блокирование механизмов, с помощью которых опухолевые клетки избегают уничтожения иммунной системой, например, путем введения генов, кодирующих РНК антисмысловую по отношению к IGF-1 .
8. Направленное убийство опухолевых клетовк введением генов, кодирующих токсины под контролем промоторов, специфически экспрессирующихся в опухолевых клетках. Например, гена, кодирующего А- цепь дифтерийного токсина .
Слайд 34
Муковисцидоз: перспективы генной терапии
В результате мутации легочный эпителий В
результате мутации легочный эпителий дефектен по гену- регулятору CFTR.
Это приводит к хроническим инфекциям, воспалениям и постепенному разрушению (derangement) дыхательного аппарата. Эти последствия по-видимому могли бы быть предотвращены, если бы функция хлорного канала была восстановлена в клетках легочного эпителия. В этом случае ретровирусные векторы неэффективны, поскольку они плохо инфицируют легочный эпителий.
Основное внимание уделяют стратегии in vivo и пытаются идти двумя путями. Во-первых, использовать репликационно дефектные аденовирусы, а во-вторых липосомы.
Эксперименты по применимости и безопасности подобных подходов проверены на мыши, нокаутированной по CFTR гену. На людях эксперименты проведены, в частности, на эпителии полости носа (nasal epithelium). Наблюдалось приближение свойств больного эпителия к нормальным.
Слайд 36
Генотерапия применима не только к наследственным заболеваниям. Предстоит

решить проблему лечения генами "чумы XX века" — синдрома
приобретенного иммунодефицита (СПИД), возникающего при заражении вирусом иммунодефицита человека (ВИЧ). ВИЧ представляет собой ретровирус, поражающий Т-лимфоциты и макрофаги. Болезнь удалось бы победить, если бы были найдены новые гены, введение которых в зараженные ВИЧ лимфоциты останавливало бы дальнейшее размножение вируса. Предложено множество хитроумных способов борьбы со СПИДом с помощью привнесенных генов. Все они основаны на новейших данных о строении и функционировании генома ретровируса. Например, вводя прямо в мышцы больного ретровирусные векторы, несущие отдельные гены ВИЧ, ученые рассчитывали на то, что гены ВИЧ после внедрения в ДНК хромосом хозяина смогут дать информацию для синтеза вирусных белков и произойдет "противоСПИДная" иммунизация больного этими белками. Однако еще не получено ощутимых результатов, которые сулили бы успех в борьбе с вирусом дикого типа, коварство которого заключается в его изменчивости.
Слайд 37
Появление принципиально новых технологий, позволяющих активно манипулировать с
генами и их фрагментами и обеспечивающих адресную доставку новых
блоков генетической информации в заданные участки генома, стало важным событием в биологии и медицине.
Т.о. лекарства будущего можно представить себе в виде клеток или тканей (органов), генетически модифицированных с помощью векторных систем, содержащих компоненты как вирусов, так и современных нам искусственных макромолекулярных комплексов.