І ІІ ІІІ типи
HERPESVIRUSES
лімфотропні
ІУ УІ УІІ УІІІ типи
вісцеротропні У тип
Всі герпесвіруси – лімфопроліферативні,
нейропатогенні, системні імунодепресанти,
всі – пантропні
Слайд 3
Дисемінація герпесвірусів в організмі людини:
від клітини
до клітини,
гематогенно,
транслімфатично та трансневрально (трансаксонально).
Зараження плоду
в інфікованому організмі матері може здійснюватись гематогенним шляхом та
трансплацентарно та трансоваріально («висхідна інфекція»).
Слайд 4
Поширення герпесвірусів
Більшість населення планети - у стані «здорового»
носійства
Віруси «ховаються» від імунної системи в структурах спинного (задні
роги, дорсальні спінальні міжпозвонкові ганглії) або головного (базальні ядра) мозку, а також в гангліонарних тканинах (тригемінальні ганглії, тазове сплетіння, сонячне сплетіння), легко долають гематоенцефалічний бар»ер.
Слайд 6
Віруси впливають на життєво важливі функції макроорганізму імунобіологічні
системи його захисту (інтерферон–цитокіновий статус, клітинні та гуморальні імунні
реакції).
розвиток біологічіного згасання (механізм старіння).
За здатністю викликати імуносупресію,
за спектром тканинно-органного тропізму,
формами інфекції - хронічна персистенція , латентна безсимптомне «здорове» носійство,
можливість інтеграції в геном клітини
Системна дія на макроорганізм
Слайд 7
Онкопотенціал герпесвірусів:
• Лімфома Беркітта (HHV–4).
• Назофарингеальна карцинома (HHV–4).
•
Лімфоми, лімфосаркоми (HHV–4).
• Аденокарцинома простати (HHV–5).
• Гемоцитобластоз, лімфоретикулез,
лімфогрануломатоз (HHV–6).
• Саркома Капоши (HHV–8).
• Хвороба Кастльмана (HHV–8).
• Первнна ефузійна лімфома порожнин тіла людини (HHV–8).
• В–клітинна лімфома (HHV–8).
Слайд 8
Вірус Люке
В природніх умовах вірус викликає аденокарциноми нирок
леопардових жаб, які мешкають у водоймах Північної Америки. Особливістю
таких пухлин - наявність ацидофільних внутрішньоядерних включень, характерних для вірусів герпеса.
Вірус Люке здатний репродукуватися в клітинах нирок тільки в умовах низької температури (нижче 13). Утворення пухлин нирок у жаб істотно підвищується в умовах підвищеної температури. Вірус накопичується в організмі у великій кількості і навіть виділяється з сечею в зовнішнє середовище. В зараженому водоймищі інфекція переходить на пуголовків.
Слайд 9
Хвороба Марека
Хвороба Марека – висококонтагіозне лімфопроліферативне захворювання курей
Характерні
ознаки – розвиток Т-клітинних лімфом та демієлінізація периферичних нервів,
печінки, гонад, м’язів, райдужки, шкіри
Уражує до 30 % поголів'я курей, летальність 10-15 % (гостра епідемічна форма може викликати загибель 80 % поголів'я). Хворіють курчата віком від 12 до 24 тижнів
Хвороба розповсюджена по всьому світу
Слайд 10
Онкогенні герпесвіруси з роду Mardivirus
Існують три серотипи
вірусу хвороби Марека:
Серотип 1 (Gallid herpesvirus-2)
Уражує курей
Росте на
ембріональних фібробластах качки та клітинах нирки курки, повільно
Утворює малі бляшки
Серотип 2 (Gallid herpesvirus-3)
Уражує курей
Росте на ембріональних фібробластах курки, повільно
Утворює середні бляшки
Серотип 3 (Meleagrid herpesvirus-1)
Уражує індиків
Росте на ембріональних фібробластах курки, швидко
Утворює великі бляшки
Слайд 11
Інкубаційний період
– 13 – 150 днів
Клінічна картина
Класична
(хромота, відвисання крил і хвоста,
зміна кольору
райдужної оболонки ока)
Гостра
(параліч, зменшення маси,
відмова від їжі, ненормальна
постава тіла)
Слайд 12
Передача і життєвий цикл
Курча вдихає вірус
Вірус потрапляє у
макрофаги та дендритні клітини легенів фагоцитозом
Із током крові
досягає селезінки, тимусу та фабріцієвої сумки. Інфікує В-лімфоцити і починає активно розмножуватися, викликаючи лізис клітин
вірус уражує CD4+ Т-кл. Частина ереходить у латентний стан *, а частина у складі цих клітин подорожує до шкіри
Вірус потрапляє у
клітини фолікулів пір'я та кератиноцитів. Із
лущенням шкіри та опалим пір'ям потрапляє у зовнішнє середовище * *
* - Т-клітини, що несуть латентний вірус можуть давати початок Т-клітинній лімфомі курей
* * - Вірус може довго зберігатися у навколишньому середовищі (до 1 року)
Слайд 13
Патогенез
Виділяють чотири фази інфекції
гостра первинна інфекція та
дегенеративні зміни ранньої фази (селезінка, тимус, фабріцієва сумка)
латентний період
(у Т-клітинах)
проліферативна фаза (Т-клітинна лімфома)
гостра вторинна інфекція на фоні імуносупресії, спричиненої лімфомою, під час якої вірус прогресує у тканинах епітелію і виходить назовні (перестають утворюватися нормальні Т-хелпери)
Часто потрапляння вірусу у фолікули пір'я супроводжується дерматитом
Слайд 14
Патанатомія
Атрофія м’язів
Дегенеративні ушкодження периферичних нервів
Лімфоматозні утворення сало-подібної консистенції
у гонадах, печінці, клітковині шкіри, серцевому та інших м'язах,
селезінці, легенях
Слайд 15
Еволюція патологічного вплву
Гострота та складність протікання захворювання
Хронічний поліневрит
Вісцеральна
лімфома
Імуносупресія
Тимчасовий параліч
Набрякання мозку
Дерматит, висипи
Слайд 16
Загальні відомості про трансформацію
Вірус здатний до трансформації СD4+
Т-клітини, в яких той перебуває у латентному стані
Вірус може
інтегруватися у геном у довільних локусах
Для трансформації необхідна велика кількість інфікованих вірусом Т-клітин. Попередниками Т-клітинних лімфом стає лише кілька клітин. Описані випадки моноклональних лімфом
Слайд 18
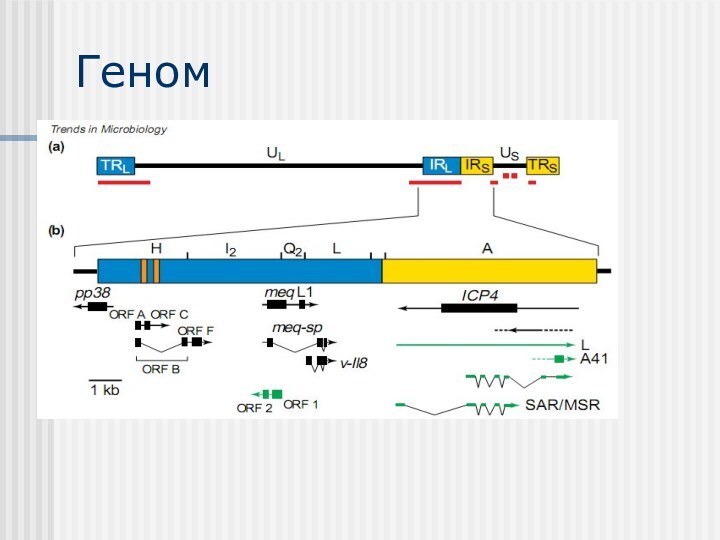
Порівняння геномів вірусу varicella–zoster virus (VZV) та вірусу
хвороби Марека (MDV)
VZV – найближчій родич MDV, який
інфікує людину. У них наявний ступінь гомології, особливо в унікальних регіонах..
Лише 5 генів VZV (білий колір) немає в MDV.
Найбільша відмінність між MDV та VZV геномами полягає у наявності довгих у унікальних довгих регіонах MDV. Унікальні довгі повтори містять гени, що кодують протехни або РНК, які є важливими для клітинного тропізму, наприклад, вірусний інтерлейкін 8, а також в онкогенності (наприклад, meq).
Слайд 19
Регуляція МНС класу 1 та ІНФ-α
Вірус здатний “вимикати”
експресію білків необхідних для асоціації ендогенних пептидів із молекулою
МНС 1 та інтрерферону альфа
Вважається, що це допомагає вірусу
зберігатися у латентному стані в Т-клітинах, не викликаючи імунної відповіді проти своїх носіїв
Непомітно проникати у клітковину шкіри, де він викликає вторинну гостру фазу
Чіткої кореляції між вірулентністю та здатністю вірусу до пригнічення МНС 1 не виявлено
Слайд 20
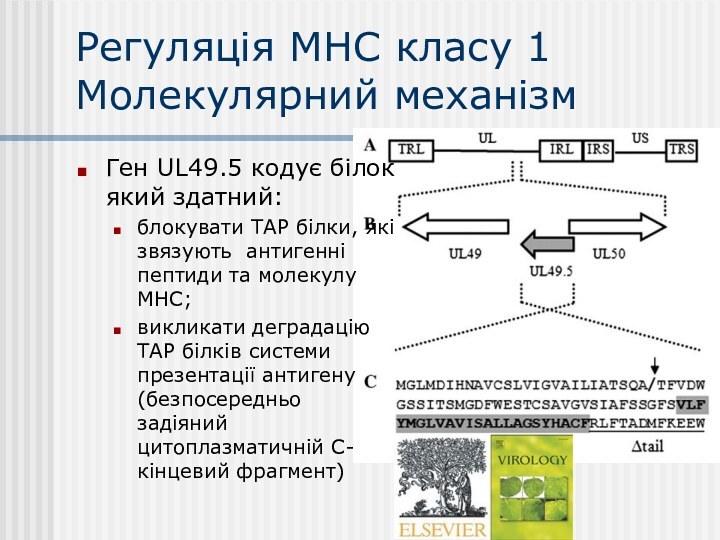
Регуляція МНС класу 1
Молекулярний механізм
Ген UL49.5 кодує білок
який здатний:
блокувати ТАР білки, які звязують антигенні пептиди та
молекулу МНС;
викликати деградацію ТАР білків системи презентації антигену (безпосередньо задіяний цитоплазматичній С-кінцевий фрагмент)
Слайд 21
Латентний стан та трансформація
Розрізнити Т-клітини, які несуть
вірус у латентному стані, але ще не є трансформованими
від тих Т-клітин, які вже є малігнізованими – неможливо
Основні гени, які беруть участь у латентному періоді та переродженні клітин:
транскрипти, антисенсові до MDV084 (ICP4)
meq (MDV004) транскрипт
Ці гени є ранніми і забезпечують перехід до латентного стану відразу після потрапляння вірусу в клітину
Слайд 22
Загальні відомості про трансформацію
Вірус здатний до трансформації СD4+
Т-клітини, в яких той перебуває у латентному стані
Вірус може
інтегруватися у геном у довільних локусах
Для трансформації необхідна велика кількість інфікованих вірусом Т-клітин. Попередниками Т-клітинних лімфом стає лише кілька клітин. Описані випадки моноклональних лімфом
Слайд 23
Деякі вірусні протеїни, що експресуються у трансформованих Т-лімфоцитах
pp38
– 24; 38 або 41 кДа – цитоплазматичний фосфопротеїн
Продукт
ORF А, В та C – 7 кДа – викликає проліферацію клітин курячих ембріональних фібробластів
meq – 40-44 кДа – головний онкоген
L1 – 107 а-к-т – подовжує час життя мРНК у клітинах
v-IL8 – інтерлейкін 8
ICP4 – трансактиватор негайно-ранніх генів
Слайд 24
Регуляція МНС класу 1 та ІНФ-α
Вірус здатний “вимикати”
експресію білків необхідних для асоціації ендогенних пептидів із молекулою
МНС 1 та інтрерферону альфа
Вважається, що це допомагає вірусу
зберігатися у латентному стані в Т-клітинах, не викликаючи імунної відповіді проти своїх носіїв
Непомітно проникати у клітковину шкіри, де він викликає вторинну гостру фазу
Чіткої кореляції між вірулентністю та здатністю вірусу до пригнічення МНС 1 не виявлено
Слайд 25
Регуляція МНС класу 1
Молекулярний механізм
Ген UL49.5 кодує білок
який здатний:
блокувати ТАР білки, які звязують антигенні пептиди та
молекулу МНС;
викликати деградацію ТАР білків системи презентації антигену (безпосередньо задіяний цитоплазматичній С-кінцевий фрагмент)
Слайд 26
Основний онкоген meq
(Marek’s disease EcoRI-Q)
Описаний Kung та
співавт. у 1992 році
Поліфункціональний ДНК-з’вязуючий білок, який є:
трансактиватором вірусних
генів;
ремодулятором хроматину;
транскрипційним фактором генів господаря
модулятором деяких клітинних каскадів
Слайд 27
Основний онкоген meq. Структура
339 амінокислот, 44 кДа. Пролін-
багата ділянка відповідає за трансактивацію (33 а-к-ти з С-кінця
– особливо). Лужний домен, “зіпер” та 40 а-к-т пролін багатої ділянки – гомологічні до с-Fos та с-Jun. Лужний фрагмент є сигналом ядерної та ядерцевої локалізації та уможливлюють зв'язування білку із ДНК.
Слайд 28
Основний онкоген meq.
Має здатність до асоціації із
клітинними прото-онкогенами
Fos та Jun
cAMP-response-element-binding protein (CREB) та cAMP-inducible
transcription factors (ATF1 та 2)
Із самим собою
Слайд 29
Докази участі Мeq у неопластичному перетворенні:
постійно експресується у
трансформованих CD41+ Т-клітинах, рецесивні мутантні віруси за цим геном
не здатні до трансформації;
siRNA до meq перешкоджають росту культури CD41+ Т-клітин;
гіперекспресія Мeq викликає трансформацію фібробластів щурів та ембріональних фібробластів курей (штучно трансформувати ним Т-клітини поки що не вдалось);
Мeq має чітку гомологію із клітинними онкогенами Fos та Jun.
Має протиапоптотичну активність
Слайд 30
Загальна картина активності онкогену
Взаємодія Meq з Jun веде
до активанії АР-1 та 2 енхансерів, підконтрольних транскрипційному фактору
Jun
Збільшується експресія інтерлейкіну-2
Катепсин-подібного білока JTAP-1
Транскрипційного фактора JAC
Антиапоптотичних білків bcl-2 Ski
Антигену, характерного для Ходжкінських лімфом CD30
Взаємодія Meq з р53 та RBp – до зміни клітинного циклу
Слайд 31
Віруси герпеса приматів
Із дегенеруючої первинної культури нирок білкової
мавпи був виділений вірус герпеса HVSaimiri, який індукує лімфолейкози
і ретикулосаркоми у деяких видів мавп Нового Світу (мармозетки, нічні мавпи, чорні павукоподібні мавпи), а також у білих новозеландських кролів. У зелених африканських мартишок вірус викликає доброякісне лімфопроліферативне захворювання подібне до інфекційного мононуклеозу.
Слайд 32
Герпесоподібний вірус (HVAteles), виділений від здорових павукоподібних мавп,
також виявився онкогенним для деяких видів мавп Нового Світу.
Вірус викликає злоякісні лімфоми (Т-клітинно-го походження).
Вірусам герпесу мавп властива висока онкогенна дія, що знищуює практично все поголів’я чутливих до них деяких видів приматів Нового світу (неприродних хазяїв).
Фібробласти та епітеліальні клітини мавп є для обох вірусів пермисивною системою, в якій віруси розмножуються і викликають в клітинах ЦПД. В непермисивній системі віруси викликають трансформацію. Для даних вірусів характерна горизонтальна передача.
Вакцина із інактивованого HVS ефективно захищає чутливих до вірусу мармозеток.
Слайд 33
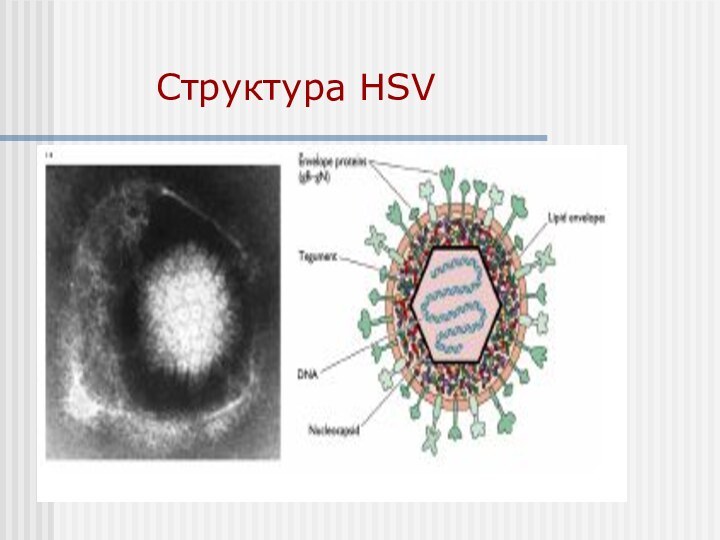
Human Herpesvirus 1 (Herpes simplex virus 1, HSV-1)
and HHV2/HSV-2
HSV-1 первинна оральна інфекція.
HSV-2
первинна статева інфекція.
HSV-1 широко розповсюджений в людській популяції;
HSV-2 менш поширений, але спостерігається ріст розповсюдження.
Латентність спостерігають в клітинах нервових гангліїв.
Часткова перехресна антигенна реакція.
(1)
~80 генів; половина з них необхідна для реплікації.
Спайсингу піддається тільки ген LАТ.
VP16/aTIF – вірусний білок утворюється в тегументі, активує вірусну транскрипцію шляхом взаємодії з клітинними транскрипційними факторами ( Oct-1and Hcf) [може взаємодіяти з транскрипційними активаторами, але не з ДНК].
Virion host shutoff protein (Vhs) –структурний вірусний білок присутній в тегументі, експресується в пізній фазі інфекції. Індукує РНКазну активність, деградує всі mРНК. Завдяки вірусній транскрипції присутній у великій кількості , тому білкові вірусні синтези не страждають.
(2)
Latency associated transcripts (LATs) –сплайсовані транскрипти, у яких відсутні polyA послідовності , присутні в ядрі та накопичуються в латентно інфікованих клітинах.
LATs приймають участь у встановленні латентної інфекції та реактивації. LATs перешкоджає літичній інфекції, інтерферуючи з вірусними транскрипційними факторами літичної фази.
ICP27 – ядерний надранній фосфопротеїн, здійснює ядерний експорт в цитоплазму, специфічно полегшує експорт моно-екзонних mРНК.
Слайд 38
HSV-1та HSV-2
1. HSV1 та HSV2 мають в геномі
трансформуючі гені (mtr), які здатні іморталізувати компетентні клітини. Ці
гени відрізняються між собою.
2. Вірyсспецифічні білки не приймають участь в механізмах індукованої трансформації і для підтримки трансформованого стану вони не потрібні.
Слайд 39
гіпотеза
непрямої коканцерогенної дії HSV за механізмом “hit and
run” (вдарив та втік) на основі таких експериментальних даних:
Необов’язкова
присутність v-ДНК в трансформованій клітині;
відсутність якого-небудь єдиного білку – продукту трансформуючого гену HSV;
неможливість знайти мутанти HSV, дефектні по властивості трансформувати клітини.
Слайд 40
Cytomegalovirus (HHV-5)
Широкий спектр клінічної патології – пантропність
реплікація в клітинах життєво важливих органів людини.
Шляхи передачі
HCMV: антенатальний, интранатальний, постнатальний, контактний (в тому числі вигодовування грудним молоком), статевий, трансфузійний.
HCMV долає плацентарний бар»ер – ураження плоду на всіх періодах вагітності
В більшості безсимптомне захворювання, можлива реактивація при імунній супресії (випадки трансплантації органів).
Лікування: Ganciclovir, Foscarnet (пірофосфат може блокувати ДНК полімеразу, попереджаючи зв”язування нуклеозидів)
Слайд 41
Геном ННV–5 персистує в клітинах крові (проблема трансплантології).
До 2% лейкоцитів донорів містять передранні білки ННV–5.
Після пересадки
органів у ~90% реципієнтів виявляють ознаки ЦМВІ, 10% – клінічно виражена ЦМВІ,
20% – ЦМВ–пневмонія, яка у 90% випадків случаев призводить до смерті
Слайд 42
HHV-6
Вірус герпесу людини 6–го типу
Виділили з В–лімфоцитів
периферичної крові хворих на лімфопроліферативними (Т–клітинна лімфома, гостра лейкемія,
ангіоімунобластоїдна лімфаденопатія) та імунодефіцитними (СНІД) захворюваннями.
Переважний тропізм до Т-лімфоцитів.
ННV–6 має гени, гомологічні відповідним послідовностям HCMV та представникам п/родини α–herpesvirinae.
Слайд 43
ННV–6
Тривала персистенція в організмі після первинного інфікування
Персистенція
: латентний стан (відсутність продукції інфекційного вірусу) у моноцитах
та ранніх попередниках клітин червоного кісткового мозку
хронічна реплікація на низькому рівні в різних анатомічних зонах ( слинні залози та тканина мозку)
Слайд 44
ННV–6А ННV–6В
ННV–6А виклакає лімфогранулематоз, лімфоретикульоз, гемоцитобластоз, разсіяний склероз
ННV–6В – раптову екзантему новонароджених (exanthema subitum or roseola
infantum)
ННV–6 – мононуклеоз із тривалою лімфаденопатією.
ННV–6 індукує у дітей лімфопроліферативне захворювання з моноклональною проліферацією В–клітин (діти від 3 міс. до 3 років).
ННV–6 – індуктор фульмінантного гепатиту
ННV–6 – проблема трансплантології.