Слайд 2
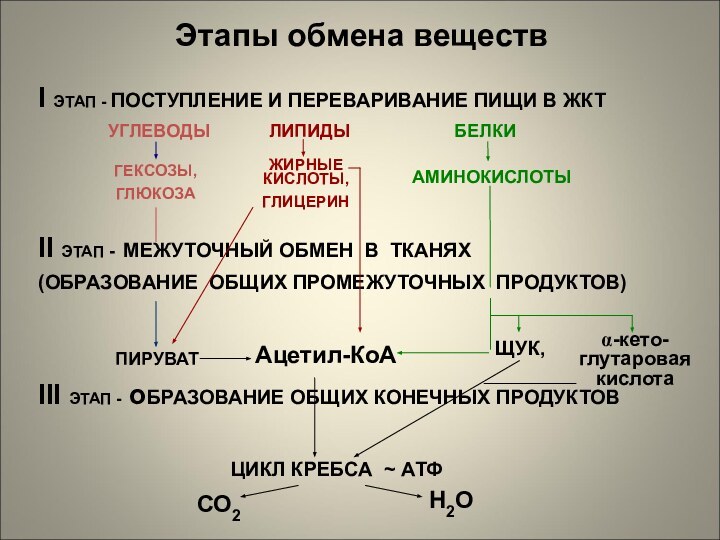
Этапы обмена веществ
I ЭТАП - ПОСТУПЛЕНИЕ И ПЕРЕВАРИВАНИЕ
ПИЩИ В ЖКТ
УГЛЕВОДЫ ЛИПИДЫ БЕЛКИ
II ЭТАП - МЕЖУТОЧНЫЙ ОБМЕН В ТКАНЯХ
(ОБРАЗОВАНИЕ ОБЩИХ ПРОМЕЖУТОЧНЫХ ПРОДУКТОВ)
III ЭТАП - оБРАЗОВАНИЕ ОБЩИХ КОНЕЧНЫХ ПРОДУКТОВ
ЦИКЛ КРЕБСА ~ АТФ
СО2
H2O
Ацетил-КоА
ЩУК,
α-кето-глутаровая кислота
ГЕКСОЗЫ,
ГЛЮКОЗА
ЖИРНЫЕ КИСЛОТЫ,
ГЛИЦЕРИН
АМИНОКИСЛОТЫ
ПИРУВАТ
Слайд 3
В результате гидролитического расщепления поступивших субстратов в ЖКТ
образуются мономеры, которые могут утилизироваться клетками тканей:
полисахариды расщепляются до
моносахаридов;
липиды (триацилглицеролы) – до жирных кислот и глицерина;
белки – до аминокислот;
нуклеиновые кислоты – до мононуклеотидов.
В процессе гидролиза пищевых веществ в виде тепла высвобождается всего 1% кумулированной в исходных продуктах энергии, которая рассеивается в виде тепла (0,6% энергии белков и углеводов, около 1% - энергии липидов).
I этап обмена веществ: Гидролитическое расщепление углеводов, белков, жиров в ЖКТ
Слайд 4
II этап:
Образование общих промежуточных продуктов
Мономеры, образовавшиеся
в первой стадии, внутриклеточно подвергаются превращениям с выделением энергии
(20-30% - около 1/3 энергии окисления расщепляющихся субстратов).
Основные реакции катаболизма:
для моносахаридов – гликолиз (конечным метаболитом является пировиноградная кислота, которая далее подвергается окислительному декарбоксилированию и превращается в активную форму уксусной кислоты – ацетил-КоА);
для жирных кислот – β-окисление (конечный продукт – ацетил-КоА; для глицерина – расщепление до пирувата, который далее превращается в ацетил-КоА);
для аминокислот и нуклеотидов – дезаминирование и расщепление безазотистых молекул до ди- и трехуглеродных карбоновых кислот и их производных. Большинство этих метаболитов превращается в ацетил-КоА.
Общим конечным продуктом второй стадии внутриклеточного катаболизма углеводов, липидов и аминокислот является ацетил-КоА.
Слайд 5
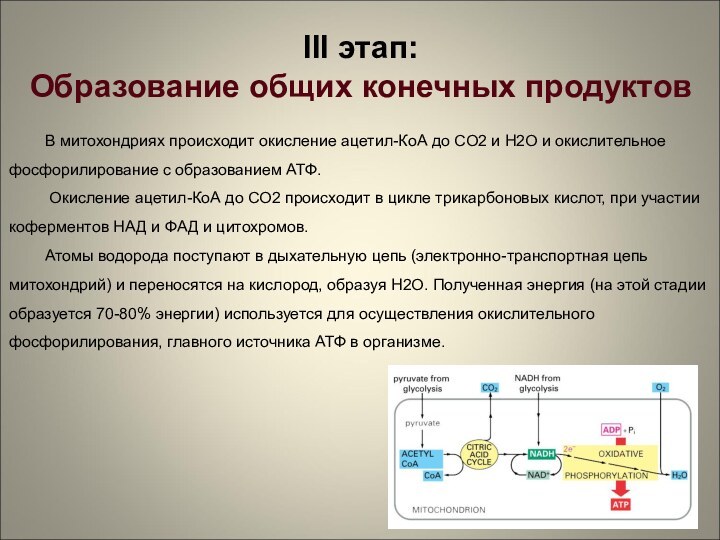
III этап:
Образование общих конечных продуктов
В митохондриях происходит
окисление ацетил-КоА до СО2 и Н2О и окислительное фосфорилирование
с образованием АТФ.
Окисление ацетил-КоА до СО2 происходит в цикле трикарбоновых кислот, при участии коферментов НАД и ФАД и цитохромов.
Атомы водорода поступают в дыхательную цепь (электронно-транспортная цепь митохондрий) и переносятся на кислород, образуя Н2О. Полученная энергия (на этой стадии образуется 70-80% энергии) используется для осуществления окислительного фосфорилирования, главного источника АТФ в организме.
Слайд 6
Типовые нарушения
обмена веществ
Нарушения энергетического обмена
Нарушения обмена белков,
углеводов и липидов
Нарушения водно-электролитного обмена
Нарушения кислотно-основного состояния
Слайд 7
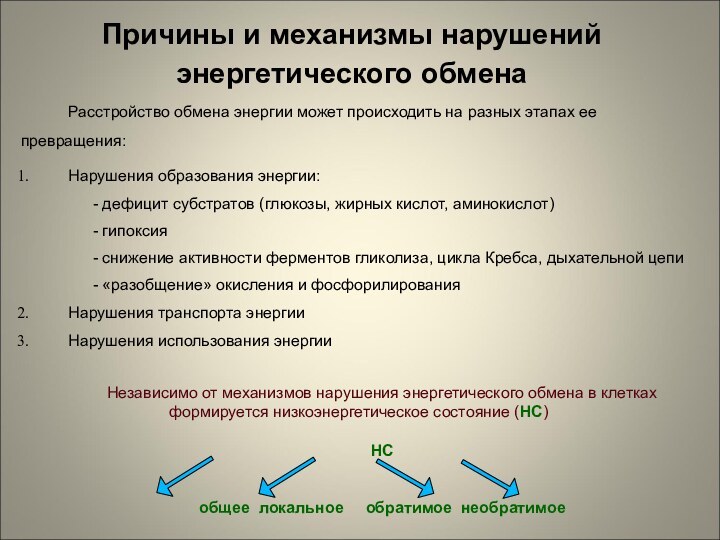
Причины и механизмы нарушений энергетического обмена
Расстройство обмена энергии
может происходить на разных этапах ее превращения:
Нарушения образования энергии:
-
дефицит субстратов (глюкозы, жирных кислот, аминокислот)
- гипоксия
- снижение активности ферментов гликолиза, цикла Кребса, дыхательной цепи
- «разобщение» окисления и фосфорилирования
Нарушения транспорта энергии
Нарушения использования энергии
Независимо от механизмов нарушения энергетического обмена в клетках формируется низкоэнергетическое состояние (НС)
НС
общее локальное обратимое необратимое
Слайд 8
Нарушение образования энергии (I):
Дефицит энергетических субстратов (алиментарная недостаточность,
нарушения проходимости пищевода, выраженных расстройствах переваривания и всасывания в
ЖКТ и др). Хронический дефицит на организменном уровне –преобладание катаболических процессов надо анаболическими (т.е. развитие кахексий, н-р раковой).
Снижение активности ферментов, участвующих в энергетическом обмене (гипо- и авитаминозы, интоксикации, нарушения регуляции синтеза ферментов и др.)
Гликолитические яды: монойодуксусная кислота, арсенат, 2,4-дезоксиглюкоза
Полная или частичная блокада цикла Кребса: дефицит пантотеновой и щавелевоуксусной кислот, тиамина и др. Специфические ингибиторы – малоат и фторацетат
Слайд 9
Нарушение образования энергии (II):
Гипоксия. Результатом гипоксии является нарушение
использования клетками углеводов. В клетках накапливаются недоокисленные продукты обмена,
что приводит к развитию ацидоза и торможению гликолиза.
Нарушение сопряжения окисления и фосфорилирования. Свободная энергия, освобождающаяся при переносе электронов, не запасается в молекуле АТФ, а выделяется в виде тепловой энергии (набухание митохондрий, переохлаждение, гипертиреоз, избыток жирных кислот, действие некоторых веществ – гало- и нитрофенолов, красителей, дикумарина и др.)
Слайд 10
Нарушение транспорта энергии:
АТФ синтезируется в митохондриях, потребляется в
энергозависимых реакциях вне их. Транспорт энергии макроэргической связи молекулы
АТФ осуществляется креатинфосфокиназной системой, функция которой – перенос энергии из митохондрий к местам ее потребления.
Нарушения энергетического обмена адениннуклеотидов и креатинфосфата характерны для патологии миокарда и многих мышечных заболеваний (прогрессирующие мышечные дистрофии, полимиозиты, атрофические расстройства мышц в результате их денервации и др.).
Слайд 11
Нарушение использования энергии:
Энергия используется на процессы синтеза, осмотическую

и механическую работу.
Синтетические процессы в клетках осуществляются за счет
энергии АТФ либо при участии других производных высокоэнергетических соединений, получающих свои концевые фосфатные группы от АТФ (дезоксирибонуклеотид-5-фосфаты, нуклеотид-5 фосфаты и др.). Нарушение процессов синтеза – снижение скорости протекания процессов регенерации. В целом – влияние на характер развития процессов репарации и восстановления структуры и функции.
В основе осмотической работы клетки – поддержание концентрационных градиентов (энергозависимый процесс). Энергия, необходимая для активного транспорта ионов, высвобождается К+, Na+, Са++-АТФ-азами, встроенными в мембраны. Прохождение Na в клетку запускает процесс фосфорилирования, выход К из клетки – дефосфорилирования белков. Следовательно, нарушение функционирования АТФ-аз сопровождается также нарушением использования энергии клеткой.
Механическая работа – двигательная активность (сокращение мышц перемещение органелл клетки).
Слайд 12
Мышечное перенапряжение (перетренированность):
Скелетные мышцы защищены от развития необратимого
низкоэнергетического состояния и крайней степени деградации адениннуклеотидов тем, что
при интенсивных АТФ-азных нагрузках развивается утомление и дальнейшая работа мышц становится невозможной.
Уменьшение величины и темпа сокращения, неполное расслабление (несовершенство нервной регуляции, чрезмерно высокий темп, неправильно сформированный двигательный навык, накопление метаболитов).
Может возникать остро после однократной, предельной, чрезмерной нагрузки и накапливаться постепенно в течение определенного промежутка времени.
Микротравмы, дистрофические изменения.
Изменение нервной регуляции, общего состояния, снижение энергетических ресурсов, ухудшение функционального состояния отдельных органов и систем обусловливают падение работоспособности, ухудшение спортивных результатов, повышенную утомляемость, снижение силы, скорости, ухудшение координации движений.
Слайд 13
Нарушение энергетического обмена на уровне целостного организма:
Суточная потребность
энергии у взрослого человека – 25-30 ккал/кг массы тела
в сутки.
Энергетические затраты – 2500-5000 ккал в сутки
Энергетические затраты измеряются методами
прямой и непрямой калориметрии
Слайд 14
Для определения количества затрачиваемой организмом энергии применяют (I):
Прямую
калориметрию (непосредственное измерение тепла, выделяемого организмом)
Основана на непосредственном учете
в биокалориметрах количества тепла, выделенного организмом. Биокалориметр представляет собой герметизированную и хорошо теплоизолированную от внешней среды камеру. В камере по трубкам циркулирует вода. Тепло, выделяемое находящимся в камере человеком или животным, нагревает циркулирующую воду. По количеству протекающей воды и изменению ее температуры рассчитывают количество выделенного организмом тепла.
Слайд 15
Для определения количества затрачиваемой организмом энергии применяют (II):
Непрямую

калориметрию (энергетический обмен оценивают, исследуя газообмен)
Основана на том, что
кислород, поглощаемый организмом, используется для окисления белков, жиров и углеводов. Окислительный распад 1 г каждого из этих веществ требует неодинакового количества О2 и сопровождается освобождением различного количества тепла.
Наиболее распространен способ Дугласа-Холдейна, при котором в течение 10-15 мин собирают выдыхаемый обследуемым человеком воздух в мешок из воздухонепроницаемой ткани (мешок Дугласа). Затем определяют объем выдохнутого воздуха и процентное содержание в нем О2 и СО2.
Количество тепла, освобождающегося после потребления организмом 1 л О2 на окисление определенного пищевого вещества, носит название калорического эквивалента кислорода:
УГЛЕВОДЫ - 5,05 ккал/л;
ЖИРЫ - 4,69 ккал/л;
БЕЛКИ - 4,46 ккал/л.
Зная общее количество О2, использованное организмом, можно вычислить энергетические затраты только в том случае, если известно, какие вещества — белки, жиры или углеводы, окислились в теле. Показателем этого может служить дыхательный коэффициент.
Дыхательным коэффициентом (ДК) называется отношение объема выделенного СО2 к объему поглощенного О2. ДК различен при окислении белков, жиров и углеводов:
ДК для углеводов = 1,0
ДК для белков = 0,8
ДК для жиров = 0,7
Слайд 16
Компенсаторные процессы при нарушениях энергетического обмена
Мобилизация субстратов
Увеличение сродства
Hb к кислороду
Усиление анаэробных процессов
Изменение интенсивности обмена веществ (гипобиоз)
Слайд 17
ОСНОВНОЙ ОБМЕН -
энергетические затраты (кал/сут), связанные с поддержанием
необходимого для жизни уровня окислительных процессов, деятельностью постоянно работающих
органов, обеспечением минимального мышечного тонуса
(минимальный уровень энергозатрат организма, необходимый для поддержания
жизнедеятельности организма в условиях физического и эмоционального покоя)
Интенсивность энергетического обмена значительно варьирует и зависит от многих факторов. Поэтому для сравнения энергетических затрат у разных людей была введена условная стандартная величина - основной обмен.
Слайд 18
Основной обмен
Основной обмен определяется в стандартных условиях:
утро, состояние
бодрствования, эмоциональный и физический покой (положение лежа, мышцы расслаблены);
натощак (через 12-16 часов после приема пищи);
температура среды около 220С (зона температурного комфорта).
Согласно формуле Дрейера, суточная величина основного обмена в килокалориях (H) составляет:
H=W0,5/K∙A0,1333,
W — масса тела, г;
А — возраст человека;
К — константа, равная для мужчины 0,1015, а для женщины — 0,1129.
НОРМЫ ОСНОВНОГО ОБМЕНА:
У мужчин среднего возраста - 1 ккал/кг/час;
у женщин среднего возраста - 0,9 ккал/кг/час;
у стариков - 0,7 ккал/кг/час;
у детей 7 лет - 1,8 ккал/кг/час;
Слайд 19
Факторы, влияющие на основной обмен:
Пол (у женщин на
10-15% ниже)
Возраст (у новорожденных – 38-42 ккал/кг массы, у
1,5-годовалых – 56-60 ккал/кг, у 7-летних – 44-45 ккал/кг, у 12-летних – 32-34 ккал/кг, у взрослых – 25-30 ккал/кг). У детей в возрасте 3-5 лет и в период полового созревания он выше, чем у взрослых, у пожилых людей он снижается.
Характер питания (при белковом питании основной обмен выше)
Воздействие климатических факторов (адаптация к холоду)
Отклонения ОО более, чем на 10-15% - показатель патологии.
Слайд 20
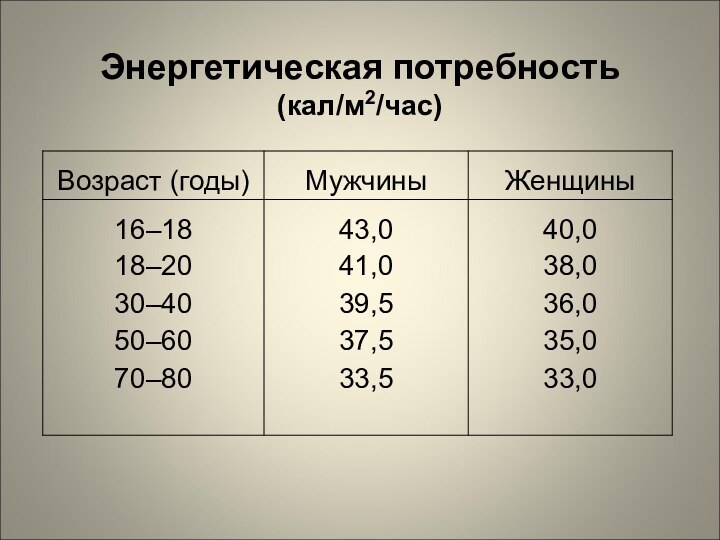
Энергетическая потребность
(кал/м2/час)
Слайд 21
Причины повышения основного обмена
Нарушения нервной регуляции (активация симпато-адреналовой
системы, стресс, заболевания ЦНС и др.);
Нарушения гормональной регуляции (щитовидная
железа, гипофиз, надпочечники: тиреотоксикоз, гиперкортицизм и др.);
Повышение температуры тела: повышение температуры тела на 10С увеличивает энергетические потребности на 10% (лихорадка, перегревание);
Гипоксия (активация работы органов дыхания, сердечно-сосудистой системы);
Эндогенные и экзогенные интоксикации (опухолевый рост, инфекционные заболевания и др.);
Голодание (1 период).
Слайд 22
Изменение энергетических потребностей при некоторых патологических состояниях (в
% к норме)
Слайд 23
Причины понижения основного обмена
Нарушения эндокринной регуляции обмена веществ
(гипотиреоз, недостаточность надпочечников и др.)
Голодание (2 стадия)
Длительная гиподинамия, паралич
мышц
Шок (торпидная фаза)
Тяжелая гипоксия
Искусственное снижение основного обмена (гибернация)
Слайд 24
Голодание – патологический процесс, обусловленный адаптацией к дефициту

калорий, субстратов и незаменимых компонентов пищи, развивающийся в результате
полного отсутствия или недостаточного поступления в организм пищевых веществ, либо при нарушениях состава пищи и ее усвоения (субстратно-энергетическая недостаточность)
Голодание как социальная проблема, а также как патологический процесс, сопровождающий ряд заболеваний
Большой вклад в изучение голодания был сделан В.А. Манассеиным (1869), В.В. Пашутиным (1902) и его учениками. Накоплено много фактов, свидетельствующих о том, что при голодании прежде всего осуществляются приспособительные механизмы, происходит своеобразная ферментативная адаптация организма к отсутствию питательных веществ и переход на эндогенное питание. Вместе с тем установлено, что нарушение удовлетворения потребности организма в пище приводит к болезням пищевой недостаточности, проявляющимся нарушением работы ферментативных систем и расстройству обменных процессов.
Слайд 25
Классификация голодания
По происхождению:
Физиологическое;
Патологическое;
Лечебное (разгрузочно-диетическая терапия).
По содержанию:
Полное голодание: -
абсолютное (без пищи и воды)(5-7 дней)
- с водой (пища не поступает)
Неполное голодание: недостаточное поступление с пищей белков, жиров, углеводов. Калорийность снижена (недоедание).
Частичное голодание: недостаточное поступление с пищей одного или нескольких необходимых компонентов (витаминов, белков, микроэлементов). Несбалансированное; калорий достаточно, но имеется дефицит некоторых ингредиентов): белковое, жировое, витаминное, минеральное, водное.
+ ускоренное голодание (в условиях стресса, физической нагрузки.
Слайд 26
Причины голодания
Внешние причины:
Отсутствие пищи
Эндогенные причины:
Нарушения переваривания и всасывания
основных питательных веществ
Состояния, сопровождающиеся повышением концентрации провоспалительных цитокинов
(н-р, лихорадка, опухолевый рост)
Нарушения эндокринной регуляции обмена веществ (н-р, гипертиреоз, сахарный диабет 1 типа)
Потеря белка и/или других нутриентов (н-р, нефротический синдром, ожоговая болезнь)
Психические расстройства (нервная анорексия)
Слайд 27
Анорексия (I):
Расстройство приема пищи, характеризующееся преднамеренным снижением веса,
вызываемым и/или поддерживаемым самим пациентом, в целях похудения или
для профилактики набора лишнего веса.
Причины анорексии (обычно задействованы все три фактора):
биологические (генетическая предрасположенность);
психологические (влияние семьи и внутренние конфликты);
социальные (влияние окружающей среды: ожидания, подражания, в частности диеты).
Слайд 28
Анорексию принято считать женским заболеванием, которое проявляется в подростковом
возрасте.
В процентном соотношении: 90% случаев больных анорексией — девушки в возрасте от 12-24
года. В остальные 10% входят женщины более зрелого возраста и мужчины. В развитых странах анорексией страдает каждая 2 девушка из 100 в возрасте от 12 до 24 лет.
Симптомы анорексии
Отрицание поддержания весового минимума, каким бы низким он ни был;
Постоянное ощущение полноты;
Способ питания: кушать стоя, раздроблять еду на мелкие куски;
Нарушения сна;
Изоляция от общества;
Панический страх поправиться.
Анорексия (II):
Слайд 29
Факторы, влияющие на продолжительность жизни при голодании
Отношение массы
тела к площади поверхности. Чем больше удельная поверхность, тем
значительнее расходование энергии и, следовательно, напряженнее обменные процессы в тканях для обеспечения гомойотермии;
Зависимость температуры тела от температуры окружающей среды;
Объем жировых запасов;
Конституция;
Пол;
Возраст. Небольшие размеры тела и менее совершенная регуляция обмена и теплообмена объясняют быструю смерть новорожденных при голодании. Возрастное снижение уровня основного обмена определяют большую продолжительность голодания у пожилых людей и животных;
Внешняя температура;
Наличие стресса, физической нагрузки;
Наличие сопутствующих заболеваний;
Продолжительность голодания определяется индивидуальными особенностями, связанными с характером нервно-гуморальной регуляции и реактивности.
Слайд 30
Периоды полного голодания по состоянию обмена веществ и
энергии
Энергетические резервы:
Гликоген – 1600 ккал
Мобилизуемые белки – 24000 ккал
Триацилглицериды
– 135000 ккал
Величина запасов, которые организм может использовать при голодании – 40-50% от массы тела
Слайд 31
Основные характеристики первого периода голодания. Период адаптации.
Изменения
гормонального фона: активизация САС (содержание адреналина возрастает в 5-7
раз), увеличение АКТГ, кортизола, альдостерона, снижение тиреоидных гормонов, пролактина, гистамина. Уменьшение секреции инсулина, увеличение продукции глюкагона:
- Активация гликогенолиза в печени в первые 12-24 часа (катехоламины, глюкагон)
- Активация глюконеогенеза и липолиза (АКТГ, глюкокортикоиды, вазопрессин)
Выраженная стресс-реакция
Повышение основного обмена; максимальные ежесуточные потери веса: 1,0-1,4 кг/сут (потеря жидкости и продуктов катаболизма)
В конце первой недели голодания – нарастание концентрации кетоновых тел (ацидотический криз)
Слайд 32
Стационарный период голодания:
Уменьшается утилизация глюкозы мышцами и жировой
тканью
Интенсификация липолиза, выработка энергии за счет свободных жирных кислот
Индукция
синтеза ферментов, обеспечивающих использования тканями кетоновых тел (концентрация кетонов возрастает в 20-30 раз)
ДК=0,7
«Спонтанная» желудочная секреция
Метаболический кетоацидоз (6-9-й день)
Слайд 33
Изменения функционального состояния органов и систем во втором
периоде голодания
Брадикардия, ↓ сократимости миокарда, ↓ АД
↓ частоты дыхания,
↓ ЖЕЛ
Активизация секреции пищеварительных желез на 7-8 день; в дальнейшем – стойкое угнетение секреции и атрофия слизистой ЖКТ
Вторичный иммунодефицит
Анемия (дефицит белка, железа, витамина В12)
Гипотиреоз, эндогенная гипотермия
Сонливость, апатия, ↓ памяти, внимания
Слайд 34
Потеря веса различных органов и тканей к концу
второго периода полного голодания
Слайд 35
Терминальный период голодания
Наступает после потери 40-45% от исходной
массы тела (у взрослого человека массой 70 кг –
на 65-75 день)
В качестве энергетического субстрата используются незаменимые белковые структуры
Белковое истощение
Снижение теплопродукции
Нарушение деятельности нервной и эндокринной систем
Слайд 37
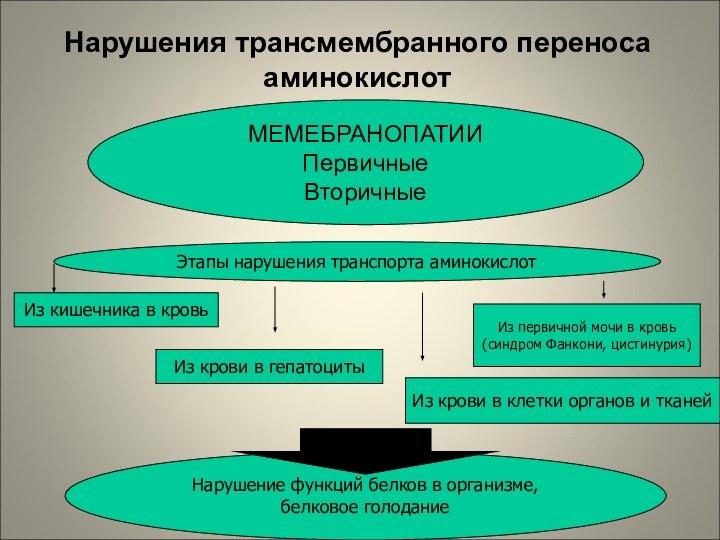
Типовые нарушения белкового обмена
Несоответствие поступления белков потребностям организма
(количественный и качественный недостаток, избыток)
Нарушения переваривания и всасывания белков
Нарушения
трансмембранного переноса аминокислот
Нарушения метаболизма аминокислот (первичные, вторичные)
Изменения содержания белков в плазме крови (диспротеинемия)
Нарушения конечных этапов катаболизма белков (гиперазотемия)
Конформационные изменения белков, сопровождающиеся их накоплением внутри и вне клеток (диспротеинозы)
Слайд 38
Интегральным показателем белкового обмена является азотистый баланс:
это разница
между количеством азота, поступающего в организм с пищей за
сутки, и количеством азота, выделяемым организмом за то же время в составе азотсодержащих компонентов мочи и кала (мочевина, мочевая кислота, аминокислоты, креатинин, соли аммония).
У здорового взрослого человека процессы распада и синтеза белка уравновешены, т.е. имеется азотистое равновесие. При этом суточная деградация белка составляет 30-40 г. Азотистый баланс может быть положительным или отрицательным.
Слайд 39
Положительный азотистый баланс – задержка азота в организме
в форме белка (усиление анаболических процессов)
В норме: интенсивный рост
(дети, подростки); регенерация; беременность, лактация; применение андрогенов
При патологии: крупные доброкачественные опухоли, некоторые злокачественные опухоли (без ↑ провоспалительных цитокинов); гиперпродукция гормона роста, инсулина
Слайд 40
Суточная потребность в белках в зависимости от возраста
Слайд 41
Отрицательный азотистый баланс – потеря азота в результате
протеолиза (усиление катаболических процессов)
Дефицит белка и аминокислот в пище
I
период голодания
Стресс
Инсулинзависимый сахарный диабет (СД 1)
Гиперкортицизм
Длительная лихорадка
Злокачественные опухоли
Инфекционные заболевания
Следствием отрицательного азотистого баланса являются дистрофические изменения в органах, похудание, в детском возрасте - задержка роста и умственного развития.
Слайд 42
Проявления белковой недостаточности
Уменьшение массы тела
Отрицательный азотистый баланс
Уменьшение синтеза
мобильных белков (альбумина, трансферрина …)
Уменьшение синтеза структурных белков (коллаген,
эластин и др.) - дистрофия, атрофия, торможение физиологической регенерации
Интоксикация
Нарушения гомеостаза (температурного, КОС, водно-электролитного)
Слайд 43
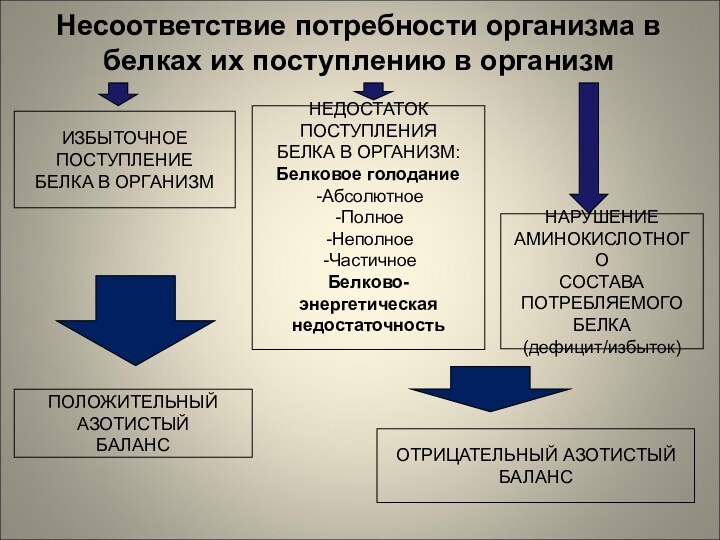
Несоответствие потребности организма в белках их поступлению в
организм
НЕДОСТАТОК
ПОСТУПЛЕНИЯ
БЕЛКА В ОРГАНИЗМ:
Белковое голодание
Абсолютное
Полное
Неполное
Частичное
Белково-энергетическая
недостаточность
ИЗБЫТОЧНОЕ
ПОСТУПЛЕНИЕ
БЕЛКА
В ОРГАНИЗМ
НАРУШЕНИЕ
АМИНОКИСЛОТНОГО
СОСТАВА
ПОТРЕБЛЯЕМОГО
БЕЛКА
(дефицит/избыток)
ОТРИЦАТЕЛЬНЫЙ АЗОТИСТЫЙ
БАЛАНС
ПОЛОЖИТЕЛЬНЫЙ
АЗОТИСТЫЙ
БАЛАНС
Слайд 44
Белково-энергетическая недостаточность
алиментарно-зависимое состояние, вызванное достаточным по длительности и/или
интенсивности преимущественным белковым и/или энергетическим голоданием,
проявляющееся дефицитом массы тела
и/или роста и комплексным нарушением гомеостаза организма в виде изменения основных метаболических процессов, водно-электролитного дисбаланса, изменения состава тела, нарушения нервной регуляции, эндокринного дисбаланса, угнетения иммунной системы, дисфункции желудочно-кишечного тракта и других органов и систем
Слайд 45
Меньшее в сравнении с потребным поступление белка в
организм ребенка, особенно раннего возраста, приводит к синдрому недостаточного
питания. Основу этого синдрома составляет белково-энергетическая недостаточность (БЭН).
Алиментарный маразм (син. алиментарная дистрофия)
Квашиоркор
Маразм-Квашиокор (маразматический квашиоркор)
Клинико-патогенетические варианты тяжелой БЭН
Слайд 46
Алиментарный маразм (I):
Болезнь длительного недостаточного питания, проявляющаяся общим
истощением, отеками, расстройством всех видов обмена веществ, дистрофией тканей
и органов с нарушением их функций.
Развивается у детей до 1 года, возникает как результат длительного недостаточного и качественно неадекватного питания (преобладает энергетическая недостаточность). Основной этиологический фактор - низкая калорийность пищи. Условно можно принять, что снижение энергетической ценности пищи на 40-50% против исходной нормальной калорийности приводит к развитию болезни.
Слайд 47
Алиментарный маразм (II):
При недостаточном поступлении в организм пищевых

веществ для восполнения энергетических затрат постепенно расходуются запасы жиров
и углеводов, усиливается катаболизм белка и уменьшается его синтез из-за недостаточного поступления незаменимых аминокислот.
При тяжелой алиментарной дистрофии полностью исчезают жировые депо и запасы гликогена в организме, возникает атрофия мышц, выявляются дистрофические изменения миокарда, печени, селезенки, слизистых оболочек.
Активность большинства клеточных ферментов падает, нарушается нервная и эндокринная регуляция вегетативных функций и обмена веществ, нарастает функциональная недостаточность сердечно-сосудистой, дыхательной, пищеварительной систем.
Снижается уровень сахара крови, холестерина и нейтрального жира, повышается уровень молочной кислоты, развивается тканевой ацидоз.
Содержание белка в плазме крови снижается, уменьшается онкотическое давление плазмы, что приводит к развитию общего отека тканей. Отечная жидкость скапливается в подкожной клетчатке и серозных полостях. Однако отеки не являются обязательным признаком болезни, возможна и безотечная форма.
Слайд 48
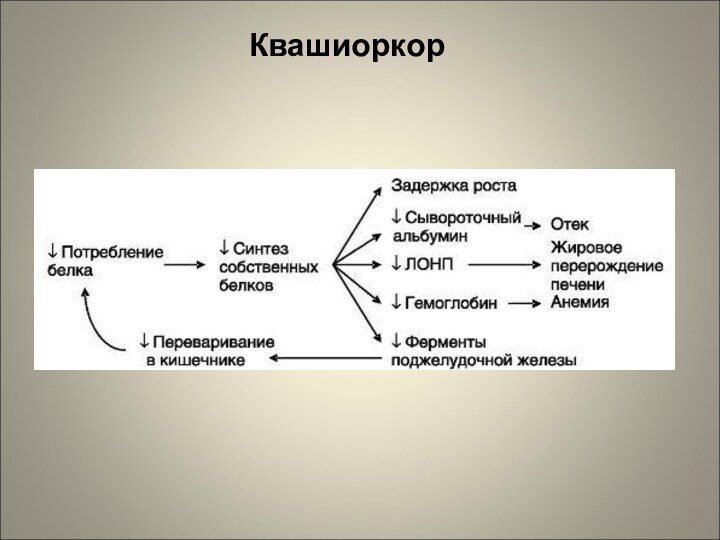
Квашиоркор – несбалансированная алиментарная БЭН (I):
Развивается у детей
в возрасте 3-6 лет;
Ведущим в патогенезе является недостаток в организме
ребенка пластических веществ и ферментов (в патогенезе преобладает белковая недостаточность). Особенно легко квашиоркор развивается у детей раннего возраста, т.к. для обеспечения интенсивных процессов роста и развития необходимо поддержание постоянного положительного азотистого баланса в организме (поступление белков должно превышать их расходование).;
энергетический дефицит компенсируется избыточным
потреблением углеводов.
Слайд 49
Для типичной клинической картины квашиоркора характерна Тетрада Джелифара,
включающая
Отеки
Отставание в физическом развитии
Атрофия мышц с сохранением подкожного
жирового слоя
Отставание в нервно-психическом развитии
Квашиоркор – несбалансированная алиментарная БЭН (II)
Слайд 50
Атрофические изменения в органах и тканях при БЭН:
ЦНС
- замедление умственного развития;
пищеварительная система - расстройства всасывания и
диарея;
ССС - гипотензия;
иммунная система - уменьшение синтеза антител и повышение чувствительности к инфекциям;
красный костный мозг - анемия;
скелетные мышцы - гиподинамия, мышечная слабость;
кости - задержка роста скелета.
Слайд 52
Нарушение расщепления белков в ЖКТ
Нарушение расщепления
белка в
желудке
Нарушение переваривания
белка в тонком кишечнике
Слайд 53
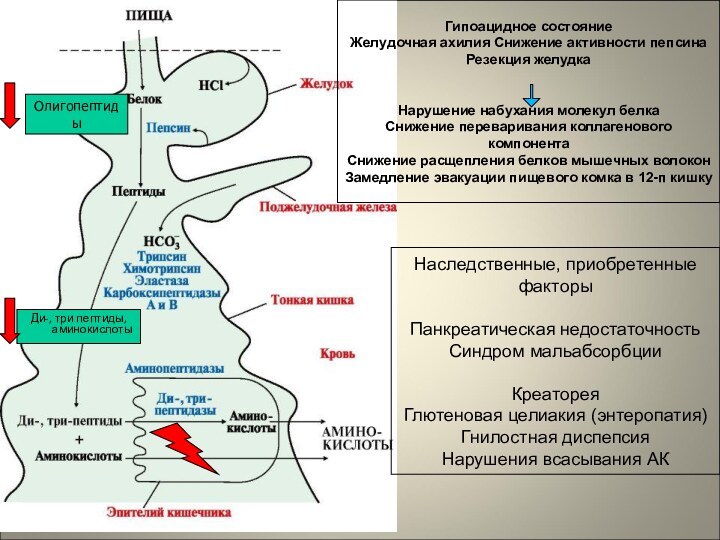
Олигопептиды
Ди-, три пептиды, аминокислоты
Гипоацидное состояние
Желудочная ахилия Снижение активности
пепсина
Резекция желудка
Нарушение набухания молекул белка
Снижение переваривания коллагенового компонента
Снижение расщепления
белков мышечных волокон
Замедление эвакуации пищевого комка в 12-п кишку
Наследственные, приобретенные
факторы
Панкреатическая недостаточность
Синдром мальабсорбции
Креаторея
Глютеновая целиакия (энтеропатия)
Гнилостная диспепсия
Нарушения всасывания АК
Слайд 54
Нарушения трансмембранного переноса аминокислот
МЕМЕБРАНОПАТИИ
Первичные
Вторичные
Этапы нарушения транспорта аминокислот
Из кишечника
в кровь
Из крови в гепатоциты
Из первичной мочи в кровь
(синдром
Фанкони, цистинурия)
Из крови в клетки органов и тканей
Нарушение функций белков в организме, белковое голодание
Слайд 55
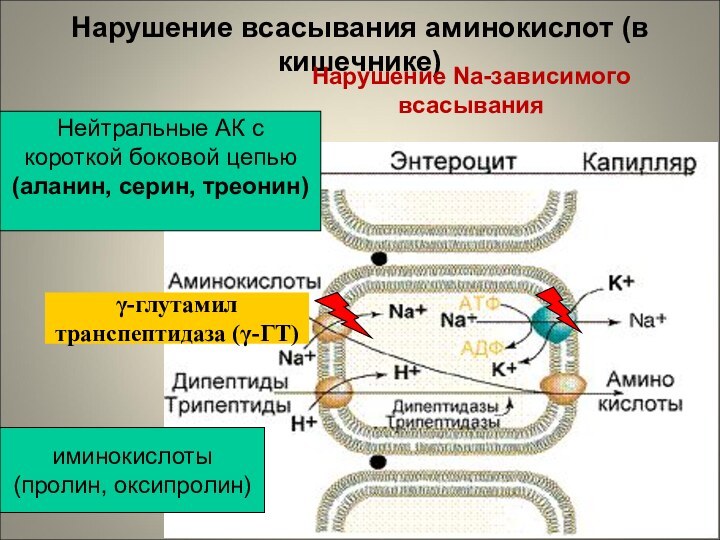
Нарушение всасывания аминокислот (в кишечнике)
иминокислоты
(пролин, оксипролин)
Нейтральные
АК с
короткой боковой цепью
(аланин, серин, треонин)
Нарушение Na-зависимого всасывания
γ-глутамил
транспептидаза
(γ-ГТ)
Слайд 56
Расстройства метаболизма аминокислот
По происхождению:
Первичные (врожденные) - фенилкетонурия, алкаптонурия.
вторичные
(приобретенные или симптоматические) расстройства - сахарный диабет,
гипокортицизм, недостаточность
СТГ).
По преимущественно нарушенной реакции метаболизма аминокислот:
нарушение трансаминирования (недостаток пиридоксина, ограниченный синтез белков, нарушение соотношения между субстратами реакции).
нарушение дезаминирования (проявляется в виде гипераминоацидемии и аминоацидурии).
нарушение декарбоксилирования.
наследственное нарушение обмена некоторых аминокислот:
нарушение обмена фенилаланина (развивается фенилкетонурия)
нарушение обмена тирозина (развивается тирозиноз, алкаптонурия и альбинизм)
нарушение обмена триптофана (развивается пеллагра).
Слайд 57
Нарушение окислительного дезаминирования
Нарушение окислительного дезаминирования -
патология катаболизма аминокислот -
удаления α-аминогруппы, которая выделяется в виде аммиака и образования
безазотистого остатка (α-кетокислоты).
Продукт дезаминирования - аммиак.
Слайд 58
Катаболизм аминокислот и, соответственно, реакции дезаминирования ускоряются при:
• голодании в результате
ускорения распада белков тканей;
• поступлении с пищей больших количеств белка;
• сахарном
диабете и других длительно протекающих тяжелых заболеваниях, также сопровождающихся распадом тканевых белков.
Сопровождается аммиачной интоксикацией
Нарушение окислительного дезаминирования
Слайд 59
Нарушение трансаминирования
Нарушение трансаминирования – нарушение реакции переноса аминогруппы
с аминокислоты (донора) на α-кетокислоту (акцептор), в результате чего образуются новая
кетокислота и новая аминокислота.
Путем трансаминирования из соответствующих α-кетокислот синтезируются заменимые аминокислоты, если их в данный момент в ткани недостаточно. Таким образом происходит перераспределение аминного азота в тканях и органах.
В6 - пиридоксальфосфат
НЕДОСТАТОЧНОСТЬ АМИНОКИСЛОТ
Слайд 60
Нарушение декарбоксилирования аминокислот
Декарбоксилирование АК - процесс отщепления карбоксильной
группы аминокислот в виде СО2. Несмотря на ограниченный круг
аминокислот и их производных, подвергающихся декарбоксилированию в животных тканях,
образующиеся продукты реакции – биогенные амины – оказывают сильное фармакологическое действие на множество физиологических функций человека и животных.
Гистидин гистамин
глутаминовая кислота гамма-аминомасляная кислота
триптофан серотонин
Слайд 61
Нарушения белкового состава плазмы крови
Гиперпротеинемии (состояния, характеризующиеся увеличением
общего содержания белка в плазме крови):
-гиперсинтетические: Усиленный антителогенез
(воспаление, аллергия, вакцинация) – абсолютная гиперпротеинемия;
Гемоконцентрационные: Сгущение крови - относительная гиперпротеинемия;
Парапротеинемия (греч. para-отклонения, несоответствие; protein-белок; haima-кровь) (состояния, характеризующиеся наличием в плазме крови белков, в норме в ней не встречающиеся) - синтез патологических белков – альфа-фетопротеина (эмбриональный белок) при первичном раке печени, IgM – при миеломной болезни;
Гипопротеинемии (состояния, характеризующиеся уменьшением общего содержания белка в плазме крови):
Гипосинтетические
Предпеченочная - дефицит пищевого белка.
Печеночная - нарушение белоксинтезирующей функции печени (интоксикации, гепатит, цирроз печени)
Постпеченочная - избыточная потеря белка с экссудатом, протеинурия.
- гемодилюционные
Слайд 62
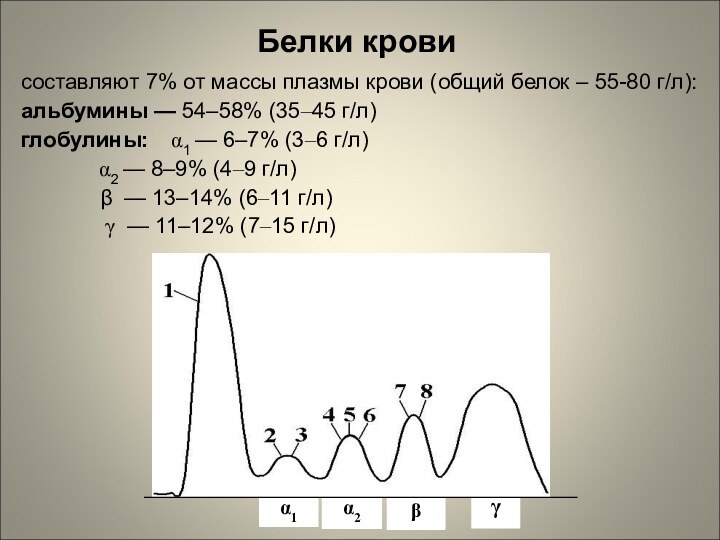
составляют 7% от массы плазмы крови (общий белок
– 55-80 г/л):
альбумины — 54–58% (35–45 г/л)
глобулины: α1 —
6–7% (3–6 г/л)
α2 — 8–9% (4–9 г/л)
β — 13–14% (6–11 г/л)
γ — 11–12% (7–15 г/л)
Белки крови
Слайд 63
ГИПОПРОТЕИНЕМИЯ
Ложная (псевдогипопротеинемия): гемодилюция
Истинная:
-Первичная (агаммаглобулинемия Брутона, анальбуминемия)
-Вторичная (чаще гипоальбуминемия):
-
пищевая недостаточность белка (квашиоркор)
- нарушения переваривания и всасывания белка
-
печеночно-клеточная недостаточность
- потеря белка с мочой
- потеря белка с ожоговой поверхности
Слайд 64
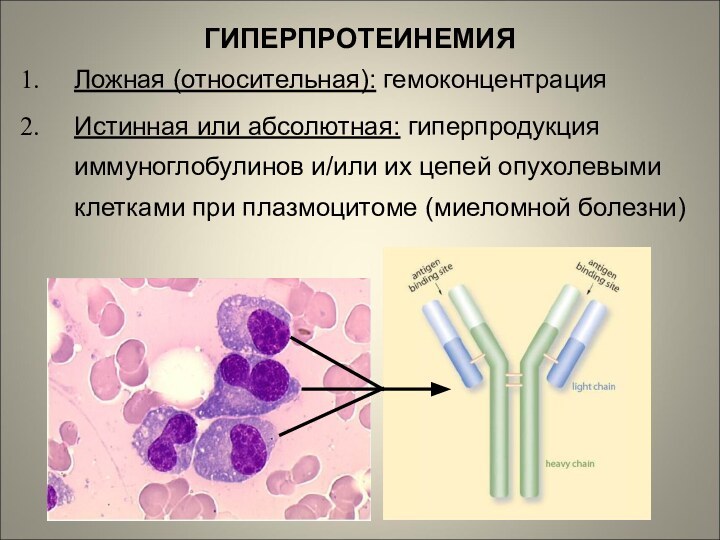
ГИПЕРПРОТЕИНЕМИЯ
Ложная (относительная): гемоконцентрация
Истинная или абсолютная: гиперпродукция иммуноглобулинов и/или
их цепей опухолевыми клетками при плазмоцитоме (миеломной болезни)
Слайд 65
Продукционная
Смешанная
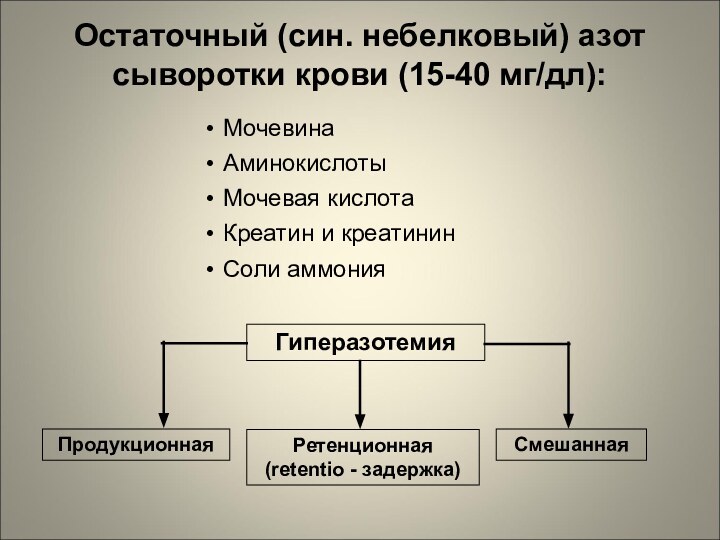
Ретенционная (retentio - задержка)
Гиперазотемия
Остаточный (син. небелковый) азот сыворотки
крови (15-40 мг/дл):
Мочевина
Аминокислоты
Мочевая кислота
Креатин и креатинин
Соли аммония
Слайд 66
Гиперазотемия
Продукционная:
- нарушение превращения аммиака в мочевину (печеночно-клеточная
недостаточность) - ↑ аммиака
- усиление катаболизма белков (III период
голодания, интоксикации, лихорадка, распад опухоли и пр.) - ↑ мочевины, аминокислот
Ретенционная:
- нарушение выведения азотистых катаболитов (острая и хроническая почечная недостаточность) - ↑ мочевины, аминокислот, мочевой кислоты, креатинина
Смешанная:
- шок (травматический, ожоговый, синдром длительного сдавления) - ↑ всех компонентов
Слайд 67
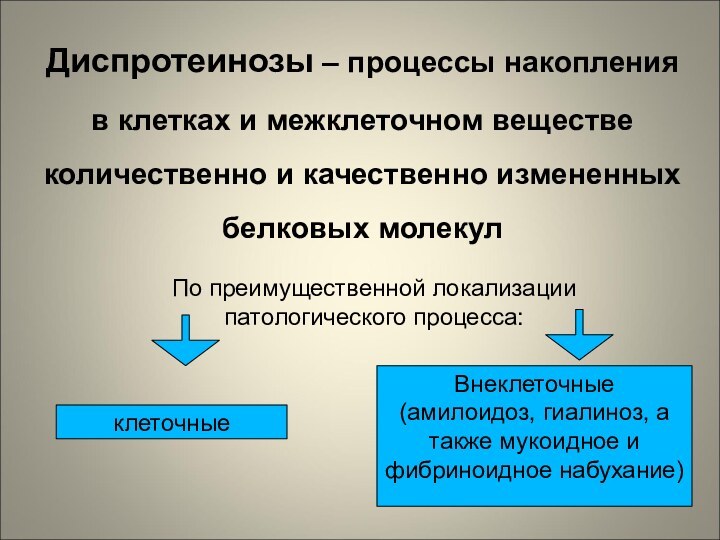
Диспротеинозы – процессы накопления в клетках и межклеточном
веществе количественно и качественно измененных белковых молекул
По преимущественной локализации
патологического процесса:
клеточные
Внеклеточные
(амилоидоз, гиалиноз, а также мукоидное и фибриноидное набухание)
Слайд 68
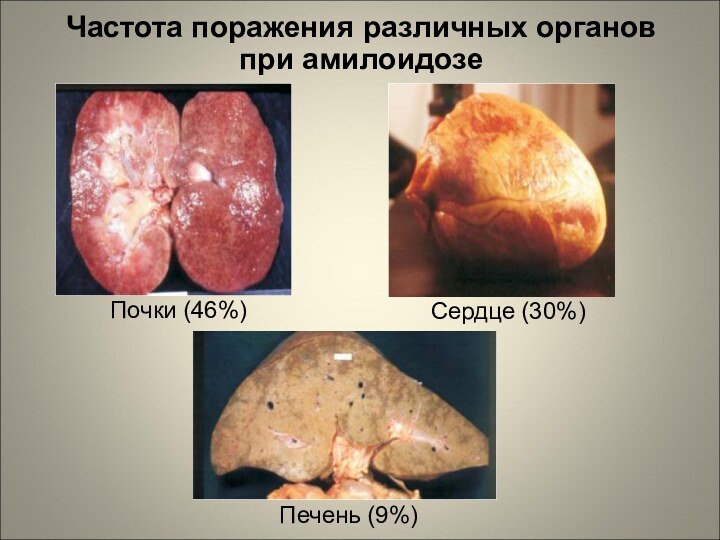
Частота поражения различных органов при амилоидозе
Почки (46%)
Сердце (30%)
Печень
(9%)
Слайд 69
Механизмы конформационных нарушений белковых молекул (амилоидогенной трансформации)
Естественная способность
белка к приобретению патологической конформации при определенных условиях (возраст,
повышение концентрации белка)
Мутации, ведущие к замене аминокислот в первичной структуре белка (наследственные формы амилоидоза)
Ограниченный протеолиз молекулы белка-предшественника (белок-предшественник β-амилоида при б-ни Альцгеймера)