Слайд 2
Иммунная природа отторжения чужеродных (прежде всего аллогенных) трансплантатов
была доказана в 40-е годы прошлого года P. Medawar,
продемонстрировавшим ключевую роль лимфоцитов в реакции отторжения и возможность развития этой реакции по типу вторичного иммунного ответа.
Дополнительный довод в пользу клеточной иммунологи- ческой природы отторжения аллотрансплантата — E.N. Mitchison по переносу сингенному реципиенту с лимфоцитами состояния сенсибилизации к трансплантату.
Слайд 4
Генетика гистосовместимости
Успехи в осуществлении анализа генетических основ тканевой
несов- местимости и трансплантационного иммунитета были связаны с использо-
ванием генетически чистых линий мышей и следовали за достижениями в изучении локусов гистосовместимости, прежде всего MHC.
Дж. Снелл (G.D. Snell) — один из сооткрывателей MHC — сформулировал генетические законы трансплантации.
Слайд 5
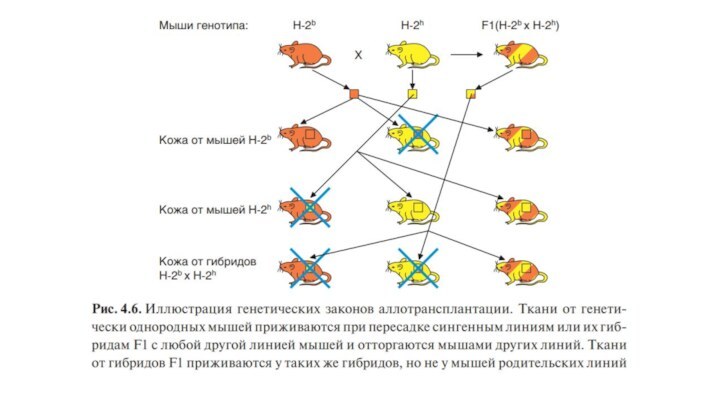
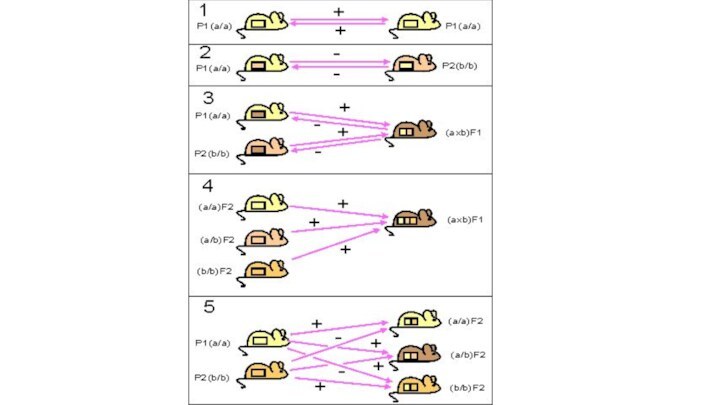
Выведение достаточного количества инбредных линий мышей позволило сформулировать результаты трансплантации
между этими линиями в виде законов трансплантации (авторы Little,
Tyzzer и Snell).
Трансплантация внутри одной инбредной линии (сингенная трансплантация) всегда успешна.
Трансплантация между особями разных инбредных линий (аллогенная трансплантация) терпит неудачу.
Трансплантаты родительских линий Р1 или Р2 приживаются у гибридов первого поколения (Р1*Р2) F1.
Трансплантаты гибридов второго поколения F2 приживаются у гибридов F1.
Трансплантаты родительских линий Р1 и Р2 приживаются у одних особей F2, но отторгаются у других.
Слайд 7
Известно много (у мышей — 30–40) генетических локусов,
обусловливающих тканевую совместимость
Однако с различиями только по одному локусу
— MHC
(у мышей — Н-2, у человека — HLA) связано развитие сильной трансплантационной реакции, релизуемой в пределах двух недель.
Наибольшую роль в развитии реакции отторжения играют различия по антигенам MHC-II, вызывающие преимущественно Т-клеточный иммунный ответ.
Слайд 8
Трансплантационный иммунитет
Рассмотрим феноменологию отторжения аллогенных тканей на примере
трансплантатов кожи. После подсадки кожного лоскута происходит его васкуляризация.
Этот процесс в основном завершается через 3–4 сут.
В случае подсадки органов на сосудистой ножке этот этап отсутствует. Начиная с 5–7-х суток, проявляются признаки иммунной реакции организма — инфильтрация лоскута мононуклеарами, развитие иммунного воспаления.
При различиях между донором и реципиентом по генам MHC отторже- ние происходит на 10–12-е сутки
При различиях по слабым локусам гистосовместимости реакция развивается медленнее и иногда приобретает хроническую форму с постепенным отмиранием клеток трансплантата и их замещением клетками хозяина в течение нескольких месяцев.
Слайд 9
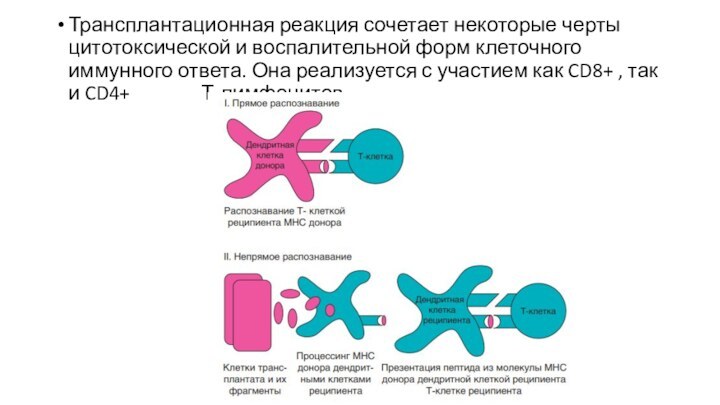
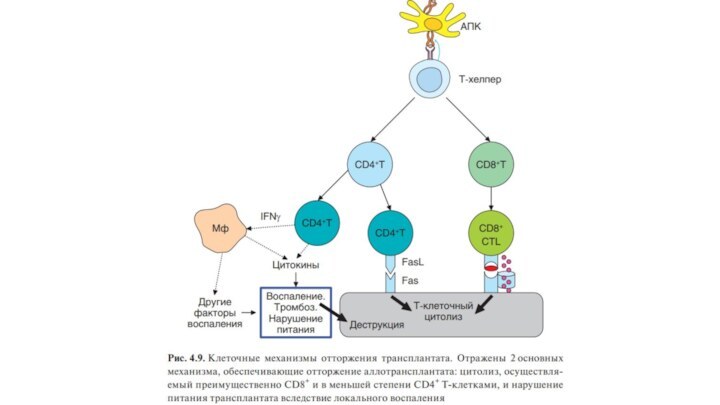
Трансплантационная реакция сочетает некоторые черты цитотоксической и воспалительной
форм клеточного иммунного ответа. Она реализуется с участием как
CD8+ , так и CD4+ Т-лимфоцитов.
Слайд 11
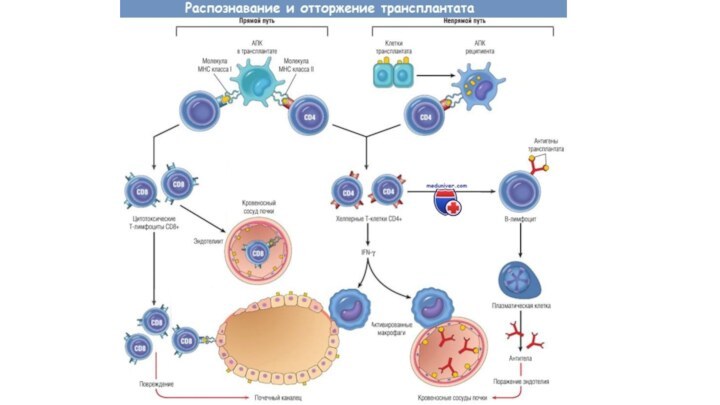
Формирующиеся эффекторные Т-клетки (Th1-клетки и цитототоксические Т-лимфоциты) поступают
в циркуляцию и в результате экспрессии на их поверхности
хемокиновых рецепторов (ССR1, ССR2, ССR3, CCR5 и др.), мигрируют в очаги воспаления, всегда сопутствующего трансплантации, и инициируют реакции, приводящие к отторжению ткани.
Наряду с этими антигенспецифическими клетками в трансплантат мигрируют естественные киллеры, а также воспалительные клетки, прежде всего макрофаги.
Лимфоидная инфильтрация — одно из самых типичных морфологических проявлений трансплантационной реакции
Слайд 13
Повторная подсадка тканей, несущих те же антигены, которые
присутствовали в первом трансплантате, вызывает ускоренную реакцию отторжения, обозначаемую
как реакция second set («второй заход»).
Она проявляется несколько иначе, чем первичная реакция. Основное отли- чие состоит в отсутствии довольно длительной фазы васкуляризации и сокращении индуктивной фазы.
При вторичном ответе на трансплантат с достаточно сильными антигенными отличиями от клеток реципиента, его кровоснабжение, как правило, не устанавливается (отсюда название — «бледный трансплантат»).
При повторной подсадке органов на сосудистой ножке быстро развивается тромбоз сосуда, и кровоснабжение нарушается. Это само по себе препятствует приживлению трансплантата,
Слайд 14
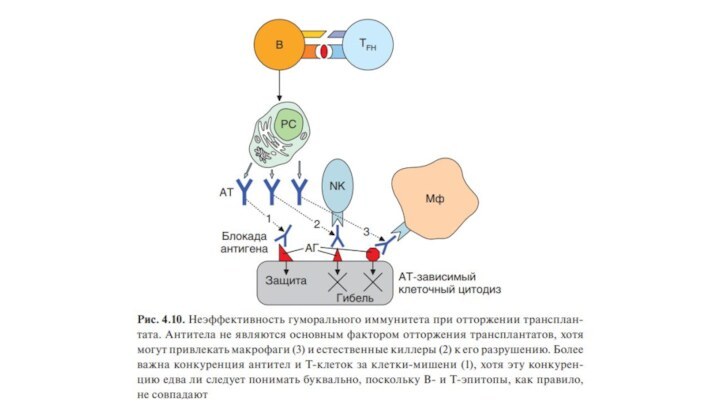
Еще П. Медавар показал, что гуморальные антитела не
играют существенной роли в отторжении аллотраснплантата.
При повторной подсадке аллогенных
тканей антитела, образующиеся в ходе иммунного ответа на аллоантигены, вносят вклад в реакцию отторжения. Они могут диффунди- ровать в трансплантат, формировать иммунные комплексы с мембранными антигенами его клеток, привлекая макрофаги и обусловливая их FсR-зави- симую активацию (рис. 4.10). В конечном счете это способствует развитию воспалительной реакции.
При пересадке ксенотрансплантатов антитела могут играть ключевую роль в отторжении. Однако это не иммунные, а естественные антитела к α-гликановым остаткам, присутствующие в сыворотке крови всех людей.
Слайд 16
Трансплантация костного мозга. Реакция «трансплантат против хозяина»
Основные отличия
иммунных механизмов отторжения костного мозга от типичных механизмов трансплантационного
иммунитета состоят в большем степени вовлечении NK-клеток и реальной роли антител в отторжении аллогенного костного мозга.
Трансплантация аллогенного костного мозга, содержащего Т-лимфоци- ты, может послужить основой для возникновения реакции «трансплантат против хозяина» (РТПХ).
Слайд 17
В настоящее время общепринятым подходом для воспроизведения РТПХ
в экспериментах на мышах служит введение лимфоидных клеток родительской
линии гибридам F1.
В этом случае реципиент не способен отторгать подсаженные клетки, так как они не содержат чужеродных антигенов, но эти клетки распознают молекулы гистосовместимости, унаследованные гибридами от второго родителя, и реагируют на них. При внутривенном введении на 7–10-е сутки развивается системная реакция, сопровождающаяся сплено- и гепатомегалией, а при введении высоких доз клеток - гибелью реципиентов.
При введении клеток в стопу развивается локальная реакция, выявляемая по увеличению региональных лимфатических узлов. Этот вариант часто применяют в экспериментах в качестве теста на состояние клеточного иммунного ответа у донора клеток.
Слайд 18
Болезнь развивается в двух вариантах — остром и
хроническом.
Острая болезнь «трансплантат против хозяина» развивается в течение 100
суток после облучения и пересадки костного мозга. Раньше ее называли вторичной радиационной болезнью, понимая под первичной прямые последствия облучения.
Реакция на антигены MHC протекает тяжелее реакции на слабые антигены гистосовместимости.
Слайд 19
Типичную для экспериментальной РТПХ клиническую картину, состоящую в
увеличении селезенки, лимфатических узлов и печени наблюдают достаточно редко.
Чаще всего наблюдается поражение трех «мишеней» — кожи (эпидермиса), печени (эпителия желчных протоков, но не гепатоцитов) и пищеварительного тракта (слизистой оболочки).
Проявлениями РТПХ в этом случае являются сыпь, желтуха, диарея, кишечные кровоизлияния. Массивное слущивание эпителия слизистой оболочки кишечника или обширные некро- тические процессы могут приводить к смертельному исходу.
Слайд 20
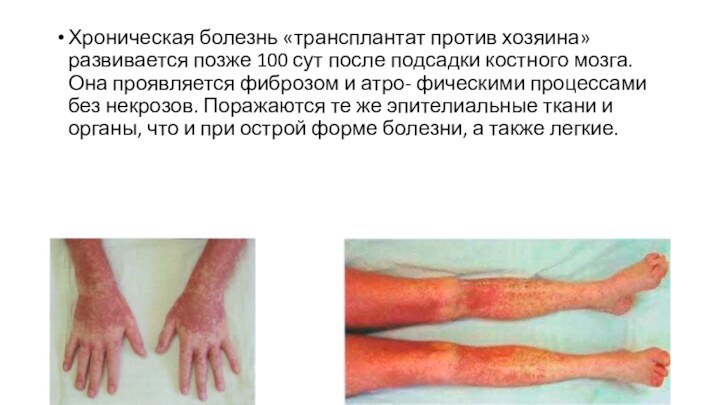
Хроническая болезнь «трансплантат против хозяина» развивается позже 100
сут после подсадки костного мозга. Она проявляется фиброзом и
атро- фическими процессами без некрозов. Поражаются те же эпителиальные ткани и органы, что и при острой форме болезни, а также легкие.
Слайд 21
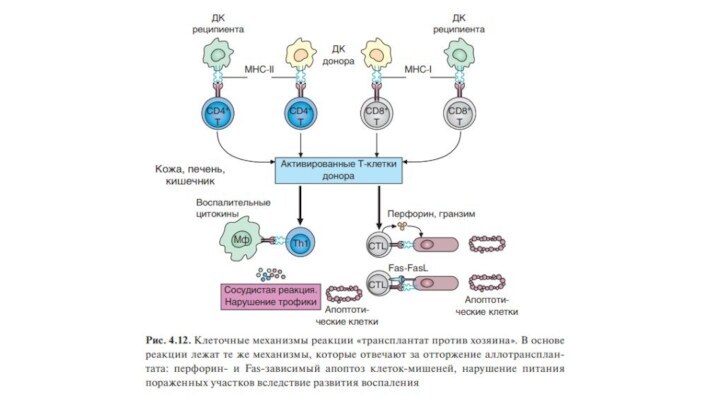
При острой экспериментальной РТПХ основной мишенью донорских лимфоцитов
служат молекулы MHC-II и в первую очередь поражаются экспрессирующие
их клетки. Это основная причина развития сопутствующего иммунодефицита.
Хроническая РТПХ в большей степени направлена против молекул MHC-I.
Поскольку при пересадках клеток происходит отбор доноров, совместимых по MHC, болезнь «трансплантат против хозяина», регистрируемая в практике трансплантаций, обычно обусловлена реакцией Т-клеток на слабые антигены гистосовместимости.