- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Семейная атаксия Фридрейха. Гепатоцеребральная дистрофия. Лабораторные и инструментальные методы диагностики. Принципы лечения
Содержание
- 2. Атаксия Фридрейха – аутосомно-рецессивная патология, когда заболевший
- 3. Код по МКБ-10 G11 Наследственная атаксия По
- 4. Причины атаксии ФридрейхаАФ-развивается в связи с дефицитом
- 6. Диагностика Симптомы атаксии Фридрейха Клиническая симптоматика более
- 7. Ощущение неуверенности и неловкости во время ходьбы
- 8. Экстраневральными признаками являются:Сердце:Нарастающая дилатационная или гипертрофическая кардиомиопатия.Зачастую
- 11. Лабораторные обследования— обследование крови на определение толерантности
- 12. КТ-главным диагностическим способом всех атаксий . Но
- 13. Лечение Из-за генетической природы заболевания все методы
- 14. МКБ: Нарушения обмена меди (E83.0)Гепатоцеребральная дистрофия ( болезнь
- 15. Формы болезни Вильсона [3]: · Бессимптомная форма;
- 16. Дрожательно-ригидная форма встречается чаще других; начинается в юношеском
- 19. Лабораторные исследования общий анализ крови: лейкопения,
- 20. Лабораторные исследования Лабораторные показатели при гепатолентикулярной дегенерации [6].
- 21. Лейпцигские балльные критерии диагностики болезни Вильсона [11] Родственники по прямой линии вновь выя
- 22. Немедикаментозное лечение [9]: · полупостельный режим – при
- 24. Индикаторы эффективности лечения: · нормализация функциональных проб
- 25. Скачать презентацию
- 26. Похожие презентации
Атаксия Фридрейха – аутосомно-рецессивная патология, когда заболевший ребенок рождается у визуально здоровой пары, но кто-нибудь из родителей является владельцем болезнетворного гена. Болезнь выражается в поражении нервных клеток – преимущественным повреждением пучков Голля, пирамидных путей, корешков и













![Семейная атаксия Фридрейха. Гепатоцеребральная дистрофия. Лабораторные и инструментальные методы диагностики. Принципы лечения Формы болезни Вильсона [3]: · Бессимптомная форма; · Печеночная форма; · Церебральная](/img/tmb/15/1475311/88884a7c172a40cb1b091428c4103500-720x.jpg)



![Семейная атаксия Фридрейха. Гепатоцеребральная дистрофия. Лабораторные и инструментальные методы диагностики. Принципы лечения Лабораторные исследования Лабораторные показатели при гепатолентикулярной дегенерации [6].](/img/tmb/15/1475311/f3c1bb46394912e40173c0b372536289-720x.jpg)
![Семейная атаксия Фридрейха. Гепатоцеребральная дистрофия. Лабораторные и инструментальные методы диагностики. Принципы лечения Лейпцигские балльные критерии диагностики болезни Вильсона [11] Родственники по прямой линии вновь выя](/img/tmb/15/1475311/e52e632e8d7a892561873d81ecf36b08-720x.jpg)
![Семейная атаксия Фридрейха. Гепатоцеребральная дистрофия. Лабораторные и инструментальные методы диагностики. Принципы лечения Немедикаментозное лечение [9]: · полупостельный режим – при высокой активности и декомпенсации цирроза;](/img/tmb/15/1475311/50ba8d7454994652e697a48f044098b8-720x.jpg)


Слайд 3
Код по МКБ-10
G11 Наследственная атаксия
По информации всемирной медицинской
статистики, атаксия Фридрейха является наиболее часто встречающимся вариантом атаксии.
Таким заболеванием страдает в среднем 5-7 пациентов на 100 000 человек, а носителем генного расстройства является один человек среди 120.Заболеванию подвержены как мужчины, так и женщины. Однако болезнь не затрагивает лиц азиатской и негроидной расы.
Слайд 4
Причины атаксии Фридрейха
АФ-развивается в связи с дефицитом или
нарушением структуры белка фратаксина, продуцируемого внутриклеточно в цитоплазме. Мутация
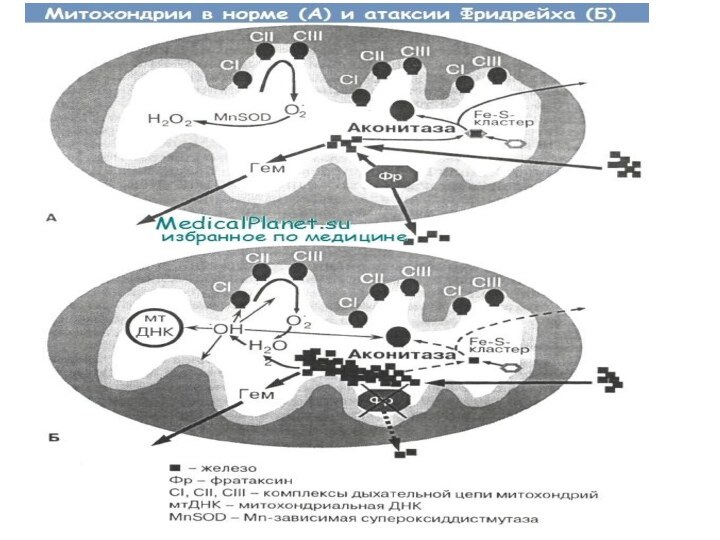
проходит в длинном плече 9-й хромосомы.Функцией белка является перенос железа из энергетических органоидов клетки – митохондрий. Железонакопительная способность митохондрий обусловлена активными процессами окисления в них. При повышении концентрации железа в митохондриях больше чем в десятикратном размере количество общего внутриклеточного железа не превышает пределов нормы, а количество цитоплазматического железа понижается. В свою очередь, это провоцирует стимуляцию генных структур, которые кодируют энзимы, переносящие железо – это ферроксидаза и пермеаза. В результате ещё более заметно нарушается баланс железа внутри клеток.Повышенное количество железа внутри митохондрий вызывает повышение численности агрессивных окислителей – свободных радикалов, повреждающие жизненно важные структуры (в данном случае, клетки).
Слайд 6
Диагностика
Симптомы атаксии Фридрейха
Клиническая симптоматика более четко выражена у людей
в возрасте 13-20 лет.Клиническая картина выражена комбинированием экстраневральных и
неврологических симптомов.Среди неврологических симптомов отмечают:
Расстройство речевого аппарата, дизартрия (может происходить не во всех случаях).
Угнетение коленных и ахилловых рефлексов (в некоторых случаях появляются задолго до развития других симптомов болезни).
Расстройство вибрационной и суставно-мышечной чувствительности.
Слайд 7 Ощущение неуверенности и неловкости во время ходьбы (чаще
всего является одним из самых первых признаков), которые становятся
сильней, когда человек находится в темном помещении. Отмечается пошатывание, пациент нередко спотыкается, могут происходить немотивированные падения. Отмечается невозможность повторить коленно-пяточную пробу, неустойчивость в позе Ромберга. Через время начинается дезориентация в руках, может поменяться почерк, ноги начинают быстро уставать. Наблюдается тремор при вытянутых руках, проведение пальценосовой пробы невозможно (человек все время промахивается).Происходит полное исчезновение или нарушение надкостничных и сухожильных рефлексов (отмечается уже на ранних сроках клинической картины, считается довольно важным звеном в диагностике).
Сенситивная и мозжечковая атаксия.
Гипотония
Нистагм
Слайд 8
Экстраневральными признаками являются:
Сердце:Нарастающая дилатационная или гипертрофическая кардиомиопатия.Зачастую именно
кардиомиопатия, как сопутствующая патология, является причиной смертельного исхода во
время атаксии Фридрейха.Скелетные патологии:Стопа Фридрейха (пальцы ног согнуты в дистальных и переразгибаются в основных фалангах, свод стопы высоко вогнут);
выраженный сколиоз;
деформированы пальцы нижних и верхних конечностей;
кифосколиоз.
Нарушение эндокринной системы:
диабет;
дисфункция яичников;
гипогонадизм;
инфантилизм.
Слайд 11 Лабораторные обследования— обследование крови на определение толерантности к
глюкозе. Данный анализ выполняется как возможность подтверждения или исключения
какого-либо из сопутствующих заболеваний, например, диабет. Производится рентгеноскопическое исследование позвоночника, а также лабораторный анализ на обследование гормонов.ЭКГ является одним из необходимых способов диагностирования атаксии Фридрейха. Диагноз подтверждают выявленные патологии межжелудочковой перегородки и аритмия сердца. Сложность диагностики состоит в том, что признаки поражения сердечнососудистой системы могут проявиться намного раньше неврологических. Зачастую больные становятся с диагнозом «ревмокардит» на учет к кардиологу.
Также выполняется ДНК-анализ ворсинок хориона. В некоторых случаях для определения этой болезни берется амниотическая жидкость у плода.
Слайд 12
КТ-главным диагностическим способом всех атаксий . Но в
этом случае она не сильно эффективна, поскольку многие изменения
в головном мозге при атаксии Фридрейха проявляются лишь на поздних этапах. Это обусловлено спинальной локализацией патологии.Ранние этапы болезни незаметны при КТ. Очень часто на поздних этапах можно диагностировать лишь незначительные атрофии полушарий и мозжечка, небольшое расширение субарахноидального пространства, боковых желудочков, мозговых цистерн.
МРТ на ранних этапах можно определить атрофию в спинном мозге, при этом дополнительно обследуются поперечные размеры спинного мозга, так как при атаксии Фридрейха эти показатели меньше нормы. Также видна неявно выраженная атрофия продолговатого мозга, мозжечка и моста.
При помощи электрофизиологического обследования определяется уровень нарушения чувствительности нервных окончаний конечностей. При атаксии Фридрейха полностью отсутствует или существенно снижена потенциальная амплитуда действия чувствительности нервных окончаний конечностей.
транскраниальная магнитная стимуляция;
электронейрография;
электромиография.
Слайд 13
Лечение
Из-за генетической природы заболевания все методы лечения
сводятся к задерживанию прогресса заболевания, что позволяет длительное время
избегать осложнений и сохранять активный образ жизни.Для лечения АФ применяют медикаментозных средств направленных на коррекцию митохондриалбных нарушений:
коэнзим Q-10-1 капс.0,5г 30-60 мг/кг ,детям 4-5 мг/кг в сут в 2 приема.
янтарная кислота -0,1 г детям 8-10 мг/кг в сут в течение 2 мес.
антиоксиданты – витамин Е (старше 14 лет) капсулы 100 мг - по 2-4 капс./сут; капсулы 200 мг - по 1-2 капс./сут; капсулы 400 мг - по 1 капс./сут. и А- до 1 года — 1650 МЕ (0,5 мг), от 1 года до 6 лет — 3300 МЕ (1 мг), от 7 лет и старше — 5000 МЕ (1,5 мг), с этой же целью (а также с общеукрепляющей) используют поливитамины;
Актовегин, ампулы по 80 мг, 2 мл
Пирацетам, ампулы по 5 мл, 20%
Прозерин, ампулы 0,05% 1 мл 01,-1мл/кг
Прозерин, таблетки 0,015
Фолиевая кислота, таблетки 0,001 г по 0,25-0,50 мкг Атаксия Фридрейха характеризуется неуклонным прогрессирующим течением, которое рано или поздно приводит к летальному исходу. Смерть наступает вследствие сердечной или дыхательной недостаточности. По статистике до 35 лет не доживает.
Слайд 14
МКБ: Нарушения обмена меди (E83.0)
Гепатоцеребральная дистрофия ( болезнь Вильсона —
Коновалова) — наследственное прогрессирующее заболевание, характеризующееся сочетанным поражением печени и
головного мозга. Передается по аутосомно-рецессивному типу. Ген ATP7B картирован на длинном плече 13 хромосомы (13q14.3-q21.1).Основная роль в патогенезе гепатоцеребральной дистрофии принадлежит наследственно обусловленному нарушению обмена, для которого характерно снижение концентрации церулоплазмина (медной оксидазы, связывающей медь в сыворотке крови), содержания общей меди в сыворотке, увеличение экскреции меди с мочой (гиперкупрурия), повышение содержания меди в ткани печени. В результате нарушения обмена медь в избыточном количестве откладывается, в первую очередь, в печени и головном мозге, а также по краю роговицы глаза (кольцо Кайзера — Флейшера).Слайд 15 Формы болезни Вильсона [3]: · Бессимптомная форма; · Печеночная форма; ·
Церебральная форма;
· Смешанная форма.
В зависимости от вовлечения в патологический
процесс печени и центральной нервной системы и характера экстрапирамидной симптоматики, распознают 5 форм гепато-церебральной дистрофии [11]:
· Брюшная (абдоминальная) форма – манифестирует в возрасте от 5 до 17 лет и характеризуется различными вариантами поражения печени, нередко принимающими злокачественное «галопирующее» течение, приводящее к смерти раньше появления симптомов со стороны нервной системы. Её продолжительность от нескольких месяцев до 3-5 лет.
· Ригидно-аритмогиперкинетическая, или ранняя форма отличается быстрым течением; начинается также в детском возрасте. В клинической картине преобладают мышечная ригидность, приводящая к контрактурам, бедность и замедленность движений, хореоатетоидные или торсионные насильственные движения. Характерны дизартрия и дисфагия, судорожный смех и плач, аффективные расстройства и умеренное снижение интеллекта. Заболевание длится 2-3 года, заканчивается летально.
· Слайд 16 Дрожательно-ригидная форма встречается чаще других; начинается в юношеском возраста,
протекает медленнее, порой с ремиссиями и внезапными ухудшениями, сопровождающимися
субфебрильной температурой; характеризуется одновременным развитием тяжѐлой ригидности и дрожания, дрожание очень ритмичное (2-8 дрожаний в секунду), резко усиливается при статическом напряжении мышц, движениях и волнении, в покое и во сне исчезает. Иногда обнаруживаются атетоидные хореоформные насильственные движения; наблюдаются также дисфагия и дизартрия. Средняя продолжительность жизни около шести лет. · Дрожательная форма начинается в возрасте 20-30 лет, протекает довольно медленно (10-15 лет и больше); дрожание резко преобладает, ригидность появляется лишь в конце болезни, а порой наблюдается гипотония мышц; отмечается амимия, медленная монотонная речь, тяжѐлые изменения психики, часты аффективные вспышки. Наблюдаются эпилептиформные припадки. · Экстрапирамидно-корковая форма встречается реже других форм. Типичные для гепатоцеребральной дистрофии нарушения в дальнейшем осложняются апоплектиформно развивающимися пирамидными парезами, эпилептиформными припадками и тяжѐлым слабоумием (обнаруживаются обширные размягчения в коре больших полушарий). Длится 6-8 лет, заканчивается летально.
Слайд 19
Лабораторные исследования
общий анализ крови: лейкопения, нормохромная анемия,
тромбоцитопения, ретикулоцитоз, ускоренная СОЭ. · общий анализ мочи: при поражении почек
можно обнаружить микрогематурию, незначительную протеинурию, гиперкальциурию. · суточная экскреция мочи: гиперкупренилурия, признаки развившейся тубулопатии с признаками: глюкозурией, аминоацидурией, фосфатурией, уратурией, протеинурией. · биохимический анализ крови: снижение церулоплазмина и общей меди, увеличение уровней свободной меди (таблица 1), аминотрасфераз (в 1,5-50 раз); билирубин повышен более чем в 2 раза, преимущественно за счет прямой фракции; уровень щелочной фосфатазы обычно повышен; может быть повышена активность гаммаглютамилтранспептидазы (ГГТП); гипоальбуминемия. · коагулограмма: снижение протромбинового индекса, гипофибриногенемия, снижение тромбинового времени. · пеницилламиновый тест: необходимо исследовать мочу, собранную сразу после приема 500 мг пеницилламина и через 12 часов. У пациентов с болезнью Вильсона-Коновалова суточная экскреция меди будет повышаться до более 1500 мкг/дл/сут (норма <50мкг/сут). У здоровых людей значительного увеличения экскреции меди с мочой не наблюдается.Инструментальные исследования [1-6]: · УЗИ печени и селезенки: позволяют выявить увеличение печени и реже селезенки, признаки портальной гипертензии и цирроза печени [5]. · МРТ головного мозга: более информативно в диагностике, чем КТ головного мозга. Характерны билатеральные очаги пониженной плотности 3-15 мм в диаметре в области базальных ганглиев (хвостатое ядро, скорлупа и бледный шар), в таламусе, в области зубчатых ядер и коры мозжечка - симптом «морды гигантской панды» [19]. По мере прогрессирования процесса выявляются признаки диффузного атрофического процесса головного мозга с равномерным расширением субарахноидальных пространств и желудочковой системы [·
Пункционная биопсия печени: 1. для морфологического исследования биоптата печени, где выявляются дистрофические изменения клеток, некрозы, слабую воспалительную инфильтрацию и фиброз различной степени выраженности
· .
Слайд 21
Лейпцигские балльные критерии диагностики болезни Вильсона [11]
Родственники по
прямой линии вновь выя
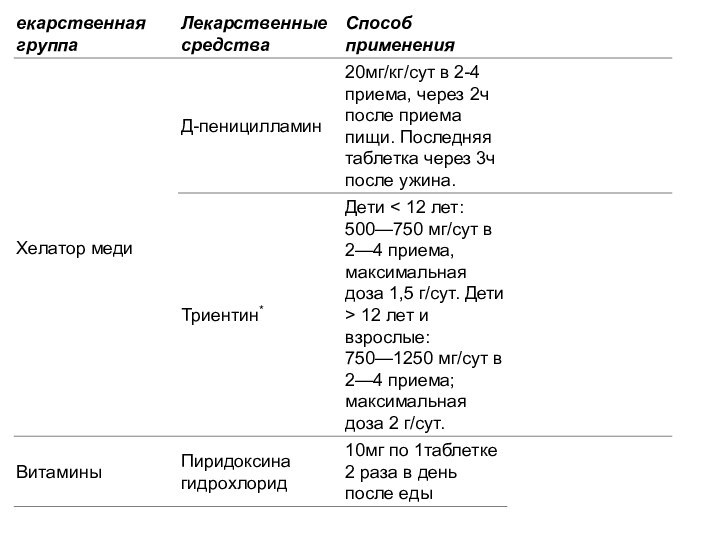
Слайд 22 Немедикаментозное лечение [9]: · полупостельный режим – при высокой активности
и декомпенсации цирроза; · диета, направленная на уменьшение поступления меди
в организм - ограничиваются продукты с высоким содержанием меди (печень, креветки, орехи, шоколад, грибы), таблица 6. Диетическое всасывание меди должно быть менее чем 1,0 мг в день [9]. Запрещается использовать медную посуду для приготовления пищи и еды. Необходимо избегать витаминные и минеральные препараты, содержащие медь. · питание по возрасту, при печеночной форме - диета №5 по Певзнеру, при наличии отеков или асцита - ограничение поваренной соли и жидкости с оценкой баланса жидкости.Медикаментозное лечение [10,11]: Современная патогенетическая терапия ГЛД основана на использовании медьэлиминирующих препаратов , главным образом Д-пеницилламина, триентина и солей цинка. Д-пеницилламин и триентин – хелатные комплексоны, образующие с медью прочные соединения, которые легко выводятся из организма с мочой. Препаратом выбора при ГЛД является Д-пеницилламин. Лечение начинают с небольшой дозы с постепенным увеличением ее до терапевтической, под контролем выделения меди с мочой. Начальные дозы составляют 250-500 мг/сут с постепенным (каждые 4-7 дней) увеличением дозы на 250 мг до лечебной дозировки 1000-1500 мг/сут, которая дается в 2-4 приема. Цинк (оксид, сульфат, ацетат) индуцирует синтез медьсвязывающих белков (металлотионинов) в эпителии тонкой кишки и гепатоцитах, что препятствует абсорбции меди в портальную циркуляцию. При лечении цинком медь выводится через кишечник. Рекомендуемая доза – 25 мг 3 раза в день, у детей и беременных в 2 раза меньше. Недостаточный ответ на лечение сопровождается повышенной экскрецией меди с мочой (более 125 мкг/сут). Показаниями к назначению препаратов цинка являются: стойкий резидуальный неврологический синдром, остающийся на фоне многолетней терапии Д- пеницилламином; обострение неврологической и (или) печеночной симптоматики в начальной стадии терапии Д-пеницилламина; доклиническая и доневрологическая стадии ГЛД. Лечение также проводится пожизненно.