- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Возбудители зоонозных инфекций
Содержание
- 2. Составитель электронного материала для СРСП и СРС: дмн, профессор Рамазанова Б.А
- 3. Чума (Plague)КЛАССИФИКАЦИЯ возбудителя чумы:Сем: EnterobacteriacеaeРод: JersiniaВид: J.pestisЧУМА
- 4. Эпидемии чумы известны с III века до
- 5. МОРФОЛОГИЯ возбудителя чумы: -ОВОИДНАЯ ПАЛОЧКА, С ЗАКРУГЛЕННЫМИ
- 6. Микроскопическая картина микробов чумы в окрашенных мазках
- 7. Микроскопическая картина клеток Y.Jestis в мазках-отпечатках селезенки
- 8. Прижизненная микроскопическая картина клеток у. pestis, выделенных
- 9. Прижизненная микроскопическая картина клеток У. pestis, выращенных
- 10. Капсула живых чумных микробов, выращенных в течение
- 11. Внешний вид клеток возбудителя чумы, выращенных в
- 12. Ультраструктура капсульных клеток возбудителя чумы, выращенных в
- 13. Цитохимическая реакция на кислые мукополисахариды капсулы
- 14. Ультратонкие срезы клеток У. pestis, обработанных специфическими
- 15. Субмикроскопическое строение клеток У. pestis, выращенных на
- 16. Ультра структура чумных микробов при делении. Условия
- 17. Прижизненная микроскопическая картина чумных бактерий, выращенных в
- 18. Способы репродукции клеток возбудителя чумы при почковании.
- 19. Чумная палочка (Yersinia pestis) - бактерия-возбудитель чумыЧумная
- 20. Возбудитель чумы в гное из бубонаВозбудитель чумы Yersinia pestis. Фото с сайта webs.wichita.edu
- 21. Возбудитель чумы (электронная микроскопия)Возбудитель чумы
- 23. КУЛЬТУРАЛЬНЫЕ СВОЙСТВА:- ФАКУЛЬТАТИВНЫЕ АНАЭРОБЫ- РАСТЕТ НА ПРОСТЫХ
- 24. Температурный оптимум чумы 28-30 "С; оптимум рН
- 25. Микроколонии бактерий возбудителя чумы, выращенных на агаре
- 26. Морфологические свойства ДВУХСУГОЧНЫХ колоний у. pestis при
- 27. Морфологические свойства двухсугочных колоний У. pestis при
- 28. Морфологические свойства четырехсуточных колоний У. pestis при
- 29. Морфология колоний чумных бактерий, выращенных в течение
- 30. Морфология колоний чумных микробов вирулентного и вакцинного
- 31. ФЕРМЕНТАТИВНЫЕ СВОЙСТВА:-До К (фруктозу, галактозу, глюкозу, мальтозу)-не
- 32. РЕЗИСТЕНТНОСТЬ:-УСТОЙЧИВ ПРИ ОоС-6 МЕСНА ОДЕЖДЕ - 6
- 33. ЭПИДЕМИОЛОГИЯ:ОСОБЕННОСТИ:зоонозное природно-очаговое заболевание (чума - зооноз грызунов,
- 34. «Черная смерть». Иллюстрация из Тоггенбургской библии, 1411 год. Представление с сайта en.wikipedia.ru
- 35. Природный резервуар чумной инфекции:Грызуны (суслики, сурки, песчанки, тарбаганы и др), зайцеобразныеБольшой тушканчик
- 36. ПЕРЕНОСЧИКИ ИНФЕКЦИИ: Блохи, реже клещи, вшиЗаболевания, вызванные
- 37. В развитии эпидемии чумы различают периоды:-ЧУМА СРЕДИ
- 38. ФАКТОРЫ ПАТОГЕННОСТИ возбудителя чумы: - ЭКЗОТОКСИНЫ («мышиный»
- 39. ПАТОГЕНЕЗ: Зависит от входных ворот. - Если
- 40. Т.О. механизм развития заболевания включает 3 стадии:Лимфогенный
- 41. Патогенез чумы
- 42. ИЗ КРОВИ МОЖЕТ ПРОНИКАТЬВ РАЗЛИЧНЫЕ ОРГАНЫ И ТКАНИМНОГОЧИСЛЕННЫЕ ОЧАГИ ИИНФЕКЦИИГЕНЕРАЛИЗАЦИЯ ПРОЦЕССА
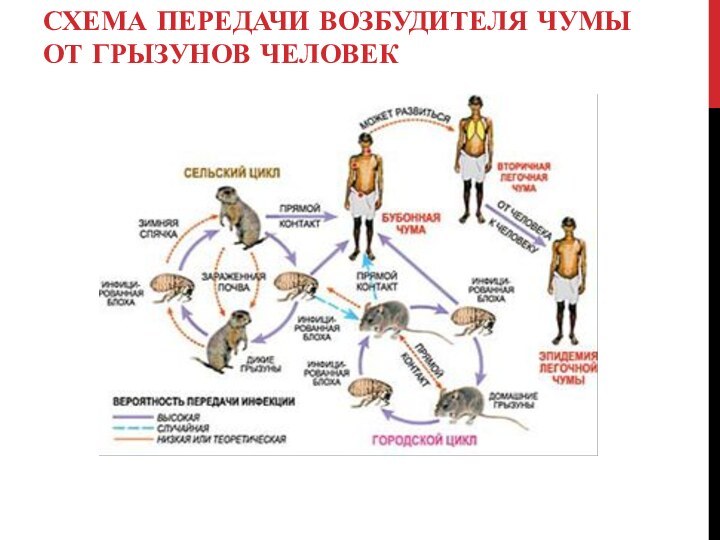
- 43. Схема передачи возбудителя чумы от грызунов человек
- 44. Инкубационный период при чему независимо от ее
- 45. КЛИНИЧЕСКИЕ ФОРМЫ ЧУМЫ (ЗАВИСЯТ ОТ СПОСОБА ПРОНИКНОВЕНИИЯ
- 46. бубонПаховый бубон при бубонной чуме
- 47. симптомы бубонной чумы
- 48. Разновидность бубонной чумы - болезни, стершей во
- 49. Противочумные костюмы
- 50. ИММУНИТЕТ:-стойкий, напряженный, пожизненный (отмечены случаи повторных заболеваний)ПРОФИЛАКТИКА:-
- 52. Микробиологическая диагностика: ОСНОВНЫЕ МЕТОДЫ ДИАГНОСТИКИ:-ЭКСПРЕСС (РИФ, ИФА,
- 53. Материал для исследования: отделяемое язвы или
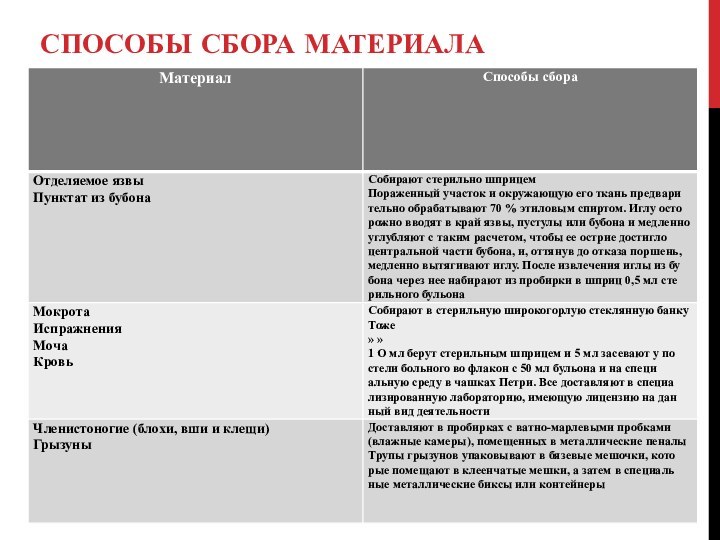
- 54. Способы сбора материала
- 55. Первый день исследования. Из доставленного материала (отделяемое
- 56. Посев. Материал засевают на проверенные на ростовые
- 57. БИОПРОБАставят на морских свинках и белых мышах.
- 58. Второй день исследования (через 18-24 ч). Изучают
- 59. Третий день исследования (через 36-48 ч). Выделенная
- 60. Четвертый день исследования (через 60-72 ч). Проводят
- 61. Основные отличительные признаки палочки чумы от палочек
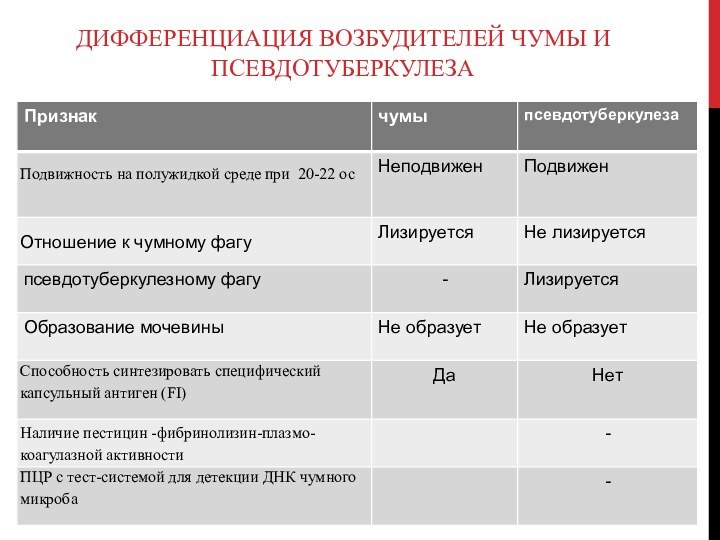
- 62. Дифференциация возбудителей чумы и псевдотуберкулеза
- 63. Патогенные свойства иерсиний обоих видов, как и
- 65. Скачать презентацию
- 66. Похожие презентации



























































Слайд 3
Чума (Plague)
КЛАССИФИКАЦИЯ возбудителя чумы:
Сем: Enterobacteriacеae
Род: Jersinia
Вид: J.pestis
ЧУМА -
острое инфекционное эпидемическое заболевание, характеризующееся тяжелой интоксикацией, лихорадкой, поражением
лимфатической и сосудистой систем, тенденцией к септицемии и смертельной коме. Особоопасная карантинная инфекция. Передается от грызунов к человеку при посредстве эктапаразитов, грызунов.Чума известна на востоке за 1000 лет до н.э.
1894 г.- в Гонконге во время чумы, ИЕРСЕН и КИТАЗАНТО независимо друг от друга обнаружили возбудителя чумы в гное бубонов у чумных больных и в органах чумных крыс.
Слайд 4 Эпидемии чумы известны с III века до н.э.,
иногда они приобретали характер пандемий. Первая достоверная пандемия 527-565
гг. («юстинианова чума»), начавшаяся в Египте и Эфиопии, привела к огромным потерям среди населения Восточной Римской империи.Самой опустошительной была вторая пандемия чумы в XIV-XV веках, вошедшая в историю под названием «великой» или «чёрной» смерти и унёсшая около 60 млн жизней. Только в Европе погибло более 25 млн человек.
По свидетельству Н.М. Карамзина, целиком вымерло население городов Глухов и Белозёрск, а в Смоленске уцелело лишь 5 человек.
Третья пандемия чумы началась в Гонконге в 1894 г. и за 20 лет унесла жизни 10 млн человек. В самом её начале были сделаны важные открытия (выделен возбудитель, доказана роль крыс в эпидемиологии чумы), что позволило организовать профилактику на научной основе.
Возбудитель чумы обнаружили Г.Н. Минх (1878) и независимо А. Иерсен и Ш. Китазато (1894). Большой вклад в изучение эпидемиологии чумы внесли исследования Д.С. Самойловича (первые в Европе), В.И. Исаева и Н.Н. Клодницкого, а также И.И. Мечникова, руководившего работой противочумных отрядов в Астраханской губернии (1911). В 40-х годах в Северной Африке была отмечена последняя эпидемическая вспышка; тем не менее с 1958 по 1979 г. в мире зарегистрировано 47 000 случаев чумы.
Последнюю вспышку чумы отметили в Индии (вторая половина 90-х годов).
Слайд 5
МОРФОЛОГИЯ возбудителя чумы:
-ОВОИДНАЯ ПАЛОЧКА, С ЗАКРУГЛЕННЫМИ КОНЦАМИ
-БИПОЛЯРНО ОКРАШЕНА
(неравномерно расположена цитоплазма)
-ГРАМ (-)
-ЖГУТИКОВ НЕТ, СПОР НЕ ОБРАЗУЕТ
-НА СРЕДАХ
С КРОВЬЮ И В ОРГАНИЗМЕ БОЛЬНОГО – КАПСУЛА.Слайд 6 Микроскопическая картина микробов чумы в окрашенных мазках культур,
выращенных вагаре Хоттингера в течение 48 ч при температуре
26-28 ос.а - штамм 1300; б - штамм КМ 872; в - штамм ЕV. Окраска по Граму
(а, б), кристаллическим фиолетовым (в) х 1150.
Микробы располагаются без определенной закономерности и имеют форму овоидов, прямых или слегка искривленных палочек с закругленными полюсами. Возможно нитеобразование.
Окраска большинства клеток равномерная.
Слайд 7 Микроскопическая картина клеток Y.Jestis в мазках-отпечатках селезенки морских
свинок, погибших от чумы. Штаммы 1300 (а), К 872
(б). Окраска фуксином Циля. x1l50.Микробы имеют цилиндрическую либо овоидную и бочкообразную формы. Многие клетки окрашены биполярно.
Слайд 8 Прижизненная микроскопическая картина клеток у. pestis, выделенных из
брюшной полости пораженной морской свинки в предагональном состоянии.
Аноптральный
контраст. Иммобилизация клеток желатиновым гелем. х1350. Форма микробов цилиндрическая, полюса сферические. Протоплазма обладает равномерной оптической плотностью. Полиморфизм микробов не выражен. Большинство составляют живые клетки. Деление микробов изоморфное. Макрофаги отличаются наличием ядра и значительно большими размерами. Слайд 9 Прижизненная микроскопическая картина клеток У. pestis, выращенных во
флаконах с бульоном Хоттингера в течение 24 ч при
шуттелировании. Штамм 1300. Аноптральный контраст. Иммобилизация клеток желатиновым гелем. x1350.а - выращивание при температуре 37-39 ос,
б - 26-280с.
Чумные микробы имеют цилиндрическую форму и сферические полюса, их оболочка на всем протяжении одинаковой толщины и светопреломляющей способности. Протоплазма характеризуется равномерной светооптической плотностью и не содержит включений, которые могли быть материальной основой биполярности, выявляемой в окрашенных мазках. Микробы, выращенные при температуре 37-39 ос, отличаются большими длиной и диаметром.
Слайд 10 Капсула живых чумных микробов, выращенных в течение 24
ч при температуре 37-39 ос в перева ре Хоттингера
с добавлением витаминов и ионов кальция. Влажный тушевой метод. Фазовый контраст. х 1350.а - штамм 1300; б штамм КМ 872.
Капсула наблюдается в виде светлых ореолов вокруг темных клеток. Размеры капсулы у отдельных микробов могут существенно варьировать.
Слайд 11 Внешний вид клеток возбудителя чумы, выращенных в бульоне
Хоттингера, при электронной микроскопии. Штамм 1300. Контрастирование фосфорно-вольфрамовой кислотой
(б, в), напылением хрома (а). х 15 000 (а), х20 000 (б, в).Независимо от способа приготовления препаратов и температуры выращивания у чумных микробов выявляются цилиндрическая форма, закругленные полюса и отсутствие в цитоплазме каких-либо включений, которые могли бы быть основой для биполярной окраски. При оттенении хромом у клеток, выращенных при температуре 37- 39 ос, снаружи от клеточной стенки имеются остатки капсулы (а). Вследствие высокого сродства биополимеров капсулы к фосфорно-вольфрамовой кислоте такие клетки отличаются высокой электрон но-оптической плотностью (б). Поверхность бескапсульных микробов покрыта складками (в).
Слайд 12 Ультраструктура капсульных клеток возбудителя чумы, выращенных в бульоне
Хоттингера при температуре 37-39 ос в течение 18 ч.
а-в - штамм 1300; г - штамм ЕУ. х40 000 (а-в); х80 000 (г).
Капсула имеет фибриллярное строение и окружает клетки в виде бахромы или короны без четкой границы. Вещество капсулы с клеточной стенкой связано непрочно. У одних клеток капсула массивная (а-в), у друтих она менее выражена (г).
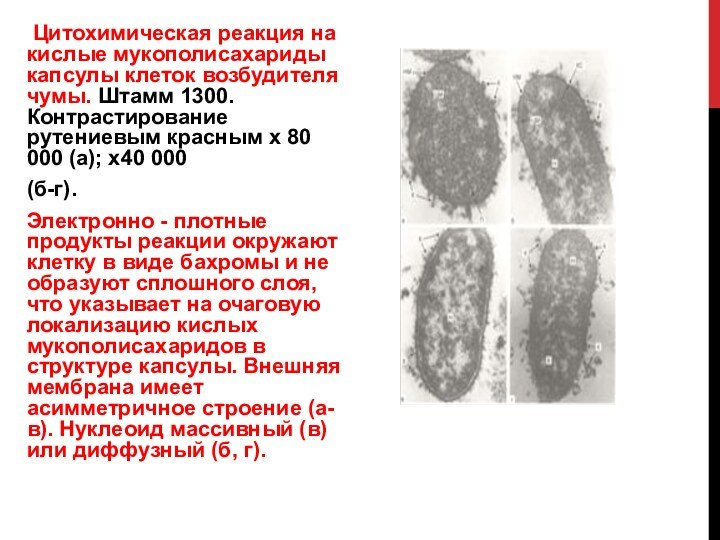
Слайд 13 Цитохимическая реакция на кислые мукополисахариды капсулы клеток
возбудителя чумы. Штамм 1300. Контрастирование рутениевым красным х 80
000 (а); х40 000(б-г).
Электронно - плотные продукты реакции окружают клетку в виде бахромы и не образуют сплошного слоя, что указывает на очаговую локализацию кислых мукополисахаридов в структуре капсулы. Внешняя мембрана имеет асимметричное строение (а-в). Нуклеоид массивный (в) или диффузный (б, г).
Слайд 14 Ультратонкие срезы клеток У. pestis, обработанных специфическими анти-F1-иммуноглобулинами,
меченными ферритином. Штамм ЕV. х40000 (а, б); х80000 (б);
х100 000 (г).Частицы комплекса ферритин - иммуноглобулин располагаются на клеточной стенке и фибриллах капсулы (а-г). Фрагмент клеточной стенки с равномерным расположением ферроглобулинов (г).
Слайд 15 Субмикроскопическое строение клеток У. pestis, выращенных на агаре
Хоттингера в течение 24 ч при температуре 26-28 ос.
Штамм 1300. х40 000 (а, г); х80 000 (б, Д); х60 000 (в).Внешняя и цитоплазмагическая мембраны имеют трехслойное строение (а-в). Периплазма может быть электронно-прозрачной (д), заполняться материалом средней плотности к электронам (а) и содержать пептидогликановый слой (б). В цитоплазме находятся рибосомы и полисомы (а-в), вакуоли (г) и нуклеоид в различной степени обособленности (а, г). На поверхности клеток могут быть везикулы (а, б, д).
Слайд 16 Ультра структура чумных микробов при делении. Условия выращивания
- см. рис. 1.10. Штамм 1300. хзо 000 (а,
б); х80 000 (в).Закладка перетяжки (а), углубление перетяжки с образованием равновеликих клеток (б), формирование полюсов клеток в зоне перетяжки (в). Внутриклеточные включения отличаются высокой плотностью по отношению к электронам (б).
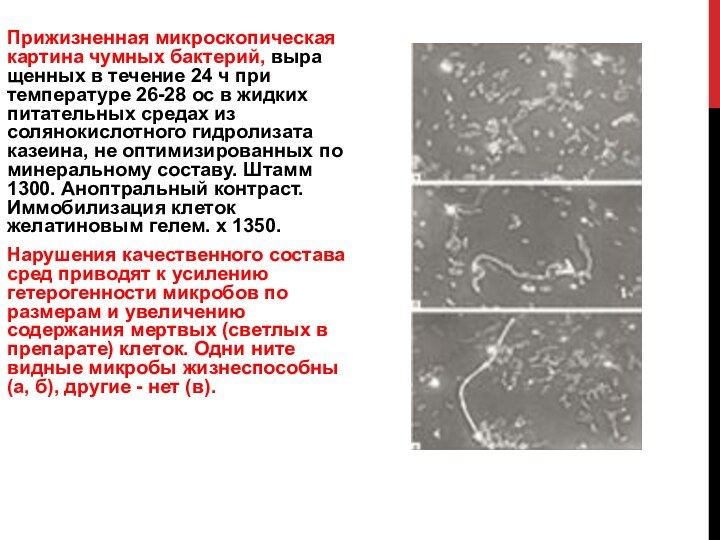
Слайд 17 Прижизненная микроскопическая картина чумных бактерий, выращенных в течение
24 ч при температуре 26-28 ос в жидких питательных
средах из солянокислотного гидролизата казеина, не оптимизированных по минеральному составу. Штамм 1300. Аноптральный контраст. Иммобилизация клеток желатиновым гелем. х 1350.Нарушения качественного состава сред приводят к усилению гетерогенности микробов по размерам и увеличению содержания мертвых (светлых в препарате) клеток. Одни нитевидные микробы жизнеспособны (а, б), другие - нет (в).
Слайд 18
Способы репродукции клеток возбудителя чумы при почковании.
Условия
выращивания - см. рис. 1.12. Штамм 1300. х60 000
(а, б, г, д, е); х80 000 (в).Почки образуются в результате боковых выпячиваний тела клеток (а, б), неравномерного деления (в, г), через дефекты в клеточной стенке (д, е). От внешней среды они ограничены цитоплазматической мембраной (г, д, е) или клеточной стенкой и могут иметь элементы нуклеоида (а-в).
Слайд 19
Чумная палочка (Yersinia pestis) - бактерия-возбудитель чумы
Чумная палочка
(Yersinia pestis) при 200-кратном увеличении. Изображение с сайта wikimedia.org
На
окрашенных электронных микрофотографиях различного масштаба представлены отдельные микробы и их колонии.
Слайд 20
Возбудитель чумы в гное из бубона
Возбудитель чумы Yersinia
pestis. Фото с сайта webs.wichita.edu
Слайд 23
КУЛЬТУРАЛЬНЫЕ СВОЙСТВА:
- ФАКУЛЬТАТИВНЫЕ АНАЭРОБЫ
- РАСТЕТ НА ПРОСТЫХ СРЕДАХ,
НО ЛУЧШЕ С ДОБАВЛЕНИЕМ КРОВИ
- ТЕМПЕРАТУРА выращивания - 28-30оС
-
рН - 7,2-7,4- молодые вирулентные колонии (R-КОЛОНИИ С ПЛОТНЫМ ЦЕНТРОМ, ВОКРУГ КРУЖЕВНАЯ КАЙМА)
-старые колонии, невирулентные (S-форма)
- в бульоне (ПЛЕНКА И СПУСКАЮЩИЕСЯ НИТИ В ВИДЕ СТАЛАКТИТОВ И ХЛОПЬЕВИДНЫЙ ОСАДОК).
Слайд 24 Температурный оптимум чумы 28-30 "С; оптимум рН 6,9-7,2.
Бактерии чумы нетребовательны к питательным средам. На бульоне через
48 ч образуют нежную плёнку на поверхности со спускающимися вниз нитями и хлопьевидный осадок (среда остаётся прозрачной). Также хорошо растут в желатине, не вызывая её разжижения.На плотных средах возбудитель чумы при 37 С образуют сероватые слизистые (за счёт капсулообразования) S- или R-колонии. Вирулентные штаммы чумы образуют R-колонии.
Стадии роста чумы. Микроскопическое изучение колоний Y. pestis выявляет три стадии роста. Через 10-12 ч культивирования вырастают «молодые» бесцветные микроколонии с неровными краями («битое стекло»). Через 18-24 ч они сливаются, формируя нежные плоские образования с фестончатыми краями и приподнятым центром («кружевные платочки»). Через 40-48 ч наблюдают «зрелые» колонии — крупные, с бурым зернистым центром и неровными краями («ромашки»).
Пигментообразование чумы. Многие, особенно вирулентные штаммы Y. pestis способны образовывать тёмный пигмент и обесцвечивать красители (например, метиленовый синий).
Слайд 25 Микроколонии бактерий возбудителя чумы, выращенных на агаре Хоттингера
при температуре 26-28 ос.
Штамм 300. Микрофотосъемка в падающем
свете. х56. а - 10-12 ч выращивания, образуются плоские нежные микроколонии с неровными краями, напоминающие кружевные платочки; б - 20-24 ч выращивания,
у микроколоний формируется выпуклый желтый, бурый или темно-коричневый центр и тонкая, почти прозрачная фестончатая периферическая зона.
Слайд 26 Морфологические свойства ДВУХСУГОЧНЫХ колоний у. pestis при микроскопическом
исследовании в проходящем свете. Условия выращивания - см. рис.
1.14. Штамм 1300. х13. Центр колоний выпуклый или запавший, коричневый или желтый (а). Периферическая зона полупрозрачная и кружевная. Колонии по внешнему виду напоминают цветок ромашки (а, б).Слайд 27 Морфологические свойства двухсугочных колоний У. pestis при микроскопическом
исследовании в падающем свете. Условия выращивания - см. рис.
1.14.а - штамм 1300; б - штамм ЕУ. х13.
Колонии серо-желтые, по форме близки к полусфере с мелкозернистой поверхностью и ровными или слегка фестончатыми краями.
Слайд 28 Морфологические свойства четырехсуточных колоний У. pestis при микроскопическом
исследовании в падающем свете. Условия выращивания - см. рис.
1.14. Штамм 1300. ЮЗ.При увеличении продолжительности культивирования центр колоний западает, периферическая зона становится плотной (а) либо узкой или исчезает (б).
Поверхность может приобретать исчерченность (в).
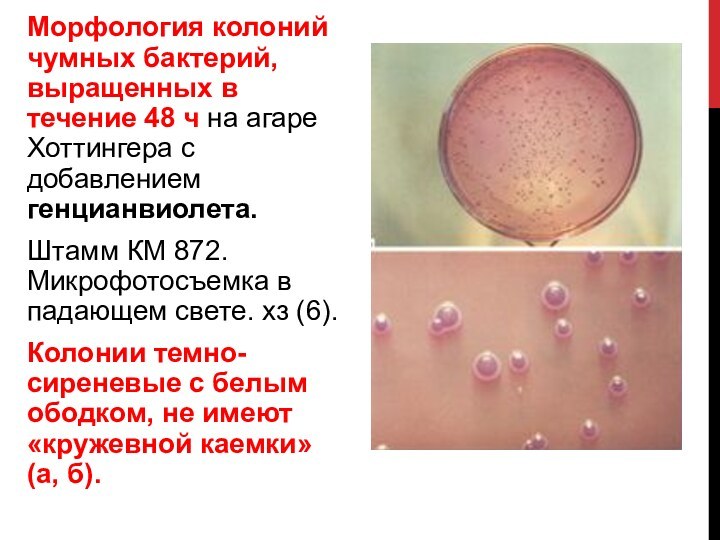
Слайд 29 Морфология колоний чумных бактерий, выращенных в течение 48
ч на агаре Хоттингера с добавлением генцианвиолета.
Штамм КМ
872. Микрофотосъемка в падающем свете. хз (6). Колонии темно-сиреневые с белым ободком, не имеют «кружевной каемки» (а, б).
Слайд 30 Морфология колоний чумных микробов вирулентного и вакцинного штаммов,
выращенных в течение 120 ч при температуре 26-28 ос
на среде Джексона- Барроуза.а - штамм 1300; б - смесь штаммов 1300 и ЕУ.
Микрофотосъемка в падающем (а) и проходящем (б) свете. х13 (б).
Бактерии вирулентных штаммов возбудителя чумы обладают способностью сорбировать гемин из питательной среды и образуют черно-бурые колонии (а).
При увеличении в проходящем свете они черно-коричневые, а у вакцинного штамма ЕУ - светлые (б).
Слайд 31
ФЕРМЕНТАТИВНЫЕ СВОЙСТВА:
-До К (фруктозу, галактозу, глюкозу, мальтозу)
-не разжижают
желатин
-образуют гиалуронидазу, фибринолизин, коагулазу
-не свертывают молоко
3 типа:
1ТИП - НЕ
ФЕРМЕНТИРУЮЩИЙ ГЛИЦЕРИН (Индия, Индокитай, Южная Корея )2ТИП - ФЕРМЕНТИРУЕТ ГЛИЦЕРИН (Африка, Сибирь Монголия)
3ТИП - ФЕРМЕНТИРУЕТ ГЛИЦЕРИН И НИТРОЗОООТРИЦПТЕЛЬНЫЕ (Юго-восток СНГ).
АНТИГЕНЫ возбудителя чумы:
Около 20 Аг
О-соматический Аг-термостабильный
Хорошо изучены капсульные Аг, особенно Д,F-1,T,W,V-термолабильные
F-1 –поверхностный, белковый Аг –используется для серологической диагностики (РНГА)
W- обладает антифагацитарной активностью
Слайд 32
РЕЗИСТЕНТНОСТЬ:
-УСТОЙЧИВ ПРИ ОоС-6 МЕС
НА ОДЕЖДЕ - 6 МЕС
В
МОЛОКЕ-90 СУТ
В ТРУПАХ-50 СУТ
В МОКРОТЕ-10 СУТ
ФРУКТАХ-11 СУТ
ХЛЕБЕ - 4
СУТ-ЧУВСТВИТЕЛЕН К ВЫСЫХАНИЮ И ВЫСОКОЙ ТЕМПЕРАТУРЕ,УФО, А/Б
КИПЯЧЕНИЕ- 1 МИН
5% РАСТВОР ФЕНОЛА-10 МИН
5% ЛИЗОЛ-10 МИН.
Слайд 33
ЭПИДЕМИОЛОГИЯ:
ОСОБЕННОСТИ:
зоонозное природно-очаговое заболевание (чума - зооноз грызунов, особенно
крыс. Полевые крысы заражают домашних крыс и мышей); С
потеплением климата популяция крыс стремительно растет, а это грозит эпидемией чумы. Особо опасная карантинная инфекция, способная к эпидемическому распространению
ИСТОЧНИК ИНФЕКЦИИ:
В начале вспышки чумы - грызуны,
затем люди, болеющие преимущественно легочной формой
Слайд 34 «Черная смерть». Иллюстрация из Тоггенбургской библии, 1411 год.
Представление с сайта en.wikipedia.ru
Слайд 35
Природный резервуар чумной инфекции:
Грызуны
(суслики, сурки, песчанки, тарбаганы
и др), зайцеобразные
Большой тушканчик
Слайд 36
ПЕРЕНОСЧИКИ ИНФЕКЦИИ:
Блохи, реже клещи, вши
Заболевания, вызванные Yersinia pestis,
является едва ли не самым старым заразных недугом. Возбудитель
чумы переносят блохи, которые побывали на больных крысахАзиатская крысиная блоха Xenopsylla cheopis передает чумную палочку от крыс к людям
Слайд 37
В развитии эпидемии чумы различают периоды:
-ЧУМА СРЕДИ ГРЫЗУНОВ
(БЛОХИ, КЛОПЫ, ВШИ) – может протекать в хр. Форме.
Имеется 99 видов блох, которые переносят чуму. Они могут быть носителями чумы в течении 1 года.-ЧУМА БУБОННАЯ У ЧЕЛОВЕКА
-ЧУМА ЛЕГОЧНАЯ У ЧЕЛОВЕКА
ПУТИ ЗАРАЖЕНИЯ ЧЕЛОВЕКА:
-КОНТАКТНЫЙ
-ТРАНСМИССИВНЫЙ (УКУС БЛОХ)
-реже АЛИМЕНТАРНЫЙ
-МЕХАНИЗМ ЗАРАЖЕНИЯ ЧУМОЙ ЧЕЛОВЕКА ОТ ЧЕЛОВЕКА - аэрогенный
Слайд 38
ФАКТОРЫ ПАТОГЕННОСТИ возбудителя чумы:
- ЭКЗОТОКСИНЫ («мышиный» токсин, гемолизин)
-
КАПСУЛА
- ФЕРМЕНТЫ АГРЕССИИ (гиалуронидаза, фибринолизин, коагулаза)
- БАКТЕРИОЦИНЫ (пестицины)
- W,V
антигены с антифагоцитарной активностью
Слайд 39
ПАТОГЕНЕЗ:
Зависит от входных ворот. - Если заражение ч/з
НЕПОВРЕЖДЕННУЮ КОЖУ И СЛИСИЗТЫЕ КОНТАКТНЫМ ПУТЕМ (бубонная форма)
, ВОЗДУШНО КАПЕЛЬНО (легочная форма), если укус в кровеносный капилляр, то развивается первичная септицемия.Бубонная форма может перейти во вторичную легочную или во вторичную септическую формы.
Инкубационный период от нескольких часов до 2-6 дней, у привитых – до 10 дней.
Проникшие бактерии активно поглощаются фагоцитами, однако фагоцитоз носит незавершенный характер ( в л/у развивается серозно - геморрагическое воспаление , с развитием бубона) и способствует дальнейшему распространению возбудителя. Одновременно чумная палочка распространяется лимфогенно, вызывая множественный лимфаденит. Затем возбудитель проникает в кровоток и диссеминирует в различные органы и ткани (септико-пиемические очаги).
Слайд 40
Т.О. механизм развития заболевания включает 3 стадии:
Лимфогенный перенос
от места проникновения до лимфатических барьеров
Распространение бактерий из
л/у в кровоток (бактериемия)Распространение микробов до забарьерных клеточных систем (генерализованная септицемия)
Заболевание начинается остро: Температура повышается до 39С и выше, озноб, явления интоксикации (резкая головная боль, разбитость, мышечные боли, помрачения сознания), больной возбужден.
Летальность при диссеминированных формах до 100%, при локализованных до 70%, при а/б терапии до 10%.
Слайд 42
ИЗ КРОВИ МОЖЕТ ПРОНИКАТЬ
В РАЗЛИЧНЫЕ ОРГАНЫ И ТКАНИ
МНОГОЧИСЛЕННЫЕ
ОЧАГИ ИИНФЕКЦИИ
ГЕНЕРАЛИЗАЦИЯ ПРОЦЕССА
Слайд 44 Инкубационный период при чему независимо от ее клинической
формы в среднем 3-6 сут.
При септической и первично-легочной
чуме инкубация обычно сокращается до 1-2 сут и может удлиняться у людей, ранее вакцинированных.
Слайд 45
КЛИНИЧЕСКИЕ ФОРМЫ ЧУМЫ (ЗАВИСЯТ ОТ СПОСОБА ПРОНИКНОВЕНИИЯ ВОЗБУДИТЕЛЯ):
Локальные
формы:
-кожная
-бубонная
Генерализованные формы:
-первично - и вторичносептическая
Внешне - диссеминированные формы:
-первично -
и вторично - легочная; вторично-кишечнаяХарактерный клинический признак чумы, появляющийся в месте входных ворот инфекции бубон ( л/у , увеличенный до размера лесного ореха, куриного яйца).
Для всех форм чумы характерны внезапность заболевания, озноб и быстрый подъем температуры до 39-40С, которая без лечения стойко держится на высоких уровнях
Слайд 48 Разновидность бубонной чумы - болезни, стершей во времена
Средневековья с лица Земли почти треть Европы - поразила
59-летнего американца. Пол Гейлрод подхватил заразу, когда пытался вытащить мышь из пасти своего задыхающегося кота по кличке Чарли. Как видно из фотографии, чума уничтожила пальцы мужчины на руках и ногах.
Слайд 50
ИММУНИТЕТ:
-стойкий, напряженный, пожизненный (отмечены случаи повторных заболеваний)
ПРОФИЛАКТИКА:
- Специфическая
по эпид. показаниям (живая вакцина штаммом EV- иммунитет 1
год; химическая чумная вакцина)- Экстренная специфическая профилактика и терапия чумы (противочумный иммуноглобулин)
-Химиотерапия чумы (стрептомицин и др)
-В природных очагах (дератизация , дезинсекция)
Слайд 52
Микробиологическая диагностика:
ОСНОВНЫЕ МЕТОДЫ ДИАГНОСТИКИ:
-ЭКСПРЕСС (РИФ, ИФА, РПГА, ПЦР
(на выявление плазмид pPst, pCas, pFa чумного микроба)
-БАКТЕРИОЛОГИЧЕСКИЙ
-БАКТЕРИОСКОПИЧЕСКИЙ (ориентировочный)
. Необходимо дифференцировать от возбудителя псевдотуберкулеза (сходны по морфологии).-БИОПРОБА ( на белых мышах, морских свинках, кроликах)
Слайд 53
Материал для исследования:
отделяемое язвы или пунктат из
пустулы при кожной форме;
содержимое бубона при бубонной форме;
мокрота, слизь из зева и мазок с миндалин при легочной форме;
испражнения при кишечной форме;
кровь - при всех формах;
в зависимости от поражений отдельных органов и систем исследуют мочу (при наличии в ней крови) и цереброспинальную жидкость (при менингеальных явлениях);
при вскрытии (аутопсии) берут кусочек бубона и материал кожных поражений, лимфатические узлы, кусочки органов трупа, кровь из полости сердца, костный мозг (при наличии загнивания);
при исследовании КРОВОСОСУШИХ членистоногих (блохи и др.) - содержимое их кишечника;
лимфатические узлы, органы и кровь синантропных (крысы, мыши) и других погибших (и болеющих) грызунов.
Слайд 55
Первый день исследования.
Из доставленного материала (отделяемое язвы, пунктат
из бубона, мокрота, испражнения, кровь и др.) готовят мазки,
высушивают их на воздухе, фиксируют в смеси Никифорова 20-30 мин. Мазок окрашивают по Граму и метиленовым синим.Для обнаружения в нативном материале фракции 1 чумного микроба ставят РПГА с иммуноглобулиновым и реакцию нейтрализации антител (РНАт) с антигенным диагностикумами или окрашивают чумной люминесцирующей сывороткой (МФА),
а в более поздние сроки ставят РПГ А с антигенным и реакцию нейтрализации антигена (PНAт) с иммуноглобулиновым диагностикумами для поиска антител к FI чумного микроба в крови больного.
Слайд 56
Посев.
Материал засевают на проверенные на ростовые качества
плотные и жидкие питательные среды: агар и бульон Хотгингера
или Мартена с добавлением к ним стимуляторов роста: кровь , сульфит натрия и др.Стимуляция необходима, так как посевная доза может быть недостаточной.
Материал (мокрота, слизь зева, содержимое вскрывшегося бубона, язвы, органы трупа человека без признаков разложения), содержащий постороннюю микрофлору, засевают на среду Туманского , содержащую генциановый фиолетовый в концентрации 1:200- 1:800 тысяч в зависимости от результатов специального контроля его ингибирующего действия на соответствующие тест-штаммы. Посевы инкубируют в термостате при температуре 28 ос, а для обнаружения фракции 1 чумного микроба - при 37 Ос.
В 1-й день исследования может быть поставлена проба с фагом - ускоренный метод.
Исследуемый материал наносят на 3 чашки со средой Туманского:
в одну чашку вносят одну каплю исследуемого материала и одну каплю чумного фага, растирают их шпателем;
в другую чашку засевают материал, а затем у края чашки наносят каплю фага и дают ей стечь в виде «дорожки»;
В третью чашку (контрольная) вносят только материал и делают его рассев.
Слайд 57
БИОПРОБА
ставят на морских свинках и белых мышах. Метод
введения исследуемого материала зависит от его характера.
Мокроту, слизь
из зева, гной из открытого абсцесса вводят путем втирания в кожу брюшной стенки (предварительно кожу эпилируют, обрабатывают стерильным изотоническим раствором натрия хлорида и скарифицируют). На скарифицированный участок наносят исследуемый материал, втирая его плоской частью скальпеля, под прикрытие м специальной воронки или стерильной крышки от чашки Петри. Незагрязненный материал (кровь, содержимое закрытого бубона и т. д.) вводят животным подкожно или внутрибрюшинно.
В зависимости от метода введения животное погибает на 3-9-й день. Для ускоренной диагностики поэтапно вскрывают животных
на l-e сутки (одну белую мышь, обработанную гидрокортизоном),
3-и сутки (морскую свинку, обработанную гидрокортизоном),
а остальных - на 6-е сутки.
Слайд 58
Второй день исследования (через 18-24 ч).
Изучают рост
на плотной и жидкой питательной среде. Из бульонной культуры
при типичном росте делают мазки, окрашивают их по Граму и метиленовым синим и микроскопируют. С плотной питательной среды отбирают типичные колонии с целью выделения чистой культуры и ее идентификации.На две-три подозрительные в отношении возбудителя чумы колонии наносят чумной бактериофаг. После инкубации в термостате через 10-12 ч про водят анализ результатов пробы с чумным бактериофагом. Лизис колоний под действием чумного бактериофага имеет диагностическое значение.
Анализируют результат ускоренной пробы с чумным бактериофагом.
При наличии в исследуемом материале возбудителя чумы отмечают:
на 1-й чашке - стерильные пятна,
на 2-й - стерильную «дорожку» на месте нанесения фага,
на 3-й - типичные колонии чумного микроба
Слайд 59
Третий день исследования (через 36-48 ч).
Выделенная культура
подлежит идентификации на основании следующих признаков:
-характерной морфологии микроба
(микропрепараты из нативного материала и чистых культур), колоний на агаре и роста в бульоне Хотrингера; -чувствительности к чумному бактериофагу;
-специфического свечения при люминесцентной микроскопии (МФА) чистой культуры;
-наличия специфического для чумного микроба АГ фракции FI, выявленной в РПГ А и РНАт;
-ферментативной активности - расщепление глицерина, мочевины, рамнозы, сахарозы, глюкозы и др.
-Одновременно с идентификацией проводят определение чувствительности к антибиотикам методом серийных разведений или методом дисков.
Слайд 60
Четвертый день исследования (через 60-72 ч).
Проводят учет
результатов идентификации по следующим тестам:
- на чувствительность к
чумному бактериофагу и антибиотикам; - на наличие фракции 1, выявленной методом МФА, в РПГА или РНАт;
на определение ферментативной активности
Учитывают пробу с чумным бактериофагом - лизис колоний чумного
микроба.
-Проводят дифференциацию чумных бактерий от бактерий псевдотуберкулеза
-Продолжают наблюдение за биопробными животными, зараженными в l-й день исследования.
Слайд 61
Основные отличительные признаки палочки чумы от палочек псевдотуберкулеза:
наличие
специфических Аг
2) неподвижность (палочки псевдотуберкулеза подвижны)
3) чувствительность к чумному
фагу4) отсутствие ферментации рамнозы
кой (МФА), посев на специальные элективные среды. Дальнейшее исследование проводят описанным выше способом.
Слайд 63 Патогенные свойства иерсиний обоих видов, как и возбудителя
чумы, определяются не только хромосомными, но и плазмидными генами.
У них обнаружены плазмиды, очень сходные с плазмидами У. pestis, которые кодируют синтез антигенов V—W и наружных белков (Yop), таких же, как у У. pestis, и других факторов вирулентности.
Они имеют общий с У. pestis кластер генов, связанных с системой транспорта железа.
Установлено, что У. pseudotuberculosis синтезирует термостабильный токсин, вызывающий гибель морских свинок при внутрибрюшинном заражении. Важную роль в патогенезе псевдотуберкулеза играет способность возбудителя к адгезии и колонизации слизистой кишечника.