- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Аминокислоты и белки
Содержание
- 2. ПОЧЕМУ ?..
- 3. Преамбула – немного философииКакое органическое соединение
- 4. Эритроциты.Белковая система гемоглобин-оксигемоглобин : перенос O2 к
- 6. Остальное - детали и в животном царстве ими управляют белки
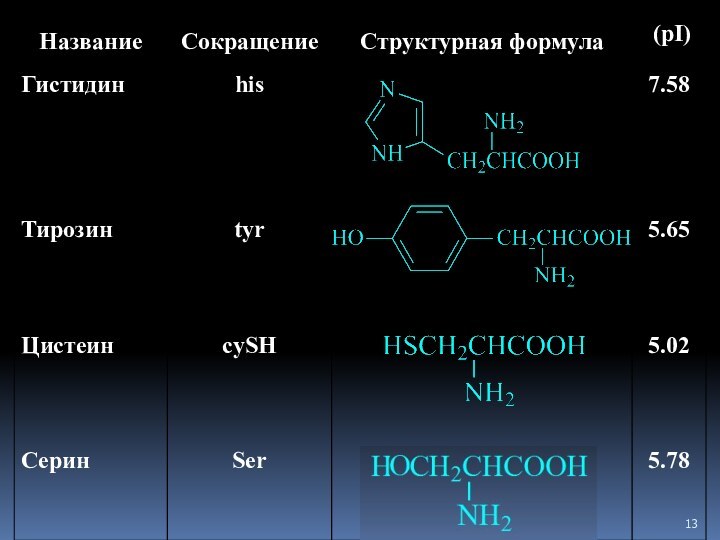
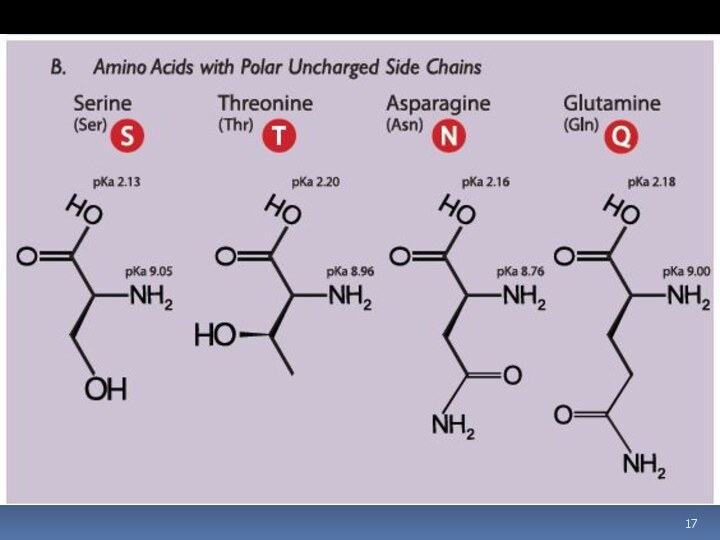
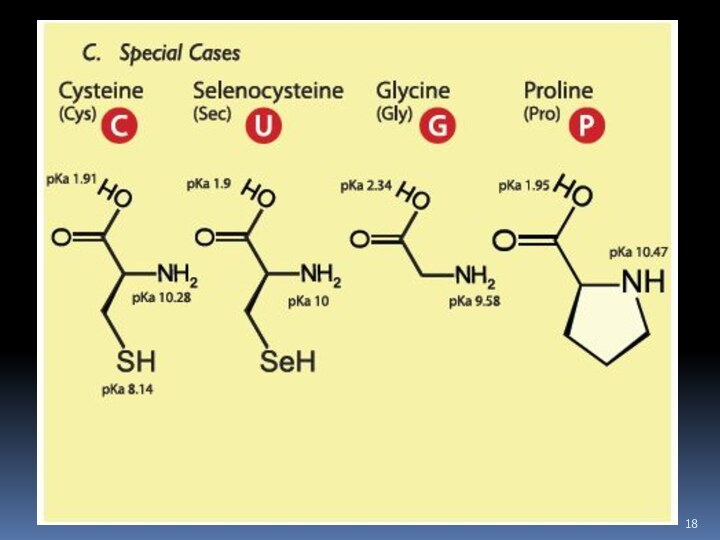
- 7. Аминокислоты Соединение, которое содержит одновременно и кислотную функциональную группу, и аминогруппу, является аминокислотой.
- 8. The key elements of an amino acid
- 9. Amino acids having both the amine and
- 14. eMolecules.com - онлайновый ресурс для рисования молекулЗадание на дом - нарисовать: ГлицинСеринФенилаланинАспарагин
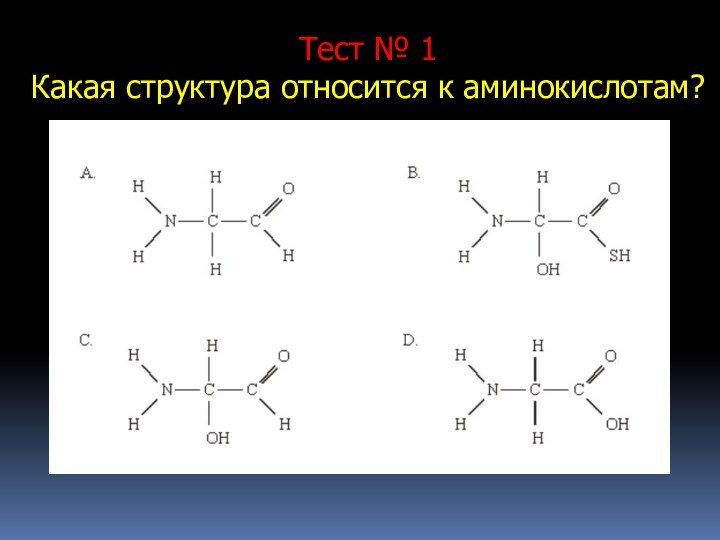
- 15. Тест № 1Какая структура относится к аминокислотам?
- 20. Незаменимые аминокислоты Незаменимыми называются аминокислоты, которые не могут
- 21. Незаменимые аминокислоты Следующие аминокислоты принято считать незаменимыми для
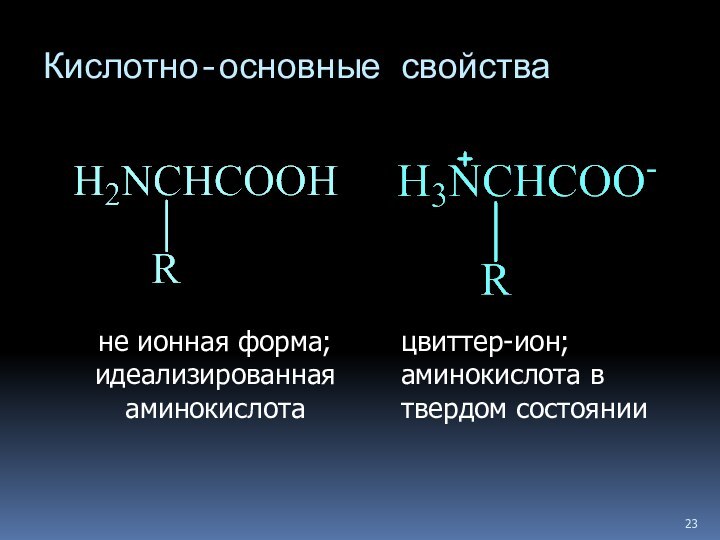
- 22. Кислотно-основные свойства
- 23. Кислотно-основные свойства не ионная форма; идеализированная аминокислота цвиттер-ион; аминокислота в твердом состоянии
- 24. Изоэлектрическая точка (рI) Изоэлектрической точкой называется такое
- 25. Способы получения аминокислот Аминирование -галогензамещенных кислот
- 26. Способы получения аминокислот Бромирование при помощи малоновой кислоты
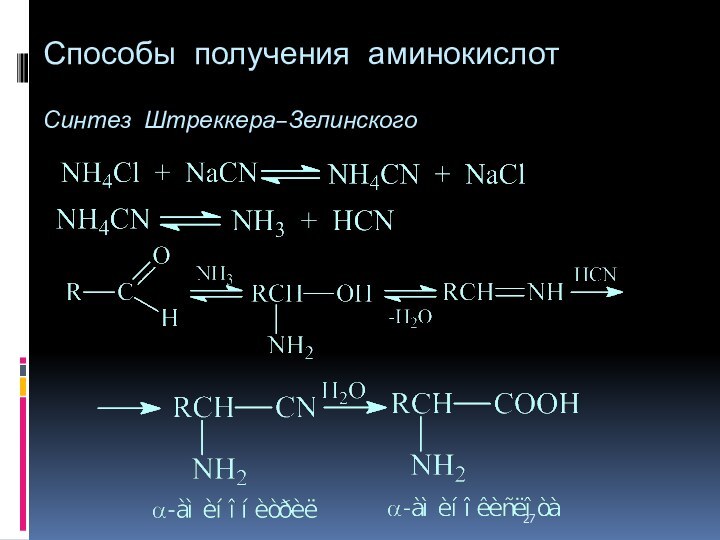
- 27. Способы получения аминокислот Синтез Штреккера–Зелинского
- 28. Способы получения аминокислот Алкилирование N-замещенных
- 29. Способы получения аминокислот Биологический способ получения
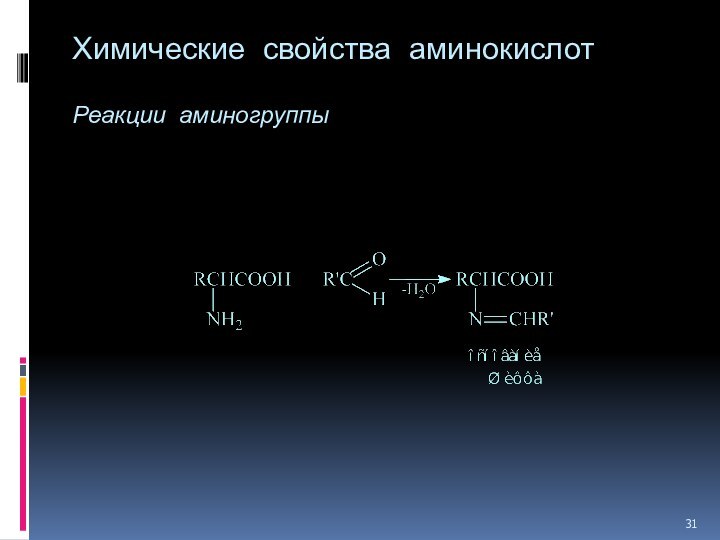
- 30. Химические свойства аминокислот Реакции аминогруппы Метод Ван-Слайка
- 31. Химические свойства аминокислот Реакции аминогруппы
- 32. Химические свойства аминокислот Реакции карбоксильной группы
- 33. Химические свойства аминокислот Реакции карбоксильной группы
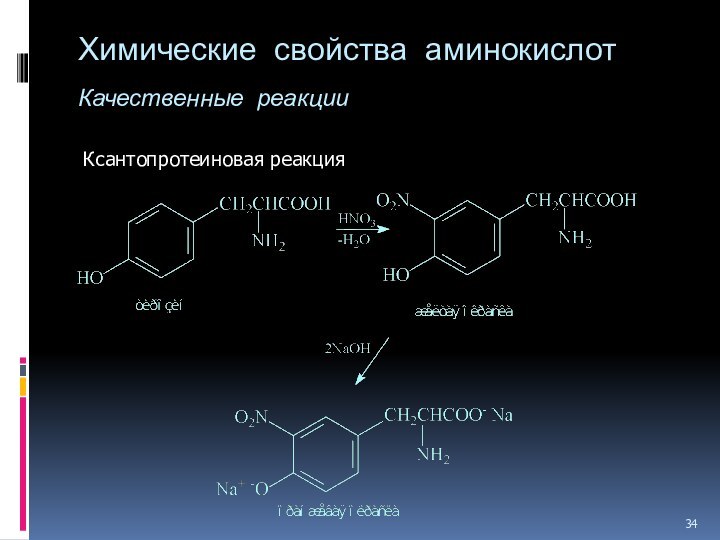
- 34. Химические свойства аминокислот Качественные реакции Ксантопротеиновая реакция
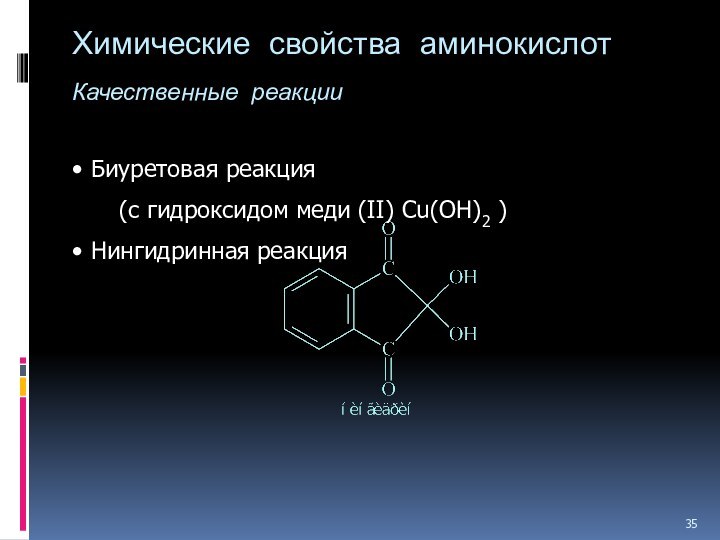
- 35. Химические свойства аминокислот Качественные реакции Биуретовая реакция (с гидроксидом меди (II) Cu(OH)2 ) Нингидринная реакция
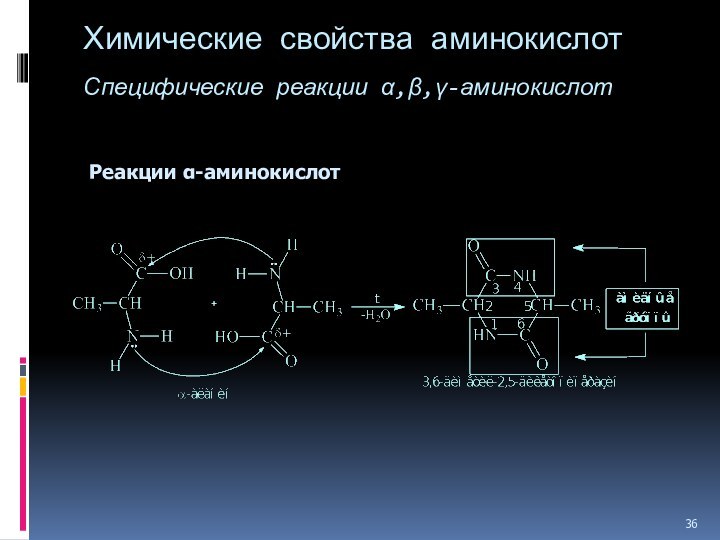
- 36. Химические свойства аминокислот Специфические реакции ,,-аминокислот Реакции -аминокислот
- 37. Химические свойства аминокислот Специфические реакции ,,-аминокислот Реакции -аминокислот
- 44. Химические свойства аминокислот Специфические реакции ,,-аминокислот Реакции -аминокислот
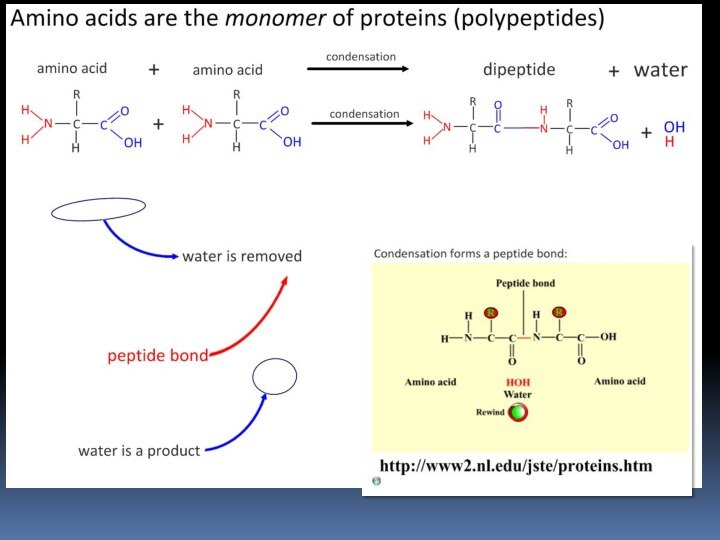
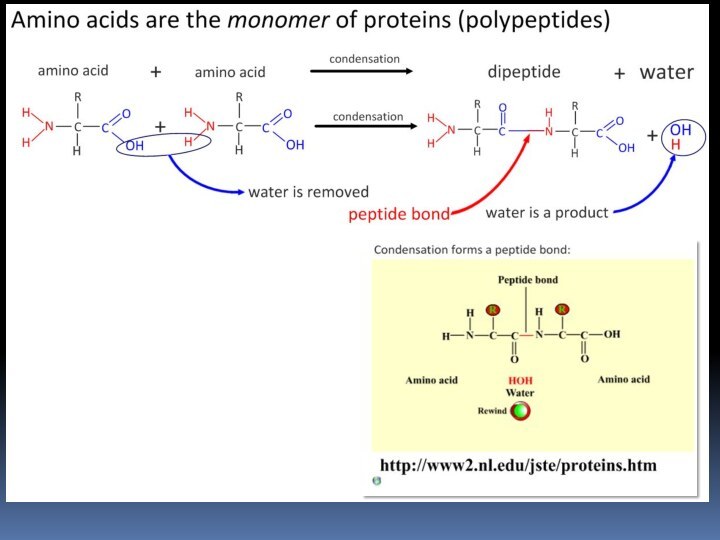
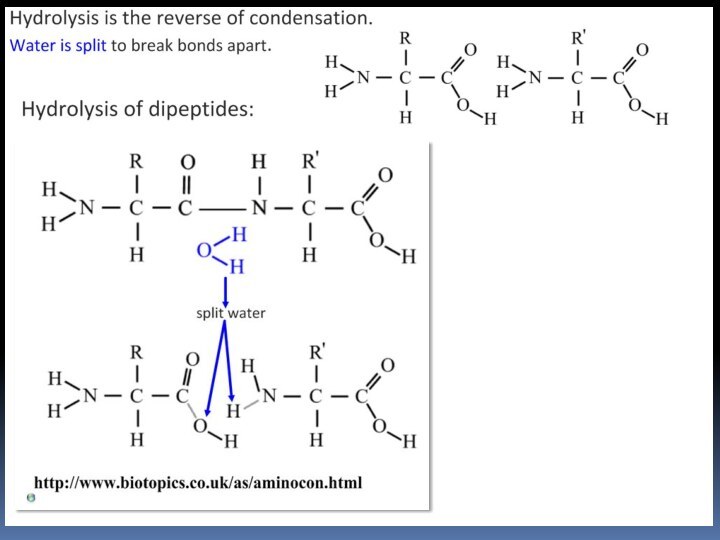
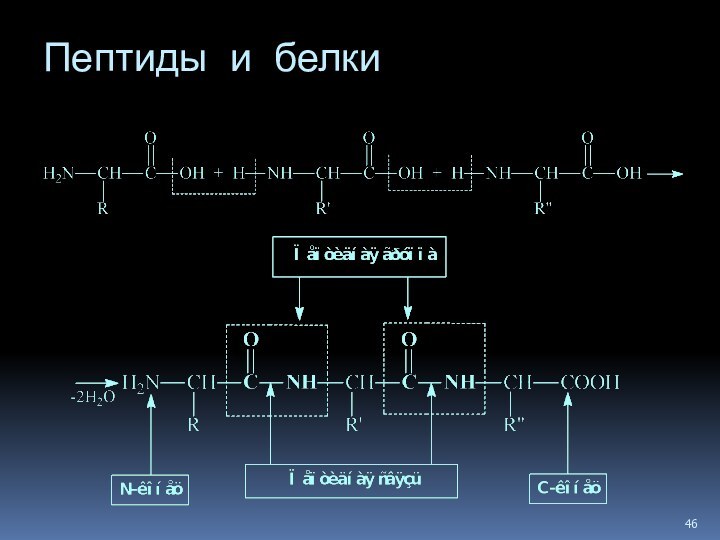
- 45. Пептиды и белки Пептиды — соединения, построенные из нескольких остатков -аминокислот, связанных амидной (пептидной) связью.
- 46. Пептиды и белки
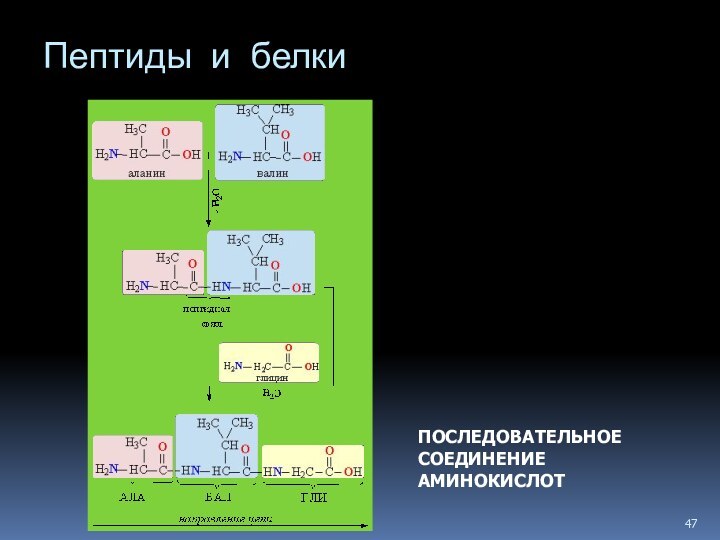
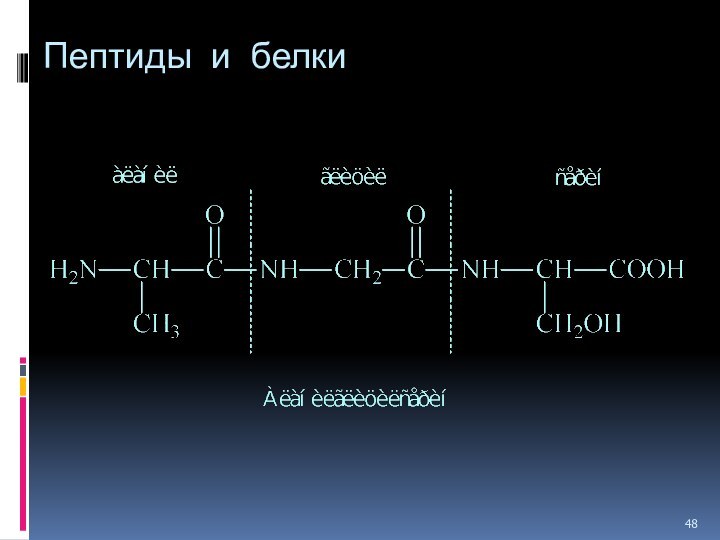
- 47. Пептиды и белки ПОСЛЕДОВАТЕЛЬНОЕ СОЕДИНЕНИЕ АМИНОКИСЛОТ
- 48. Пептиды и белки
- 49. Пептиды и белки Первичная структура белка инсулина не позволяет увидеть , как он работает...
- 50. Пептиды и белки
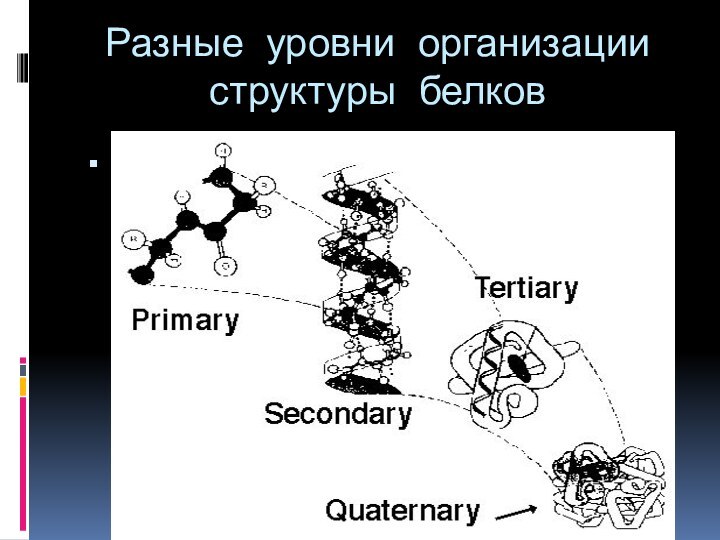
- 51. Разные уровни организации структуры белков
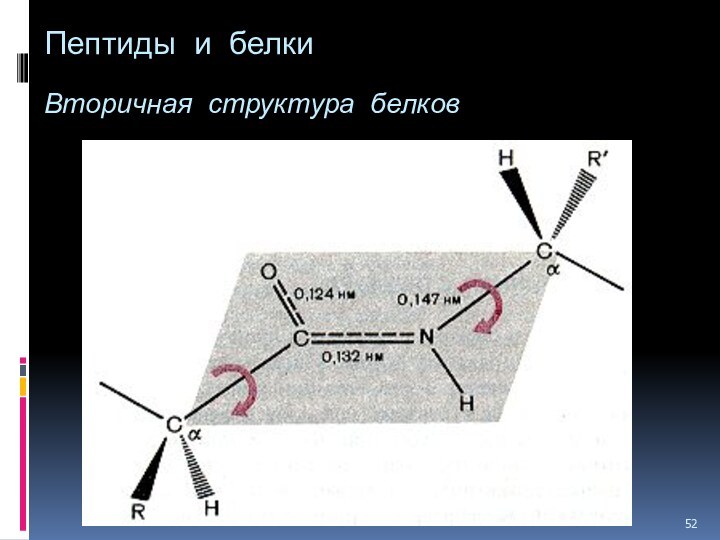
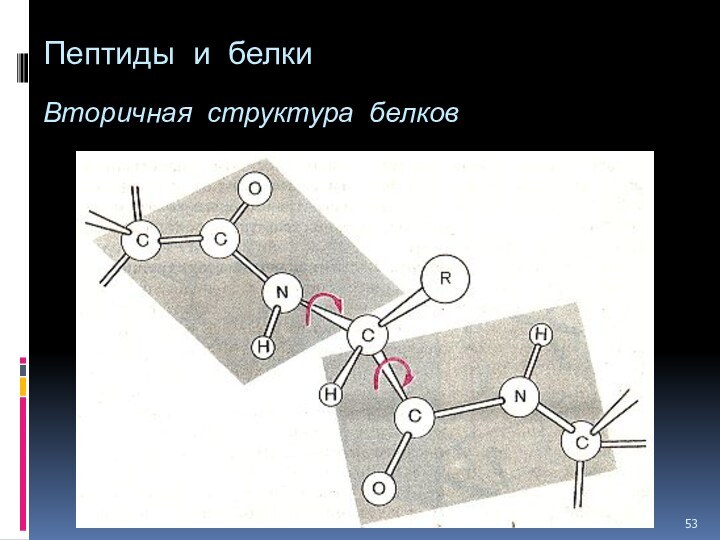
- 52. Пептиды и белки Вторичная структура белков
- 53. Пептиды и белки Вторичная структура белков
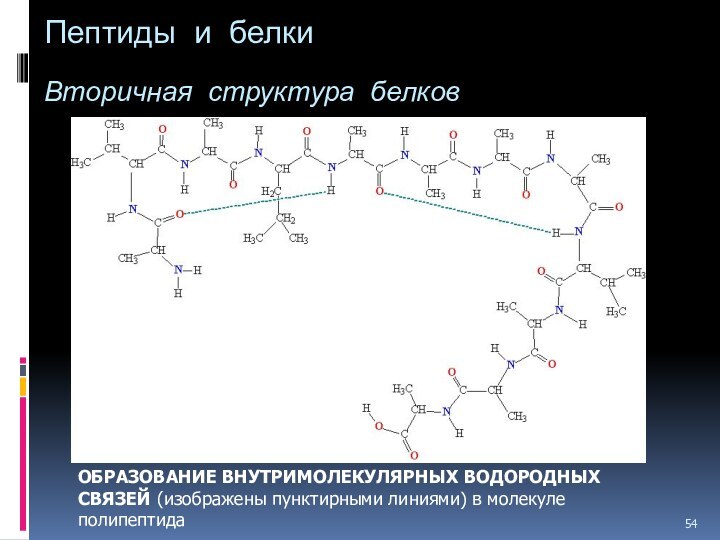
- 54. Пептиды и белки Вторичная структура
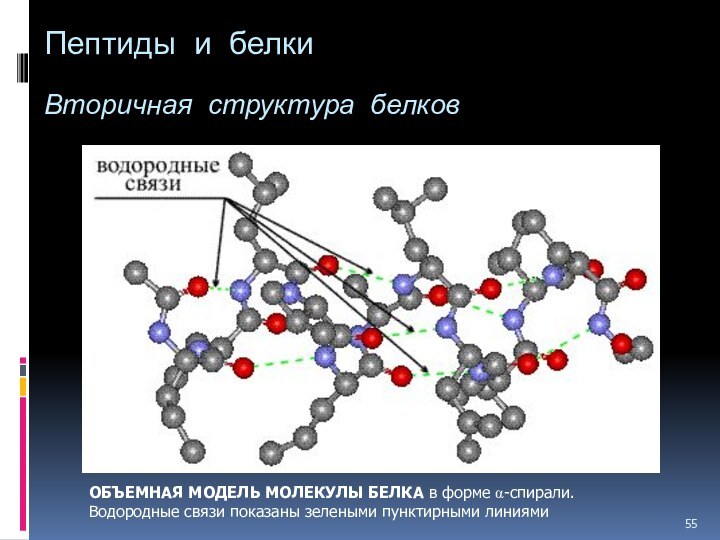
- 55. Пептиды и белки Вторичная структура
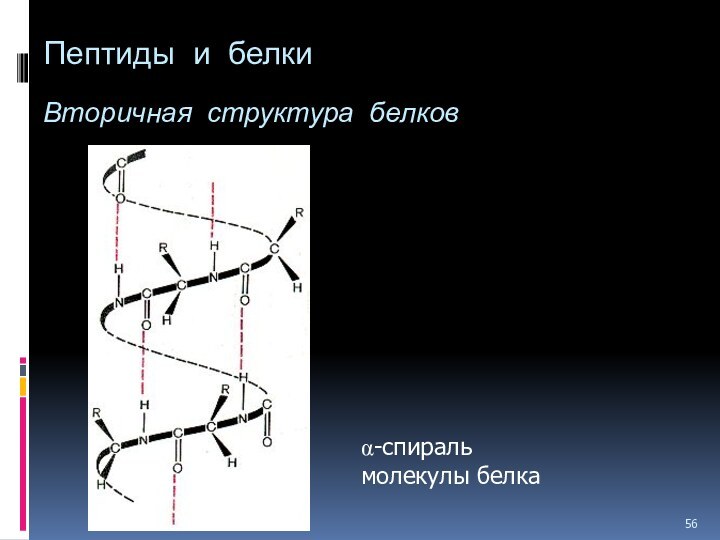
- 56. Пептиды и белки Вторичная структура белков a-спираль молекулы белка
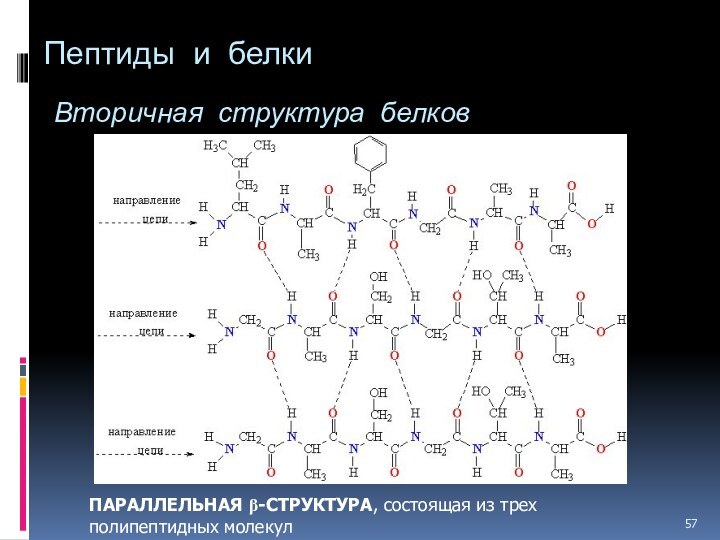
- 57. Пептиды и белки Вторичная структура белков ПАРАЛЛЕЛЬНАЯ b-СТРУКТУРА, состоящая из трех полипептидных молекул
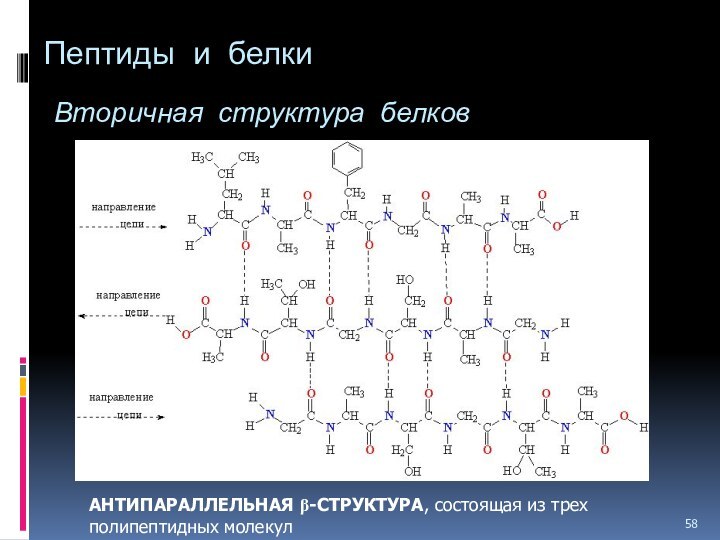
- 58. Пептиды и белки Вторичная структура белков АНТИПАРАЛЛЕЛЬНАЯ b-СТРУКТУРА, состоящая из трех полипептидных молекул
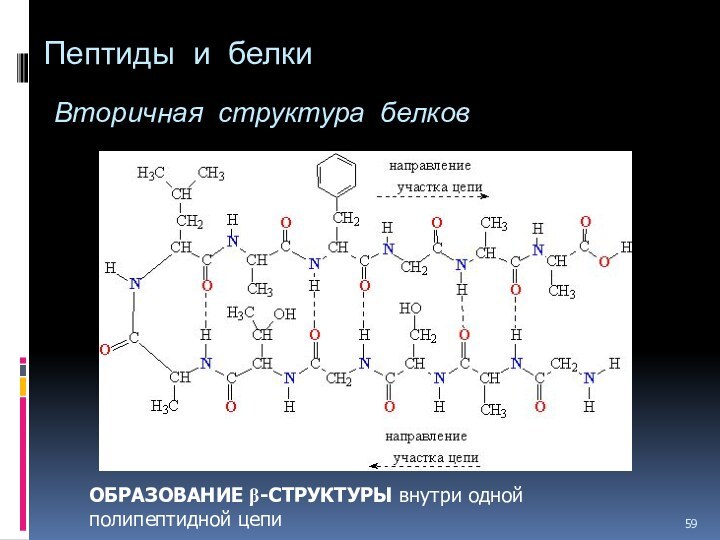
- 59. Пептиды и белки Вторичная структура белков ОБРАЗОВАНИЕ b-СТРУКТУРЫ внутри одной полипептидной цепи
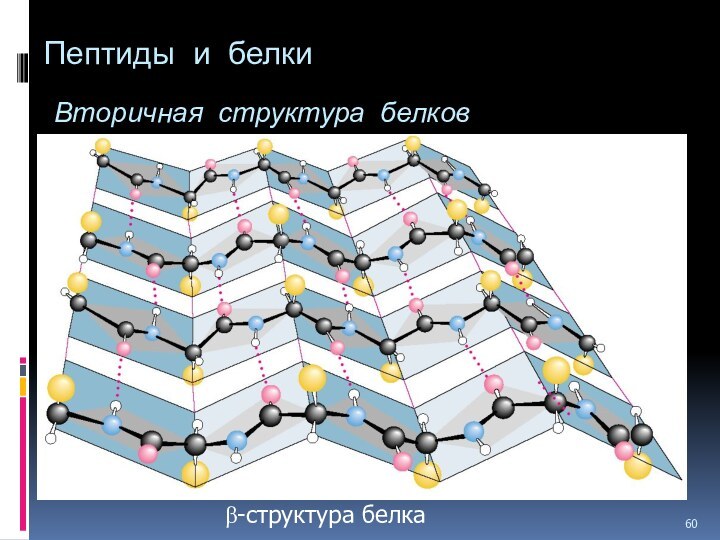
- 60. Пептиды и белки Вторичная структура белков b-структура белка
- 61. Пептиды и белки Вторичная
- 62. Пептиды и белки Вторичная
- 63. Пептиды и белки Третичная структура
- 64. Пептиды и белки Ионные взаимодействия
- 65. Пептиды и белки Дисульфидные взаимодействия
- 66. Пептиды и белки Глобулярные белкиГЛОБУЛЯРНАЯ
- 67. Пептиды и белки Фибриллярные белкиФИБРИЛЛЯРНЫЙ
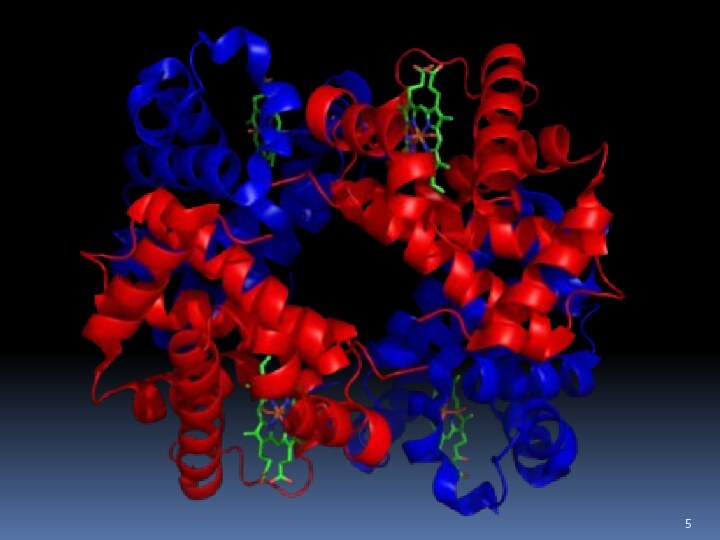
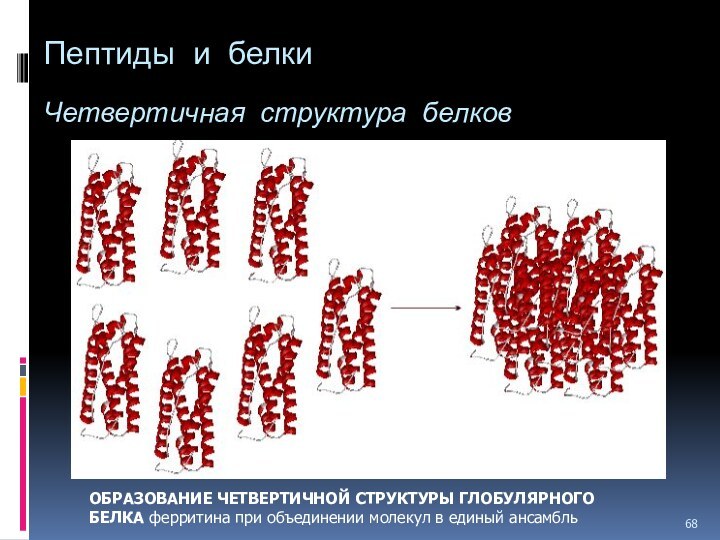
- 68. Пептиды и белки Четвертичная структура
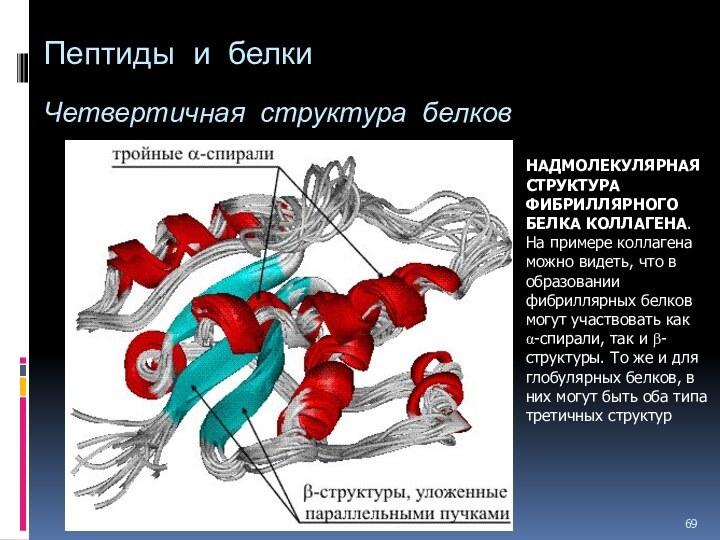
- 69. Пептиды и белки Четвертичная структура
- 70. Пептиды и белки Денатурация белковДенатурация
- 71. Функции белков Ферментативная Строительная
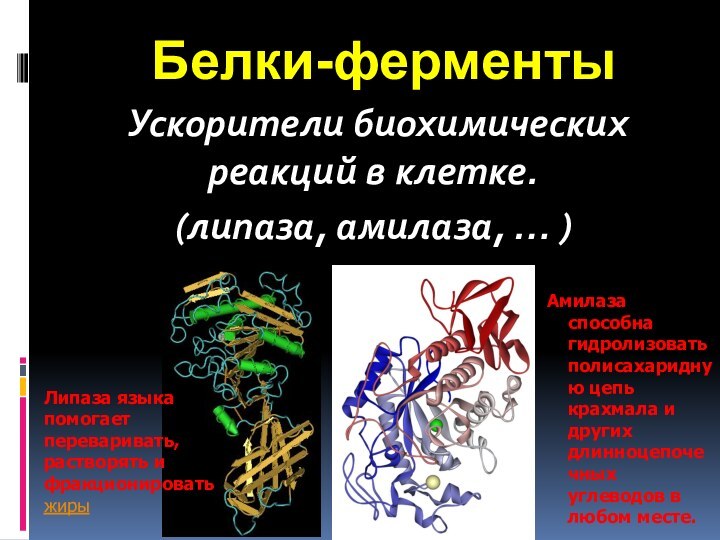
- 72. Белки-ферменты Ускорители биохимических реакций в клетке.(липаза, амилаза,
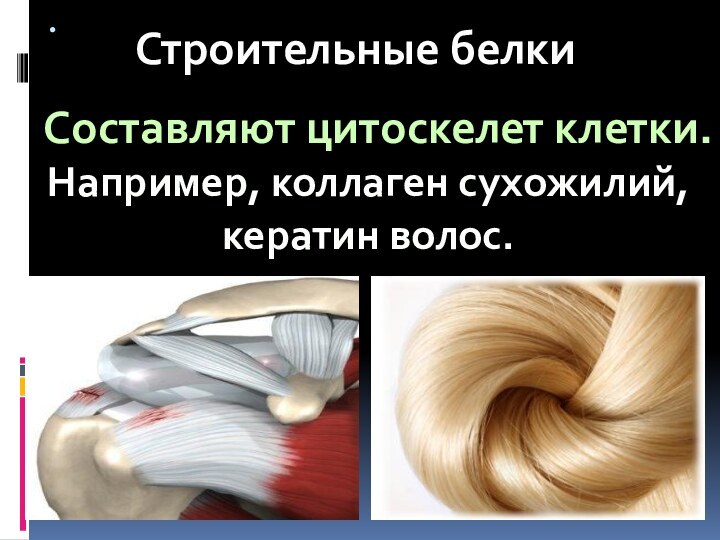
- 73. Строительные белки Входят в состав биологических мембран
- 74. . Строительные белкиНапример, коллаген сухожилий, кератин волос.Составляют цитоскелет клетки.
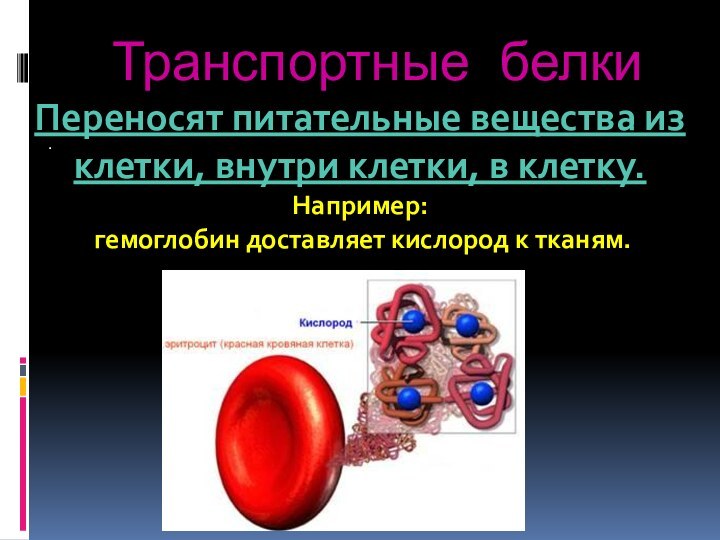
- 75. Транспортные белки.Переносят питательные вещества из клетки, внутри клетки, в клетку. Например: гемоглобин доставляет кислород к тканям.
- 76. Сократительные белки.Используются организмом для движения.Например, актомиозин.
- 77. Регуляторные белкиВыполняют функцию управления деятельностью ферментов.Например: гормон инсулин, тирозин; гормон роста – гипофиз.
- 78. Пищевые белки.Используются на ранних этапах развития организма для роста.Например: казеин молока, яичный альбумин.
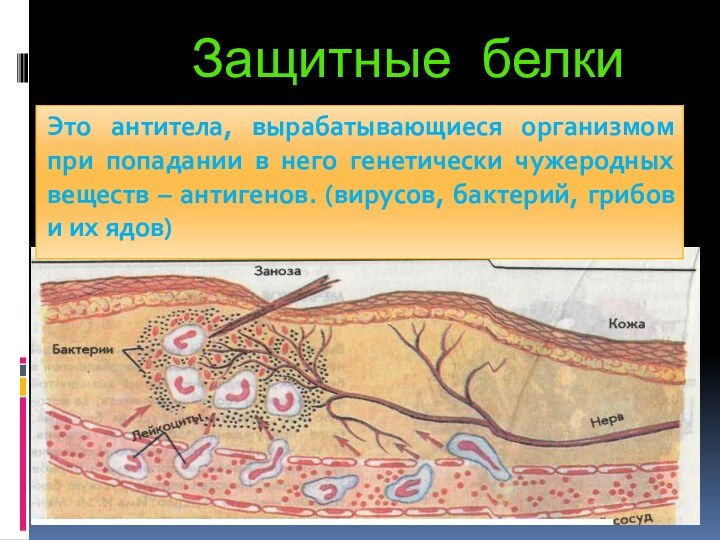
- 79. Защитные белкиЭто антитела, вырабатывающиеся
- 80. .При расщеплении 1 грамма белков
- 81. Скачать презентацию
- 82. Похожие презентации






























Слайд 3
Преамбула –
немного философии
Какое органическое соединение является химической
предпосылкой и основой жизни в обоих царствах -
и растений) ???
Слайд 4
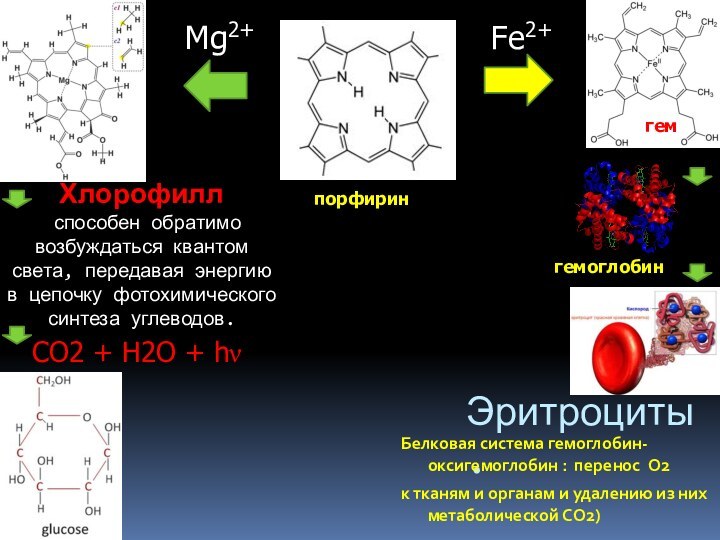
Эритроциты.
Белковая система гемоглобин-оксигемоглобин : перенос O2
к тканям
и органам и удалению из них метаболической СО2)
гемоглобин
Fe2+
Mg2+
порфирин
гем
Хлорофилл
способен
обратимо возбуждаться квантом света, передавая энергию в цепочку фотохимического синтеза углеводов.СO2 + H2O + hn
Слайд 7
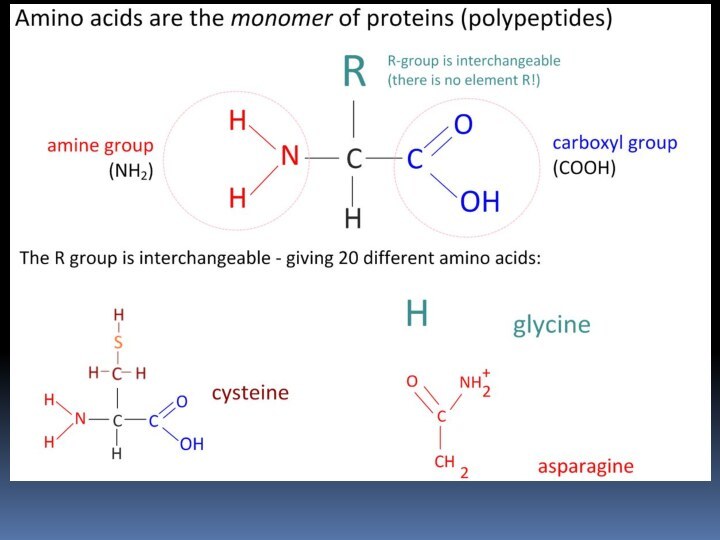
Аминокислоты
Соединение, которое содержит одновременно и кислотную функциональную группу,
и аминогруппу, является аминокислотой.
Слайд 8 The key elements of an amino acid are carbon, hydrogen, oxygen,
and nitrogen, though other elements are found in the side-chains
of certain amino acids About 500 amino acids are known[1] and can be classified in many ways.
Structurally they can be classified according to the functional groups' locations as alpha- (α-), beta- (β-), gamma- (γ-) or delta- (δ-) amino acids; other categories relate to polarity, pH level, and side chain group type (aliphatic, acyclic, aromatic, containing hydroxyl or sulfur, etc.)
In the form of proteins, amino acids comprise the second largest component (after water) of human muscles, cells and other tissues.[2] Outside proteins, amino acids perform critical roles in processes such as neurotransmitter transport and biosynthesis.
Слайд 9 Amino acids having both the amine and carboxylic
acid groups attached to the first (alpha-) carbon atom have particular
importance in biochemistry. They are known as 2-, alpha-, or α-amino acids (generic formula H2NCHRCOOH in most cases[3] where R is an organic substituent known as a "side-chain");[4] often the term "amino acid" is used to refer specifically to these. They include the 22 proteinogenic ("protein-building") amino acids[5][6][7] which combine into peptide chains ("polypeptides") to form the building blocks of a vast array of proteins.[8]These are all L-stereoisomers ("left-handed" isomers) although a few D-amino acids ("right-handed") occur in bacterial envelopes and some antibiotics.[9]
Twenty of the proteinogenic amino acids are encoded directly by triplet codonsin the genetic code and are known as "standard" amino acids.
The other two ("non-standard" or "non-canonical") are pyrrolysine (found in methanogenic organisms and other eukaryotes) and selenocysteine (present in many noneukaryotes as well as most eukaryotes).
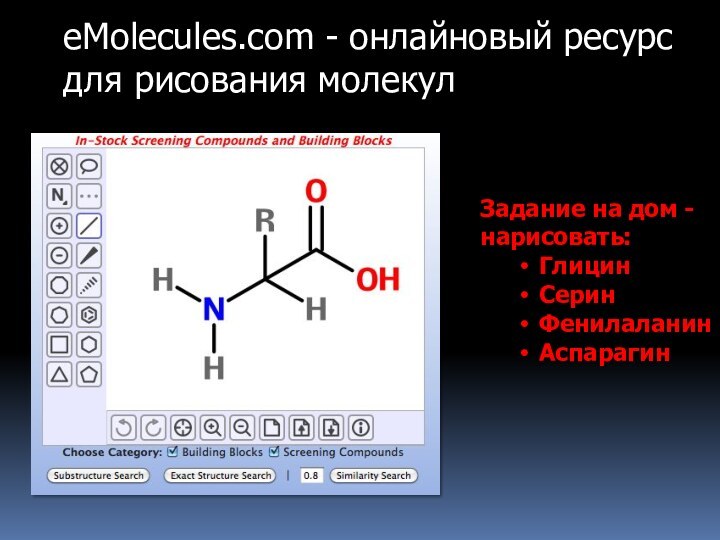
Слайд 14
eMolecules.com - онлайновый ресурс для рисования молекул
Задание на
дом - нарисовать:
Глицин
Серин
Фенилаланин
Аспарагин
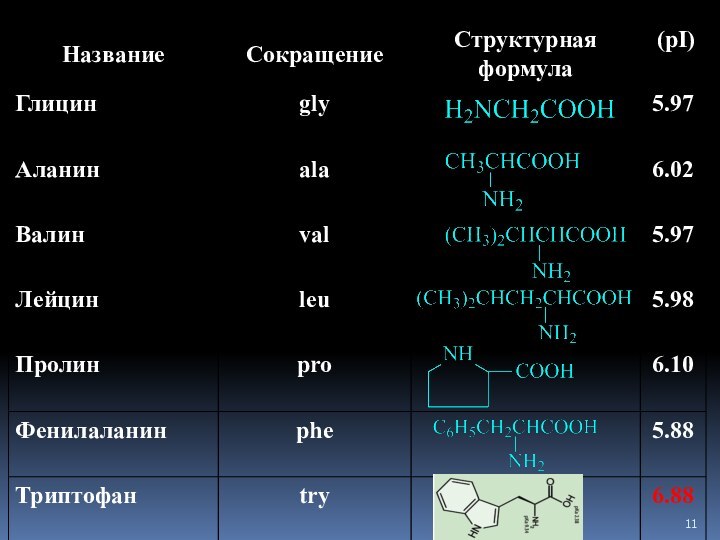
Слайд 20
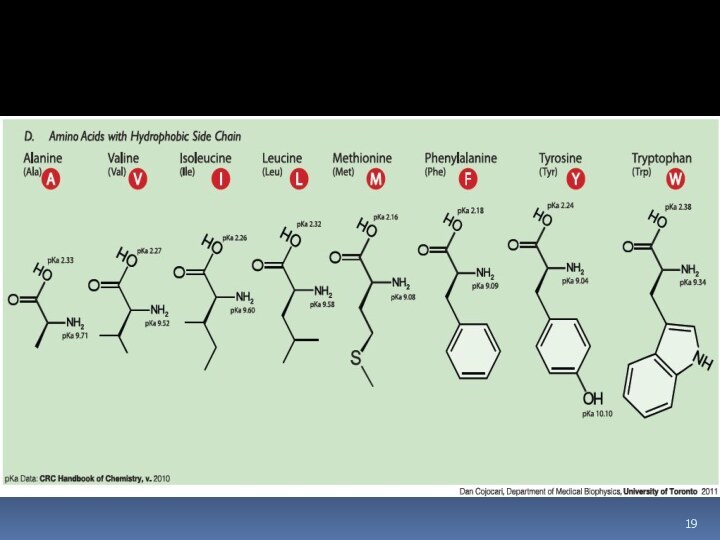
Незаменимые аминокислоты
Незаменимыми называются аминокислоты, которые не могут быть
синтезированы организмом из веществ, поступающих с небелковой пищей, в
количествах, достаточных для того, чтобы удовлетворить физиологические потребности организма.
Слайд 21
Незаменимые аминокислоты
Следующие аминокислоты принято считать незаменимыми для организма
человека:
изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и
валин.
Слайд 23
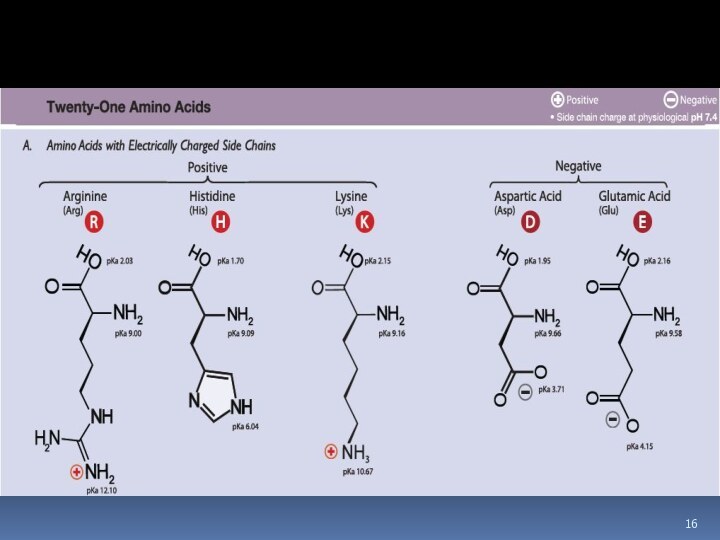
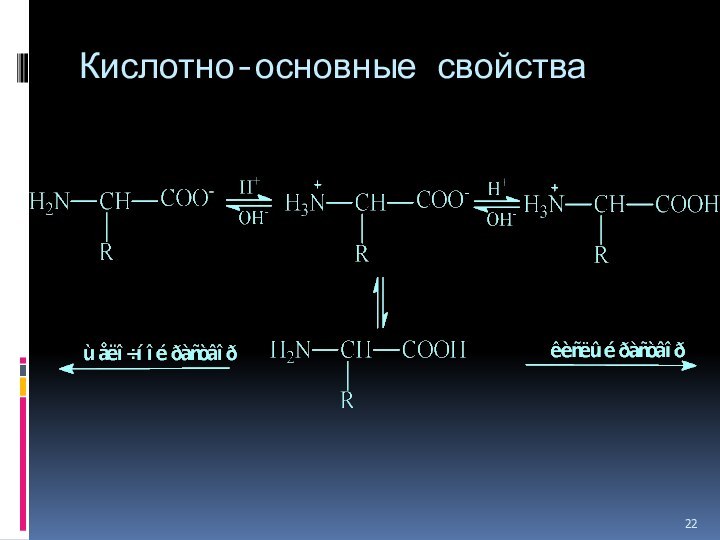
Кислотно-основные свойства
не ионная форма;
идеализированная аминокислота
цвиттер-ион;
аминокислота в
твердом состоянии
Слайд 24
Изоэлектрическая точка (рI)
Изоэлектрической точкой называется такое значение
pH, имеющее определенное значение для каждой аминокислоты, при котором
содержание диполярного иона (цвиттер-иона) максимальноIsoelectric point
At pH values between the two pKa values, the zwitterion predominates, but coexists in dynamic equilibrium with small amounts of net negative and net positive ions. At the exact midpoint between the two pKa values, the trace amount of net negative and trace of net positive ions exactly balance, so that average net charge of all forms present is zero.[38] This pH is known as theisoelectric point pI, so pI = ½(pKa1 + pKa2).
The individual amino acids all have slightly different pKa values, so have different isoelectric points. For amino acids with charged side-chains, the pKa of the side-chain is involved. Thus for Asp, Glu with negative side-chains, pI = ½(pKa1 + pKaR), where pKaR is the side-chain pKa. Cysteine also has potentially negative side-chain with pKaR = 8.14, so pI should be calculated as for Asp and Glu, even though the side-chain is not significantly charged at neutral pH. For His, Lys, and Arg with positive side-chains, pI = ½(pKaR + pKa2). Amino acids have zero mobility in electrophoresis at their isoelectric point, although this behaviour is more usually exploited for peptides and proteins than single amino acids. Zwitterions have minimum solubility at their isolectric point and some amino acids (in particular, with non-polar side-chains) can be isolated by precipitation from water by adjusting the pH to the required isoelectric point.
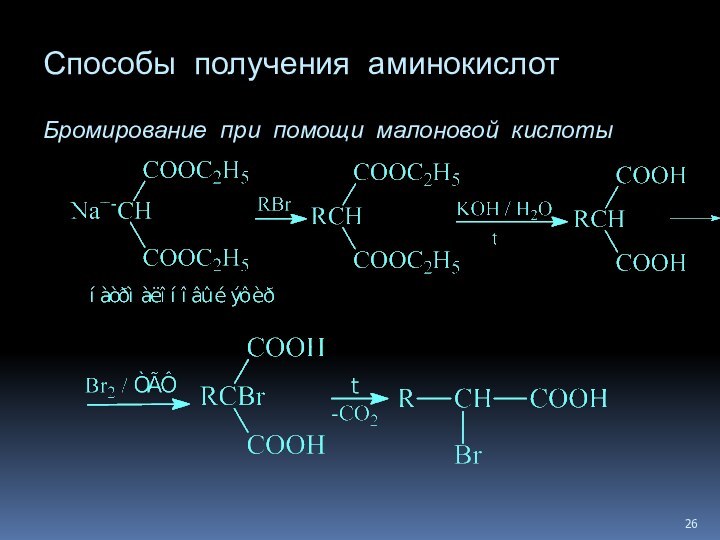
Слайд 28
Способы получения аминокислот
Алкилирование N-замещенных аминомалоновых эфиров
Аминирование эфиров
-галоген-замещенных кислот (с помощью фталимида калия)
Слайд 29
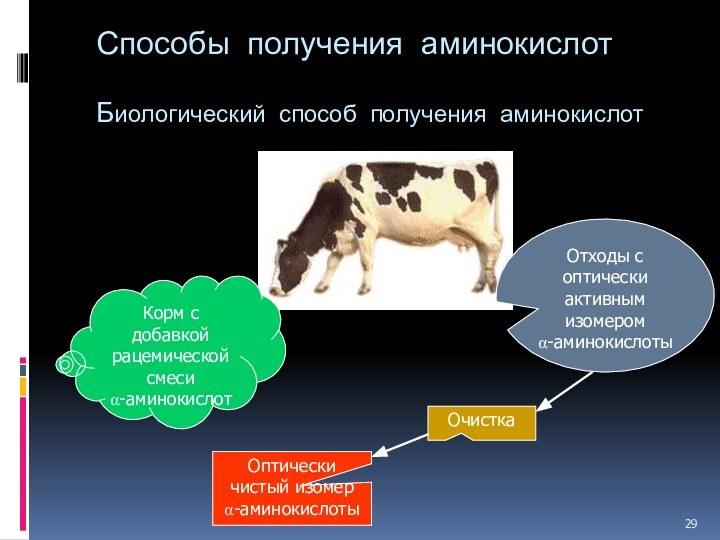
Способы получения аминокислот
Биологический способ получения аминокислот
Корм с добавкой
рацемической смеси
a-аминокислот
Отходы с оптически активным изомером
a-аминокислоты
Очистка
Оптически чистый
изомер
a-аминокислоты
Слайд 35
Химические свойства аминокислот
Качественные реакции
Биуретовая реакция
(с гидроксидом
меди (II) Cu(OH)2 )
Нингидринная реакция
Слайд 36
Химические свойства аминокислот
Специфические реакции ,,-аминокислот
Реакции -аминокислот
Слайд 37
Химические свойства аминокислот
Специфические реакции ,,-аминокислот
Реакции -аминокислот
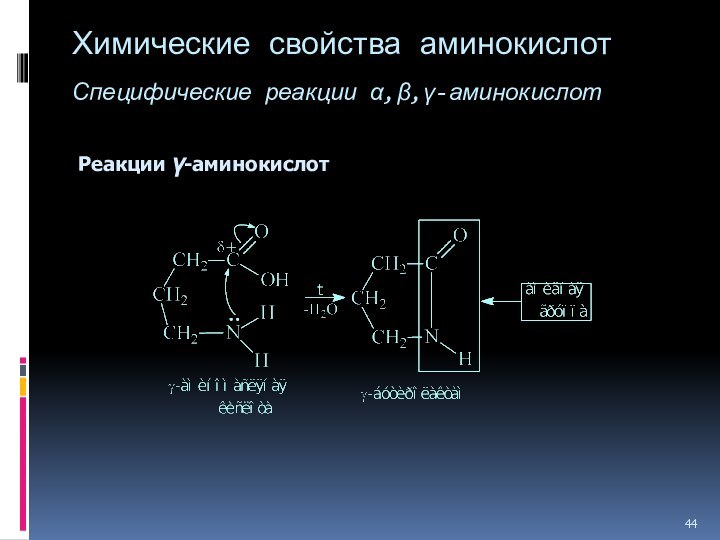
Слайд 44
Химические свойства аминокислот
Специфические реакции ,,-аминокислот
Реакции -аминокислот
Слайд 45
Пептиды и белки
Пептиды — соединения, построенные из
нескольких остатков -аминокислот, связанных амидной (пептидной) связью.
Слайд 49
Пептиды и белки
Первичная структура белка инсулина не
позволяет увидеть , как он работает...
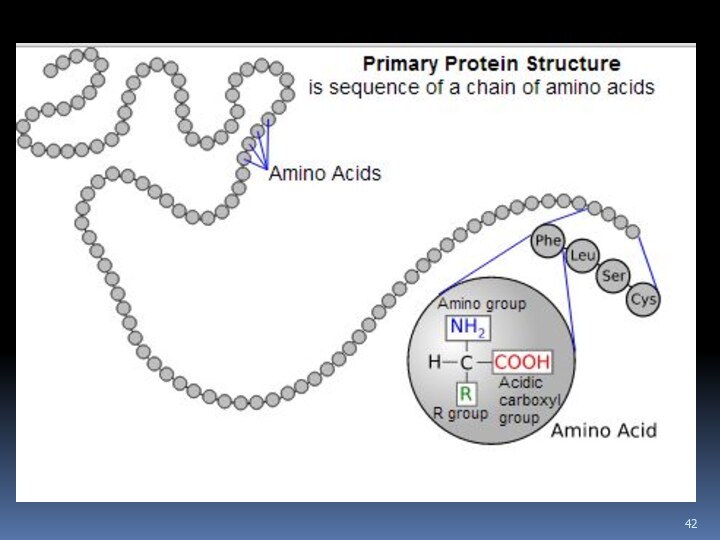
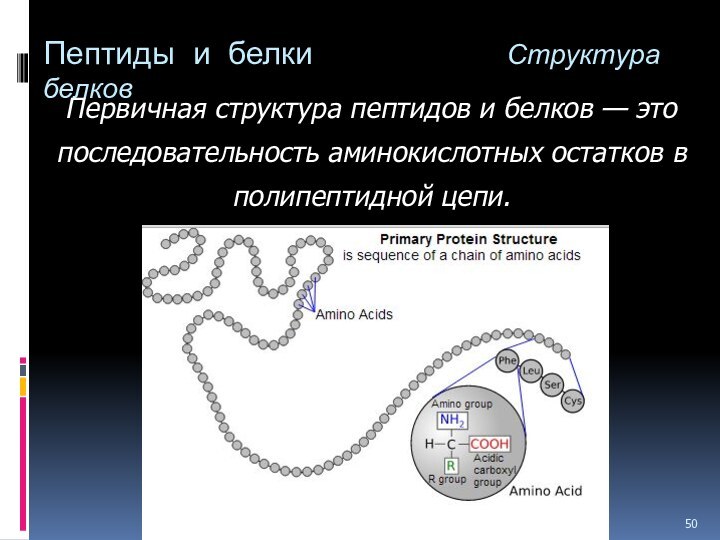
Слайд 50 Пептиды и белки
Структура белков
Первичная структура пептидов и белков — это
последовательность аминокислотных остатков в полипептидной цепи.
Слайд 54
Пептиды и белки
Вторичная структура белков
ОБРАЗОВАНИЕ ВНУТРИМОЛЕКУЛЯРНЫХ
ВОДОРОДНЫХ СВЯЗЕЙ (изображены пунктирными линиями) в молекуле полипептида
Слайд 55
Пептиды и белки
Вторичная структура белков
ОБЪЕМНАЯ МОДЕЛЬ
МОЛЕКУЛЫ БЕЛКА в форме a-спирали. Водородные связи показаны зелеными
пунктирными линиями
Слайд 57
Пептиды и белки
Вторичная структура белков
ПАРАЛЛЕЛЬНАЯ
b-СТРУКТУРА, состоящая из трех полипептидных молекул
Слайд 58
Пептиды и белки
Вторичная структура белков
АНТИПАРАЛЛЕЛЬНАЯ
b-СТРУКТУРА, состоящая из трех полипептидных молекул
Слайд 59
Пептиды и белки
Вторичная структура белков
ОБРАЗОВАНИЕ
b-СТРУКТУРЫ внутри одной полипептидной цепи
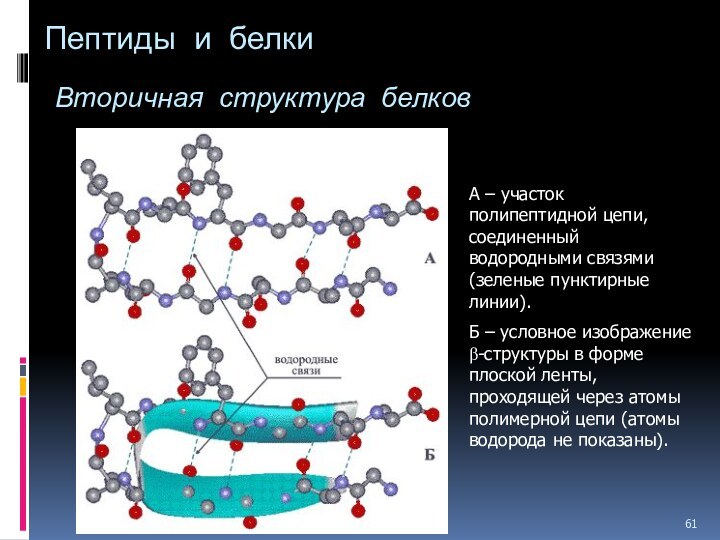
Слайд 61
Пептиды и белки
Вторичная структура белков
А
– участок полипептидной цепи, соединенный водородными связями (зеленые пунктирные
линии).Б – условное изображение b-структуры в форме плоской ленты, проходящей через атомы полимерной цепи (атомы водорода не показаны).
Слайд 62
Пептиды и белки
Вторичная структура белков
Вторичная
структура белка — это более высокий уровень структурной организации,
в котором закрепление конформации происходит за счет водородных связей между пептидными группами.
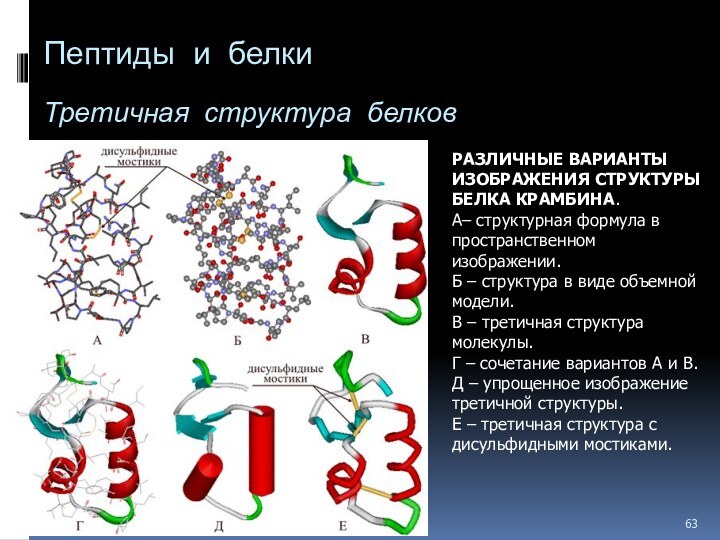
Слайд 63
Пептиды и белки
Третичная структура белков
РАЗЛИЧНЫЕ ВАРИАНТЫ
ИЗОБРАЖЕНИЯ СТРУКТУРЫ БЕЛКА КРАМБИНА.
А– структурная формула в пространственном
изображении. Б – структура в виде объемной модели.
В – третичная структура молекулы.
Г – сочетание вариантов А и В.
Д – упрощенное изображение третичной структуры.
Е – третичная структура с дисульфидными мостиками.
Слайд 66
Пептиды и белки
Глобулярные белки
ГЛОБУЛЯРНАЯ СТРУКТУРА АЛЬБУМИНА (белок
куриного яйца). В структуре помимо дисульфидных мостиков присутствуют свободные
сульфгидридные HS-группы цистеина, которые в процессе разложения белка легко образуют сероводород – источник запаха тухлых яиц. Дисульфидные мостики намного более устойчивы и при разложении белка сероводород не образуют
Слайд 67
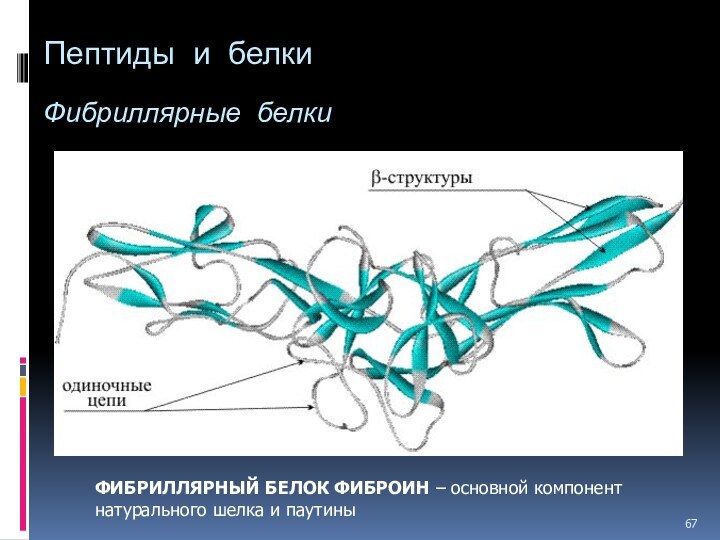
Пептиды и белки
Фибриллярные белки
ФИБРИЛЛЯРНЫЙ БЕЛОК ФИБРОИН –
основной компонент натурального шелка и паутины
Слайд 68
Пептиды и белки
Четвертичная структура белков
ОБРАЗОВАНИЕ ЧЕТВЕРТИЧНОЙ
СТРУКТУРЫ ГЛОБУЛЯРНОГО БЕЛКА ферритина при объединении молекул в единый
ансамбль
Слайд 69
Пептиды и белки
Четвертичная структура белков
НАДМОЛЕКУЛЯРНАЯ СТРУКТУРА
ФИБРИЛЛЯРНОГО БЕЛКА КОЛЛАГЕНА. На примере коллагена можно видеть, что
в образовании фибриллярных белков могут участвовать как a-спирали, так и b-структуры. То же и для глобулярных белков, в них могут быть оба типа третичных структур
Слайд 70
Пептиды и белки
Денатурация белков
Денатурация белков — это
разрушение их природной (нативной) пространственной структуры с сохранением первичной
структуры
Слайд 71
Функции белков
Ферментативная
Строительная
Транспортная
СократительнаяРегуляторная
Пищевая
Защитная
Энергетическая
Рецепторная
?





























