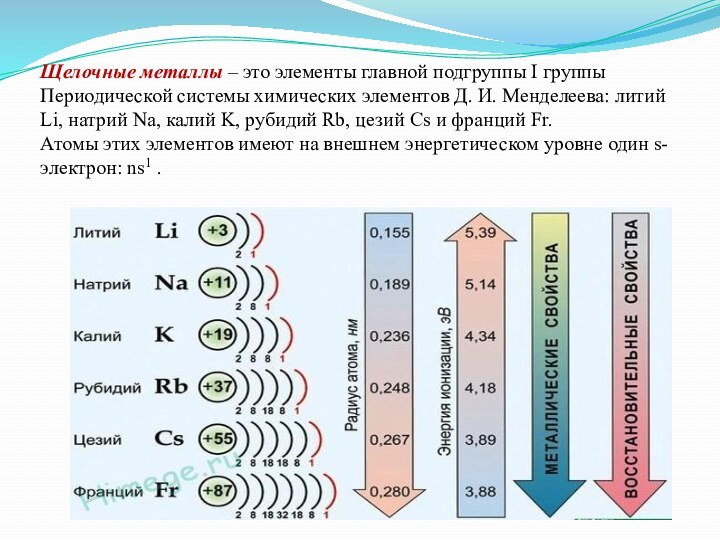
группы Периодической системы химических элементов Д. И. Менделеева: литий
Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr.Атомы этих элементов имеют на внешнем энергетическом уровне один s-электрон: ns1 .
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть










![Элементы первой группы главной подгруппы Качественная реакцияК+1.Окрашивает пламя горелки в фиолетовый цвет.2.С реактивом Фишера2KCl + Na3[Co(NO2)6] → K2Na[Co(NO2)6]↓(желт.крист.осадок) + 2 NaCl](/img/tmb/14/1372979/d5318ed686f1442392cfb19ef6f87757-720x.jpg)












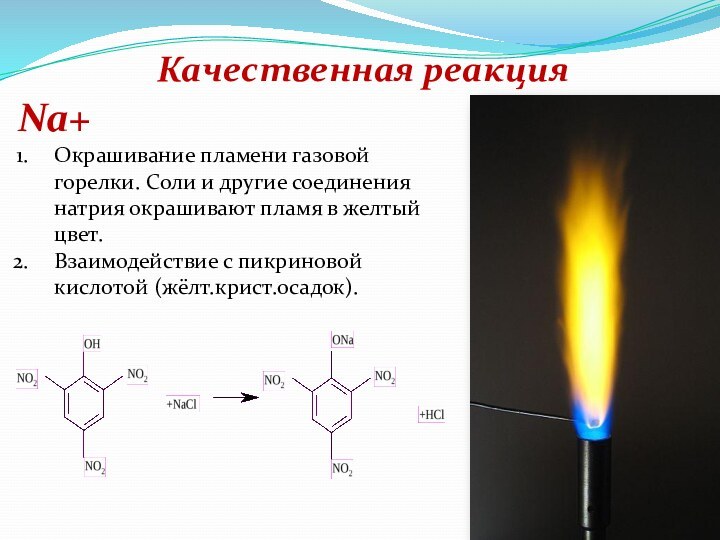
Натрий
натрий под слоем керосина.
4. Натрий растворяется почти во всех кислотах с образованием большого количества солей:
2Nа + 2НСl = 2NаСl + Н2
2Nа + Н2SО4 = Na2SО4 + Н2
Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются.
Важнейшие соединения калия
Химические свойства
Цезий
На воздухе и в атмосфере кислорода цезий мгновенно воспламеняется, образуя смесь пероксида Сs2O2 и надпероксида цезия CsO2.
Плотность франция при нормальных условиях равна 1,87 г/см³, то есть он намного легче алюминия, но является одним из наиболее плотных щелочных металлов.