Слайд 3
Газ — агрегатное состояние вещества, характеризующееся очень
слабыми связями между составляющими его частицами (молекулами, атомами или
ионами), а также их большой подвижностью.
Определение
Слайд 4
сопротивляется деформации
не имеет фиксированного объёма
стремится заполнить весь доступный
объём
сжимается
Физические свойства
Слайд 5
Слово «газ» было придумано в начале
XVII века фламандским естествоиспытателем Я. Б. ван Гельмонтом для
обозначения полученного им «мёртвого воздуха» (углекислого газа).
В России для обозначения газов М. В. Ломоносов употреблял термин «упругие жидкости», но он не прижился.
История
Слайд 6
1754 г. – Джозеф Блэк обнаружил, что при нагревании
белой магнезии (углекислый магний) образуется жжёная магнезия (окись магния)
и выделяется «связанный воздух», то есть углекислый газ:
MgCO3 MgO + CO2
Открытие CO2
Слайд 7
1766 г. - Г. Кавендиш (Англия) изучил свойства
«горючего воздуха». Он установил, что этот газ при сгорании
на воздухе образует воду. Г. Кавендиша считают первооткрывателем водорода.
Открытие водорода
Слайд 8
18 августа 1868 г. одновременно два астронома -
Норман Локьер (Англия) и Жюль Жансен (Франция) обнаружили новый
газ, образовавшийся в результате солнечных вспышек.
Открытие гелия
Слайд 9
1771 г. – Карл Шееле (Швеция) прокаливал селитру
с серной кислотой и затем разлагал получившийся оксид азота.
1774
г. - Джозеф Пристли (Англия) разлагал оксид ртути в герметично закрытом сосуде и направлял на это соединение солнечные лучи с помощью мощной линзы.
Открытие кислорода
Слайд 10
13 августа 1894 года
Джон Уильям Стретт
Уильям Рамзай
(Лорд Рэлей)
Открытие аргона
Слайд 11
Молекулярно-кинетическая теория газов
все тела состоят из частиц: атомов,
молекул и ионов;
частицы находятся в непрерывном хаотическом движении (тепловом);
частицы
взаимодействуют друг с другом путём абсолютно упругих столкновений.
Слайд 12
Молекулярно-кинетическая теория идеального газа
Основные признаки модели:
расстояния между молекулами
велики по сравнению с их размерами;
взаимодействие между молекулами на
расстоянии отсутствует;
при столкновениях молекул действуют большие силы отталкивания;
время столкновения много меньше времени свободного движения между столкновениями.
Слайд 13
Кинетическая теория газов
Исходные предположения:
газ
состоит из частиц пренебрежимо малого объема,
эти частицы находятся в
непрерывном беспорядочном движении,
частицы газа не притягиваются друг к другу,
частицы газа являются идеально упругими, поэтому их столкновения не сопровождаются потерей кинетической энергии,
средняя кинетическая энергия частиц газа пропорциональна его абсолютной температуре.
Слайд 15
Закон Бойля-Мариотта
При постоянной температуре и массе
идеального газа произведение его давления и объема постоянно.
Слайд 16
Авогадро (1811г.)
В равных объемах идеальных газов при одинаковых
давлении и температуре содержится одинаковое число молекул.
Слайд 17
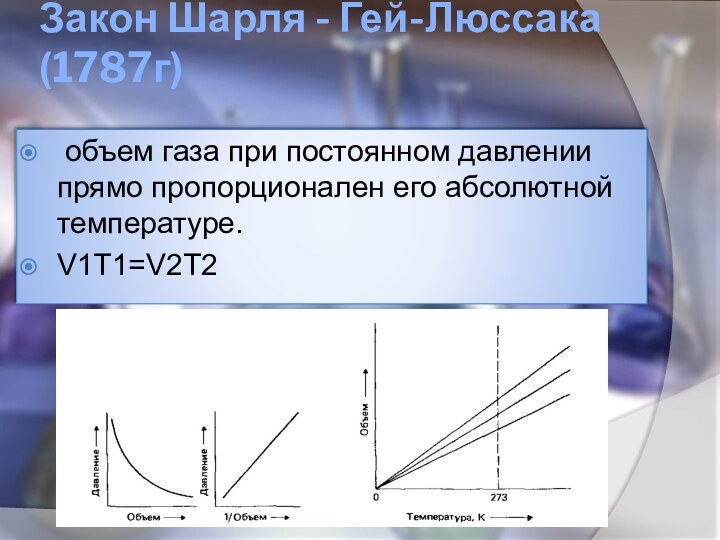
Закон Шарля - Гей-Люссака(1787г)
объем газа при постоянном
давлении прямо пропорционален его абсолютной температуре.
V1T1=V2T2
Слайд 19
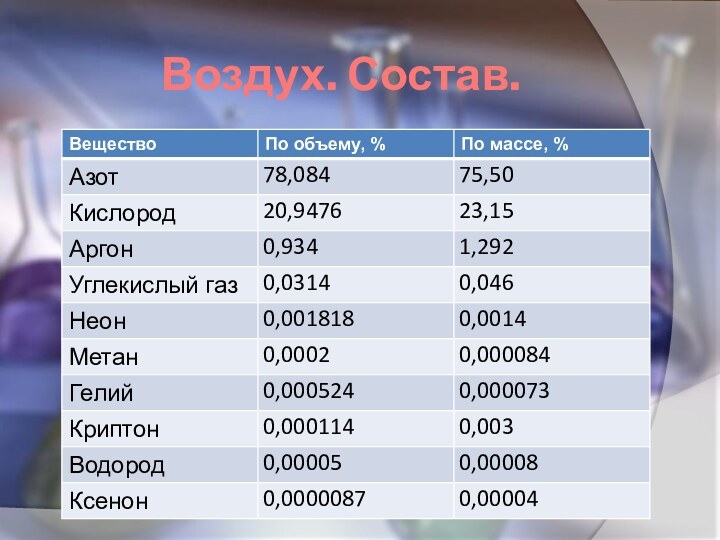
Воздух
Джозеф Блэк (16 апреля 1728, Бордо, Франция —
6 декабря 1799, Эдинбург)
Слайд 22
Азот, N2
Физические свойства:
отсутствие цвета, вкуса, запаха., малорастворим.
Существуют кристаллические модификации твердого азота.
Жидкий азот
Чилийская селитра
Слайд 25
Природный газ. Состав. Физические свойства.
Основную часть природного газа
составляет метан (CH4) — от 92 до 98 %.
В состав природного газа могут также входить более тяжёлые углеводороды — гомологи метана:
этан (C2H6),
пропан (C3H8),
бутан (C4H10).
а также другие неуглеводородные вещества:
водород (H2),
сероводород (H2S),
диоксид углерода (СО2),
азот (N2),
гелий (Не).
Слайд 27
Химическое загрязнение биосферы.
Основные источники загрязнения атмосферы
транспорт
бытовые котельные
промышленность
Основные вредные
примеси пирогенного происхождения:
Оксид углерода,
сернистый ангидрид, серный ангидрид, сероводород и сероуглерод, оксиды азота, соединения фтора, соединения хлора, аэрозольное загрязнение атмосферы.
Слайд 28
Фотохимический туман (смог).
Фотохимический туман представляет
собой многокомпонентную смесь газов и аэрозольных частиц первичного и
вторичного происхождения. В состав основных компонентов смога входят озон, оксиды азота и серы, многочисленные органические соединения перекисной природы, называемые в совокупности фотооксидантами.
Слайд 29
Химическое загрязнение природных вод
Всякий водоем или водный источник
связан с окружающей его внешней средой. На него оказывают
влияние условия формирования поверхностного или подземного водного стока, разнообразные природные явления, индустрия, промышленное и коммунальное строительство, транспорт, хозяйственная и бытовая деятельность человека. Последствием этих влияний является привнесение в водную среду новых, несвойственных ей веществ - загрязнителей, ухудшающих качество воды.
Слайд 30
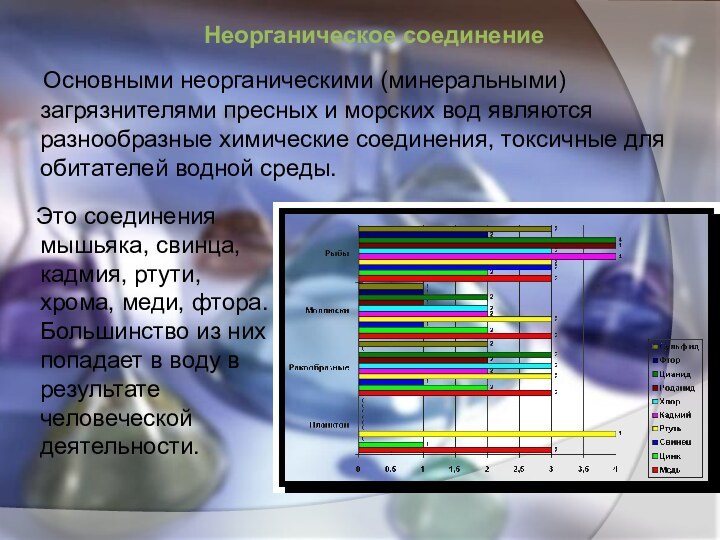
Это соединения мышьяка, свинца, кадмия, ртути,
хрома, меди, фтора. Большинство из них попадает в воду
в результате человеческой деятельности.
Основными неорганическими (минеральными) загрязнителями пресных и морских вод являются разнообразные химические соединения, токсичные для обитателей водной среды.
Неорганическое соединение
Слайд 31
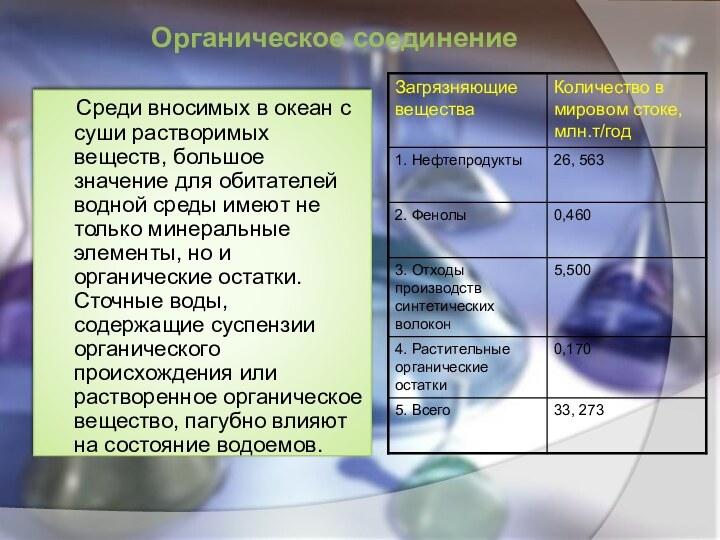
Среди вносимых в океан с суши растворимых веществ,
большое значение для обитателей водной среды имеют не только
минеральные элементы, но и органические остатки. Сточные воды, содержащие суспензии органического происхождения или растворенное органическое вещество, пагубно влияют на состояние водоемов.
Органическое соединение
Слайд 32
Кислотные дожди
В пресной воде рек и
озер много ядовитых веществ, в ней могут быть болезнетворные
микробы.
В результате в некоторых местах Земли выпадают вредные, так называемые кислотные дожди.
Это пагубно влияет как на растения так и на животных.
Слайд 33
Кислотные осадки (дожди, туманы, снег) -
это осадки, кислотность которых выше нормальной. Мерой кислотности является
значение pH (водородный показатель). Шкала значения pH идет от 02 (крайне высокая кислотность), через 7 (нейтральная Среда) до 14 (щелочная среда), причем нейтральная точка (чистая вода) имеет pH=7.
Последствия кислотных дождей
Слайд 34
Азотная и серная кислоты
Химический анализ
кислотных осадков показывает присутствие серной (H2SO4) и азотной (HNO3)
кислот. При сжигании топлива в воздух попадает диоксид серы, также происходит реакция атмосферного азота с атмосферным кислородом и, образуются оксиды азота.
Слайд 35
Борьба с кислотными дождями
Большинство людей остается безучастными
к проблеме кислотных дождей.
Для борьбы
с кислотными дождями необходимо направить усилия на сокращения выбросов кислотообразующих веществ угольными электростанциями. А для этого необходимо:
использование низкосернистого угля или его очистка от серы
установка фильтров для очистки газообразных продуктов
применение альтернативных источников энергии
Наиболее характерны кислотные дожди для индустриальных стран с высокоразвитой энергетикой.
Слайд 36
Тяжелые металлы, находящиеся в природных водах, отрицательно влияют
на почки, печень, центральную нервную систему, вызывая различные онкологические
заболевания. Кислотные дожди разъедают металлы, краски, синтетические соединения, разрушают архитектурные памятники.
Последствия
Слайд 37
Почвенный покров Земли представляет собой важнейший компонент биосферы
Земли. Именно почвенная оболочка определяет многие процессы, происходящие в
биосфере.
Чрезвычайно важно изучение глобального биохимического значения почвенного покрова, его современного состояния и изменения под влиянием антропогенной деятельности.
Загрязнение почвы