- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Генні хвороби.Діагностика спадкових захворювань
Содержание
- 2. Питання лекції:Генні (молекулярні) хворобиДіагностика, лікування і профілактика спадкових захворювань
- 3. 1. Генні (молекулярні) хвороби
- 4. Мутації – причини спадкових захворюваньЕтіологічними факторами спадкових
- 5. Генні мутаціїГенні мутації пов’язані з: випадінням (делеції) додаванням (інсерції) перестановкою нуклеотидів у гені (інверсії або заміни)
- 7. Генні хвороби — різноманітні за клінічними проявами
- 8. Загальна частота генних хвороб у популяції складає
- 9. Одна й та ж генна хвороба може
- 10. Мутації, що викликають спадкові захворювання, можуть змінювати структурні транспортні й ембріональні білкиферменти
- 11. Первинні ефекти мутантних алелівПервинні ефекти мутантних алелів
- 12. Час прояву спадкового захворюванняЧас прояву спадкового захворювання
- 13. Фенотипові ефекти патологічних мутаційВКЛЮЧАЮТЬ летальність на ранніх
- 14. Якщо розвиток ембріона не зупинився
- 15. ГенокопіїМутації різних генів можуть призводити до подібних
- 16. БілокГен 1Ген 2
- 17. Класификація генних хворобКласифікація генних хвороб може бути
- 18. У відповідності до генетичного принципу класифікації генні
- 19. Клінічний принцип класифікації визначається залученістю до патологічного
- 20. Патогенетична класифікація поділяє спадкові хвороби на 3
- 21. спадкові хвороби обміну речовин поділяють за типами
- 22. ГемоглобінопатіїГрупа захворювань, що викликаються первинним дефектом пептидних
- 23. Колагенові хворобиХвороби порушення обміну сполучної тканиниВ основі
- 24. Синдром Елерса-Данло: розтяжність шкіри рубці на лобі
- 27. Спадкові хвороби обміну амінокислотНайчисленніша група спадкових захворювань
- 28. Фенілкетонурія (ФКУ)Уперше описана О. Фелінгом у 1934
- 30. ФКУ зустрічається у світі з частотою 1
- 31. Відомо декілька форм фенілкетонурії (різняються за тяжкістю)Це
- 32. Більшість хворих — блондини із світлою шкірою
- 34. На даний час розроблено методи допологової діагностикиРання діагностика і профілактичне лікування запобігає розвитку хвороби
- 35. Альбінізм (очно-шкірний)Захворювання описано у 1959 р., зумовлено
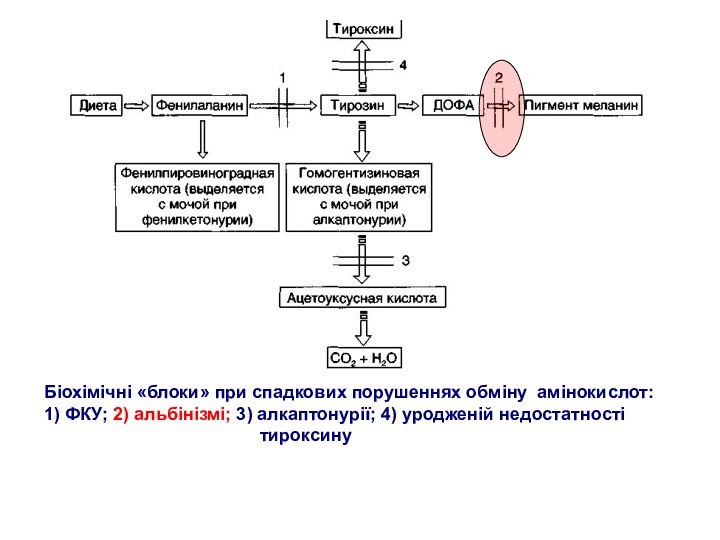
- 36. Біохімічні «блоки» при спадкових порушеннях обміну амінокислот:1)
- 39. Райдужка при альбінізмі
- 40. АлкаптонуріяПерше описане генне захворювання (1909 р., А.
- 43. Біохімічні «блоки» при спадкових порушеннях обміну амінокислот:1)
- 44. АміноацидуріїАміноацидурії - виведення підвищеної кількості амінокислот із
- 45. Симптомами захворювань є: діарея затримка розумового розвитку епілепсія атаксія ураження печінки блювота задишка
- 46. Лікування проводять індивідуально (залежно від конкретного дефекта)
- 47. спадкові захворювання, пов’язані з порушенням обміну вуглеводів
- 48. Глікогенова хвороба (глікогенози)Пов’язана із порушенням синтезу й
- 49. Глікогеноз (I тип — хвороба Гірке)Перетворення глікогену
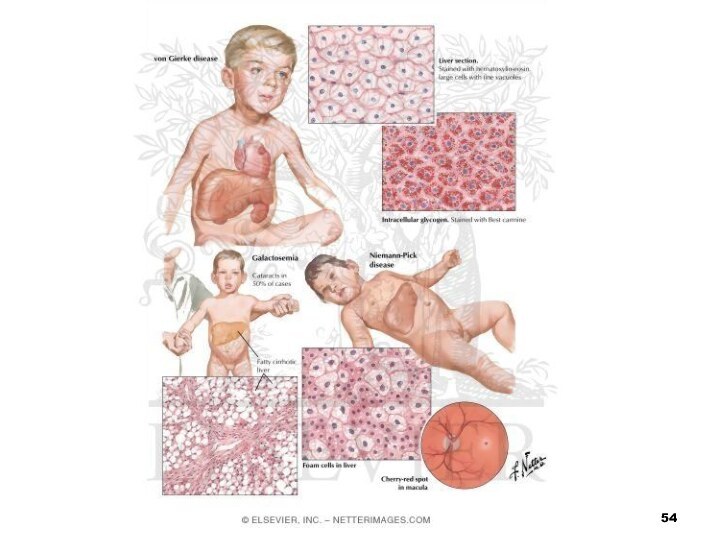
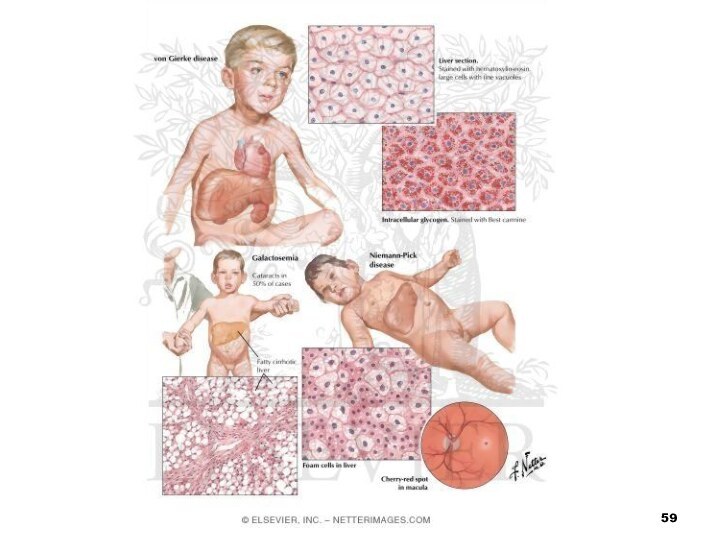
- 52. ГалактоземіяВідбувається накопичення у крові хворого галактози, що
- 53. Хвороба проявляється з перших днів життя розладами
- 55. спадкові захворювання, пов’язані з порушенням ліпідного обміну
- 56. До числа ретельно вивчених спадкових захворювань ліпідного
- 57. Хвороба Гоше характеризується накопиченням цереброзидів у клітинах
- 58. Хвороба Німана-Піка зумовлена зниженням активності фермента сфінгомієліназиВідбувається
- 60. Амавротична ідіотія (хвороба Тея-Сакса) також належить до
- 61. 2. Діагностика спадкових захворювань. Пренатальна діагностика
- 62. Діагностика спадкових захворювань у різний час ґрунтувалася
- 63. Клінічна картина спадкових захворюваньСиндром ДаунаСиндром ПатауАльбінізмРетинобластома
- 64. Класифікація методів діагностики (1)За часом проведенняПренатальна (дородова), у тому числі преімплантаційнаПостнатальна (післяродова)
- 65. Класифікація методів діагностики (2)За методамиЦитогенетичні (мікроскопічне дослідження
- 66. Переваги сучасних методів діагностикиСвоєчасність і точність (доклінічна,
- 67. Пренатальна (дородова) діагностика Це комплексна галузь
- 68. Показання до проведення пренатальної діагностики (1)Наявність у
- 69. Показання до проведення пренатальної діагностики (2)Гетерозиготність обох
- 70. Методи пренатальної діагностикиІнвазійніНеінвазійніПередбачають безпосереднійконтакт із плодомНемає безпосередньогоконтакту із плодом
- 71. Інвазійні методи пренатальної діагностикиЗастосовуються з 8-го по
- 72. Інвазійні методи діагностикиАмніоцентез (прокол плідного міхура для
- 73. Неінвазійні методи діагностикиУльтразвукове дослідженняРадіографіяВизначення альфа-фетопротеїну
- 74. Визначення альфа-фетопротеїну (АФП)АФП – білок, що виробляється
- 75. Ультразвукова діагностикаВикористовується для виявлення уроджених вад розвиткуґрунтується
- 76. Ультразвукова діагностика На поверхню живота вагітної жінки
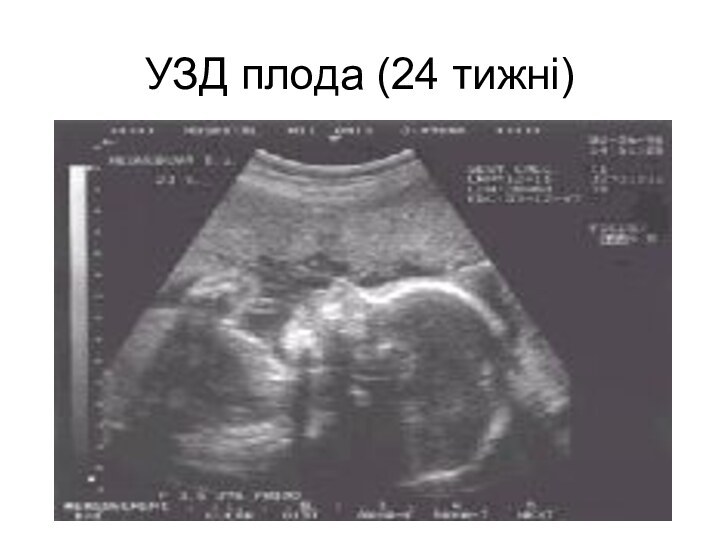
- 77. УЗД плода (24 тижні)
- 78. За допомогою УЗД можна визначити
- 79. Біопсія хоріона і плацентиБільш ранні, ніж УЗД,
- 80. Біопсія хоріона і плацентиДозволяє діагностувати хромосомні і генні хворобиРезультати протягом 3-4 днів після взяття матеріалу
- 81. Біопсія хоріона і плацентиУскладнення Відносно висока частота
- 82. АмніоцентезПрокол міхура під контролем УЗД для взяття
- 83. АмніоцентезДозволяє діагностувати багато хромосомних хворобхвороби, зчеплені зі
- 84. Амніоцентез також дозволяє проводити
- 85. КордоцентезЗабір зразків крові (лейкоцитів) із пуповинних судин плода для цитогенетичних, молекулярно-генетичних і біохімічних аналізів
- 86. КордоцентезКров більше придатна для досліджень, ніж клітини
- 87. ФетоскопіяПряме розглядання плода через фетоскоп – тонкий
- 88. ФетоскопіяПроводиться на 18-23 тижніВикористовується рідко, лише при особливих показанняхУскладнення – викидні в 7-8% випадків фетоскопії
- 89. Преімплантаційна діагностика – діагностика на ранніх стадіях
- 90. Виділення клітини зембріону людини на стадії 12
- 91. Неінвазійні методи діагностики, пов’язані з отриманням клітин
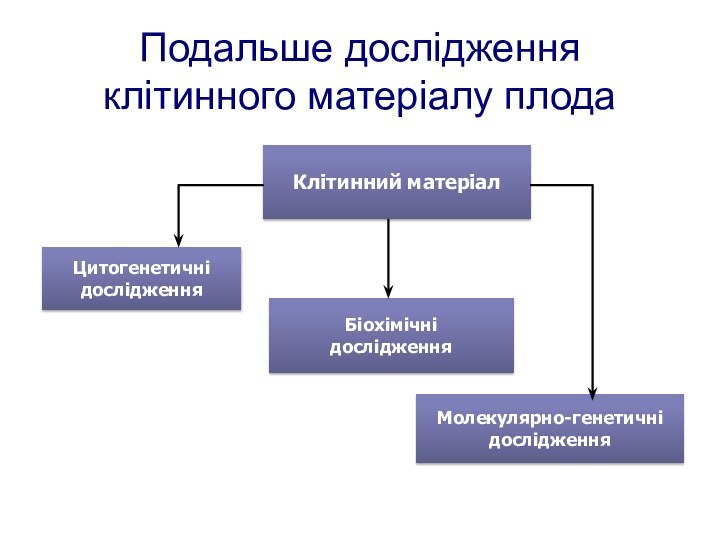
- 92. Молекулярно-генетичнідослідженняПодальше дослідження клітинного матеріалу плодаКлітинний матеріалБіохімічнідослідженняЦитогенетичні дослідження
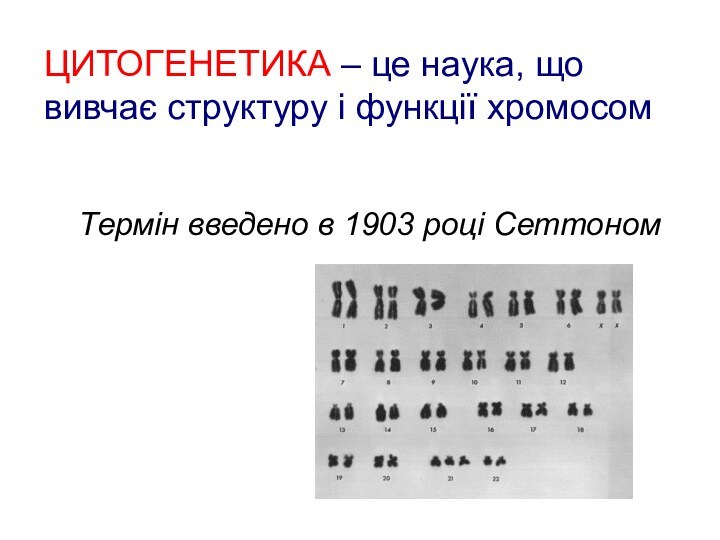
- 93. ЦИТОГЕНЕТИКА – це наука, що вивчає структуру
- 94. Цитогенетичні дослідженняЗастосування – дослідження каріотипу, діагностика геномних
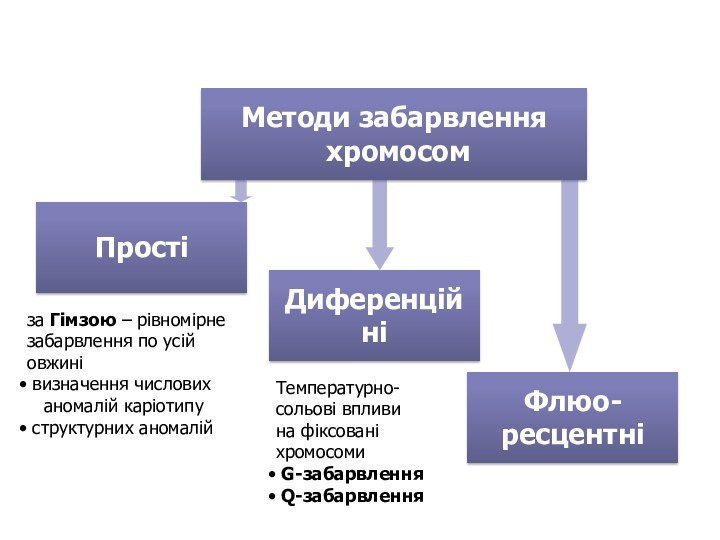
- 96. Методи забарвлення хромосомПростіДиференційніФлюо- ресцентніза Гімзою –
- 97. Хромосоми досліджуються:У метафазіУ прометафазі
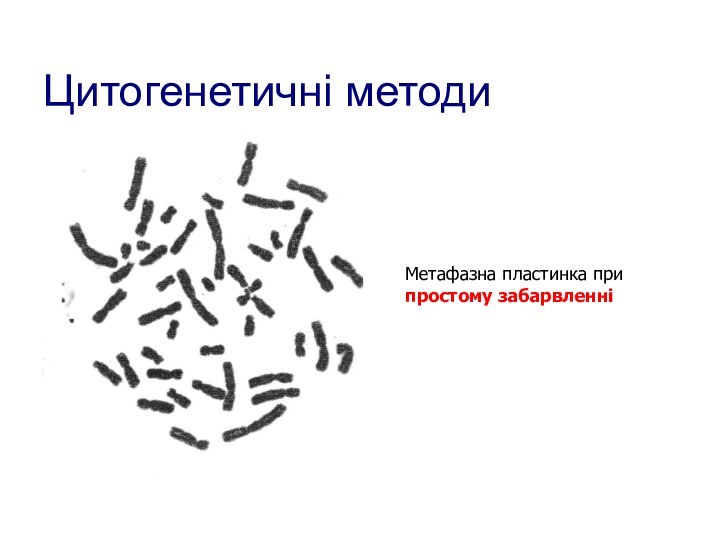
- 98. Цитогенетичні методиМетафазна пластинка припростому забарвленні
- 99. Цитогенетичні знахідкиМетафазна пластинка зрадіаційно індукованимихромосомними абераціямиМетафазна пластинка з хімічноіндукованими абераціями
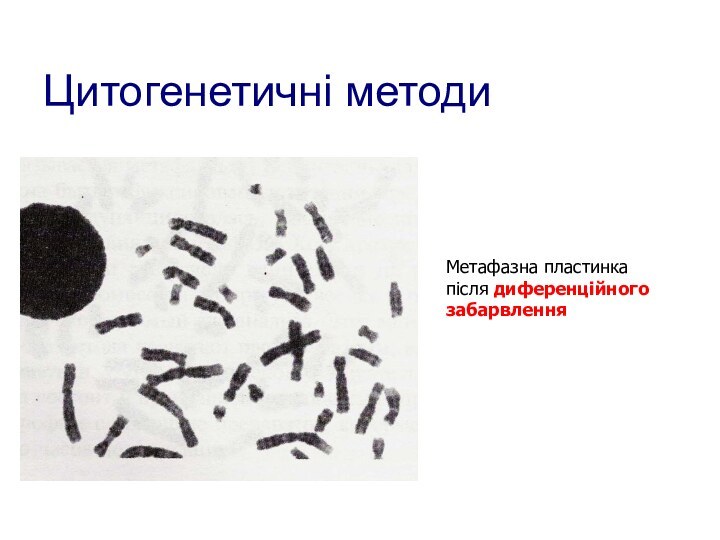
- 100. Цитогенетичні методиМетафазна пластинкапісля диференційногозабарвлення
- 101. Цитогенетичні методиА)Б)Каріотипи при простому (А) і диференційному забарвленні (Б)
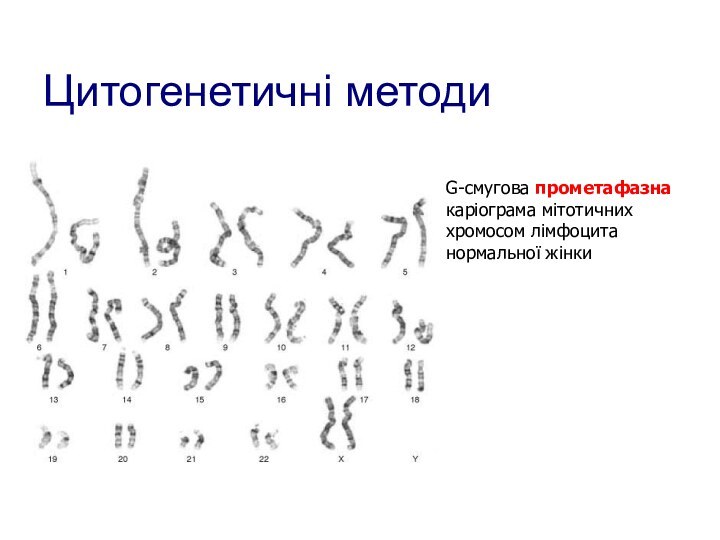
- 102. Цитогенетичні методиG-смугова прометафазнакаріограма мітотичних хромосом лімфоцита нормальної жінки
- 103. Диференційне забарвлення хромосомХ-хромосомаХромосома 2
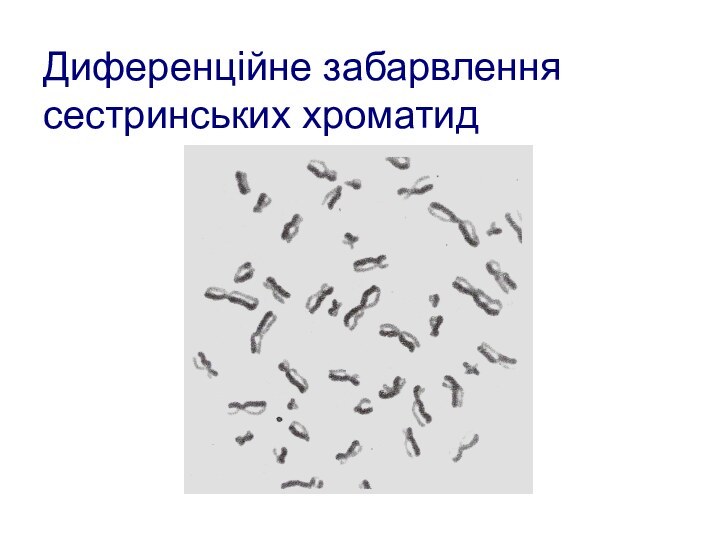
- 104. Диференційне забарвлення сестринських хроматид
- 105. Цитогенетичні знахідкиА)Б)Хроматидні аберації (А) і сестринські хроматидні
- 106. Молекулярно-цитогенетині методиМетод FISH – флуоресцентної
- 107. FISHЛокалізація гена м’язовоїглікогенфосфорилази в11-ій хромосомі людини
- 108. Застосування FISHВстановлення локалізації генівХромосомні абераціїАнеуплоїдії та ін.
- 109. Показання до цитогенетичних дослідженьКлінічна симптоматика хромосомної хворобиНаявність
- 110. Біохімічні дослідженняЗастосовуються для:- діагностики спадкових хвороб- діагностики
- 111. Показання до застосування біохімічних досліджень у новонароджених СудомиБлювотаКомаЖовтяницяГіпотонія м’язівСпецифічний запах сечі і пота АцидозПорушення кислотно-основного стануЗупинка росту
- 112. Молекулярно-генетичні дослідженняОсновна мета – виявлення варіацій у
- 113. Проект «Геном людини»Реєстрація хвороби якспадковоїЛокалізація гена в
- 114. Основні етапи молекулярно-генетичних дослідженьОтримання зразківДНК (або РНК)
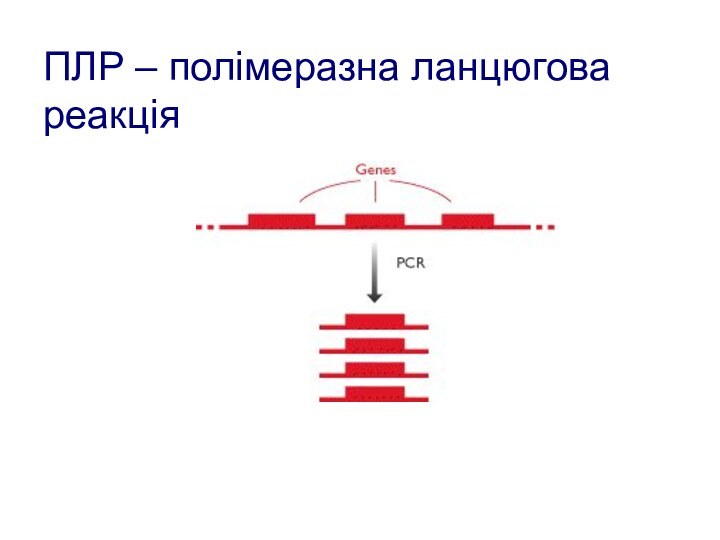
- 115. ПЛР – полімеразна ланцюгова реакція
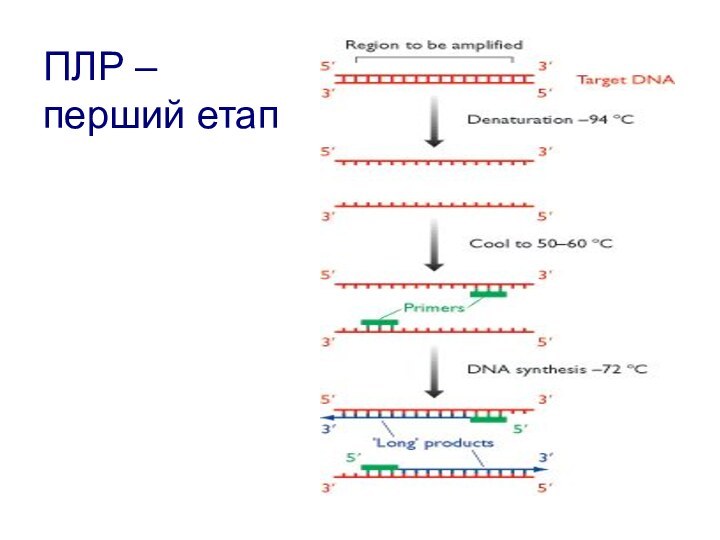
- 116. ПЛР – перший етап
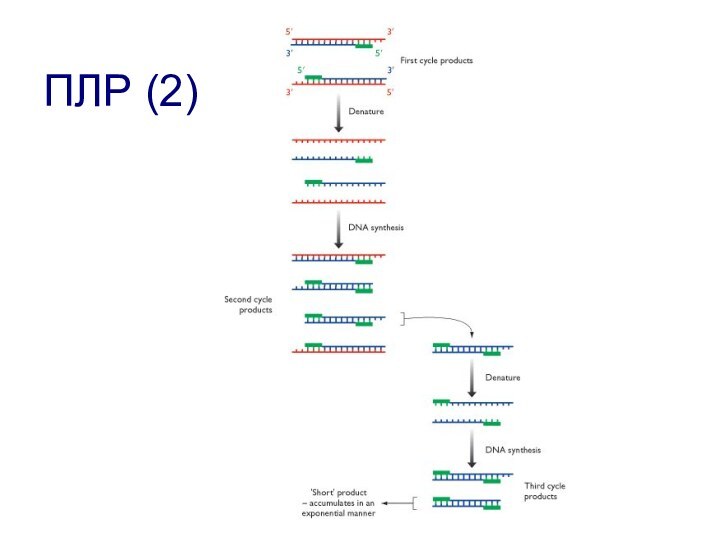
- 117. ПЛР (2)
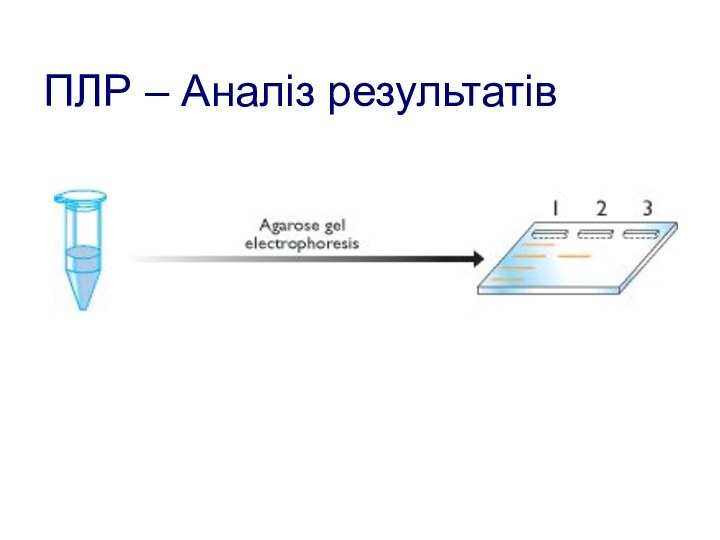
- 118. ПЛР – Аналіз результатів
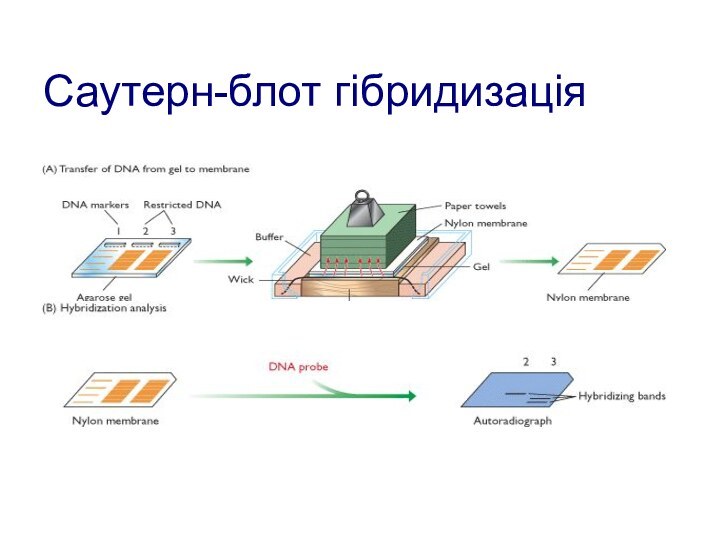
- 119. Саутерн-блот гібридизація
- 120. ДНК-чипиМікрочипи – скляні пластинки із ячейками, заповненими
- 121. Лікування спадкових захворювань
- 122. Лікування спадкових захворюваньДо нещодавна такі хвороби вважалися
- 123. Євфеніка і євгенікаУ 20-і роки ХХ сторіччя
- 124. НормокопіюванняНормокопіювання – це нормалізація фенотипу при патологічному
- 125. Корекція обміну може проводитисяНа рівні субстрата біохімічної
- 126. На рівні продукта гена шляхом заміщення або
- 127. Застосування комбінованих методів лікування при спадкових хворобах
- 128. Арсенал методів лікування спадковихзахворюваньЗаміснатерапіяЗагальнозміцнюючатерапіяОперативнелікуванняДієтотерапіяВведення в організмвідсутніх або
- 129. Лікування хромосомних синдромів і захворювань із спадковою
- 130. Генотерапія – сучасний метод лікування спадкових хворобГенетична
- 131. Перше застосування генотерапії1990 р. (США) для лікування
- 132. Способи введення генів до організмуEx vivo –
- 133. Вектори – способи доставки генів у організмВірусні
- 134. Лікувальні ефекти генотерапії досягаються:Корегуванням або заміною дефектного
- 135. Профілактика спадкових захворювань. Медико-генетичне консультування
- 136. До 1970-х років первинна профілактика спадкових захворювань полягала у відмові від народження дітей
- 137. Види профілактики спадкових захворюваньПервинна – виключення зачаття
- 138. Сучасні підходи до профілактики спадкових захворювань1. Охорона
- 139. 4. Доклінічна діагностика спадкових хвороб із наступними
- 140. Медико-генетичне консультування (МГК)Це постійний елемент у профілактиці
- 141. Основні задачі МГК (1)Установлення точного діагнозу спадкової патологіїПренатальна діагностика уроджених і спадкових захворюваньВизначення типу успадкування захворювання
- 142. Оцінка величини ризику народження хворої дитини і
- 143. Медико-генетичну допомогу в Україні надають:Міські медико-генетичні кабінетиМіжрайонні
- 144. Етапи медико-генетичної консультаціїДіагнозПрогнозВисновокПорадаМетоди Генетичні Клінічні Цитогенетичні Біохімічні
- 145. Скринінг (виявлення) захворювань новонародженихЗразки крові у кожної
- 146. « Нам знадобляться лікарі настільки обізнані
- 147. Скачать презентацию
- 148. Похожие презентации








































































































Слайд 2
Питання лекції:
Генні (молекулярні) хвороби
Діагностика, лікування і профілактика спадкових
захворювань
Слайд 4
Мутації – причини спадкових захворювань
Етіологічними факторами спадкових захворювань
є мутації:
геномні (зміна числа хромосом)
хромосомні (зміна структури
хромосом)генні (молекулярні)
Слайд 5
Генні мутації
Генні мутації пов’язані з:
випадінням (делеції)
додаванням
(інсерції)
перестановкою нуклеотидів у гені (інверсії або заміни)
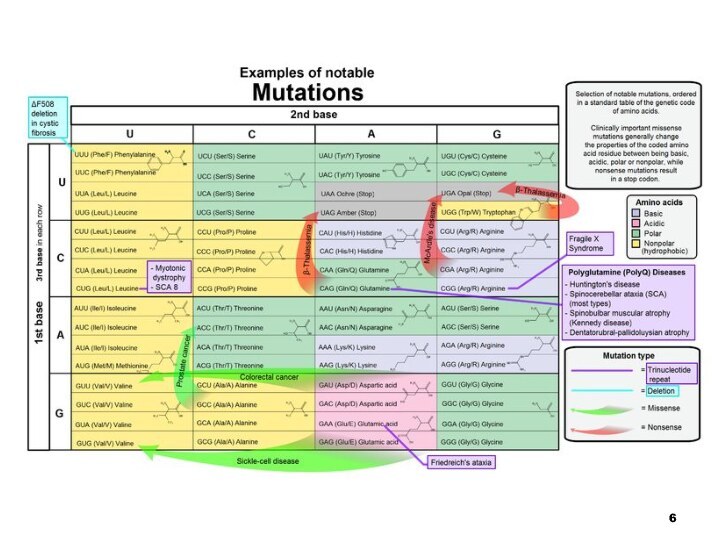
Слайд 7 Генні хвороби — різноманітні за клінічними проявами захворювання,
зумовлені генними мутаціями
Характерним є менделевське успадкування
Відхилення від менделевсько-морганівських
правил можуть бути пов’язаними із фенотиповими ефектами генів (летальність, стерильність)
Слайд 8
Загальна частота генних хвороб у популяції складає 1-2%
Умовно,
частоту генних захворювань вважають
високою, якщо вона зустрічається з
частотою
1 випадок на 10.000 новонародженихсередньою - 1 на 10.000 - 40.000 новонароджених
і далі - низькою
Слайд 9 Одна й та ж генна хвороба може зумовлюватися
різними мутаціями
Наприклад, у гені муковісцидозу описано біля 200 мутацій,
що викликають хворобу Понад 30 патологічних мутацій відомо для гена фенілкетонурії
Слайд 10
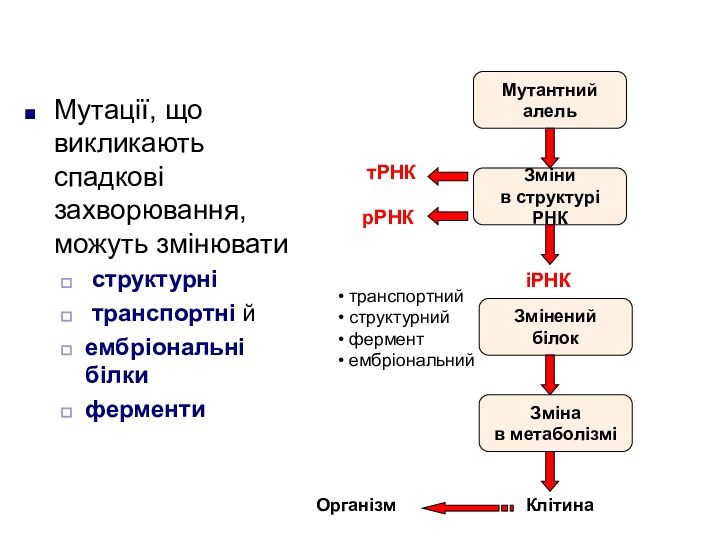
Мутації, що викликають спадкові захворювання, можуть змінювати
структурні
транспортні й
ембріональні білки
ферменти
Слайд 11
Первинні ефекти мутантних алелів
Первинні ефекти мутантних алелів можуть
проявлятися в 4 варіантах:
відсутність синтезу поліпептидного ланцюга (білка)
синтез аномального за первинною структурою поліпептидного ланцюга (білка)
кількісно недостатній синтез поліпептидного ланцюга (білка)
кількісно надлишковий синтез поліпептидного ланцюга (білка)
Слайд 12
Час прояву спадкового захворювання
Час прояву спадкового захворювання залежить
від ролі продуктів порушених генів:
хвороби, викликані порушеннями транскрипційних факторів,
проявляються внутрішньоутробнопри патології ферментів – на 1-ому році життя
при патології рецепторів – від 1 року до пубертантного періоду
при патології модуляторів білкових функцій – у ранньому дорослому періоді до 50 років
Слайд 13
Фенотипові ефекти патологічних мутацій
ВКЛЮЧАЮТЬ
летальність на ранніх стадіях
розвитку зародка, до імплантації. Це проявляється у вигляді зачаття,
що не відбулося (імплантації), у фертильних жінок при нормальному статевому життіСлайд 14 Якщо розвиток ембріона не зупинився на
ранніх стадіях, то фенотипові ефекти можуть формуватися у вигляді
3 варіантів:дизморфогенез (уроджені вади розвитку),
порушений обмін речовин,
змішані ефекти (дизморфогенез і аномальний обмін речовин)
Слайд 15
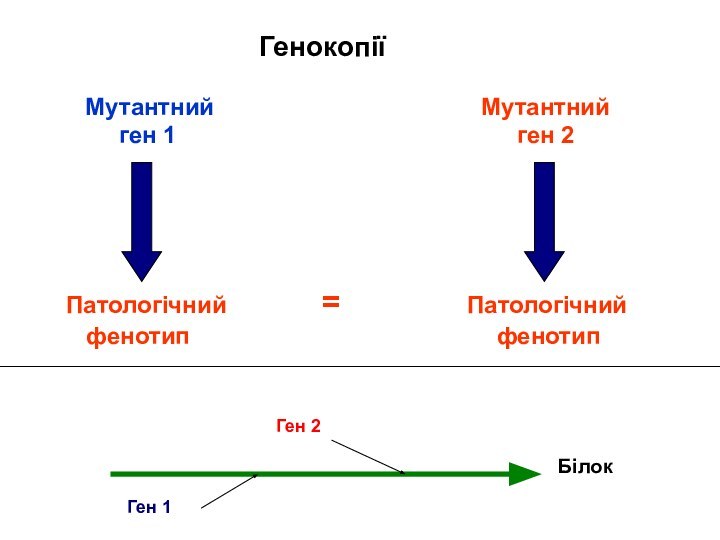
Генокопії
Мутації різних генів можуть призводити до подібних фенотипових
ефектів, подібної клінічної картини
Генокопія – це подібність фенотипових проявів
мутацій різних генів
Слайд 17
Класификація генних хвороб
Класифікація генних хвороб може бути генетичною,
клінічною, патогенетичною
У залежності від функції первинних продуктів відповідних
генів генні хвороби поділяються на спадкові порушення ферментних систем (ферментопатії або ензимопатії)
дефекти білків крові (гемоглобінопатії)
дефекти структурних білків (колагенові хвороби)
генні хвороби із нез’ясованим первинним біохімічним дефектом
Слайд 18 У відповідності до генетичного принципу класифікації генні хвороби
можна поділити на групи згідно із типами успадкування:
аутосомно-домінантні
аутосомно-рецесивні
Х-зчеплені
домінантніХ-зчеплені рецесивні
Y-зчеплені (голандричні)
мітохондріальні.
Така класифікація допомагає визначити вид медико-генетичної допомоги
Слайд 19 Клінічний принцип класифікації визначається залученістю до патологічного процесу
різних систем і органів:
Розрізняють спадкові хвороби
нервові
нервово-м’язові
шкірні
очні
опорно-рухового апарату
ендокринні
крові
серцево-судинної системи
психічні
сечостатевої системи
та ін.Слайд 20 Патогенетична класифікація поділяє спадкові хвороби на 3 групи
в залежності від основного патогенетичного ланцюга:
спадкові хвороби обміну
речовинуроджені вади розвитку (моногенної природи)
комбіновані стани
Слайд 21
спадкові хвороби обміну речовин поділяють за типами обміну:
порушення
вуглеводного
амінокислотного обміну
обміну вітамінів, ліпідів, металів та ін.
До спадкових захворювань
обміну речовин належать ферментопатії (ензимопатії)
В основі ферментопатій полягають:
зміни активності фермента
зниження інтенсивності його синтезу (у гетерозигот 50% активність фермента порівняно з нормальним станом)
Слайд 22
Гемоглобінопатії
Група захворювань, що викликаються первинним дефектом пептидних ланцюгів
гемоглобіну і пов’язаними з цим порушенням його властивостей і
функцій (метгемоглобінопатії, еритроцитози, серпоподібно-клітинна анемія, таласемія та ін.)
Слайд 23
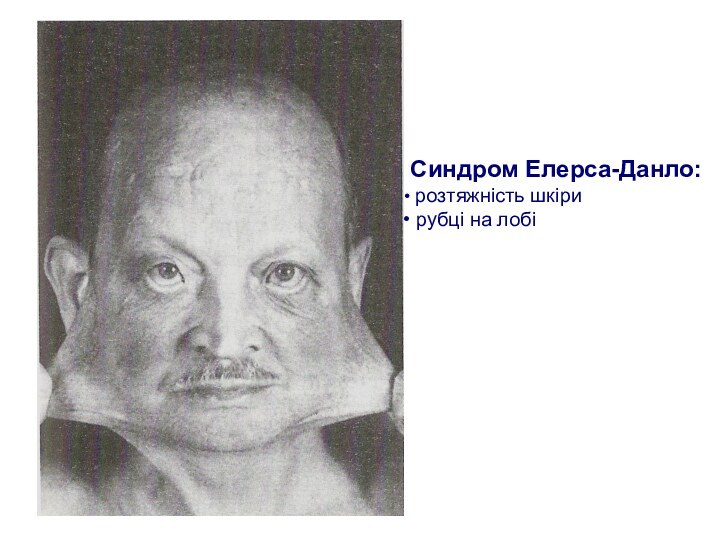
Колагенові хвороби
Хвороби порушення обміну сполучної тканини
В основі -
генетичні дефекти біосинтезу й руйнації колагену – компонента сполучної
тканини (хвороба Елерса-Данло, хвороба Марфана)
Слайд 27
Спадкові хвороби обміну амінокислот
Найчисленніша група спадкових захворювань обміну
речовин
Майже всі успадковуються за аутосомно-рецесивним типом
Причина захворювань — недостатність
фермента, відповідального за синтез амінокислотХвороби супроводжуються блювотою і зневодненням організму, летаргічним станом або збудженням і судомами
У дорослішому віці проявляється пригнічення розумового і фізичного розвитку
Слайд 28
Фенілкетонурія (ФКУ)
Уперше описана О. Фелінгом у 1934 р.
У хворих порушено перетворення амінокислоти фенілаланіну в тирозин через
різке зниження активності фермента фенілаланінгідроксилазиВнаслідок вміст фенілаланіну в крові і сечі хворих значно зростає
Далі фенілаланін перетворюється в феніл-ПВК, яка є нейротропною отрутою і порушує формування мієлінової оболонки навколо аксонів центральної нервової системи
Слайд 30 ФКУ зустрічається у світі з частотою 1 на
1000 новонароджених. Однак за цим показником є значні відміни
між популяціями:1:2600 у Турції
1:4500 в Ірландії
1: 30000 у Швеції
1:119000 в Японії
Частота гетерозиготного носійства у більшості європейських популяцій становить 1:100
Локус (фенілгідроксилази) розташований у довгому плечі 12-ї хромосоми. Можливою є молекулярно-генетична діагностика і виявлення гетерозиготного носійства.
Хвороба успадковується за аутосомно-рецесивним типом
Слайд 31
Відомо декілька форм фенілкетонурії (різняються за тяжкістю)
Це пов’язано
з наявністю 4-х алелів гена і їхніми комбінаціями
Дитина з
фенілкетонурією народжується здоровою, але в перші ж тижні у зв’язку із надходженням фенілаланіну до організму із молоком матері розвивається підвищена збудливість і судомний синдром, схильність до дерматитів, сеча і пот хворих мають характерний «мишачий» запах, але головними симптомами ФКУ є судомні напади й олігофренія Слайд 32 Більшість хворих — блондини із світлою шкірою і
блакитними очима (недостатній синтез меланіну)
Діагностика ФКУ: клінічні дані, біохімічний
аналіз сечі (на феніл-ПВК), крові (на фенілаланін)Для цього декілька крапель крові на фільтровальному папері піддають хроматографії і визначають вміст фенілаланіну
Іноді застосовують пробу Фелінга — до 2,5 мл свіжої сечі дитини додають 10 крапель 5% розчину трьоххлористого заліза та оцтової кислоти. Поява синьо-зеленого забарвлення вказує на наявність захворювання
Лікування ФКУ добре розроблено і полягає у призначенні хворому дієти (овочі, фрукти, варення, мед) і спеціально оброблених гідролізатів білків із низьким вмістом фенілаланіну (лофелак, кетоніл, мінафен та ін.). Маркировка продукції
Слайд 34
На даний час розроблено методи допологової діагностики
Рання діагностика
і профілактичне лікування запобігає розвитку хвороби
Слайд 35
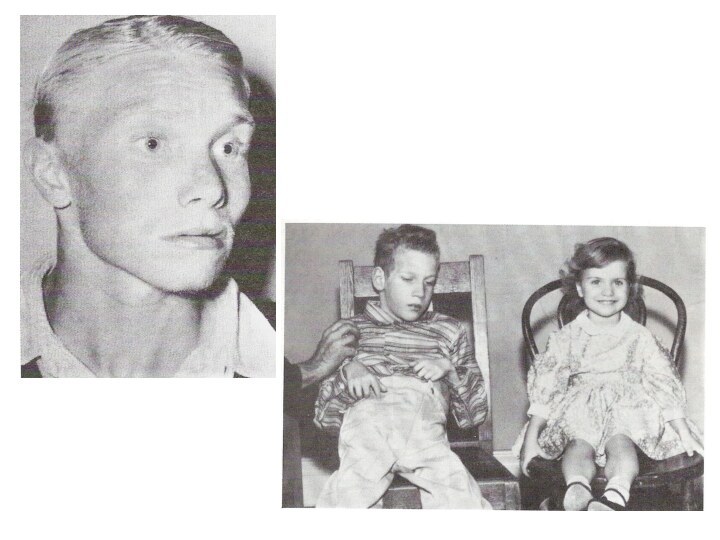
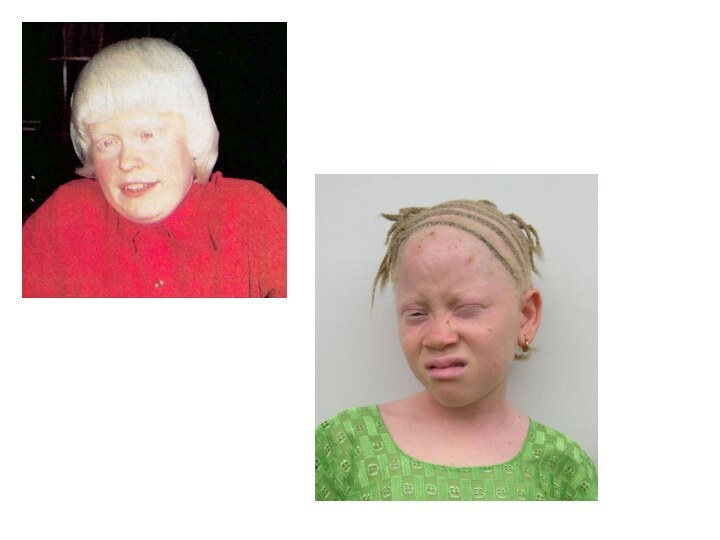
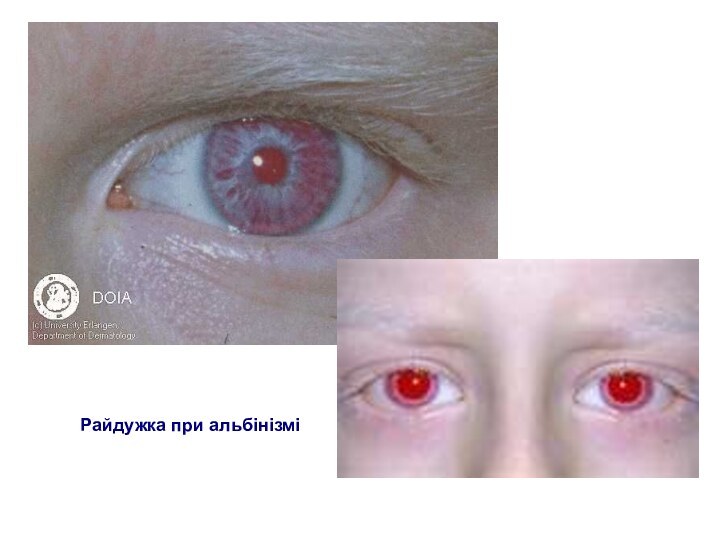
Альбінізм (очно-шкірний)
Захворювання описано у 1959 р., зумовлено відсутністю
синтеза фермента тирозинази
У хворих
знебарвлення шкіри, волосся, очей, незалежно
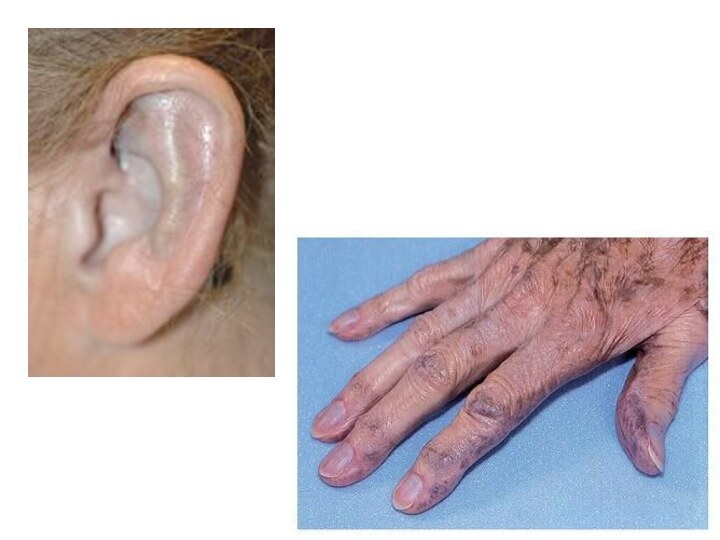
від раси і вікушкіра хворих рожево-червона, абсолютно не піддається засмазі. Має схильність до злоякісних новоутворень
волосся біле або жовтувате
райдужка сіро-блакитного кольору, але може бути й рожеватою через віддзеркалення світла від очного дна
сильний острах світла, зір знижений і не покращується із віком.
Альбінізм зустрічається з частотою 1 на 39.000, успадковується за аутосомно-рецесивним типом
Ген локалізований на довгому плечі 11-ї хромосоми
Слайд 36
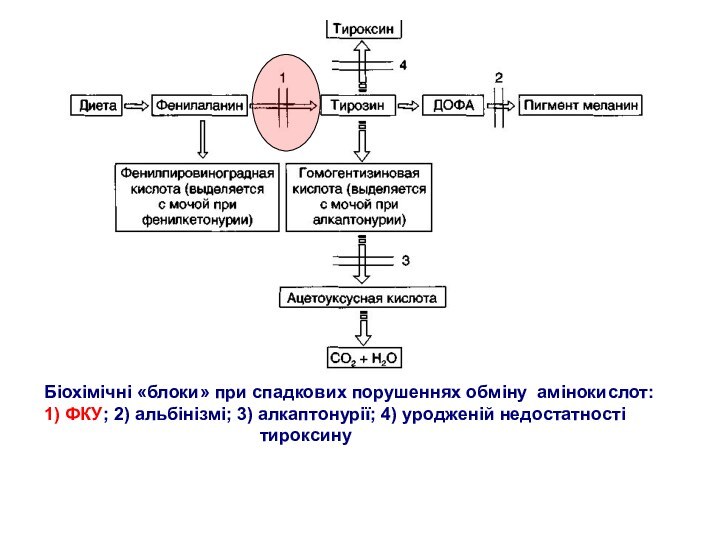
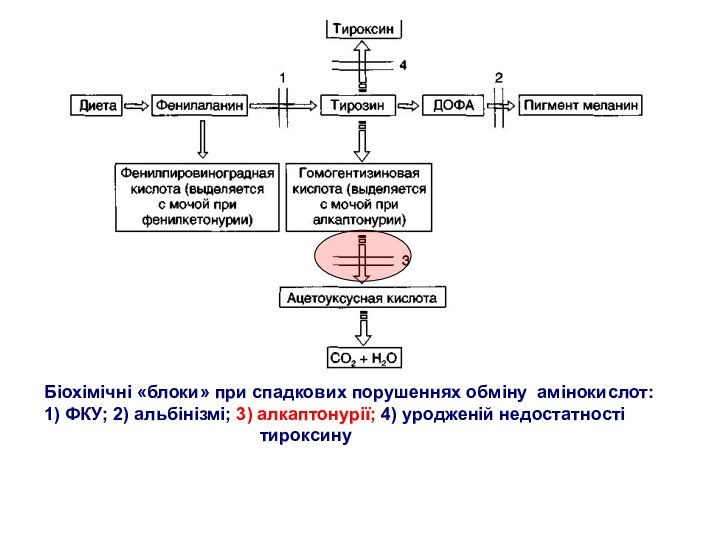
Біохімічні «блоки» при спадкових порушеннях обміну амінокислот:
1) ФКУ;
2) альбінізмі; 3) алкаптонурії; 4) уродженій недостатності
тироксину
Слайд 40
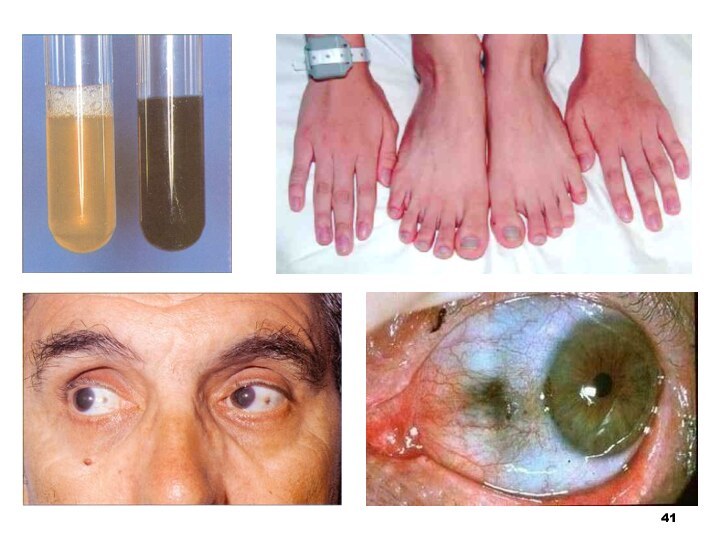
Алкаптонурія
Перше описане генне захворювання (1909 р., А. Гаррод)
Уроджене
порушення обміну фенілаланіну і тирозину (недостатність гомогентизат-1,2-діоксигенази), що характеризується
екскрецією гомогентизинової кислоти із сечеюКлінічно зазвичай проявляється остеоартритами
При зберіганні сечі або додаванні луги сеча темніє (наслідок утворення продуктів полімеризації гомогентизинової кислоти)
Охроноз (наприклад, блакитне забарвлення вух) і артрити
Лікування симптоматичне
Слайд 43
Біохімічні «блоки» при спадкових порушеннях обміну амінокислот:
1) ФКУ;
2) альбінізмі; 3) алкаптонурії; 4) уродженій недостатності
тироксину
Слайд 44
Аміноацидурії
Аміноацидурії - виведення підвищеної кількості амінокислот із сечею
або наявність у сечі продуктів їхнього обміну, які в
нормі не містяться в ній (наприклад, кетонові тіла)Розвивається переважно внаслідок спадкових порушень транспорту амінокислот через епітелій ниркових канальців
Сумарна частота різних урій (включаючи ФКУ) сягає (за деякими, скоріше заниженими, оцінками) 1:200 новонароджених
Слайд 45
Симптомами захворювань є:
діарея
затримка розумового розвитку
епілепсія
атаксія
ураження печінки
блювота
задишка
Слайд 46
Лікування проводять індивідуально (залежно від конкретного дефекта)
дієта
із зниженим вмістом білка
прийом великої кількості води
підлужування
сечі для запобігання утворенню каменів
Слайд 47
спадкові захворювання, пов’язані з порушенням обміну вуглеводів
Вуглеводи
входять до складу низки біологічно-активних речовин — гормонів, ферментів,
мукополісахаридів, що виконують енергетичну і структурну функціїВнаслідок порушення вуглеводного обміну розвивається глікогенова хвороба (глікогенози – 7 типів), галактоземія та ін.
Слайд 48
Глікогенова хвороба (глікогенози)
Пов’язана із порушенням синтезу й розпаду
глікогену — тваринного крохмалю
Глікоген – депо глюкози в організмі
При
порушенні процесів синтезу й утилізації глікогену у людини розвиваються різні типи глікогенозівДо них належать хвороба Гірке, хвороба Помпе та ін.
Слайд 49
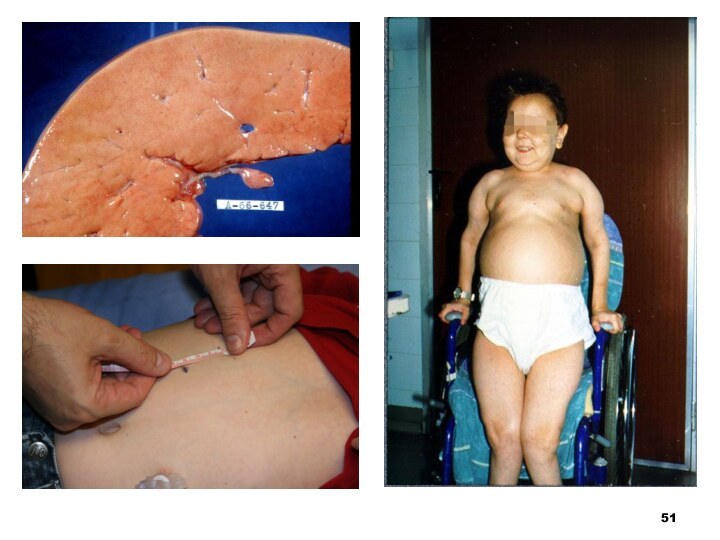
Глікогеноз (I тип — хвороба Гірке)
Перетворення глікогену в
глюкозу не відбувається, позаяк відсутній фермент глюко-6-фосфатаза, який регулює
рівень глюкози в кровіВнаслідок у хворого розвивається гіпоглікемія
У печінці, нирках і слизовій кишечника накопичується глікоген
Хвороба успадковується за аутосомно-рецесивним типом
Відразу ж після народження головними симптомами хвороби є гіпоглікемічні судоми і гепатомегалія (збільшення печінки)
З 1-го року життя відзначається затримка росту
Характерним є вигляд хворого: велика голова, «лялькове обличчя", коротка шія, живіт, що випинає. Крім того, відзначаються носові кровотечі, затримка фізичного і статевого розвитку, м’язова гіпотонія. Інтелект при цьому нормальний. У крові підвищується рівень сечової кислоти, тому з віком може розвинутися подагра
Як лікування застосовується дієтотерапія: частий прийом їжі, підвищений вміст вуглеводів і обмеження жирів у дієті
Слайд 52
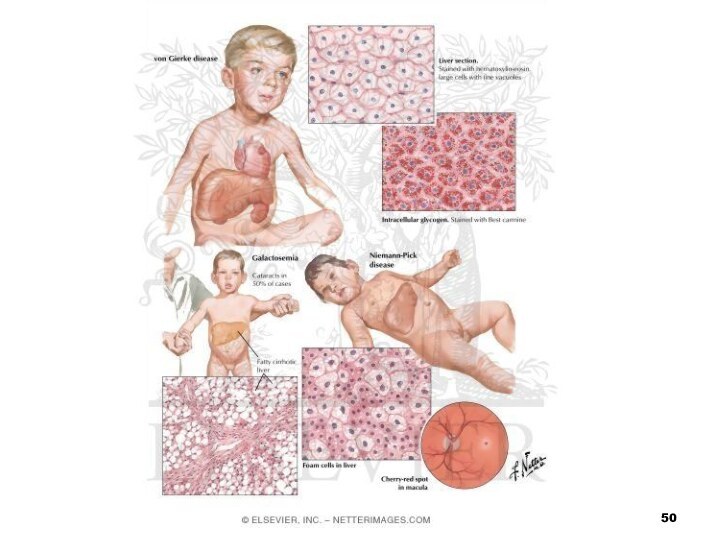
Галактоземія
Відбувається накопичення у крові хворого галактози, що призводить
до ураження багатьох органів: печінки, нервової системи, очей та
ін.Симптоми хвороби з’являються у новонароджених після прийому молока, оскільки галактоза — складова частина молочного цукру лактози
При гідролізі лактози утворюються глюкоза і галактоза
Остання необхідна для мієлінізації нервових волокон
При надлишку галактози в організмі вона в нормі перетворюється на глюкозу за допомогою фермента галактозо-1-фосфат-уридил-трансферази
При зниженні активності цього фермента відбувається накопичення галактозо-1-фосфату, токсичного для печінки, мозку, кришталика ока
Слайд 53 Хвороба проявляється з перших днів життя розладами травлення,
інтоксикацією (проносом, блювотою, зневодненням)
У хворих збільшується печінка, розвивається печінкова
недостатність і жовтяницяВиявляється катаракта (помутніння кришталика ока), розумова відсталість
У дітей, що померли на першому році життя, при розтині виявляють цироз печінки
Найточнішими методами діагностики галактоземії є визначення активності фермента галактозо-1-фосфат-уридилтрансферази в еритроцитах, а також галактози в крові і сечі, де рівні її збільшено
При виключенні з їжі молока (джерела галактози) і ранньому призначенні дієти хворі діти можуть нормально розвиватися
Тип успадкування галактоземії — аутосомно-рецесивний. Ген локалізований на короткому плечі 9-ї хромосоми. Хвороба зустрічається з частотою 1 на 16.000 новонароджених
Слайд 55
спадкові захворювання, пов’язані з порушенням ліпідного обміну
спадкові
хвороби обміну ліпідів (ліпідози) поділяються на два основних типи:
внутрішньоклітинні, за яких відбувається накопичення ліпідів у клітинах різних тканин
хвороби з порушенням метаболізму ліпопротеїнів, що містяться в крові
Слайд 56 До числа ретельно вивчених спадкових захворювань ліпідного обміна
першого типу належать:
хвороба Гоше
хвороба Німана-Піка
амавротична
ідіотія (хвороба Тея-Сакса) Слайд 57 Хвороба Гоше характеризується накопиченням цереброзидів у клітинах нервової
і РЕС, зумовленим дефіцитом фермента глюкоцереброзидази
Це призводить до накопичення
у клітинах РЕС глюкоцереброзидуУ клітинах мозку, печінки, лімфатичних вузлах виявляються великі клітини Гоше
Накопичення цереброзиду у клітинах нервової системи призводить до їхньої руйнації
Розрізняють дитячу і ювенільну форми хвороби
Дитяча проявляється у перші місяці життя затримкою розумового і фізичного розвитку, збільшенням живота, печінки і селезінки, затрудненням ковтання, спазмом гортані. Можлива дихальна недостатність, інфільтрація (ущільнення легень клітинами Гоше) і судоми. Смерть настає на першому році життя
Найчастіше зустрічається ювенільна форма хвороби Гоше. Уражає дітей різного віку, має хронічний характер.Проявляється, як правило, на першому році життя. Виникає пігментація шкіри (коричневі плями), остеопороз (зниження щільності кісток), переломи, деформація кісток. У тканинах мозку, печінки, селезінки, кісткового мозку міститься велика кількість глюкоцереброзидів. У лейкоцитах, клітинах печінки і селезінки знижена активність глюкозидази. Тип успадкування аутосомно-рецесивний. Ген локалізований на довгому плечі 1-ї хромосоми.
Слайд 58
Хвороба Німана-Піка зумовлена зниженням активності фермента сфінгомієлінази
Відбувається накопичення
сфінгомієліну в клітинах печінки, селезінки, мозку, ретикуло-ендотеліальної системи
Внаслідок дегенерації
нервових клітин порушується діяльність нервової системиВиділяють декілька форм захворювання, що розрізняються клінічно (час початку, перебіг і тяжкість неврологічних проявів). Однак є й спільні для усіх форм симптоми
Хвороба частіше проявляється у ранньому віці
У дитини збільшуються лімфатичні вузли, розміри живота, печінки і селезінки; відзначаються блювота, відмова від їжі, м’язова слабкість, зниження слуху й зору. У 20-30% дітей на сітківці ока виявляється пляма вишньового кольору (симптом "вишневої кісточки"). Ураження нервової системи призводить до відставання нервово-психічного розвитку, глухоті, сліпоті. Різко знижується сталість до інфекційних захворювань. Діти гинуть у ранньому віці
Успадкування хвороби — аутосомно-рецесивне. Ген сфінгомієлінази картований на хромосомі 11
Діагностика хвороби Німана-Піка основана на виявленні у плазмі крові і спинномозковій рідині підвищеного вмісту сфінгомієліну. У периферичній крові виявляються великі зернисті пінисті клітини Піка. Лікування симптоматичне
Слайд 60 Амавротична ідіотія (хвороба Тея-Сакса) також належить до захворювань,
пов’язаних із порушенням ліпідного обміну
Для неї характерно відкладення у
клітинах мозку, печінки, селезінки та інших органах ліпіда гангліозидуПричина - зниження активності фермента гексозамінідази А в організмі. Відбувається руйнування аксонів нервових клітин
Хвороба проявляється у перші місяці життя. Дитина стає млявою, малорухомою, байдужою до оточуючих. Затримка психічного розвитку призводить до зниження інтелекту до ступеня ідіотії. Відзначається м’язова гіпотонія, судоми, характерний симптом «вишневої кісточки» на сітківці ока
До кінця першого року життя настає сліпота — атрофія зорових нервів. Пізніше розвивається повна нерухомість. Смерть настає у 3-4 роки
Тип успадкування хвороби — аутосомно-рецесивний. Ген локалізований на довгому плечі 15-ї хромосоми
Слайд 62
Діагностика спадкових захворювань у різний час ґрунтувалася на:
Клінічному
аналізі
Параклінічних лабораторних і інструментальних методах
Специфічних методах лабораторної генетичної діагностики
Слайд 64
Класифікація методів діагностики (1)
За часом проведення
Пренатальна (дородова), у
тому числі преімплантаційна
Постнатальна (післяродова)
Слайд 65
Класифікація методів діагностики (2)
За методами
Цитогенетичні (мікроскопічне дослідження хромосом)
Молекулярно-генетичні
(вивчення послідовності нуклеотидів у ДНК)
Біохімічні (визначення біохімічних порушень)
Клінічні (визначення
специфічних зовнішніх проявів захворювань)
Слайд 66
Переваги сучасних методів діагностики
Своєчасність і точність (доклінічна, пренатальна,
преімплантаційна діагностика)
Мала кількість матеріалу для аналізу
Можливість пересилання зразків до
спеціалізованих установ
Слайд 67
Пренатальна (дородова) діагностика
Це комплексна галузь медицини,
яка використовує
ультразвукові дослідження (УЗД)
оперативну техніку
лабораторні методи досліджень
у
дородовій діагностиці патологічних станів (у тому числі спадкових)
Слайд 68
Показання до проведення пренатальної діагностики (1)
Наявність у родині
точно встановленого спадкового захворювання
Вік майбутньої матері від 35 років,
батька – від 40 років
Слайд 69
Показання до проведення пренатальної діагностики (2)
Гетерозиготність обох батьків
за аутосомно-рецесивним захворюванням
Наявність хромосомних перебудов (особливо транслокацій) у одного
з батьківРобота на шкідливих виробництвах, проживання у місцевостях із підвищеним радіаційним фоном в анамнезі вагітної
Слайд 70
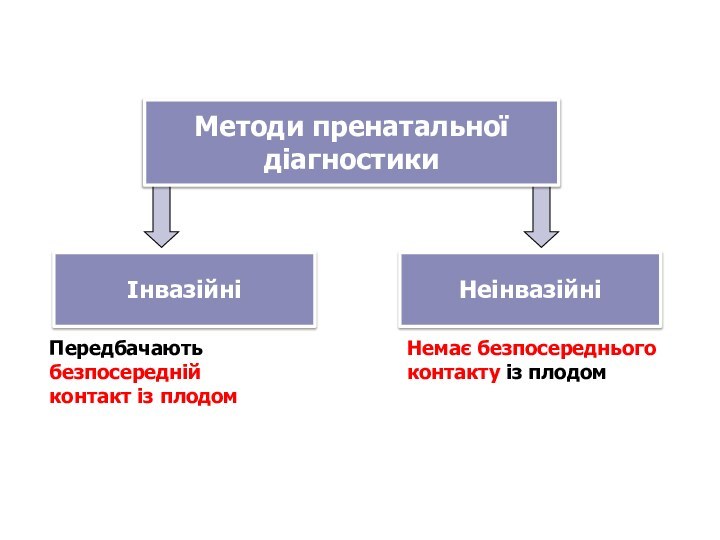
Методи пренатальної
діагностики
Інвазійні
Неінвазійні
Передбачають безпосередній
контакт із плодом
Немає безпосереднього
контакту із
плодом
Слайд 71
Інвазійні методи пренатальної діагностики
Застосовуються з 8-го по 22-й
тиждень вагітності
ґрунтуються на отриманні клітин і тканин плода
Аналіз клітин
плода дозволяє діагностувати усі хромосомні хвороби і не менше 300 генних хвороб
Дозволяють запобігти 4/5 випадків народження дітей із спадковими хворобами і уродженими вадами розвитку
Слайд 72
Інвазійні методи діагностики
Амніоцентез (прокол плідного міхура для отримання
навколоплідної рідини)
Біопсія хоріона і плаценти
Кордоцентез (взяття крові з пуповини)
Фетоскопія
(введення зонду й огляд плода)Біопсія шкіри або печінки плода
Слайд 73
Неінвазійні методи діагностики
Ультразвукове дослідження
Радіографія
Визначення альфа-фетопротеїну
Слайд 74
Визначення альфа-фетопротеїну (АФП)
АФП – білок, що виробляється клітинами
печінки плода
Визначення проводиться на 15-16-му тижні вагітності у сироватці
крові вагітноїКонцентрація АФП суттєво підвищується при спинномозковій килі, уродженому нефрозі, дефектах нервової трубки і черевної стінки; знижується у жінок, які виношують плід із хромосомними аномаліями (синдром Дауна, Едвардса та ін.)
Слайд 75
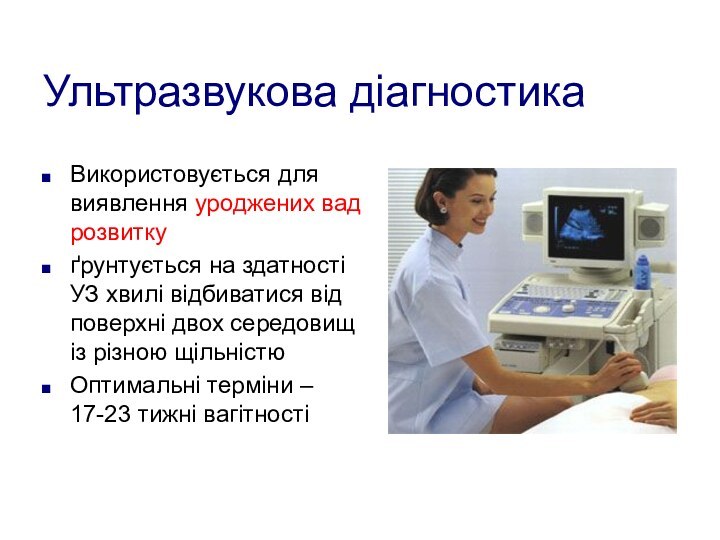
Ультразвукова діагностика
Використовується для виявлення уроджених вад розвитку
ґрунтується на
здатності УЗ хвилі відбиватися від поверхні двох середовищ із
різною щільністюОптимальні терміни – 17-23 тижні вагітності
Слайд 76
Ультразвукова діагностика
На поверхню живота вагітної жінки встановлюється
спеціальний датчик (трансдюсер), що випускає звукові хвилі високої частоти.
При досягненні тканин плода ці хвилі відбиваються і уловлюються датчиком знову.
Комп’ютерна обробка цих хвиль формує зображення на моніторі. Зображення називається сонограмою. Іноді використовують датчик, який вводиться у піхву жінці (частіше - на ранніх термінах вагітності).
Слайд 79
Біопсія хоріона і плаценти
Більш ранні, ніж УЗД, терміни
проведення – 7-11 тижнів
Ворсинки хоріона беруть особливим шприцем за
допомогою гнучкого катетера через шійку матки
Ворсинки досліджують цитологічними, біохімічними, молекулярно-генетичними методами
Слайд 80
Біопсія хоріона і плаценти
Дозволяє діагностувати хромосомні і генні
хвороби
Результати протягом 3-4 днів після взяття матеріалу
Слайд 81
Біопсія хоріона і плаценти
Ускладнення
Відносно висока частота спонтанних
абортів (викиднів) – 2,5 – 3%
Можливі поперечні уроджені ампутації
кінцівок (рекомендовано проводити біопсію хоріона не раніше 8-го тижня, плацентобіопсії – не раніше 12-го тижня)
Слайд 82
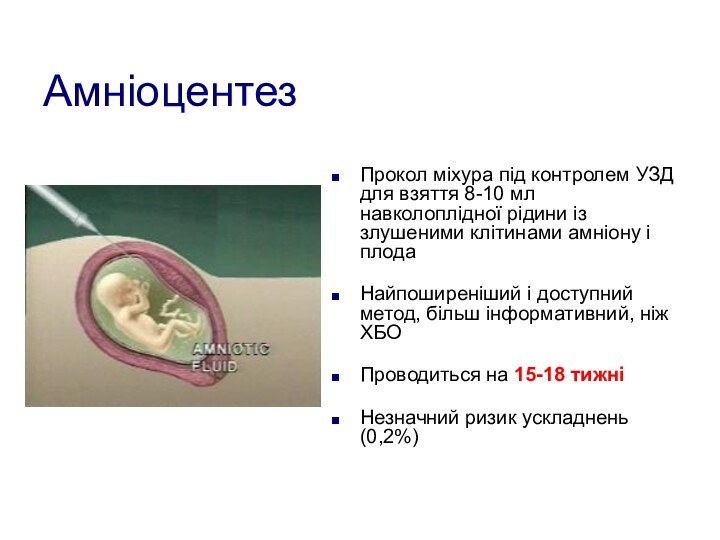
Амніоцентез
Прокол міхура під контролем УЗД для взяття 8-10
мл навколоплідної рідини із злушеними клітинами амніону і плода
Найпоширеніший
і доступний метод, більш інформативний, ніж ХБО
Проводиться на 15-18 тижні
Незначний ризик ускладнень (0,2%)
Слайд 83
Амніоцентез
Дозволяє діагностувати
багато хромосомних хвороб
хвороби, зчеплені зі статтю
хвороби
обміну речовин (хвороба Тея-Сакса, мукополісахаридози, глікогенози, ФКУ та ін.)
Слайд 85
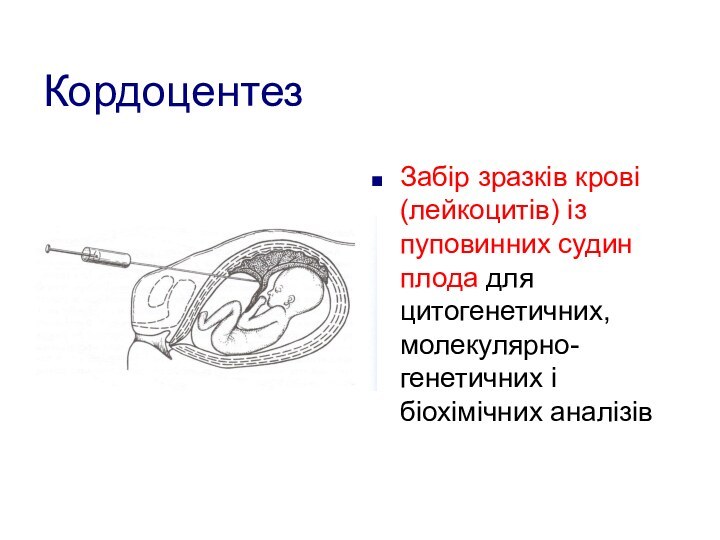
Кордоцентез
Забір зразків крові (лейкоцитів) із пуповинних судин плода
для цитогенетичних, молекулярно-генетичних і біохімічних аналізів
Слайд 86
Кордоцентез
Кров більше придатна для досліджень, ніж клітини амніотичної
рідини, позаяк лімфоцити швидше культивуються
Проводиться під контролем УЗД на
18-22 тижні вагітності
Дозволяє діагностувати хромосомні хвороби, ензимопатії та ін.
Слайд 87
Фетоскопія
Пряме розглядання плода через фетоскоп – тонкий еластичний
волоконно-оптичний зонд під контролем УЗД
Зонд вводиться у порожнину амніона
через черевну порожнину
Слайд 88
Фетоскопія
Проводиться на 18-23 тижні
Використовується рідко, лише при особливих
показаннях
Ускладнення – викидні в 7-8% випадків фетоскопії
Слайд 89 Преімплантаційна діагностика – діагностика на ранніх стадіях зародкового
пухирця
Виділення ембріону перед імплантацією лаважем матки або виділення яйцеклітин
із наступним екстракорпоральним заплідненням і розвитком зиготи до стадії бластоцисти
Визначення хромосомних і геномних мутацій у бластомерах або полярних (редукційних) тільцях яйцеклітини, що дозріває, після запліднення
Слайд 90
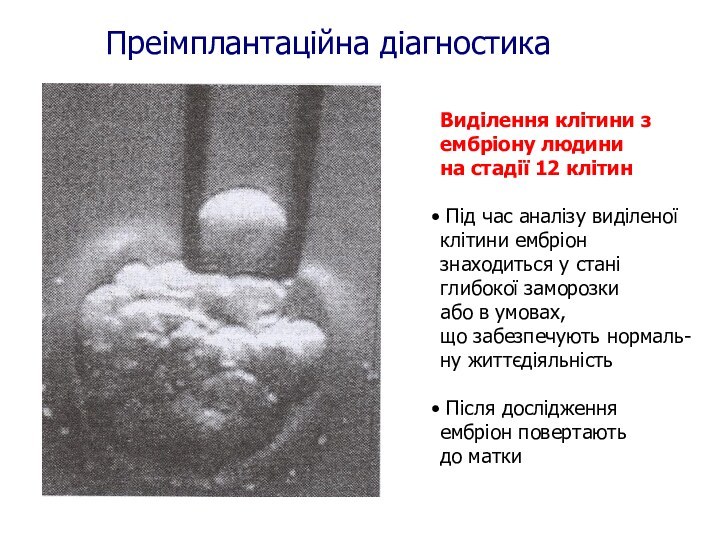
Виділення клітини з
ембріону людини
на стадії 12 клітин
Під
час аналізу виділеної
клітини ембріон
знаходиться у стані
глибокої заморозки
або
в умовах,
що забезпечують нормаль-
ну життєдіяльністьПісля дослідження ембріон повертають до матки
Преімплантаційна діагностика
Слайд 91
Неінвазійні методи діагностики, пов’язані з отриманням клітин плода
Імунофлюоресцентні
або магнітні методи для проточного сортування дозволяють отримати клітини
плода з крові матеріДля виділення еритроцитів застосовуються мічені моноклональні антитіла до білків їхніх мембран
Слайд 92
Молекулярно-генетичні
дослідження
Подальше дослідження клітинного матеріалу плода
Клітинний матеріал
Біохімічні
дослідження
Цитогенетичні
дослідження
Слайд 93 ЦИТОГЕНЕТИКА – це наука, що вивчає структуру і
функції хромосом
Термін введено в 1903
році Сеттоном
Слайд 94
Цитогенетичні дослідження
Застосування – дослідження каріотипу, діагностика геномних і
хромосомних мутацій при дослідженні ядер соматических, що діляться, статевих
або інтерфазних клітинСутність методу – мікроскопічний аналіз хромосом (найчастіше за усе світлова мікроскопія)
Слайд 96
Методи забарвлення
хромосом
Прості
Диференційні
Флюо-
ресцентні
за Гімзою – рівномірне
забарвлення по усій
овжині
визначення числових
аномалій каріотипу
структурних аномалій
Температурно-
сольові впливи
на фіксовані
хромосоми
G-забарвленняQ-забарвлення
Слайд 99
Цитогенетичні знахідки
Метафазна пластинка з
радіаційно індукованими
хромосомними абераціями
Метафазна пластинка з
хімічно
індукованими абераціями
Слайд 102
Цитогенетичні методи
G-смугова прометафазна
каріограма мітотичних
хромосом лімфоцита
нормальної жінки
Слайд 105
Цитогенетичні знахідки
А)
Б)
Хроматидні аберації (А) і сестринські хроматидні обміни
(Б) при
захворюваннях
із хромосомною нестабільністю
Слайд 106
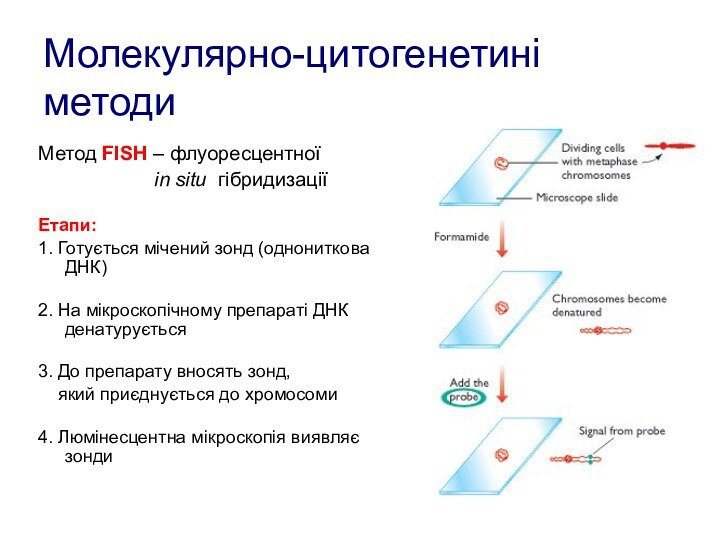
Молекулярно-цитогенетині методи
Метод FISH – флуоресцентної
in
situ гібридизаціїЕтапи:
1. Готується мічений зонд (однониткова ДНК)
2. На мікроскопічному препараті ДНК денатурується
3. До препарату вносять зонд,
який приєднується до хромосоми
4. Люмінесцентна мікроскопія виявляє зонди
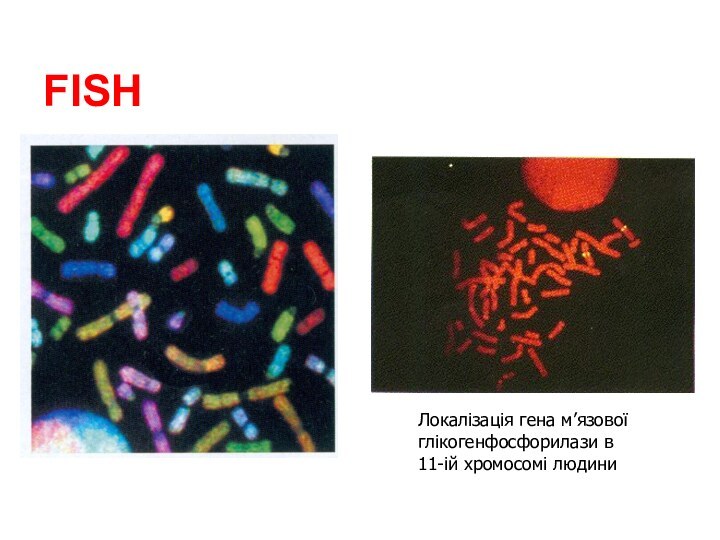
Слайд 109
Показання до цитогенетичних досліджень
Клінічна симптоматика хромосомної хвороби
Наявність у
дитини множинних уроджених вад розвитку
Багаторазові спонтанні аборти, мертвонародження або
уроджені вади розвитку у дітейПорушення репродуктивної функції нез’ясованого генеза у жінок і чоловіків
Затрика розумового розвитку дитини
Пренатальна діагностика
Лейкози
Слайд 110
Біохімічні дослідження
Застосовуються для:
- діагностики спадкових хвороб
- діагностики гетерозиготних
станів у дорослих (хвороба Коновалова-Вільсона, недостатність альфа1-антитрипсину, недостатність глюкозо-6–фосфатдегідрогенази)
Слайд 111
Показання до застосування біохімічних досліджень у новонароджених
Судоми
Блювота
Кома
Жовтяниця
Гіпотонія
м’язів
Специфічний запах сечі і пота
Ацидоз
Порушення кислотно-основного стану
Зупинка росту
Слайд 112
Молекулярно-генетичні дослідження
Основна мета – виявлення варіацій у структурі
досліджуваної ділянки ДНК (алеля, гена, регіону хромосоми) навіть до
розшифровки первинної послідовності ДНКВ основі методів – «маніпуляції» із ДНК і РНК
Слайд 113
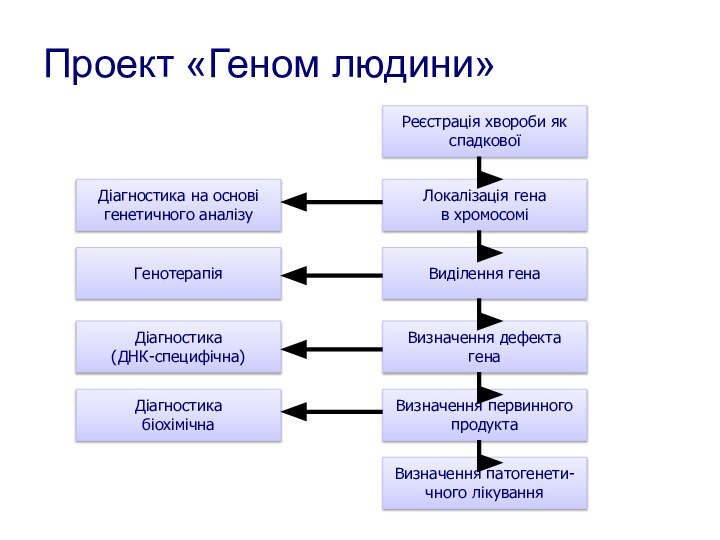
Проект «Геном людини»
Реєстрація хвороби як
спадкової
Локалізація гена
в хромосомі
Виділення
гена
Визначення дефекта
гена
Визначення первинного
продукта
Визначення патогенети-
чного лікування
Діагностика на основі
генетичного аналізу
Генотерапія
Діагностика
(ДНК-специфічна)
Діагностика
біохімічна
Слайд 114
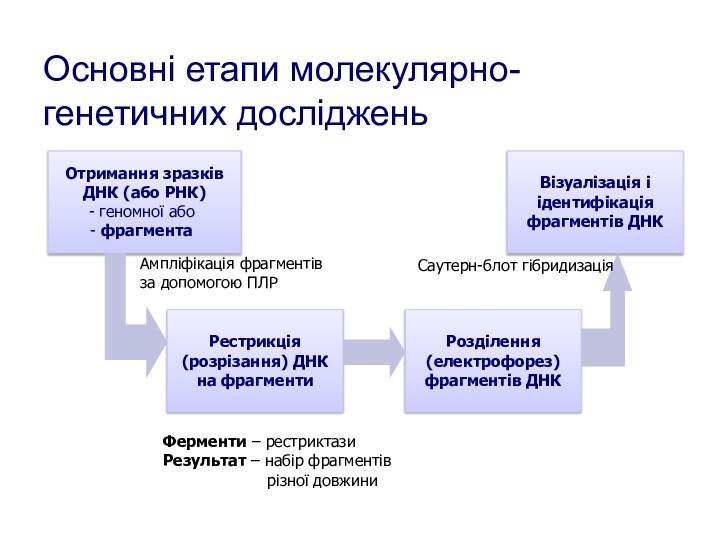
Основні етапи молекулярно-генетичних досліджень
Отримання зразків
ДНК (або РНК)
геномної
або
фрагмента
Рестрикція
(розрізання) ДНК
на фрагменти
Розділення
(електрофорез)
фрагментів ДНК
Візуалізація і
ідентифікація
фрагментів ДНК
Ампліфікація фрагментів
за
допомогою ПЛРФерменти – рестриктази
Результат – набір фрагментів
різної довжини
Саутерн-блот гібридизація
Слайд 120
ДНК-чипи
Мікрочипи – скляні пластинки із ячейками, заповненими поліакриламідним
гелем, у яких знаходяться відрізки ДНК
Мікрочип експонують із ДНК
людини, яка обстежується
Позитивна реакція у вигляді квадрата, що світиться
Процес може бути автоматизованим
Слайд 122
Лікування спадкових захворювань
До нещодавна такі хвороби вважалися невиліковними
Зараз
є ефективні методи лікування деяких хвороб
Неможливість виліковування пов’язана або
із неповними знаннями патогенезу, або із труднощами ранньої діагностики
Слайд 123
Євфеніка і євгеніка
У 20-і роки ХХ сторіччя М.
Кольцов запропонував концепцію євфеніки – виявлення позитивних властивостей людини
за рахунок впливу чинників оточуючого середовища (харчування, виховання, лікування)
Слайд 124
Нормокопіювання
Нормокопіювання – це нормалізація фенотипу при патологічному генотипі
Такий
підхід реалізується при лікування багатьох спадкових хвороб обміну речовин
Слайд 125
Корекція обміну може проводитися
На рівні субстрата біохімічної реакції
– компонента їжі, що піддається метаболізму за допомогою генетично
детермінованого фермента (дієтичне обмеження, дієтичне додавання, посилення виведення токсичних метаболітів і т.п.)Слайд 126 На рівні продукта гена шляхом заміщення або додавання
недостатньої біологічно активної речовини (гормони роста, інсулін, антигемофільний глобулін
і т.п.)На рівні фермента шляхом додавання кофактора, модифікації ферментативної активності, восповнення фермента.
Слайд 127
Застосування комбінованих методів лікування при спадкових хворобах дозволяє
Повністю
позбавитися клінічної картини у 12% випадків
Суттєво покращити стан у
57% випадків
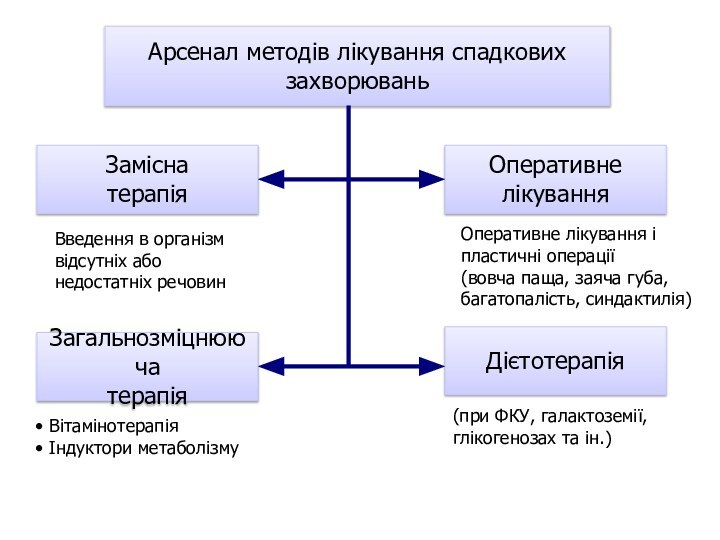
Слайд 128
Арсенал методів лікування спадкових
захворювань
Замісна
терапія
Загальнозміцнююча
терапія
Оперативне
лікування
Дієтотерапія
Введення в організм
відсутніх або
недостатніх
речовин
Вітамінотерапія
Індуктори метаболізму
Оперативне лікування і
пластичні операції
(вовча паща, заяча
губа,багатопалість, синдактилія)
(при ФКУ, галактоземії,
глікогенозах та ін.)
Слайд 129 Лікування хромосомних синдромів і захворювань із спадковою схильністю
- симптоматичне
Корекція розумової відсталості
Крекция уповільненого росту
Корекция недорозвитку гонад
Корекция специфічногно
зовнішнього виду
Слайд 130
Генотерапія – сучасний метод лікування спадкових хвороб
Генетична (генна)
терапія заснована на можливості використання функціональних генів у якості
лікарських речовинГенотерапія – це сукупність біомедичних технологій, заснованих на введенні хворому генетичних конструкцій («молекулярне протезування»)
Слайд 131
Перше застосування генотерапії
1990 р. (США) для лікування двох
дівчаток із тяжким імунодефіцитом, зумовленим дефіцитом аденозиндезамінази (АДА)
Ген АДА
за допомогою віруса ввели до Т-лімфоцитів пацієнтів
Слайд 132
Способи введення генів до організму
Ex vivo – ген
зазвичай вводиться до клітини крові пацієнта поза його організмом,
із наступним поверненням змінених клітин до організмуIn situ – локальна генотерапія, наприклад введення до трахеї і бронхів при муковісцидозі або в масу пухлини
In vivo – системне введення у кров (не реалізовано)
In utero – введення генів до ембріону або плода людини (не реалізовано)
Слайд 133
Вектори – способи доставки генів у організм
Вірусні вектори
(успішно перетинають захисні бар’єри організма від проникнення чужої ДНК)
Невірусні
(макромолекулярні) вектори
Слайд 134
Лікувальні ефекти генотерапії досягаються:
Корегуванням або заміною дефектного гена
Експресією
введеного терапевтичного гена
Пригніченням функції «хворого» або надактивного гена (антисенс-терапія)
введенням антисенсорної ДНК або РНКСлайд 136 До 1970-х років первинна профілактика спадкових
захворювань полягала у відмові від народження дітей
Слайд 137
Види профілактики спадкових захворювань
Первинна – виключення зачаття плодом
із спадковою патологією
Вторинна – елімінація (видалення) ембріонів і плодів
із патологією
Третинна – створення умов для розвитку і функціонування організма, які не дозволяють розвиватися патологічному фенотипу (нормокопіювання)
Слайд 138
Сучасні підходи до профілактики спадкових захворювань
1. Охорона оточуючого
середовища для запобігання новим мутаціям
2. Медико-генетичне консультування для визначення
тактики дітонародження і виношування вагітності3. Пренатальна та преімплантаційна діагностика спадкових захворювань
Слайд 139 4. Доклінічна діагностика спадкових хвороб із наступними заходами
із нормокопіювання
5. Організація і проведення санітарно-просвітницької роботи із пропаганди
медико-генетичних знань
Слайд 140
Медико-генетичне консультування (МГК)
Це постійний елемент у профілактиці спадкових
захворювань
Головна задача – визначення прогнозу народження хворих дітей у
родині і консультування з питань подальшого планування сім’їОсновная мета - попередження народження хворої дитини
Слайд 141
Основні задачі МГК (1)
Установлення точного діагнозу спадкової патології
Пренатальна
діагностика уроджених і спадкових захворювань
Визначення типу успадкування захворювання
Слайд 142 Оцінка величини ризику народження хворої дитини і надання
допомоги в прийнятті рішення
Пропаганда медико-генетичних знань серед лікарів і
населенняОсновні задачі МГК (2)
Слайд 143
Медико-генетичну допомогу в Україні надають:
Міські медико-генетичні кабінети
Міжрайонні медико-генетичні
кабінети
Обласні медико-генетичні центри
НДІ спадкової патології і медичної генетики
Центри охорони
материнства і дитинства
Слайд 144
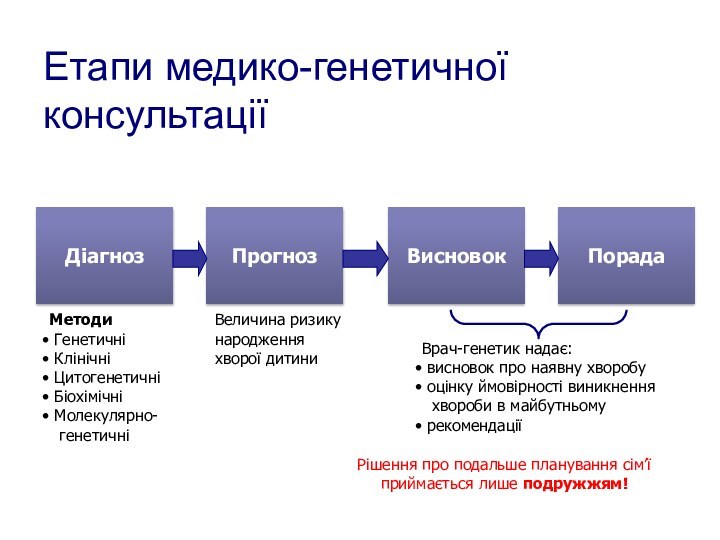
Етапи медико-генетичної консультації
Діагноз
Прогноз
Висновок
Порада
Методи
Генетичні
Клінічні
Цитогенетичні
Біохімічні
Молекулярно-
генетичні
Величина ризику
народження
хворої дитини
Врач-генетик надає:
висновок про наявну хворобу
оцінку
ймовірності виникнення
хвороби в майбутньомурекомендації
Рішення про подальше планування сім’ї
приймається лише подружжям!
Слайд 145
Скринінг (виявлення) захворювань новонароджених
Зразки крові у кожної дитини
відбираються в перші 7 днів життя
У багатьох країнах проводяться
скринінгові програми із виявлення гіпотиреоїдизму і фенілкетонурії
Слайд 146
« Нам знадобляться лікарі настільки
обізнані в
молекулярній анатомії і
фізіології хромосом і генів, наскільки
кардіохірург знає роботу серця іструктуру судинного дерева»
П. Берг (1981)
« Наші лікарі повинні як абетку знати закони
спадковості. Впровадження у життя
наукової істини про закони спадковсті
допоможе позбавити людство від багатьох
скорбот та горя»
І. П. Павлов (1935)





























