Слайд 2
ГИДРАТАЦИЯ
Это способность нативных белков сорбировать полярные молекулы воды
за счет свободных и связанных полярных групп белковых молекул.
Ионная
адсорбция
амино- и карбоксильные группы
Молекулярная адсорбция
пептидные, гидроксильные, сульфгидрильные группы
Осмотически и капиллярно-связанная вода
В рН изоэлектрической точки гидратация белка минимальная
Слайд 3
Практическое значение гидратации
Имеет большое значение при производстве студней
и различных полуфабрикатов, т.к. усиливается набухание, липкость пищевой массы,
сочность продуктов:
рубленые котлеты;
бифштексы;
фарши для пельменей;
тесто;
омлеты;
колбасы
Слайд 4
Денатурация
Это разрушение нативной структуры белка, сопровождающееся потерей биологической
активности
(верментативной, гормональной).
При денатурации белков происходят следующие основные изменения:
резко
снижается растворимость белков;
теряется биологическая активность, способность к гидратации и видовая специфичность;
улучшается атакуемость протеолитическими ферментами;
повышается реакционная способность белков;
происходит агрегирование белковых молекул;
заряд белковой молекулы равен нулю.
В результате потери белками видовой специфичности
пищевая ценность продукта не снижается.
Слайд 5
Каждый белок имеет определенную температуру денатурации
Для белков:
рыбы t
= 30 °С;
яичного белка t = 55...50 °С;
мяса t
= 55...60 °С и т.п.
Большая часть белков денатурируется при 60-80 °С, однако встречаются белки и термостабильные, например, α-лактоглобулин молока и α-амилазы некоторых бактерий.
Однако степень денатурирующего воздействия температуры на белки зависит и от их влажности, реакции и солевого состава среды и присутствия небелковых соединений.
подкисление мяса и рыбы при приготовлении;
в присутствии сахарозы и крахмала процесс замедляется;
повышение температуры усиливает набухание коллагена и повышает его перевариваемость.
Слайд 6
Во многих растительных продуктах содержатся ингибиторы протеаз, которые
подавляют активность этих пищеварительных ферментов (пепсин, трипсин, химотрипсин, α-амилаза).
Ингибиторы протеаз содержатся в семенах бобовых (соя, фасоль и др.) и злаковых (пшеница, ячмень и др.) культур, в картофеле, яичном белке и других продуктах растительного и животного происхождения.
При тепловой обработке все они почти полностью разрушаются, в результате усвояемость белков заметно повышается.
Слайд 7
МЕЛАНОИДИНООБРАЗОВАНИЕ
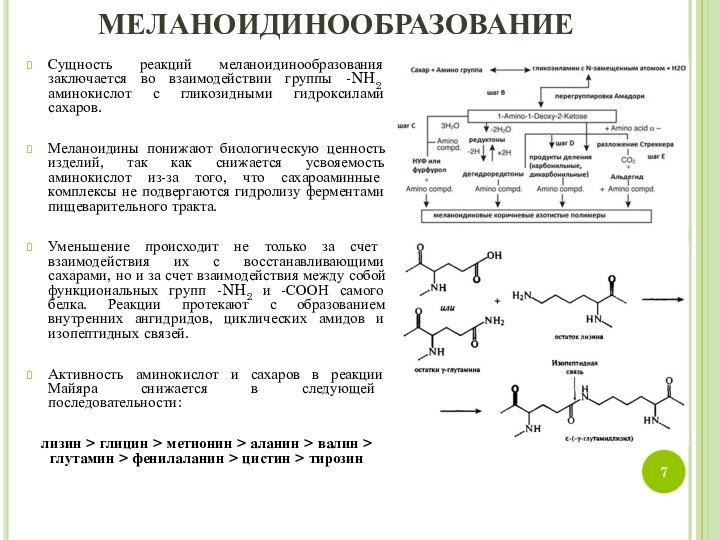
Сущность реакций меланоидинообразования заключается во взаимодействии группы -NH2
аминокислот с гликозидными гидроксилами сахаров.
Меланоидины понижают биологическую ценность изделий,
так как снижается усвояемость аминокислот из-за того, что сахароаминные комплексы не подвергаются гидролизу ферментами пищеварительного тракта.
Уменьшение происходит не только за счет взаимодействия их с восстанавливающими сахарами, но и за счет взаимодействия между собой функциональных групп -NH2 и -СООН самого белка. Реакции протекают с образованием внутренних ангидридов, циклических амидов и изопептидных связей.
Активность аминокислот и сахаров в реакции Майяра снижается в следующей последовательности:
лизин > глицин > метионин > аланин > валин > глутамин > фенилаланин > цистин > тирозин
Слайд 8
Эти реакции оказывают различное влияние на органолептические свойства
готовых изделий:
+
заметно улучшают внешний вид жареного или тушеного
мяса, котлет;
образование вкусной, хрустящей, золотистокоричневой корочки хлеба и др.
-
снижается пищевая ценность получаемых продуктов в результате связывания белков, витаминов, аминокислот в комплексные соединения.
Слайд 9
ДЕСТРУКЦИЯ
При нагревании пищевых продуктов до 100 °С происходит
разрушение макромолекул денатурированных белков.
При дальнейшем воздействии температуры происходит
деполимеризация белковой молекулы с образованием водорастворимых азотистых веществ.
Очень продолжительное нагревание при высоких температурах (180-300 °С) обусловливает деструкцию аминокислот и образование полиаминокислотных комплексов. При варке мяса глютамин превращается в глютаминовую кислоту, а инозиновая кислота распадается с образованием гипоксантина. Эти процессы играют решающую роль в формировании вкуса и аромата вареного мяса.
Слайд 10
Термически индуцированные мутагены образуются в белоксодержащей пище в
процессе ее обжаривания в масле, выпечки, копчения в дыму
и сушки. Мутагены вызывают наследственные изменения в ДНК, и их воздействие на здоровье человека может быть от незначительного до летального.
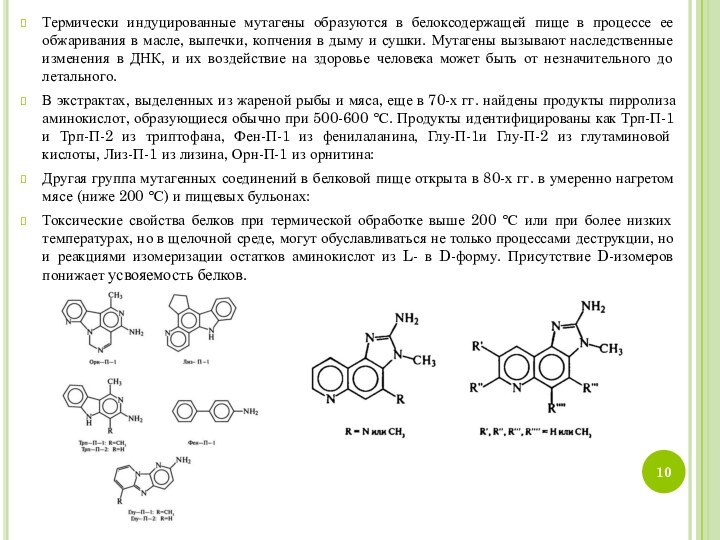
В экстрактах, выделенных из жареной рыбы и мяса, еще в 70-х гг. найдены продукты пирролиза аминокислот, образующиеся обычно при 500-600 °С. Продукты идентифицированы как Трп-П-1 и Трп-П-2 из триптофана, Фен-П-1 из фенилаланина, Глу-П-1и Глу-П-2 из глутаминовой кислоты, Лиз-П-1 из лизина, Орн-П-1 из орнитина:
Другая группа мутагенных соединений в белковой пище открыта в 80-х гг. в умеренно нагретом мясе (ниже 200 °С) и пищевых бульонах:
Токсические свойства белков при термической обработке выше 200 °С или при более низких температурах, но в щелочной среде, могут обуславливаться не только процессами деструкции, но и реакциями изомеризации остатков аминокислот из L- в D-форму. Присутствие D-изомеров понижает усвояемость белков.