- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Регистрационное удостоверение – это документ, подтверждающий допуск лекарственного средства к производству, импорту, продаже и применению на территории Российской Федерации.Срок действия – бессрочно- для впервые регистрируемых в РФ – 5 лет
Содержание
- 2. Регистрационное удостоверение – это документ, подтверждающий допуск
- 3. Нормативно-правовая базаФедеральный закон №61-ФЗ «Об обращении лекарственных
- 4. Уполномоченный орган по регистрации ЛСМинистерство здравоохранения и
- 5. Государственной регистрации подлежат:1) оригинальные лекарственные препараты;2) воспроизведенные
- 6. Не допускается гос.регистрация:Различных ЛП под одинаковым торговым
- 7. После клинического исследованияПеред клиническим исследованиемЭкспертиза ЛС1) экспертиза
- 8. Заявление о госрегистрацииНаименование и адрес заявителя и
- 9. Регистрационное досье ЛСПроекты макетов упаковкиПроект НД либо
- 10. Порядок гос.регистрации ЛСПодача заявления о государственной регистрации
- 11. Размеры госпошлины: 25.3 гл. НК РФ1. Экспертиза
- 12. Государственная регистрация ИМН и мед.техники
- 13. Уполномоченный орган – Федеральная служба по
- 14. Регистрации подлежат ИМН: /приборы, аппараты, инструменты, комплекты,
- 15. Классификация ИМН в зависимости от степени риска
- 16. Скачать презентацию
- 17. Похожие презентации
Регистрационное удостоверение – это документ, подтверждающий допуск лекарственного средства к производству, импорту, продаже и применению на территории Российской Федерации. Срок действия – бессрочно - для впервые регистрируемых в РФ – 5 лет














Слайд 3
Нормативно-правовая база
Федеральный закон №61-ФЗ «Об обращении лекарственных средств»
Приказ
МЗСР РФ от 26 августа 2010 г. №749н «Об
утверждении формы документа, содержащего результаты мониторинга безопасности лекарственного препарата для медицинского применения в целях подтверждения его гос.регистрации»Приказ МЗСР РФ от 26 августа 2010 г. №759н «Об утверждении порядка представления необходимых документов, из которых формируется регистрационное досье на ЛП для медицинского применения в целях его гос.регистрации»
Приказ от 26 августа 2010 г. №747н «Об утверждении порядка и сроков размещения на официальном сайте МЗСР РФ в сети "интернет" информации, связанной с осуществлением гос.регистрации ЛП для медицинского применения»
Приказ Росздравнадзора от 17.08.2007 №2314-пр/07 «О Комитете по этике"
Слайд 4
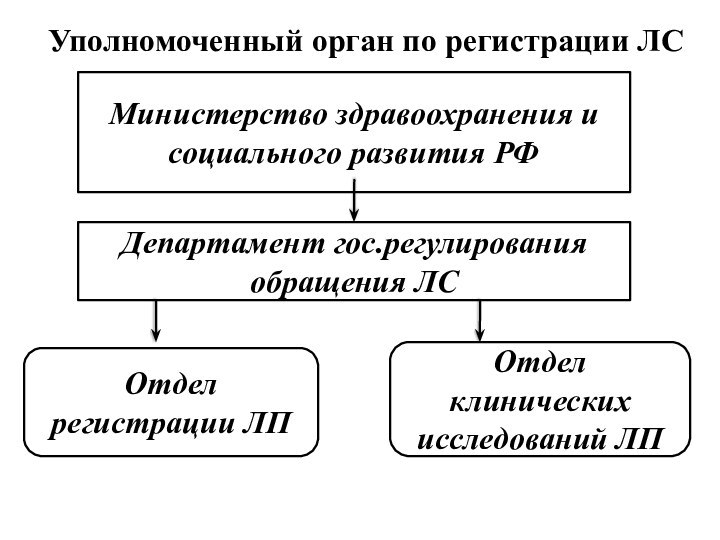
Уполномоченный орган по регистрации ЛС
Министерство здравоохранения и социального
развития РФ
Департамент гос.регулирования обращения ЛС
Отдел регистрации ЛП
Отдел клинических исследований
ЛП
Слайд 5
Государственной регистрации подлежат:
1) оригинальные лекарственные препараты;
2) воспроизведенные препараты;
3)
новые комбинации зарегистрированных ранее препаратов;
4) препараты, зарегистрированные ранее, но
произведенные в других лекарственных формах, в новой дозировке
Слайд 6
Не допускается гос.регистрация:
Различных ЛП под одинаковым торговым наименованием
Одного
ЛП, выпускаемого производителем под различными
торговыми наименованиями ипредставленного
на гос.регистрацию
в виде двух и более ЛП
Слайд 7
После клинического исследования
Перед клиническим исследованием
Экспертиза ЛС
1) экспертиза документов
для получения разрешения на проведение КИ
2) этическая экспертиза
возможности проведения КИ1) экспертиза качества ЛС и отношения ожидаемой пользы к возможному риску применения
Слайд 8
Заявление о госрегистрации
Наименование и адрес заявителя и (или)
производителя ЛП и адрес места производства
Наименование препарата (МНН и
торговое)Перечень веществ, входящих в состав, с указанием количества каждого из них
ЛФ, дозировка, способы введения и применения, срок годности ЛП
Описание фармакологических и фармакодинамических или иммунобиологических свойств ЛП
Заявленная производителем
предельная отпускная цена
на препарат, включенный в
перечень ЖНВЛП
Слайд 9
Регистрационное досье ЛС
Проекты макетов упаковки
Проект НД либо указание
соответствующей фармакопейной статьи
Схема технологического процесса производств
Информация об условиях хранения,
перевозки и др.Отчет о результатах доклинического исследования
Проект протокола клинического исследования
Информационный листок пациента
Проект инструкции по применению
Переведенная на русский язык и заверенная в установленном порядке копия документа, подтверждающего регистрацию лекарственного препарата в случае его регистрации вне пределов РФ
Слайд 10
Порядок гос.регистрации ЛС
Подача заявления о государственной регистрации ЛП
Экспертиза
документов для получения разрешения на проведение КИ ЛП и
этической экспертизыРассмотрение уполномоченным органом экспертных заключений и принятие решения о возможности выдачи разрешения на проведение КИ ЛП
Принятие МЗСР РФ решения о проведении КИ ЛП
Экспертиза качества ЛС и экспертиза отношения ожидаемой пользы к возможному риску
применения ЛП
6. Принятие уполномоченным органом решения о государственной регистрации ЛП
Слайд 11
Размеры госпошлины:
25.3 гл. НК РФ
1. Экспертиза документов (до
КИ) – 75 000
2. Экспертиза качества ЛС и отношения
пользы к риску – 225 000
3. Внесение изменений в
инструкцию по применению
- 50 000
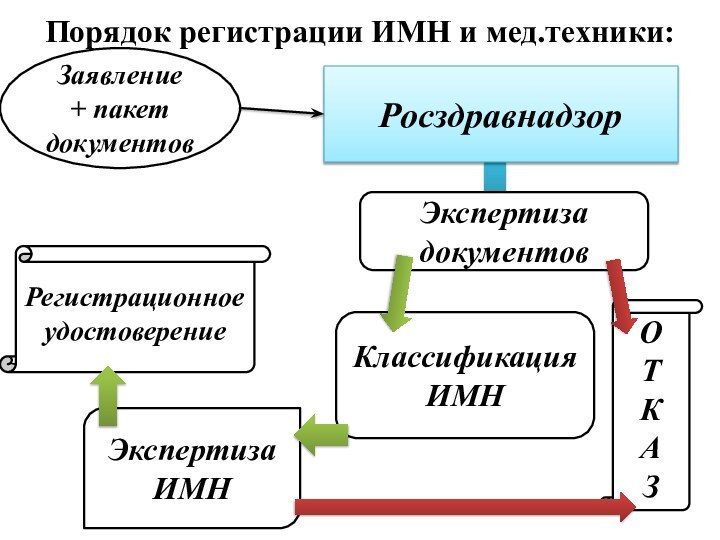
Слайд 13 Уполномоченный орган – Федеральная служба по надзору в
сфере здравоохранения и социального развития
Приказ МЗСР РФ
№735 от 30.10.2006 «Об утверждении Административного регламента Федеральной службы по надзору в сфере здравоохранения и социального развития по исполнению государственной функции по регистрации изделий медицинского назначения»Срок действия регистрационного удостоверения – не ограничен
Слайд 14 Регистрации подлежат ИМН: /приборы, аппараты, инструменты, комплекты, наборы реагентов,
оборудование и др./
предназначенные для:
профилактики, диагностики (in vitro), лечения заболеваний,
реабилитации, исследований мед. характера, контроля над зачатием и др.физиотерапевтического и иного воздействия на организм человека, за исключением химического, фармакологического и иммунобиологического и др.
Слайд 15
Классификация ИМН
в зависимости от степени риска применения
класс
3 - с высокой степенью риска;
класс
2б - с повышенной степенью риска;класс 2а - со средней степенью риска;
класс 1 - с низкой степенью
риска.





























