- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии Кислород, его получение. применение и свойства 8 класс
Содержание
- 2. «Кислород- это вещество вокруг которого вращается земная
- 3. Кислород. Оксиды. Горение.
- 4. Нахождение в природе:Кислород – самый распространенный элемент
- 5. История открытияАнглийский ученый Д. Пристли в
- 6. ПолучениеВ лаборатории получают при реакции разложения сложных
- 7. Физические свойстваБесцветный газ, без вкуса, запаха,
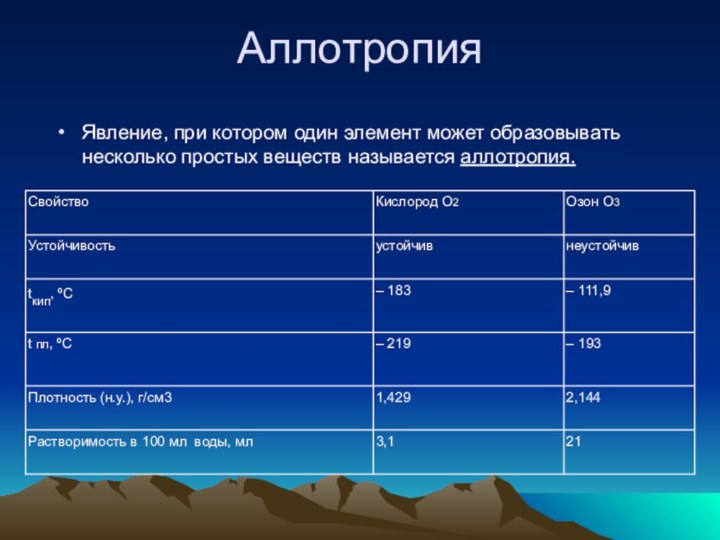
- 8. АллотропияЯвление, при котором один элемент может образовывать несколько простых веществ называется аллотропия.
- 9. Участвует в реакциях горения и окисления:Медленное окисление
- 10. ОксидыВзаимодействие веществ с кислородом относится к реакциям
- 11. Применение кислородаВ разных отраслях химической промышленности:МеталлургииСварка и
- 12. Воздух.Видеоопыт
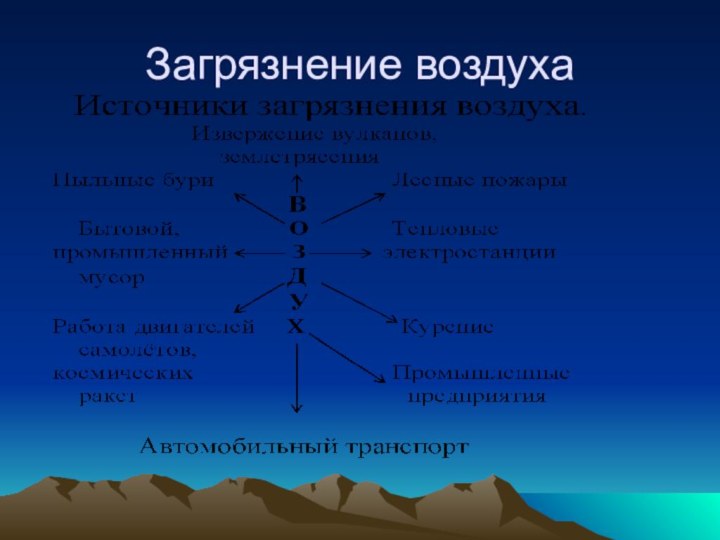
- 14. Загрязнение воздуха
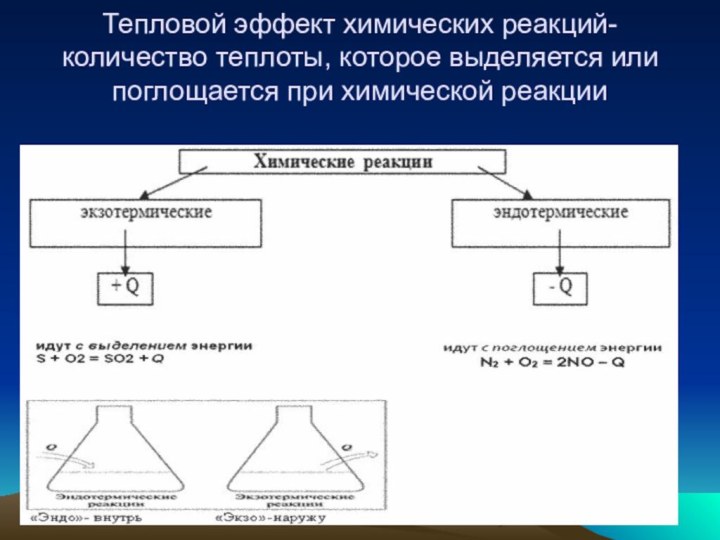
- 16. Тепловой эффект химических реакций-количество теплоты, которое выделяется или поглощается при химической реакции
- 17. Термохимия, термохимические уравнения.Термохимия - раздел химии, в задачу
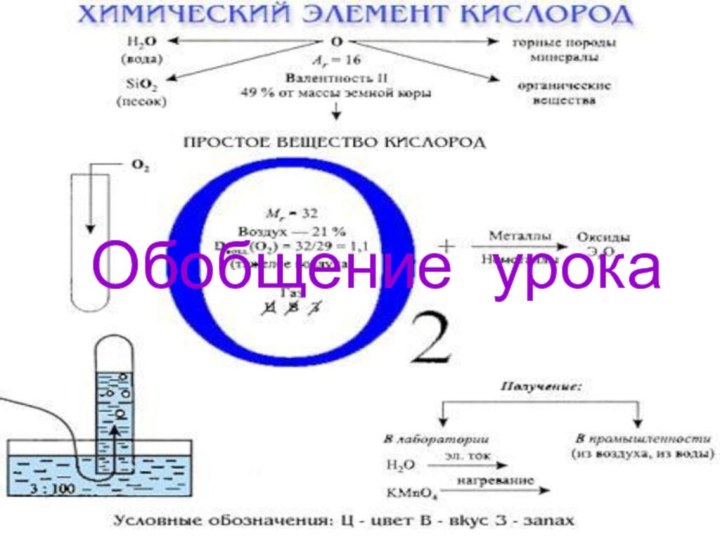
- 18. Обобщение урока
- 19. Скачать презентацию
- 20. Похожие презентации
«Кислород- это вещество вокруг которого вращается земная химия»














Слайд 3
Кислород. Оксиды. Горение.
Общая характеристика.
Химический знак – О
Атомная масса Аr
=16Химическая формула О2
Относительная молекулярная масса 32
Слайд 4
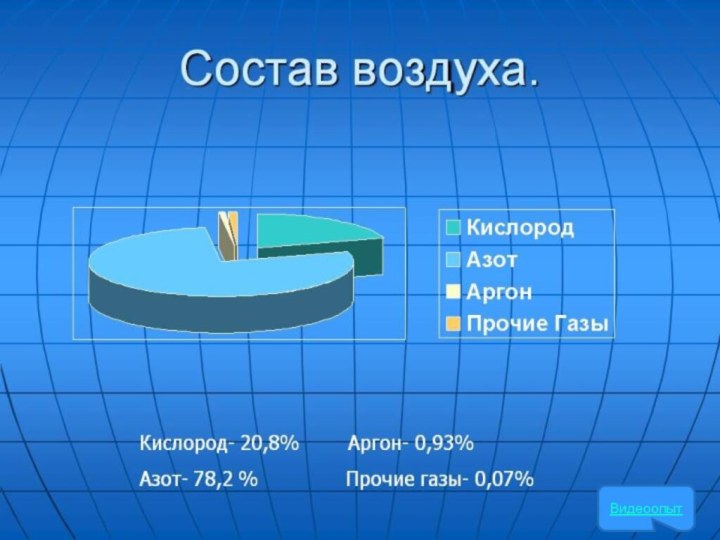
Нахождение в природе:
Кислород – самый распространенный элемент в
природе.
В воздухе содержится – 20,9%
В земной коре, горных породах,
растениях, животных, органических соединениях, итого 49 % по массе.
Слайд 5
История открытия
Английский ученый Д. Пристли в 1774
году, изучая газы, проделал опыты с разложением оксида ртути,
получил газ, который поддерживал горение и назвал его oxydeniym.
Слайд 6
Получение
В лаборатории получают при реакции разложения сложных веществ:
2Н2
О ---- 2 Н2 + О2
2Нg О --------
2 Нg + О22КМпО4 ----К2МпО4+ МпО2 + О2
Катализаторы – вещества, которые ускоряют химические реакции, но сами при этом не расходуются. Пример: оксид марганца (IV) ускоряет разложение пероксида водорода.
Слайд 7
Физические свойства
Бесцветный газ, без вкуса, запаха, малорастворим
в воде. При температуре -183о С –сжижается, а при
температуре до - 218о С затвердевает.Аллотропное видоизменение кислорода - озон О3, который образуется в воздухе при грозовых разрядах.
Слайд 8
Аллотропия
Явление, при котором один элемент может образовывать несколько
простых веществ называется аллотропия.
Слайд 9
Участвует в реакциях горения и окисления:
Медленное окисление –
реакция окисления, которая идёт медленно, с постепенным выделением теплоты,
и не сопровождается выделением света.Горение – это реакция, при которой происходит окисление веществ с выделением теплоты и света.
С + О2 ----- СО2
S + O2 ----- SO2
3Fe + 2O2 -----Fe3O4
Химические свойства
Слайд 10
Оксиды
Взаимодействие веществ с кислородом относится к реакциям окисления,
образует оксиды.
Оксиды – сложные вещества, которые состоят из двух
элементов, одним из которых является кислород.Делятся:
-кислотные SO3 CO2 N2O5
-основные CaO K2O
Слайд 11
Применение кислорода
В разных отраслях химической промышленности:
Металлургии
Сварка и резка
металлов
Ракетных двигателях
Используется в медицине
фотосинтез - дыхание, гниение, разложение.
6 СО
2 + 6 Н 2 О ------- С6 Н12 О6 + 6 О2Слайд 16 Тепловой эффект химических реакций-количество теплоты, которое выделяется или
поглощается при химической реакции
Слайд 17
Термохимия, термохимические уравнения.
Термохимия - раздел химии, в задачу которого
входит определение и изучение тепловых эффектов реакции.
Термохимические уравнения – уравнения
в которых указывается количество поглощенной или выделенной теплоты.2HgO —> 2Hg + O2 – 180 кДж,
С(тв) + O2(г) —> СO2(г) + 394 кДж