- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Периодический закон и Периодическая система Д. И. Менделеева
Содержание
- 2. Вставь пропущенные слова. Вопрос 1Химический элемент –
- 3. Вопрос 2Атом состоит из ……, находящегося в
- 4. Вопрос 3В состав ….. входят протоны и
- 5. Вопрос 4В ядре сосредоточена основная …… атома,
- 6. Вопрос 5Заряд электрона равен ……, его масса
- 7. Вопрос 6Атом в целом имеет заряд, равный
- 8. Вопрос 7Число электронов, как и протонов, в
- 9. Вопрос 8Число нейтронов находится как ….. атомной
- 10. Вопрос 9Важнейшей характеристикой атома является ……. ……. ……. .Важнейшей характеристикой атома является заряд ядра атома.
- 11. Вопрос 10Атомы одного и того же элемента,
- 12. Вопрос 10Атомы одного и того же элемента,
- 13. Вопрос 11Атомная масса элементов дробная величина, потому
- 14. Вопрос 11Атомная масса элементов дробная величина, потому
- 15. Вопрос 12Орбиталь – это …. ….. …..
- 16. Вопрос 12Орбиталь – это область пространства вокруг
- 17. Вопрос 13Важнейшей характеристикой движения электрона является запас
- 18. Вопрос 13Важнейшей характеристикой движения электрона является запас
- 19. Вопрос 14На первом энергетическом уровне максимально может
- 20. Вопрос 15На втором энергетическом уровне максимально может
- 21. Вопрос 16Общее количество энергетических уровней в атоме
- 22. Вопрос 17В периоде происходит ….. заполнение орбиталей
- 23. Вопрос 17В периоде происходит постепенное заполнение орбиталей
- 24. Вопрос 18Число электронов на высшем (внешнем, самом
- 25. Вопрос 18Число электронов на высшем (внешнем, самом
- 26. Вопрос 19Запись электронного строения с указанием энергетических
- 27. Вопрос 19Запись электронного строения с указанием энергетических
- 28. Вопрос 20Периодический закон был сформулирован … ….
- 29. Вопрос 21Формулировки периодического закона: свойства элементов и
- 30. Вопрос 21Формулировки периодического закона: свойства элементов и
- 31. Вопрос 22Д.И. Менделеев рассматривал зависимость свойств от
- 32. Вопрос 23Свойства элементов и их соединений изменяются периодически, потому что периодически повторяется строение ….. .
- 33. Вопрос 23Свойства элементов и их соединений изменяются периодически, потому что периодически повторяется строение атома.
- 34. Вопрос 24Периодическая система содержит 7 ….. и
- 35. Вопрос 25Период - …… ……. В периоде
- 36. Вопрос 25Период – горизонтальный ряд. В периоде
- 37. Вопрос 26Группа - ….. ….. . Группы
- 38. Вопрос 26Группа – вертикальный ряд. Группы содержат
- 40. Скачать презентацию
- 41. Похожие презентации
Вставь пропущенные слова. Вопрос 1Химический элемент – это ……. …… …….. .Химический элемент – это определённый вид атомов.






































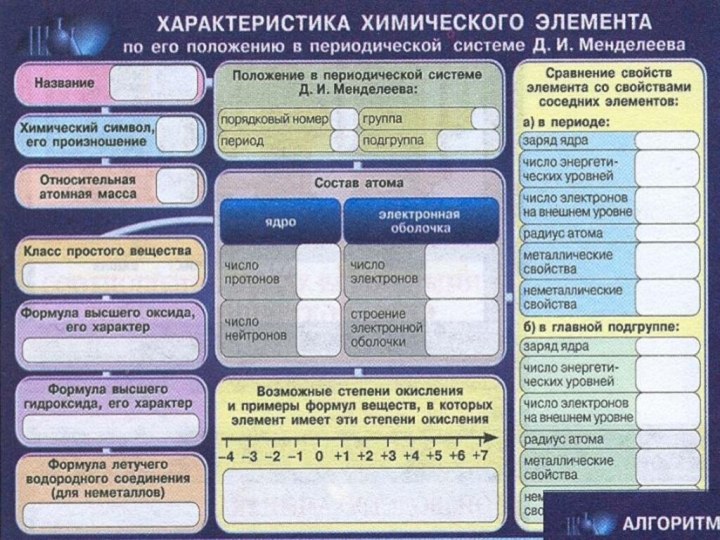

Слайд 3
Вопрос 2
Атом состоит из ……, находящегося в центре
атома, и …….., движущихся около него.
Атом состоит из ядра,
находящегося в центре атома, и электронов, движущихся около него.
Слайд 4
Вопрос 3
В состав ….. входят протоны и нейтроны.
Заряд протона равен …., нейтрона - ….. . Их
массы одинаковы и равны …… .В состав ядра входят протоны и нейтроны. Заряд протона равен + 1, нейтрона - 0 . Их массы одинаковы и равны 1.
Слайд 5
Вопрос 4
В ядре сосредоточена основная …… атома, ядро
заряжено ……. .
В ядре сосредоточена основная масса атома, ядро
заряжено положительно.
Слайд 6
Вопрос 5
Заряд электрона равен ……, его масса считается
равной …… .
Заряд электрона равен -1, его масса считается
равной 1.
Слайд 7
Вопрос 6
Атом в целом имеет заряд, равный ……
(электронейтрален), потому что число протонов и электронов ……. .
Атом
в целом имеет заряд, равный нулю (электронейтрален), потому что число протонов и электронов одинаково.
Слайд 8
Вопрос 7
Число электронов, как и протонов, в атоме
химического элемента равно …… …… химического элемента.
Число электронов, как
и протонов, в атоме химического элемента равно порядковому номеру химического элемента.
Слайд 9
Вопрос 8
Число нейтронов находится как ….. атомной массы
и ……. ……. …….. .
Число нейтронов находится как разность
атомной массы и порядкового номера элемента.
Слайд 10
Вопрос 9
Важнейшей характеристикой атома является ……. ……. …….
.
Важнейшей характеристикой атома является заряд ядра атома.
Слайд 11
Вопрос 10
Атомы одного и того же элемента, отличающиеся
количеством ….. (а потому и массой) называются …… .
Несмотря на разную массу, это атомы одного и того же элемента, потому что …… …… у них одинаков.
Слайд 12
Вопрос 10
Атомы одного и того же элемента, отличающиеся
количеством нейтронов (а потому и массой) называются изотопами. Несмотря
на разную массу, это атомы одного и того же элемента, потому что заряд ядра у них одинаков.
Слайд 13
Вопрос 11
Атомная масса элементов дробная величина, потому что
существуют ….. , и в периодической системе приводится среднее
арифметическое их масс.
Слайд 14
Вопрос 11
Атомная масса элементов дробная величина, потому что
существуют изотопы, и в периодической системе приводится среднее арифметическое
их масс.
Слайд 15
Вопрос 12
Орбиталь – это …. ….. ….. …..
….. . Орбитали сферической формы - … - орбитали,
орбитали в форме восмёрки - ..., …., …. – орбитали.
Слайд 16
Вопрос 12
Орбиталь – это область пространства вокруг ядра
атома. Орбитали сферической формы - s - орбитали, орбитали
в форме восмёрки – p, d, f – орбитали.
Слайд 17
Вопрос 13
Важнейшей характеристикой движения электрона является запас его
…. . В зависимости от запаса его …. электрон
может находиться на определённом энергетическом уровне.
Слайд 18
Вопрос 13
Важнейшей характеристикой движения электрона является запас его
энергии. В зависимости от запаса его энергии электрон может
находиться на определённом энергетическом уровне.
Слайд 19
Вопрос 14
На первом энергетическом уровне максимально может быть
…. электрона.
На первом энергетическом уровне максимально может быть два
электрона.
Слайд 20
Вопрос 15
На втором энергетическом уровне максимально может быть
…. электронов.
На втором энергетическом уровне максимально может быть восемь
электронов.
Слайд 21
Вопрос 16
Общее количество энергетических уровней в атоме равно
номеру ……, в котором находится элемент.
Общее количество энергетических уровней
в атоме равно номеру периода, в котором находится элемент.
Слайд 22
Вопрос 17
В периоде происходит ….. заполнение орбиталей электронами.
Каждый новый период начинается с заполнения электронами ….. энергетического
уровня.
Слайд 23
Вопрос 17
В периоде происходит постепенное заполнение орбиталей электронами.
Каждый новый период начинается с заполнения электронами нового энергетического
уровня
Слайд 24
Вопрос 18
Число электронов на высшем (внешнем, самом дальнем
от ядра) уровне равно ….. ….. . Внешний электронный
слой атомов элементов одной группы (главной подгруппы) ….. .
Слайд 25
Вопрос 18
Число электронов на высшем (внешнем, самом дальнем
от ядра) уровне равно номеру группы. Внешний электронный слой
атомов элементов одной группы (главной подгруппы) одинаков.
Слайд 26
Вопрос 19
Запись электронного строения с указанием энергетических уровней,
вида орбиталей и количества электронов на орбиталях - …….
…… .
Слайд 27
Вопрос 19
Запись электронного строения с указанием энергетических уровней,
вида орбиталей и количества электронов на орбиталях – электронная
формула.
Слайд 28
Вопрос 20
Периодический закон был сформулирован … …. ….
в …. году.
Периодический закон был сформулирован Дмитрием Ивановичем Менделеевым
в 1869 году.
Слайд 29
Вопрос 21
Формулировки периодического закона: свойства элементов и их
соединений находятся в периодической зависимости от …. …. (Д.И.
Менделеев), от …. ….. (современная).
Слайд 30
Вопрос 21
Формулировки периодического закона: свойства элементов и их
соединений находятся в периодической зависимости от массы атома (Д.И.
Менделеев), от заряда ядра (современная).
Слайд 31
Вопрос 22
Д.И. Менделеев рассматривал зависимость свойств от …..
…. , поскольку …. …. …. …. .
Д.И. Менделеев
рассматривал зависимость свойств от массы атома, поскольку не было известно о строении атома.
Слайд 32
Вопрос 23
Свойства элементов и их соединений изменяются периодически,
потому что периодически повторяется строение ….. .
Слайд 33
Вопрос 23
Свойства элементов и их соединений изменяются периодически,
потому что периодически повторяется строение атома.
Слайд 34
Вопрос 24
Периодическая система содержит 7 ….. и
8 …….. .
Периодическая система содержит 7 периодов и
8 групп.
Слайд 35
Вопрос 25
Период - …… ……. В периоде радиус
атомов элементов слева направо …… . Число электронов внешнего
энергетического уровня ….. . Металлические свойства элементов ….. , а неметаллические ….. .
Слайд 36
Вопрос 25
Период – горизонтальный ряд. В периоде радиус
атомов элементов слева направо уменьшается. Число электронов внешнего энергетического
уровня увеличивается. Металлические свойства элементов ослабевают, а неметаллические усиливаются.
Слайд 37
Вопрос 26
Группа - ….. ….. . Группы содержат
две ….. (главную и побочную). В группе (сверху вниз)радиус
атомов элементов ….. , число электронов внешнего энергетического уровня ….. . Неметаллические свойства элементов ….., а металлические - …… .
Слайд 38
Вопрос 26
Группа – вертикальный ряд. Группы содержат две
подгруппы (главную и побочную). В группе (сверху вниз) радиус
атомов элементов увеличивается, число электронов внешнего энергетического уровня одинаково. Неметаллические свойства элементов ослабевают, а металлические - усиливаются.





























