Слайд 2
Цели урока:
Обучающие:
Закрепить знания
Обобщить знания
3. Систематизировать знания
Развивающие:
1.Развивать аналитическое мышление
2.
Устанавливать логические связи
3. Развивать творческие способности.
Воспитательные:
Воспитывать познавательный интерес к
процессу обучения
Оборудование: цинк, соляная кислота, пробирка с пробкой,перекись водорода, оксид марганца, спички, покровное стекло, лучина, чашка Петри с водой, фенолфталеин , калий металлический, нож, пинцет, фарфоровая пластина, спички.
Слайд 3
Приветствие веществам
- О каких элементах идет речь?
1.В чем горят дрова и газ,
Фосфор, водород, алмаз?
Дышит чем любой из нас
Каждый миг и каждый час?
Без чего мертва природа?
Правильно, без….
2. Я – важнейший элемент,
Без меня и Солнца нет.
Я – без запаха и цвета,
Легче газа в мире нету.
Я вхожу в состав воды,
Нефти, всяческой еды.
На планете я пришелец,
Космос – вот где я умелец.
Я – источник света звезд,
Жизнь на Землю я принес,
И в таблице элементов,
Попрошу заметить, первый!
-Какими способами можно получить кислород?
-Какими способами можно получить водород?
Слайд 4
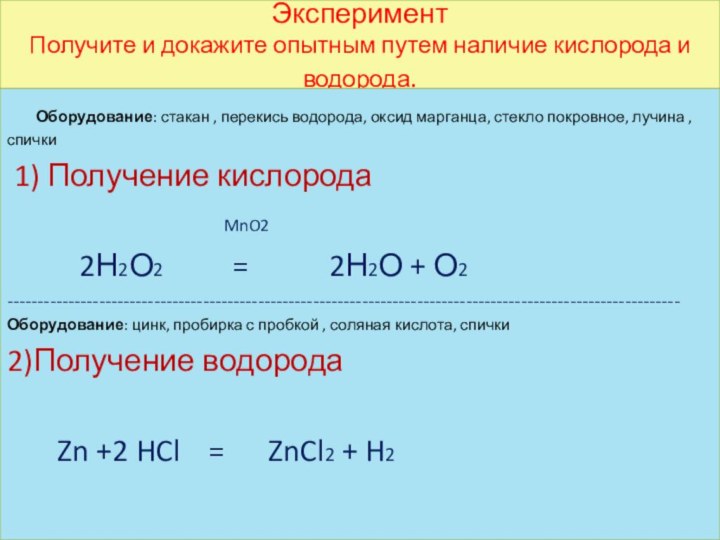
Эксперимент
Получите и докажите опытным путем наличие кислорода и
водорода.
Оборудование: стакан , перекись водорода, оксид марганца,
стекло покровное, лучина , спички
1) Получение кислорода
MnO2
2Н2О2 = 2Н2О + О2
--------------------------------------------------------------------------------------------------------------
Оборудование: цинк, пробирка с пробкой , соляная кислота, спички
2)Получение водорода
Zn +2 HCl = ZnCl2 + H2
Слайд 5
Сравните свойства кислорода и водорода
Слайд 6
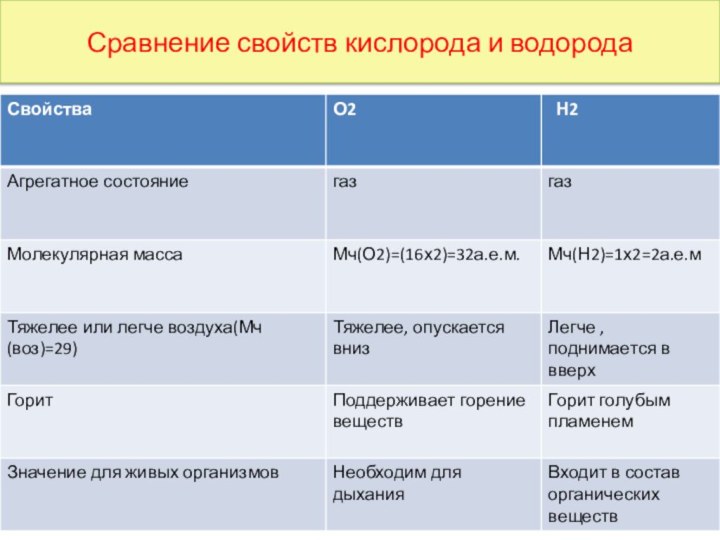
Сравнение свойств кислорода и водорода
Слайд 7
Установите взаимосвязь
между водородом и кислородом
2Н2+ О2= 2Н2О
-При каких условиях протекает
эта реакция?
Демонстрация опыта «Получение гремучего газа»(диск химия 8кл)
Не шутите с Водородом!
Он горит, рождая воду,
В смеси с Кислородом-братом
Он взрывается, ребята!
Слайд 8
Взаимодействие водорода с кислородом
Слайд 9
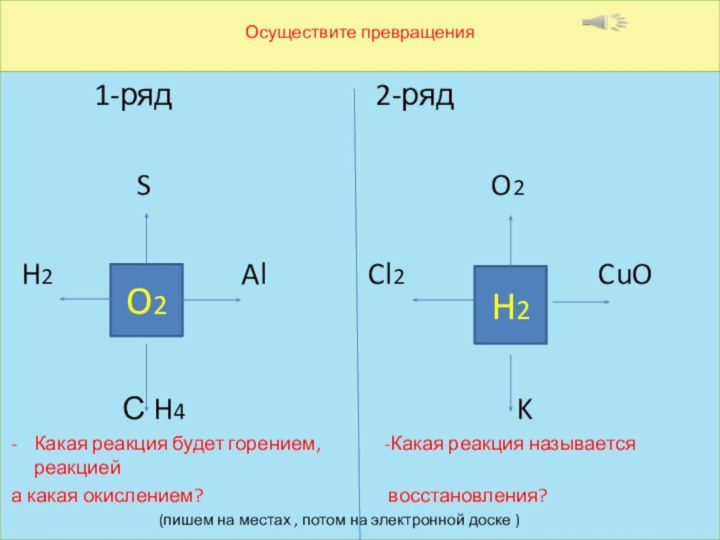
Осуществите превращения
1-ряд
2-ряд
S O2
H2 Al Cl2 CuO
С H4 K
Какая реакция будет горением, -Какая реакция называется реакцией
а какая окислением? восстановления?
(пишем на местах , потом на электронной доске )
O2
H2
Слайд 10
Невероятно , но факт
Демонстрация:
2К+ Н2О=2КОН +Н2
-Что здесь невероятного?
-Какие еще металлы относятся к щелочным?
Напишите подобную реакцию.
Почему метал не тонет , а «бегает» по поверхности воды?
- Наличие какого вещества подтверждает изменение окраски фенолфталеина ?
Слайд 11
Используйте ресурсы
(измени- убери- добавь- получи)
2 Cu +
O2 = 2CuO
Слайд 12
Используйте ресурсы
(измени- убери- добавь- получи)
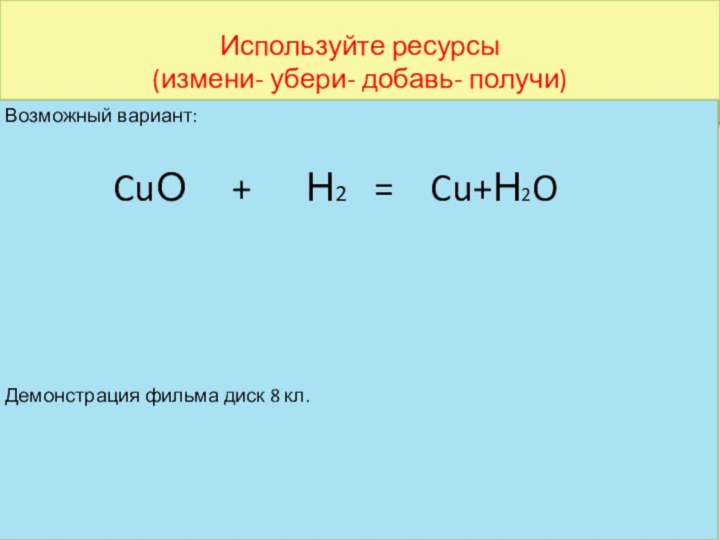
Возможный вариант:
CuО +
Н2 = Cu+Н2O
Демонстрация фильма диск 8 кл.
Слайд 13
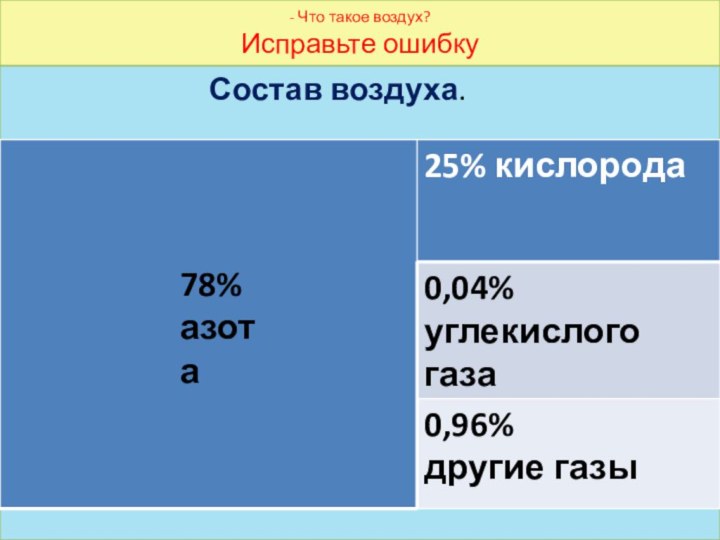
- Что такое воздух?
Исправьте ошибку
Слайд 14
Что правда , что ложь?
1.При t=-183 кислород
превращается в голубую жидкость
2.В атмосфере находиться много неактивного азота,
это важно для дыхания т.к. снижается концентрация чистого кислорода , являющегося сильным окислителем.
3.Аппарат Киппа служит для получения водорода.
4.Оксиды –это вещества состоящие из трех элементов один из которых кислород
5.Сложные вещества не горят в кислороде.
6. Водород не используется для восстановления металлов из их оксидов.
7.Химические реакции сопровождаются тепловым эффектом.
8. Реакции идущие с выделением тепла называются эндотермическими
9.Используя закон сохранения массы веществ и энергии, можно найти массу вещества зная энергию .
Слайд 15
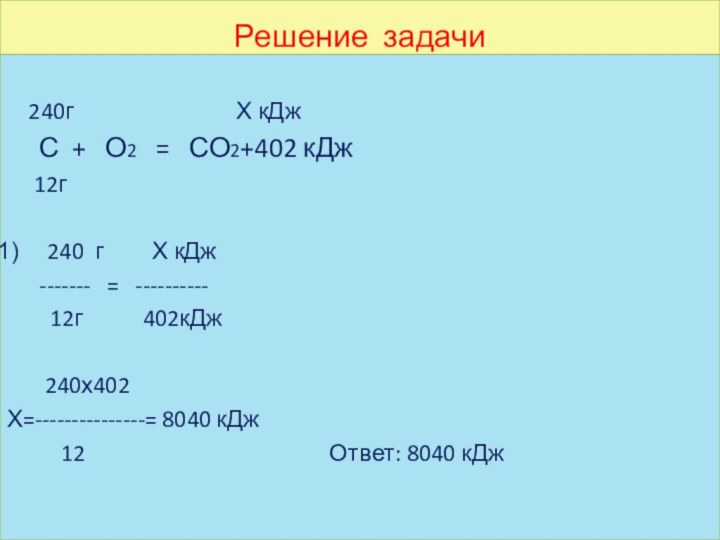
Решите задачу
Сгорело 240 г угля, сколько энергии выделилось.
Термохимическое
уравнение.
С+О2= СО2+402 кДж
Слайд 16
Решение задачи
240г
Х кДж
С + О2 = СО2+402 кДж
12г
240 г Х кДж
------- = ----------
12г 402кДж
240х402
Х=---------------= 8040 кДж
12 Ответ: 8040 кДж
Слайд 17
Выберите главное.
Водород - основа мира. Космос, звездный небосвод,
На
три четверти по массе составляет водород.
В недрах Солнца "выгорая",
нам тепло и свет дает,
Но Земля, хотя и рядом, а состав совсем не тот.
При создании планеты испарился легкий газ.
В атмосфере с литосферой лишь один процент сейчас.
По теориям различным даже этот водород,
Не от первых дней остался - Солнце нам, по дружбе, шлет.
Газ от солнечной короны ветром солнечным летит,
Как магнитная ловушка на пути Земля стоит.
С кислородом в связь вступая, с неба капает дождем,
Невозможно перечислить, где найдем его потом.
Он в бензине, и в ракете, он во всем живом на свете,
В щелочах, гидридах разных, часть рабочая кислот,
Школьник, парта, бутерброд - все содержит водород!
Без него как без воды - ни туды и не сюды!!!!
Несмотря на роль в природе и огромнейший запас
( На Земле в десятку входит) не давался в руки газ.
Слайд 18
Выберите главное.
Но наука начинала свой стремительный полет-
ПАРАЦЕЛЬС одним
из первых получает водород.
РОБЕРТ БОЙЛЬ и ДЖОЗЕФ ПРИСТЛИ, АНТУАН
ЛАВУАЗЬЕ,
ГЕНРИ КАВЕНДИШ трудились над проблемой о воде.
Газ получен и изучен. Время дела настает-
ШАРЛЬ, построив шар воздушный, отправляется в полет.
На земле, горя в горелках, наивысший жар дает,
В домнах, вместо углерода, отнимает кислород.
На заводах газ гремучий стал взрывчатку вытеснять,
ЗОНД-ШАРАМ, узнать погоду, легче газа не создать.
В производстве маргарина, лаков, красок и кислот,
Удобрений и варенья - всюду нужен водород.
У воды есть брат активный. Взяв "с запасом" кислород
пероксид, как окислитель, в быт пришел и на завод.
Производство полимеров, ткань, картину осветлит,
В медицине и в консервах всех микробов победит.
Разлагаясь, пар горячий для турбины создает
Плюс избыток кислорода здесь же топливо сожжет.
У подводных лодок скорость под водою возрастет,
Для торпеды, для ракеты пар дает и кислород.