- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Неметаллы, их положение в периодической системе химических элементов Д.И. Менделеева, строение атома (на примере атома хлора, кислорода, азота). Отличие физических свойств неметаллов от металлов. Взаимодействие неметаллов с простыми веществами
Содержание
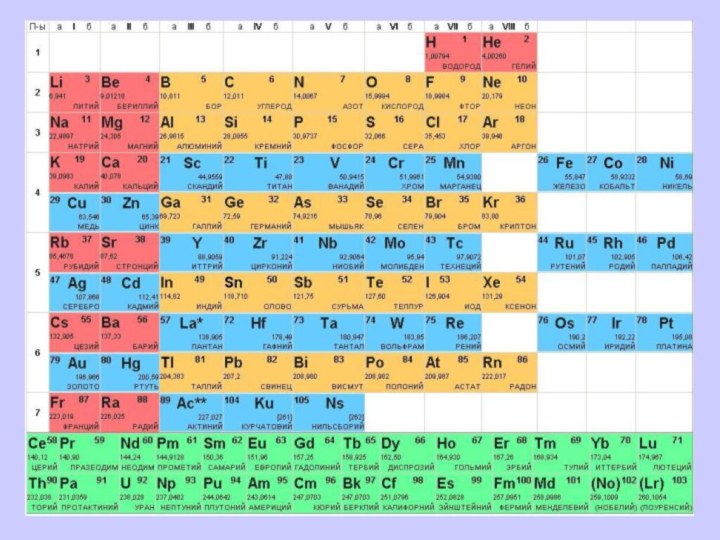
- 2. I. Положение неметаллов в периодической системе химических элементов Д.И. Менделеева
- 4. II.Строение атома неметаллов
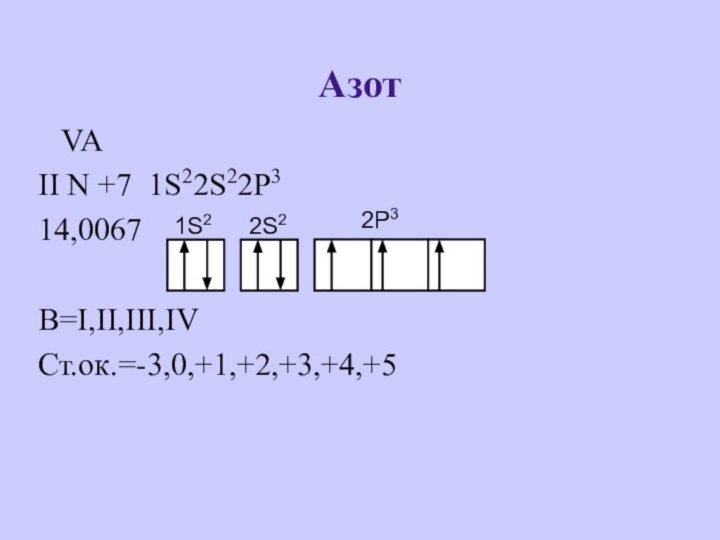
- 5. Азот VAII N +7 1S22S22P314,0067В=I,II,III,IVСт.ок.=-3,0,+1,+2,+3,+4,+5
- 6. Кислород VIAII O +8 1S22S22P4 15,9994 В=IIСт.ок.=-2,0,+2,+4O0+4e 2O-2
- 7. Хлор VIIAIII CL +17 1S22S22P63S23P53D0
- 8. III. Типы кристаллических решетокКристаллическая решетка – это соединение точек пространства прямыми линиями, образующими пространственный каркас.
- 9. Атомная кристаллическая решеткаРешетки, образованные атомами веществ, связанных ковалентных связью.Примеры: алмаз, кремний.
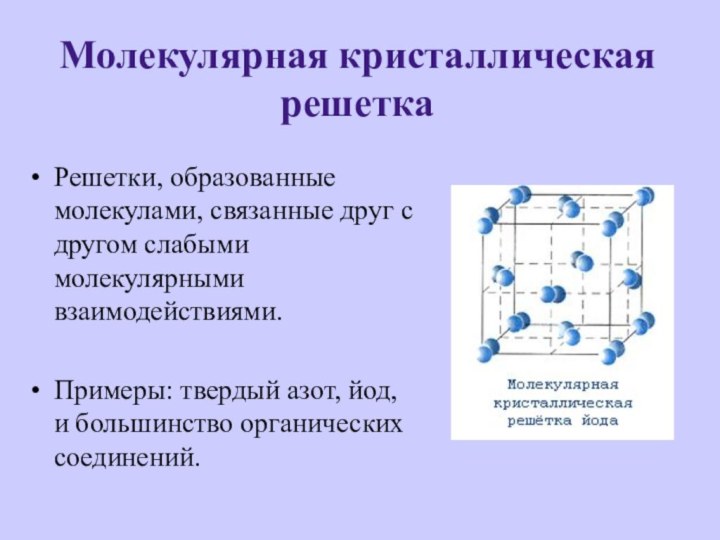
- 10. Молекулярная кристаллическая решеткаРешетки, образованные молекулами, связанные друг
- 11. IV. АллотропияАллотропия – это возможность существования одного
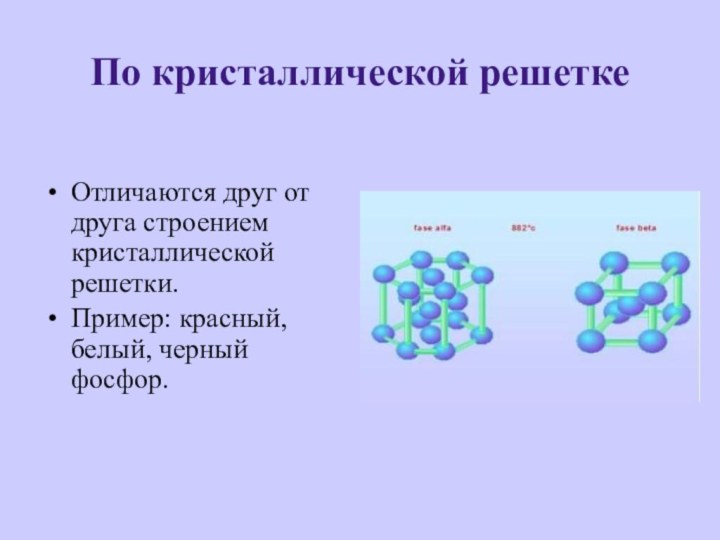
- 12. По кристаллической решеткеОтличаются друг от друга строением кристаллической решетки. Пример: красный, белый, черный фосфор.
- 13. По количеству атомовВещества отличаются по количеству атомов в молекуле. Примеры: озон и кислород, аллотропные формы углерода.
- 14. V.Физические свойства неметалловАгрегатное состояниеЦветЭлектро- и теплопроводность
- 15. Агрегатное состояниеГазообразное(H2,N2,Cl2,F2,O2,O3+все инертные газы)Жидкое(Br2)Твёрдое(S8,P,I2,C,B,Si,Se,As)
- 16. ЦветКрасный(PКР, Seаморф)Красно-бурый(Br2)Жёлтый(S)Зелёный(Cl2 - жёлто-зелёный газ)Фиолетовый(пары I2)Темно-серый(Si)Бесцветный(N2, O2)
- 17. Электро- и теплопроводностьБольшинство не проводят электрический ток (исключения: Cr, Si, графит) не теплопроводны не являются электролитами
- 18. VI. Химические свойства неметаллов как простых веществВзаимодействие
- 19. Взаимодействие с металлами2Mg + O2 = 2MgO
- 20. Взаимодействие с неметаллами4P + 5O2 = 2P2O5
- 21. Скачать презентацию
- 22. Похожие презентации
I. Положение неметаллов в периодической системе химических элементов Д.И. Менделеева















Слайд 7
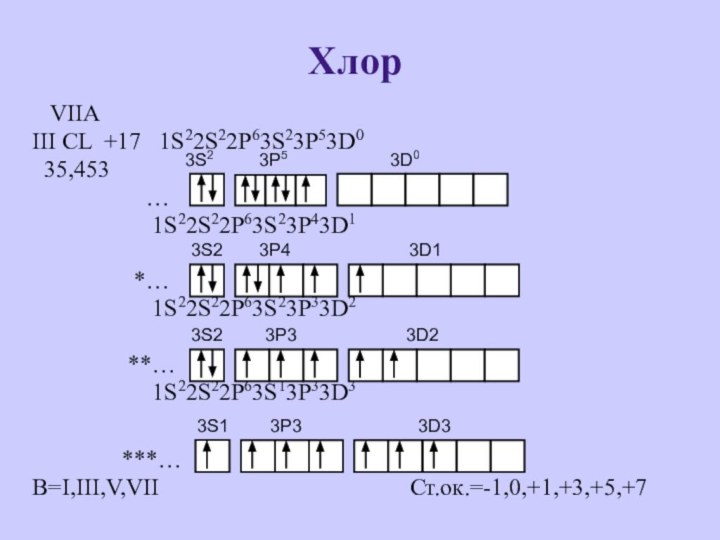
Хлор
VIIA
III CL +17 1S22S22P63S23P53D0
35,453
…
1S22S22P63S23P43D1
*…
1S22S22P63S23P33D2
**…
1S22S22P63S13P33D3
***…
В=I,III,V,VII Ст.ок.=-1,0,+1,+3,+5,+7
Слайд 8
III. Типы кристаллических решеток
Кристаллическая решетка – это соединение
точек пространства прямыми линиями, образующими пространственный каркас.
Слайд 9
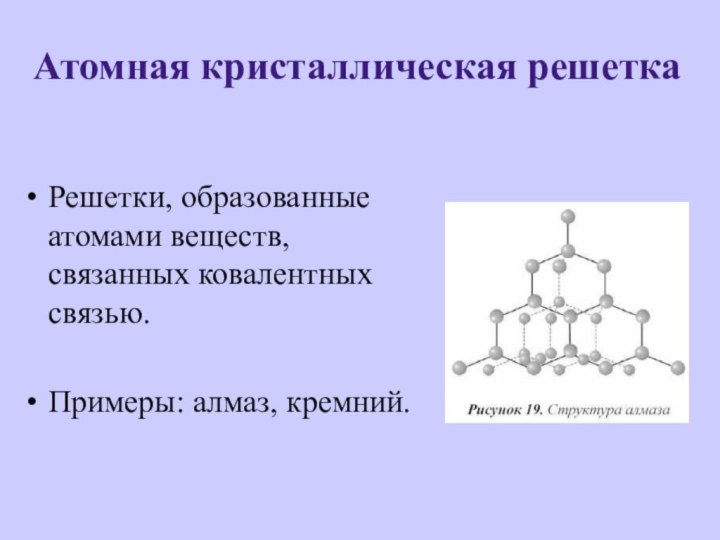
Атомная кристаллическая решетка
Решетки, образованные атомами веществ, связанных ковалентных
связью.
Примеры: алмаз, кремний.
Слайд 10
Молекулярная кристаллическая решетка
Решетки, образованные молекулами, связанные друг с
другом слабыми молекулярными взаимодействиями.
Примеры: твердый азот, йод, и большинство
органических соединений.
Слайд 11
IV. Аллотропия
Аллотропия – это возможность существования одного и
того же химического элемента в виде нескольких простых веществ.
Виды
аллотропии:По кристаллической решетке.
По количеству атомов в молекуле.
Слайд 12
По кристаллической решетке
Отличаются друг от друга строением кристаллической
решетки.
Пример: красный, белый, черный фосфор.
Слайд 13
По количеству атомов
Вещества отличаются по количеству атомов в
молекуле.
Примеры: озон и кислород, аллотропные формы углерода.
Слайд 15
Агрегатное состояние
Газообразное
(H2,N2,Cl2,F2,O2,O3+все инертные газы)
Жидкое
(Br2)
Твёрдое
(S8,P,I2,C,B,Si,Se,As)
Слайд 16
Цвет
Красный(PКР, Seаморф)
Красно-бурый(Br2)
Жёлтый(S)
Зелёный(Cl2 - жёлто-зелёный газ)
Фиолетовый(пары I2)
Темно-серый(Si)
Бесцветный(N2, O2)
Слайд 17
Электро- и теплопроводность
Большинство не проводят электрический ток (исключения:
Cr, Si, графит)
не теплопроводны
не являются электролитами
Слайд 18
VI. Химические свойства неметаллов как простых веществ
Взаимодействие с
простыми веществами - металлами
Взаимодействие с простыми веществами -
неметалламиВзаимодействие со сложными веществами на примере реакций горения органических веществ и галогенирования непредельных углеводородов
Слайд 19
Взаимодействие с металлами
2Mg + O2 = 2MgO
t
2Al
+ 3S = Al2S33Mg + 2P = Mg3P2
t
2Na + Cl2 = 2NaCl
t
Ca + H2 = CaH2
t
3Mg + N2 = Mg3N2





























