- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Фтор
Содержание
- 2. Фтор – довольно распространенный элемент. Из минералов
- 3. Простое вещество. Подобно водороду фтор образует двухатомные
- 4. Молекула фтора F2 имеет относительно небольшую массу
- 5. Вследствие высокой химической активности фтор вызывает коррозию
- 6. Широкое применение фтора началось в связи с
- 7. Фтор исключительно активен химически, он — сильнейший
- 8. По образному выражению акад. А. Е. Ферсмана,
- 9. Исключительно активно протекает взаимодействие фтора с большинством
- 10. Фтор окисляет некоторые так называемые инертные газы:
- 11. Е АОF MOXeF
- 12. В соответствии с закономерным изменением характера элементов
- 13. Ионные фториды кристаллические вещества с высокой температурой
- 14. Многие фториды металлов в низких степенях окисления
- 15. По химической природе ионные фториды являются основными
- 16. Основные фториды при гидролизе создают щелочную среду,
- 17. В неводных растворах PF5 взаимодействует с основными
- 18. Комплексные фториды весьма разнообразны. Координационное число по
- 19. Фтор со взрывом взаимодействует с водородом даже
- 20. Молекула фторида водорода НF сильно полярна и
- 21. Собственная ионизация жидкого НF незначительна (К =
- 22. Жидкий фторид водорода - сильный ионизирующий растворитель.
- 23. Даже НNО3 в этих условиях ведет себя
- 24. В жидком НF ведут себя как кислоты
- 25. Амфотерными соединениями в жидком НF являются, например,
- 26. HF неограниченно растворяется в воде. HF ионизируется
- 27. При нейтрализации HF образуются фторогидрогенаты 2HF
- 28. Термическое разложение фторогидрогенатов используется для получения чистого
- 29. Характерная особенность плавиковой кислоты (фтористоводородной = фтороводородной)
- 30. В соединениях со фтором у кислорода проявляется
- 31. Молекула ОF2 имеет угловую форму. Дифторид кислорода
- 32. ОF2 довольно легко гидролизуется основаниями,
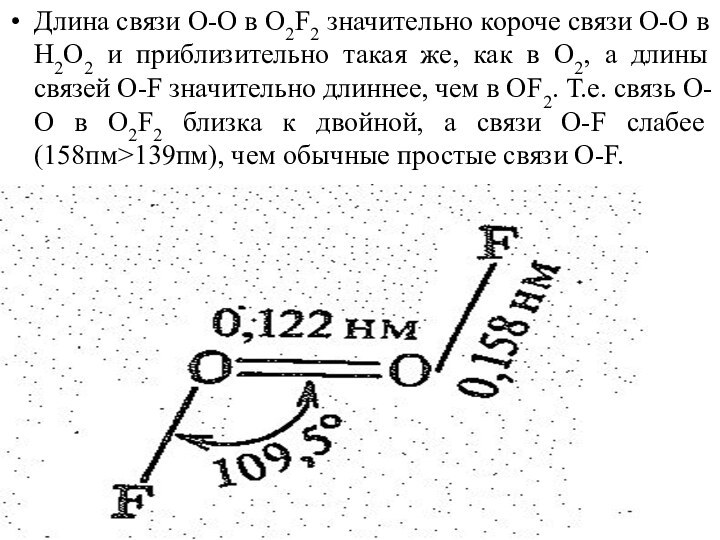
- 33. Длина связи О-О в О2F2 значительно короче
- 34. Соединение крайне неустойчиво, что определяется низкой энергией разрыва связи ОF (75 кДж/моль).
- 35. Скачать презентацию
- 36. Похожие презентации
Фтор – довольно распространенный элемент. Из минералов фтора наибольшее значение имеют СаF2 — плавиковый шпат (флюорит), Nа3А1F6 — криолит и Са5(РО4)3F— фторапатит. Фтористые соединения содержатся в организме человека (в основном в зубах и костях). В природе

























![Фтор При нейтрализации HF образуются фторогидрогенаты 2HF + KOH = K[HF2] +](/img/tmb/14/1360773/21be79294dcd4cf9435857487158bb7a-720x.jpg)






Слайд 3 Простое вещество. Подобно водороду фтор образует двухатомные молекулы
F2, что соответствует следующей электронной конфигурации:
( σsсв)2 (σs разр)2
(σхсв)2 ( πy, zсв )4 (πy, zразр)4.Поскольку на связывающих орбиталях имеется на два электрона больше, чем на разрыхляющих, порядок связи в молекуле F2 принимается равным 1.
Слайд 4 Молекула фтора F2 имеет относительно небольшую массу и
достаточно подвижна, поэтому фтор в обычных условиях — газ
(светло-желтого цвета), обладает низкой температурой плавления (—223 °С) и кипения (—187 oС).Из-за высокой окислительной активности фтора и большой прочности его соединений фтор получают в свободном состоянии электролизом его расплавленных соединений. Для этих целей обычно используют эвтектическую смесь НF – КF или фторогидрогенаты калия (например K[HF2] - дифторогидрогенат калия).
Фтор и его соединения сильно ядовиты (исключение составляют CF4, SF6 - элегаз и некоторые другие вещества).
Слайд 5 Вследствие высокой химической активности фтор вызывает коррозию почти
всех материалов. В качестве материала аппаратуры для получения фтор,
его хранения и перевозки используется нержавеющая сталь, медь; никель (и некоторые его сплавы), который устойчив к действию фтора за счет образования защитной пленки NiF2.В целом проблема эта разрешена, и фтор перевозится в больших количествах в гигантских автоцистернах (обычно в сжиженном виде).
Слайд 6 Широкое применение фтора началось в связи с работами
по разделению изотопов урана (в виде 235UF6 и 238UF6)
диффузионным методом. UF4 используется для получения металлического урана. (Фтор также используется в технологии редких элементов Nb, Ta и др.). В настоящее время фтор широко применяется для синтеза различных хладоагентов и полимерных материалов—фторопластов, отличающихся высокой химической стойкостью.Жидкий фтор и ряд его соединений применяются в качестве окислителя ракетного топлива.
Слайд 7 Фтор исключительно активен химически, он — сильнейший окислитель.
Высокая химическая активность фтора объясняется тем, что его молекула
имеет низкую энергию диссоциации (159 кДж/моль), в то время как химическая связь в большинстве соединений фтора отличается большой прочностью (порядка 200—600 кДж/моль). (Энергия связи E(H-F) =566, E(Si-F)=582 кДж/моль). Кроме того, энергия активации реакций с участием атомов фтора низка (≤ 4 кДж/моль). Благодаря малой энергии связи молекулы фтора легко диссоциируют на атомы.Низкое значение энергии связи молекулы F2 можно объяснить сильным отталкиванием электронных пар, находящихся на π-орбиталях, обусловленным малой длиной связи F-F.
Слайд 8 По образному выражению акад. А. Е. Ферсмана, фтор
«всесъедающий». В атмосфере фтора горят такие стойкие вещества, как
стекло (в виде ваты), вода:SiO2 + 2F2 = SiF4 + O2;
2Н2O + 2F2 = 4НF + O2 (О3, ОF2).
В этих реакциях в качестве одного из продуктов горения образуется кислород (!), т. е фтор как окислитель сильнее кислорода.
Pt сгорает во фторе Pt + F2 = PtF6 (Тпл. = 61, Ткип. = 69 оС) получается летучее кристаллическое вещество темно-красного цвета. Относится к числу самых сильных окислителей, является сильнейшим фторирующим реагентом.
Слайд 9 Исключительно активно протекает взаимодействие фтора с большинством простых
веществ. С серой и фосфором он взаимодействует даже при
температуре жидкого воздуха (—190 °С):S + 3F2 = SF6 (г), ΔНo298 = -1207 кДж/моль;
2P + 3F2 = 2PF3 (ж), ΔНo298 = -311,7кДж/моль;
2Р + 5F2 =2РF5 (кр), ΔНo298 = -3186 кДж/моль.
Реакции с фтором водородсодержащих веществ (H2O, H2, NH3, B2H6, SiH4, AlH3 и др.) сопровождается образованием HF.
2NH3(г) + 3F2(г) = 6HF(г) + N2(г); ΔGo = —1604 кДж/моль
2NH3(г) +6F2(г) = 6HF(г) + 2NF3(г); ΔGo = —1772 кДж/моль
Первая протекает при высоких Т (ΔS>0) вторая – при более низких Т (ΔS<0).
Слайд 10 Фтор окисляет некоторые так называемые инертные газы: (при
нормальном Р)
Хе + 2F2 = ХеF4(к), ΔНo298 =
– 252 кДж/моль;Хе + 3F2 = ХеF6(к) (при повышенном Р = 6МПа)
Хе + F2 = ХеF2(к) (электр. разр., УФ-излучение)
2ХеF2 = Хе + ХеF4; 3ХеF4 = Хе + 2ХеF6.
ХеF6 + H2O = ХеOF4(ж) + 2HF;
ХеOF4 +2H2O = ХеO3(т) + 4HF
Xe + PtF6 = Xe+[PtF6]-.
Непосредственно фтор не взаимодействует лишь с гелием, неоном и аргоном.
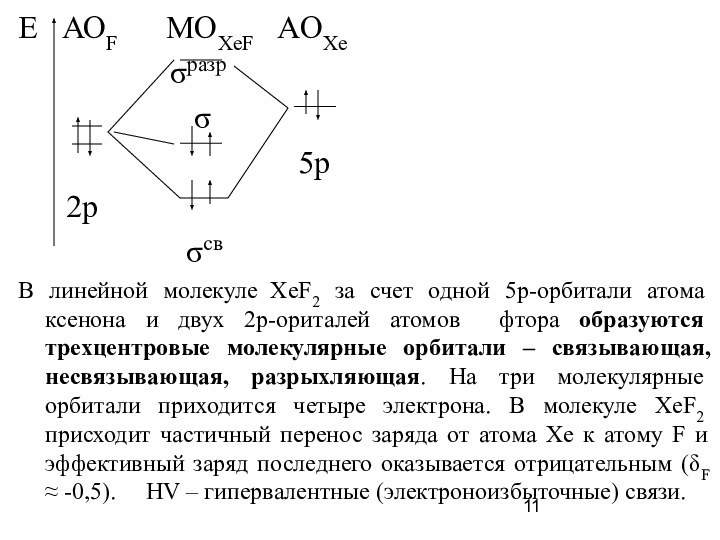
Слайд 11 Е АОF MOXeF AOXe
σ
5p
2р
σсв
В линейной молекуле ХеF2 за счет одной 5р-орбитали атома ксенона и двух 2р-ориталей атомов фтора образуются трехцентровые молекулярные орбитали – связывающая, несвязывающая, разрыхляющая. На три молекулярные орбитали приходится четыре электрона. В молекуле XeF2 присходит частичный перенос заряда от атома Xe к атому F и эффективный заряд последнего оказывается отрицательным (δF ≈ -0,5). HV – гипервалентные (электроноизбыточные) связи.
Слайд 12 В соответствии с закономерным изменением характера элементов по
периодам и группам периодической системы закономерно изменяются и свойства
фторидов, например:Химическая природа
NaF, MgF2 основная
AlF3 амфотерная
AlF63-
SiF4, PF5, SF6, (ClF5) кислотная
SiF62-, PF6-, SF60, (ClF6-)
Известно много прочных комплексов ([BF4]-, [BeF4]2-,
[SiF6]2-, [AlF6]3- и др.). WF6>ReF6> OsF6>IrF6>PtF6
Слайд 13 Ионные фториды кристаллические вещества с высокой температурой плавления.
Координационное число иона фтора 6 (NаF) или 4 (СаF2).
Ковалентные фториды газы или жидкости.
Промежуточное положение между ионными и ковалентными фторидами занимают фториды с высокой степенью полярности связи, которые можно назвать ионно-ковалентными соединениями.
К последним, например, можно отнести кристаллические ZnF2, МnF2, СоF2, NiF2, в которых эффективные заряды электроположительных атомов составляют 1,56; 1,63; 1,46; 1,40 соответственно.
Слайд 14 Многие фториды металлов в низких степенях окисления получают
действием раствора HF на оксиды, гидроксиды, карбонаты и пр.,
например:3НF + Аl(ОН)3 = АlF3 + 3H2О
Фториды неметаллов и металлов в высоких степенях окисления получают фторированием простых веществ или низших фторидов, например:
F2 + Cl2 = 2СlF; СlF + F2 = СlF3; СlF3 + F2 = СlF5
I2 + 7F2 = 2IF7
Стабильность фторидов возрастает с увеличением положительной степени окисления галогенов.
Согласно методу МО, трифториды характеризуются неравноценными связями Г-F: одной трехцентровой F-Г-F и одной двухцентровой Г-F.
(2- трехцентровых и 1-двухцентровых связей соответственно у пентафторида.)
Слайд 15 По химической природе ионные фториды являются основными соединениями,
а ковалентные фториды — кислотными. Так в реакции
2NаF + SiF4 = Nа2[SiF6]основный кислотный гексафторосиликат натрия
ионный NаF выступает в качестве донора, а ковалентный SiF4 — в качестве акцептора электронных пар, носителем которых является фторид-ион F-.
Слайд 16 Основные фториды при гидролизе создают щелочную среду, а
кислотные фториды — кислотную
NaF + H2O =
NaOH + HFSiF4 + 3Н2O = Н2SiО3 + 4НF
Амфотерные фториды взаимодействуют как с основными, так и с кислотными фторидами. В последнем случае образуются смешанные фториды, например:
2КF + ВеF2= К2[ВеF4]
(ВеF2 как кислотное соединение)
ВеF2 + SiF4 = Be[SiF6]
(ВеF2 как основное соединение)
Слайд 17
В неводных растворах PF5 взаимодействует с основными фторидами
KF + PF5 = KPF6
С
жидким HF образует НF + PF5 = HPF6 – гексафторофосфорная кислота (водный раствор – очень сильная кислота)
Слайд 18 Комплексные фториды весьма разнообразны. Координационное число по фтору
для элементов 2-го периода равно 4, для элементов других
периодов типичное координационное число 6. Кроме того, встречаются комплексные фториды, в которых координационное число комплексообразователя равно 7, 8 и 9, например:К2[ВеF4] К3[А1F6] К2[NbF7] К2[ReF9]
Эти же примеры показывают, что во фторокомплексах стабилизируется. высшая степень окисления центральных атомов.
Производные фторокомплексов представляют собой преимущественно ионые соединения либо относятся к смешанным (полимерным) фторидам (например, ВеSiF6).
Соединения с водородом типа НВF4, НРF6, Н2SiF6 в свободном состоянии неустойчивы. Их водные растворы — очень сильные кислоты (типа HClO4).
Слайд 19 Фтор со взрывом взаимодействует с водородом даже при
низких температурах и (в отличие от хлора) в темноте
с образование фтористого водородаH2 + F2 = 2HF↑
Обычно фтористый водород получают при нагревании действием серной кислоты на флюорит:
CaF2 + H2SO4 = CaSO4 + 2HF↑
Слайд 20 Молекула фторида водорода НF сильно полярна и имеет
большую склонность к ассоциации за счет водородных связей в
зигзагообразные цепи. Поэтому фторид водорода в обычных условиях — бесцветная жидкость (Тпл. -83 °С, Ткип. 19,5 оС) с резким запахом, сильно дымящая на воздухе. Даже в состоянии газа фторид водорода состоит из смеси полимеров Н2F2, Н3F3, Н4F4, Н5F5, Н6F6. Простые молекулы НF существуют лишь при температурах выше 90 °С. Вследствие высокой прочности связи (энергия диссоциации 565 кДж/моль) термический распад НF на атомы становится заметным выше 3500 oC.Слайд 21 Собственная ионизация жидкого НF незначительна (К = 2,07⋅10-11).
Она происходит путем перехода протона (или соответственно иона фтора)
от одной молекулы к другой, сопровождающегося превращением водородной связи из межмолекулярной в межатомную и в ковалентную. При этом образуются сольватированные фтороний-ион FH2+ и фторогидрогенат-ион НF2- по схемеН—F⋅⋅⋅Н—F⋅⋅⋅Н—F ↔ [H—F—H]+ + [F—Н—F]-
Слайд 22 Жидкий фторид водорода - сильный ионизирующий растворитель. В
нем хорошо растворяются вода, фториды, сульфаты и нитраты s-элементов
I группы, несколько хуже аналогичные соединения s-элементов II группы. При этом растворенные вещества, отнимая от молекул НF протоны, увеличивают концентрацию отрицательных ионов (HF2-), т. е. ведут себя как основания. Например:КNO3 + 2НF ↔ К+ + НNO3 + HF2-
Слайд 23 Даже НNО3 в этих условиях ведет себя как
основание:
НNО3 + 2НF ↔ NО3Н2+ + HF2-
индифферентный
в воде этиловый спирт в жидком фториде водорода оказывается таким же сильным основанием, как КОН в воде:С2Н5ОН + 2НF ↔ С2Н5OН2+ + HF2-
Слайд 24 В жидком НF ведут себя как кислоты вещества
— акцепторы фторид-ионов, например BF3, SbF5:
BF3 + 2НF = FH2+ + ВF4-SbF5 + 2НF = FH2+ + SbF6-
При растворении кислот увеличивается концентрация положительных фто-роний-ионов FH2+.
Слайд 25 Амфотерными соединениями в жидком НF являются, например, фториды
алюминия и хрома (III):
3NаF +
АIF3 = 3Nа+ + А1F63-(АIF3 как кислотное соединение)
АlF3 + 3ВF3 = А13+ + 3ВF4-
(АIF3 как основное соединение)
Слайд 26 HF неограниченно растворяется в воде. HF ионизируется с
образованием ионов OH3+ и F-.
Последние взаимодействуя с HF, образуют
фторогидрогенат-ионы: 2HF +Н2О = OH3+ +НF2-. Раствор НF (плавиковая кислота) (фтороводородная = фтористоводородная) является кислотой средней силы (К=6,2⋅10-4). В растворе содержатся также комплексные ионы Н2F3-, Н3F4-, НnFn+1-. Поэтому при нейтрализации растворов плавиковой кислоты образуются не фториды, а фторогидрогенаты типа К[НF2].
Слайд 27
При нейтрализации HF образуются фторогидрогенаты
2HF +
KOH = K[HF2] + H2O
КНF2, КH2F3, КH3F4, КH4F5 Тпл соответственно 239, 62, 66, 72 оС
Эти соединения, как правило, хорошо кристаллизуются и плавятся без разложения Полимерные гидрогенат-ионы имеют зигзагообразную форму. Они образованы за счет водородной связи.
Слайд 28 Термическое разложение фторогидрогенатов используется для получения чистого НF
и фторида металла:
KHF2 = KF + HFК [НnFn+1] = К [Нn-1Fn] + НF
Слайд 29 Характерная особенность плавиковой кислоты (фтористоводородной = фтороводородной) ее
способность взаимодействовать с диоксидом кремния:
SiO2 (к)
+ 4НF (р) = SiF4 (г) + 2Н2O (ж)SiF4 (г) + 2НF (р) = H2SiF6 (р)
Поэтому ее обычно хранят в сосудах из свинца, каучука, полиэтилена или парафина, а не в стеклянной посуде. Она токсична, при попадании на кожу вызывает плохо заживающие болезненные язвы.
Плавиковая кислота применяется для травления стекла, удаления песка с металлического литья, получения фторидов и т. д. Фторид водорода в основном используется в органическом синтезе.
Слайд 30 В соединениях со фтором у кислорода проявляется электроположительная
поляризация атомов.
Простейший представитель такого рода соединений — дифторид
кислорода ОF2: его получают при быстром пропускании фтора через охлажденный 2%-ный раствор щелочи: 2F2 + 2NaOH = OF2 + 2NaF + H2O.
ОF2 в воде малорастворим и с ней не взаимодей-ствует. Он смешивается (не реагируя) с Н2, СН4 или СО. При пропускании через такую смесь искры происходит сильный взрыв. Смеси ОF2 с Cl2, Br2 и I2 взрываются при комнатной температуре. ОF2 выделяет остальные галогениды из их кислот и солей:
ОF2 +4НX (ag) = 2X2 + 2HF + H2O.
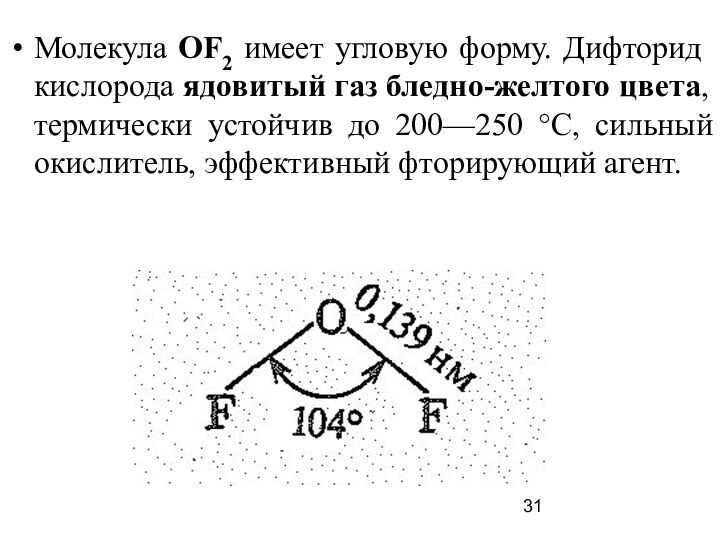
Слайд 31 Молекула ОF2 имеет угловую форму. Дифторид кислорода ядовитый
газ бледно-желтого цвета, термически устойчив до 200—250 °С, сильный
окислитель, эффективный фторирующий агент.Слайд 32 ОF2 довольно легко гидролизуется основаниями, водой
– гораздо медленнее:
OF2 + 2NaOH = 2NaF +
O2 + H2O. Но с горячим паром происходит взрыв:
ОF2 + Н2О = О2 + 2HF.
Молекула О2F2 образуется (в виде красной летучей жидкости) в результате непосредственного взаимодействия простых веществ в электрическом разряде или под действием ионизирующих излучений при температуре жидкого воздуха (—190 °С). (Разлагается при – 57 оС). Оранжево-желтый газ при н.у. Диамагнитна (все электроны спарены). В диоксидифториде О2F2 радикал О22+ ковалентно связан с атомами фтора.





























