Слайд 2
Цель: Обобщить и систематизировать знания учащихся о составе,
строении и свойствах классов неорганических соединений
Задачи:
Обучающие:
закрепить знания учащихся
о классификации основных классов неорганических соединений и умения давать названия веществам.
Развивающие:
развивать “химическую” зоркость уч-ся, находить логические связи между названием вещества и его химической формулой.
Воспитательные:
воспитывать у учащихся чувство взаимопомощи, умения работать в коллективе.
Здоровьесберегающие:
соблюдать правила техники безопасности на уроке при проведении эксперимента; добиваться оптимальной работоспособности в течение всего урока, за счет смены видов деятельности; создавать благоприятный психологический климат на уроке.
Слайд 3
Загадка 1.
Два элемента в них всего-
Кислород
важней всего.
Слайд 4
1. Известно ли вам, дети, какие есть оксиды
на планете? У оксидов пристрастия разные:
то кислоты им
нравятся праздные, то к воде их душа склоняется — скажите, как они называются?
2. А эти спешат к основаниям, растворимые, очень желанные, но с водой дружбу водят не все, ж, поверь.
Назовите оксиды теперь.
3. Бывает двойственный оксид, он, позабыв и честь, и стыд, то к сильной кислоте спешит, то где-то щелочь сторожит, и тем и другим поклоняется. Как такой оксид называется?
Слайд 5
Оксид
10 баллов. Найти оксиды и распределить их по
группам. Дать названия.
А1(0Н)3, СО2, Mn2O7, HNO3, H2Si03, Na2HPO4, Mg(OH)2,
CaCO3, RbOH, CuO, HBr, FeO, CsOH, Ca(OH)Cl, H2SO3, K2NaPO4, A1(OH)2C1, NaHCO3, KC1, N2O5, H3PO4, H2SO4, H2S
Слайд 6
Оксид
20 баллов. Вопрос: Соотнесите название и степень окисления
атома химического элемента 1) железо +3; 2) хлор -1;
3) сера +6 и формулы соединений а) SO2; б) FeO; в) SO3; г) HCl; д) Fe2O3; е) Cl2O7
Слайд 7
Оксид
30 баллов. Вопрос: кварцевый песок, кремнезём, горный хрусталь,
агат, опал, яшма, глина. Что объединяет все эти вещества?
Слайд 8
Загадка 2.
Группы атомов о-аш -
Очень важный признак наш,
«Фенолфталеиновый» в нас
Становится малиновым.
Слайд 9
Основание
10 баллов Найти основания и распределите их по
группам. Дать названия.
А1(0Н)3, СО2, Mn2O7, HNO3, H2Si03, Na2HPO4, Mg(OH)2,
CaCO3, RbOH, CuO, HBr, FeO, CsOH, Ca(OH)Cl, H2SO3, K2NaPO4, A1(OH)2C1, NaHCO3, KC1, N2O5, H3PO4, H2SO4, H2S
Слайд 10
Основание
20 баллов. «Третий лишний». Найдите лишнее в каждом
ряду.
1)LiOH, Cu(OH)2, Ba(OH)2
2) Fe(OH)3, Zn(OH)2, NaOH
3) Al(OH)3,
Fe(OH)3, KOH.
Объясните результаты
Слайд 11
Основание
Практическое задание (30 баллов)
Изучим свойства оснований поскорей. Начнем
эксперимент со щелочей. Сольем сначала щелочь с кислотой, из
них получим только соль с водой.
Провести реакцию нейтрализации едкого натрия с серной кислотой и записать уравнение реакции в тетрадях.
А если с солью щелочь взять, получатся другая соль и основание опять.
Теперь возьмем оксид кислотный
И растворимый гидроксид,
И под водой на дне стакана —
Очередная соль лежит.
Выполнить эксперимент. Получить углекислый газ и пропустить через него раствор гидроксида кальция. Взять любой нерастворимый гидроксид, который с кислотой любезничать спешит, а в результате — соль с водою.
Слайд 13
Загадка 3.
Водород в состав их входит,
За собой остаток водит,
Они
кислые на вкус Их ……………. зовут.
Слайд 14
Кислота
10 баллов. Найти основания и распределите их на
группы. Дать названия.
А1(0Н)3, СО2, Mn2O7, HNO3, H2Si03, Na2HPO4, Mg(OH)2,
CaCO3, RbOH, CuO, HBr, FeO, CsOH, Ca(OH)Cl, H2SO3, K2NaPO4, A1(OH)2C1, NaHCO3, KC1, N2O5, H3PO4, H2SO4, H2S
Слайд 15
Кислота
20 баллов. Вопрос: соотнесите формулу кислоты 1) H2SO4,
2) HNO3, 3) H2CO3 и оксида химического элемента, соответствующего
кислоте а) CO, б) SO2, в) SO3, г) N2O5, д) CO2, е) N2O3. Объясните результаты.
Слайд 16
Кислота
Записать уравнения реакции.(30 баллов)
Кислота, кроме азотной,
И металл
до водорода,
Образуют соль охотно
И, конечно, водород.
Кислота
и основание
Образуют соль и воду.
Именно вот это свойство
Взяли все кислоты в моду.
В кислоту внесешь оксид ты
Настоящего металла,
Без сомненья, соль и воду
Ты получишь, если надо.
Слайд 17
Загадка 4.
Металл и кислотный остаток
В них
дружно живут,
Эти вещества ……..зовут.
Слайд 18
Соль
10 баллов. Найти основания и распределите их на
группы. Дать названия.
А1(0Н)3, СО2, Mn2O7, HNO3, H2Si03, Na2HPO4, Mg(OH)2,
CaCO3, RbOH, CuO, HBr, FeO, CsOH, Ca(OH)Cl, H2SO3, K2NaPO4, A1(OH)2C1, NaHCO3, KC1, N2O5, H3PO4, H2SO4, H2S
Слайд 19
Соль
20 баллов. Вопрос: Найдите потерявшихся родственников: KNO3, MnCl2,
Ca3(PO4)2, AlCl3, CaCO3, Fe(NO3)3, Na3PO4, K2CO3. Ответ поясните.
Слайд 20
Соль
30 баллов. Реши задачу:
При взаимодействии 5г оксида кальция
с оксидом углерода (IV) была получена соль. Какова масса
полученной соли?
Слайд 21
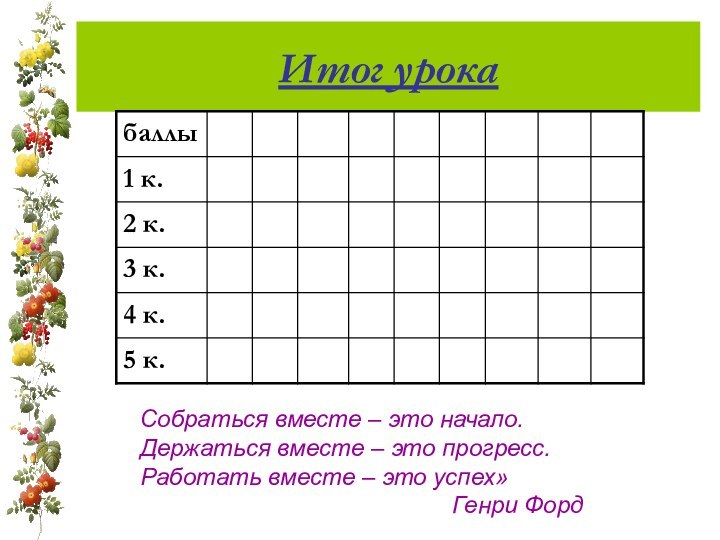
Итог урока
Собраться вместе – это начало.
Держаться вместе
– это прогресс.
Работать вместе – это успех»
Генри Форд
Слайд 22
Домашние задание:
повторить тему:
«Основные классы неорганических веществ».
Письменно:
из перечисленных ниже веществ выпишите формулы тех, между
которыми существует генетическая связь. Составьте цепочку
превращений и запишите уравнения реакций.
1 вариант. Na, BaSО4, SO2, Ba, КCI, PbO, ZnSO4,
Ba(OH)2, CO2, BaO.
2 вариант. NaNO3, P 2O5, PbCI2, H 2SO4, K 3PO4,
CuO, H 3PO4, Fe, CaO, P.
Слайд 23
Рефлексия
Понравился ли вам урок?
Какие трудности вы
испытали?
Каковы ваши пожелания учителю и друг другу?
Поднимите руки,
если вы с этим утверждением согласны:
1-мне было комфортно на уроке;
2-я получил ответы на все интересующие меня вопросы
Слайд 24
Ну что ж? Закончился урок.
Пускай пойдёт он нам
всем впрок.
Посев научный же на почве плодородной
Всегда взойдёт для
жатвы всенародной.