- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Бета-лактамиды (природные и полусинтетические пенициллины и цефалоспорины)
Содержание
- 2. Цель лекции: Изучить физико-химические и фармакологические
- 3. План лекции: План излагаемой лекции соответствует всем разделам фармакопейной статьи.
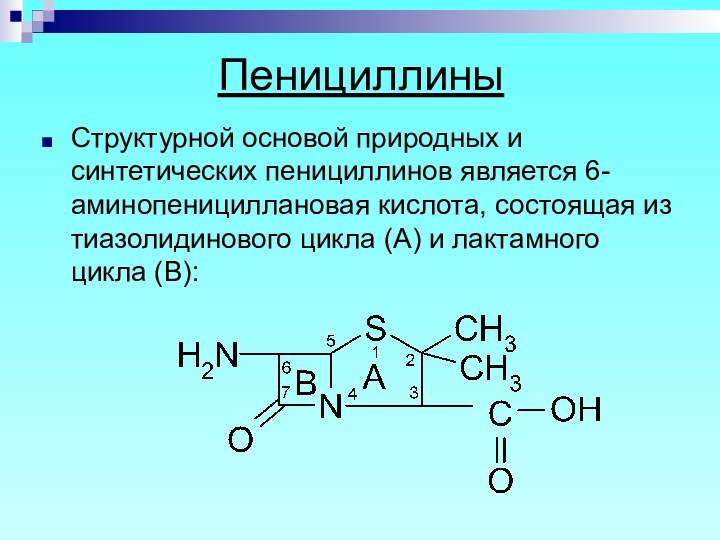
- 4. Пенициллины Структурной основой природных и синтетических пенициллинов
- 5. Специфическая биологическая активность обусловлена наличием тиазолидинового и
- 6. Для выделения и очистки пенициллинов используют хроматографию,
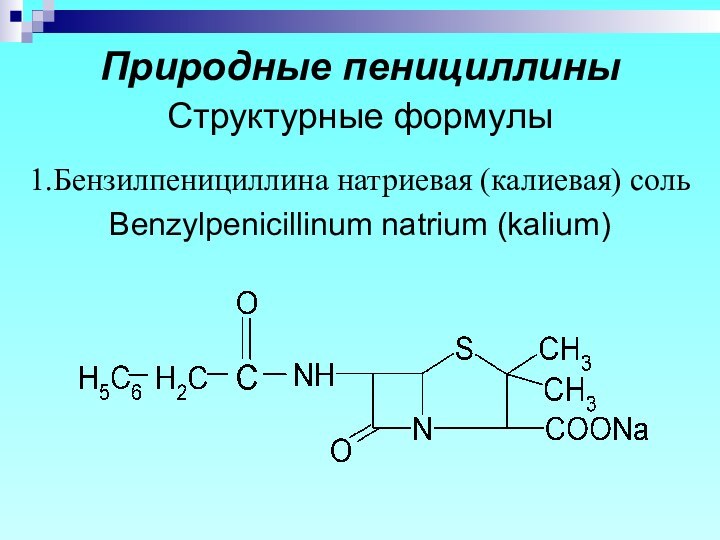
- 7. Природные пенициллины Структурные формулы 1.Бензилпенициллина натриевая (калиевая) соль Benzylpenicillinum natrium (kalium)
- 8. 2.Бензилпенициллина новокаиновая соль Benzylpenicillinum novocainum
- 9. 3.Бензатин-бензилпенициллин Benzathinum BenzylpenicillinumN,N’ - дибензилэтилендиаминовая соль бензилпенициллина
- 10. 4.Феноксиметилпенициллин Phenoxymethylpenicillinum
- 11. Полусинтетические пенициллины 1.Ампициллина тригидрат Ampicillinum trihydratumα-аминобензилпенициллин
- 12. 2.Оксациллина натриевая соль Oxacillinum natriumнатриевой соли 3-фенил-5-метил-4-изоксазолилпенициллина моногидрат
- 13. 3.Карбенициллина динатриевая соль Carbenicillinum dinatriumдинатриевая соль 6-(α-карбокси фенилацетамидо)пенициллановой кислоты
- 14. 4.Амоксициллин Amoxicillinum trihydratumα-амино-п-оксибензилпенициллин
- 15. Физические свойства Препараты – белые кристаллические порошки,
- 16. Растворимость пенициллинов
- 17. Растворимость пенициллинов
- 18. Определение подлинности 1. УФ – спектроскопия:
- 19. Определение подлинности 2. ИК - спектроскопия
- 20. Общие реакции для группы β - лактамидов
- 21. Cu2+Зеленый осадок
- 22. C FeCl3 – образуется комплексная соль красного цвета
- 23. Обнаружение азотистого основания а) с насыщенным
- 24. Проба Лассеня для обнаружения N и SПрепарат
- 25. Окислительная минерализация а) сплавление со щелочью с
- 26. Реакция на СООН – группу:образование комплексных солей
- 27. ампициллин – желтое окрашивание;бензилпенициллин (Na, K) – желтый осадок;феноксиметилпенициллин – желто-зеленый осадок.
- 28. Взаимодействие с реактивом Марки (формальдегид в концентрированной
- 29. Взаимодействие с реактивом Марки (формальдегид в концентрированной
- 30. Частные реакции1. Бензилпенициллина Na и K солиОсаждение
- 31. HClHClгидролитическоерасщепление,изомеризация
- 32. Пенилловая кислотаHCl
- 33. Обнаружение катионов Na и K1) окраска
- 34. Реакция Витали-Морена:Препарат выпаривают в смеси с дымящей
- 35. Выделение фенилуксусной кислоты после кипячения в 4% NaOH и последующего добавления избытка разбавленной H2SO4 (по запаху)
- 36. 2. Бензилпенициллина новокаиновая соль: На новокаин – образование азокрасителя с β-нафтоломNaOHHCl β-нафтолNaNO2
- 37. 3. Бициллин-I (бензатин-бензилпенициллин): Обнаружение N,N –
- 38. Окислительное разложение:Препарат + NaOH + KMnO4 –
- 39. 4. Ампициллина тригидрат:с реактивом Фелинга – красно-фиолетовое
- 40. 5. Карбенициллина натриевая соль:реакция декарбоксилирования:
- 41. 6. АмоксициллинАмоксициллин имеет свободный фенольный гидроксил и реагирует с реактивом Миллона:(р-р HNO3,содержащий NO2,NO3,Hg+2,Hg+)Hg2+HNO2
- 42. Чистота:кислотность или щелочность (рН = 5,5; 7,5);потеря
- 43. Чистота:светопоглощающие примеси;йодсорбирующие примеси не более 6% (обратная
- 44. Устойчивость бензилпенициллина устойчив на холоду только в
- 45. Гидролиз и разложение:В щелочной среде: пенициллоиновая кислотапениллоиновая кислота-CO2
- 46. В кислой среде:Пенициллоиновая кислота разлагается до: +пенальдиновая кислотапеницилламин
- 47. В сильно кислых растворах рН
- 48. пениллоиновая кислотапенилловая кислота-CO2-H2O
- 49. Количественное определение Состоит из двух этапов: определение
- 50. H+пенициламинпенальдиновая кислота+динатриевая соль пенициллоиновой кислотыNaOH
- 51. пенальдиновая кислотапенициламинпенициламиновая кислотаИзбыток J2 оттитровывают тиосульфатом натрия Na2S2O3 +I22 HI+6 HI3 I2
- 52. 2. Меркуриметрический метод после последовательного щелочного и кислотного гидролиза титруют Hg(NO3)2Точка эквивалентности регистрируется потенциометрическиНД (амоксициллин) Hg(NO3)2Hg(NO3)2
- 53. определяют Na, K, новокаиновую солиБензилпенициллин извлекают амилацетатом и осаждают в виде N-этилпиперидиновой соли.3. Гравиметрический метод
- 54. В новокаиновой соли бензилпенициллина новокаин
- 55. Определение бензатина после извлечения эфиром методом неводного
- 56. Na - соль оксациллина, динатриевую соль карбенициллина
- 57. Спектрофотометрический метод (ФС, МФ)а) Феноксиметилпенициллин в NaOH
- 58. Активность пенициллинов – метод диффузии в агар1 ЕД = 0,5988 мкг химически чистой Na-соли бензилпенициллина
- 59. Применение: антибактериальные препараты.Совместимость: пенициллины нельзя объединять с
- 60. Фармакокинетика: выводятся с мочой 90% в неизменном
- 61. Цефалоспорины Структурная основа – конденсированная система, состоящая изß – лактамного кольца и дигидротиазинового цикла
- 62. Цефалоспорины являются производными 7-аминоцефалоспорановой кислоты и 7-аминодезацетоксицефалоспорановой кислоты.
- 63. Получение:природный цефалоспорин С – продукт жизнедеятельности плесневого
- 64. Из пенициллинов с помощью химической трансформации можно получить 7 –аминодезацетоксицефалоспорановую кислоту.[O] 7АДЦК
- 65. Цефалексин (кефлекс) Cefalexinum7(α-D-фенилглициламин) –3-метил-3-цефем-4 карбоновая кислота
- 66. Цефалотина натриевая соль Cefalotinum natriumНатриевая соль –7-(тиенилацетамидо) цефалоспорановой кислоты
- 67. Описание: белые кристаллические порошки, практически не растворимы
- 68. Идентификация1.Спектрофотометрия в УФ и ИК областях. λ = 260 нм, 4000-400 см-1, ЯМР.2.ТСХ.3.Удельное вращение.
- 69. 4. Гидроксамовая пробаCu(NO3)2 NH2OHOH-
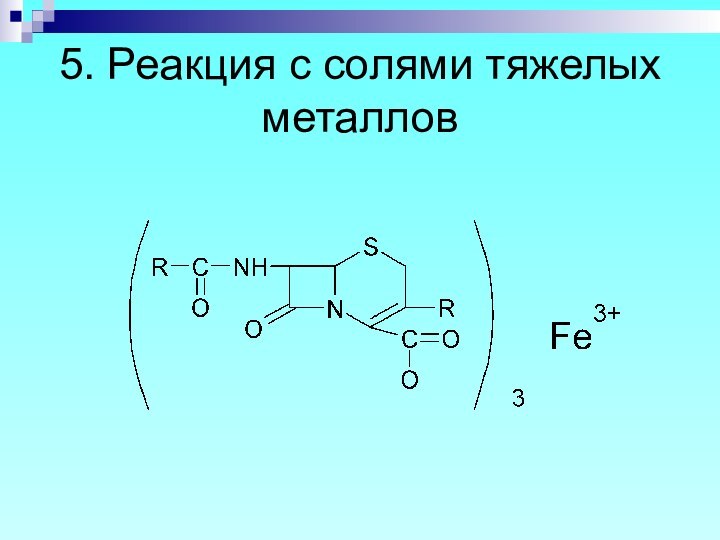
- 70. 5. Реакция с солями тяжелых металлов
- 71. 6. Цефалексин - на аминокислоту: нингидриновая проба
- 72. Чистота:примеси – ВЭЖХ; наличие специфических примесей – ГЖХ.
- 73. Количественное определение:1. Обратная йодометрия: 1 эквивалент цефалоспорина
- 75. Хранение: в хорошо укупоренной таре.Применение: антибактериальные (грамположительные и грамотрицательные микроорганизмы).
- 76. Стабильность:В сильнокислой среде – гидролиз 3 –ацетоксиметильной группы.
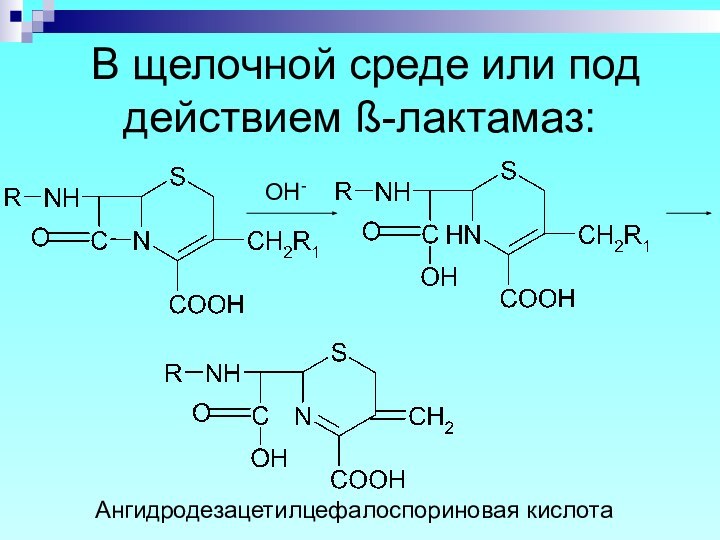
- 77. В щелочной среде или под действием ß-лактамаз:OH- Ангидродезацетилцефалоспориновая кислота
- 78. Ингибиторы ß- лактамаз.Пенициллины и цефалоспорины ингибируются ß-лактамазами,
- 79. Выделяется определенными штаммами микроорганизмов, обладает слабой антибактериальной
- 80. Калиевая соль клавулановой кислоты.3-(2-оксилиден)-7-оксо-4-окса-1-азобицикло [3.2.0] гептан-2 карбоксилат калия
- 81. Описание: белый кристаллический порошок, гигроскопичен, легко растворим
- 82. Идентификация: ИК-спектроскопия; ВЭЖХ; реакция на К+.
- 83. Испытание на чистоту и количественное определение проводят
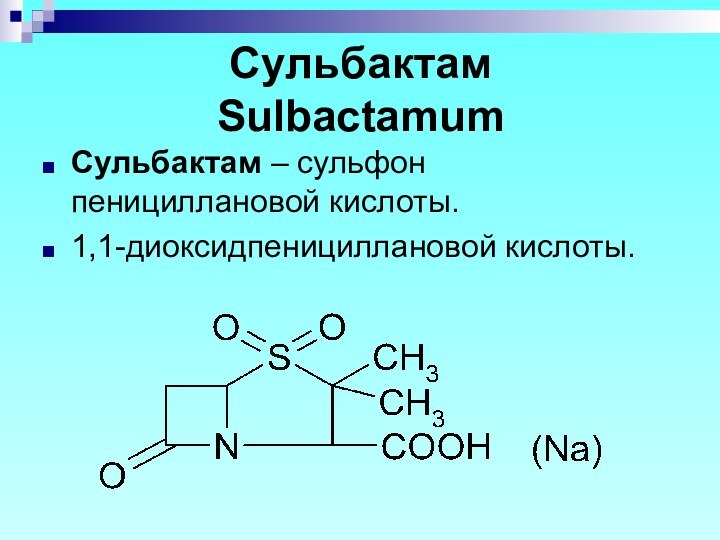
- 84. Сульбактам Sulbactamum Сульбактам – сульфон пенициллановой кислоты. 1,1-диоксидпенициллановой кислоты.
- 85. Описание: белый кристаллический порошок, хорошо растворим в
- 86. Анализ аналогичен пенициллинамИдентификация:1. ТСХ2. Обнаружение Na+Чистота:ВЭЖХ, прозрачность, цветность
- 87. Количественное определение1. Спектрофотометрия2. ВЭЖХХранениев сухом, защищённом от света месте
- 88. Уназин UnasynУназин состоит из ампициллина натрия и сульбактама натрия (2:1).
- 89. Скачать презентацию
- 90. Похожие презентации
Цель лекции: Изучить физико-химические и фармакологические свойства, методы оценки качества лекарственных средств указанной группы во взаимосвязи со структурой.

























































![Бета-лактамиды (природные и полусинтетические пенициллины и цефалоспорины) Из пенициллинов с помощью химической трансформации можно получить 7 –аминодезацетоксицефалоспорановую кислоту.[O] 7АДЦК](/img/tmb/12/1119682/782e8d2b0b8ea5d26b2e01e479419118-720x.jpg)













![Бета-лактамиды (природные и полусинтетические пенициллины и цефалоспорины) Калиевая соль клавулановой кислоты.3-(2-оксилиден)-7-оксо-4-окса-1-азобицикло [3.2.0] гептан-2 карбоксилат калия](/img/tmb/12/1119682/b23734cc30b7d66ca7b095e1a0628b33-720x.jpg)








Слайд 4
Пенициллины
Структурной основой природных и синтетических пенициллинов является
6-аминопенициллановая кислота, состоящая из тиазолидинового цикла (А) и лактамного
цикла (В):
Слайд 5 Специфическая биологическая активность обусловлена наличием тиазолидинового и лактамного
колец, а также заместителем в 6-ом положении.
Биосинтез природных пенициллинов
осуществляется отобранными промышленными штаммами плесени, инкубированными в питательной среде, содержащей аминокислоты, углеводы, жиры и обязательно предшественников для формирования радикала в 6-ом положении.Слайд 6 Для выделения и очистки пенициллинов используют хроматографию, ионообменную
сорбцию.
Природные пенициллины имеют серьезный недостаток – они легко разрушаются
под действием фермента пенициллиназы (β-лактамазы). Это послужило предпосылкой для синтеза полусинтетических пенициллинов на основе 6-амино-пенициллановой кислоты (6-АПК), которую чаще всего ацилируют по аминогруппе в 6-ом положении.
Слайд 7
Природные пенициллины
Структурные формулы
1.Бензилпенициллина натриевая (калиевая) соль
Benzylpenicillinum
natrium (kalium)
Слайд 9
3.Бензатин-бензилпенициллин
Benzathinum Benzylpenicillinum
N,N’ - дибензилэтилендиаминовая соль бензилпенициллина
Слайд 11
Полусинтетические пенициллины
1.Ампициллина тригидрат
Ampicillinum trihydratum
α-аминобензилпенициллин
Слайд 12
2.Оксациллина натриевая соль
Oxacillinum natrium
натриевой соли 3-фенил-5-метил-4-изоксазолилпенициллина моногидрат
Слайд 13
3.Карбенициллина динатриевая соль
Carbenicillinum dinatrium
динатриевая соль 6-(α-карбокси фенилацетамидо)пенициллановой кислоты
Слайд 15
Физические свойства
Препараты – белые кристаллические порошки, без
запаха. Натриевые и калиевые соли слегка гигроскопичны, карбенициллина динатриевая
соль – гигроскопична.
Слайд 18
Определение подлинности
1. УФ – спектроскопия:
соли бензилпенициллина λ = 280-286 нм. феноксиметилпенициллин λmax= 268-274 нм, λmin = 272 нм; ампициллин λmax = 256, 261, 267, λmin = 255, 260, 266 нм
Слайд 20
Общие реакции для группы β - лактамидов
Разрыв β–лактамного кольца – образование медной соли гидроксамовой
кислоты – осадок зеленого цвета.NH2OH
NaOH
Слайд 23
Обнаружение азотистого основания
а) с насыщенным раствором
йода – коричневый осадок;
б) с реактивом Майера – белый осадок.
Слайд 24
Проба Лассеня для обнаружения N и S
Препарат прокаливают
с солями Na, фильтруют:
а) к части фильтрата добавляют FeSO4,
затем при подкислении приливают FeCl3. Образуется синий осадок – берлинская лазурь. 6NaCN + FeSO4 → Na4[Fe(CN)6] + Na2SO4;
3Na4[Fe(CN)6] + 4FeCl3 → Fe4[Fe(CN)6]3 + 12NaCl
б) часть фильтрата нагревают с соляной кислотой, образуется H2S, который обнаруживается по почернению бумаги пропитанной Pb(CH3COO)2.
Слайд 25
Окислительная минерализация
а) сплавление со щелочью с образованием
S2- иона:
S2- + Pb2+ → PbS
или с нитропруссидом Na – красно-фиолетовое окрашивание Na4[Fe(CN)5NOS]б) минерализация в концентрированной азотной кислоте (HNO3) до сульфат – иона:
SO42- + Ba2+ → BaSO4 ↓
Слайд 27
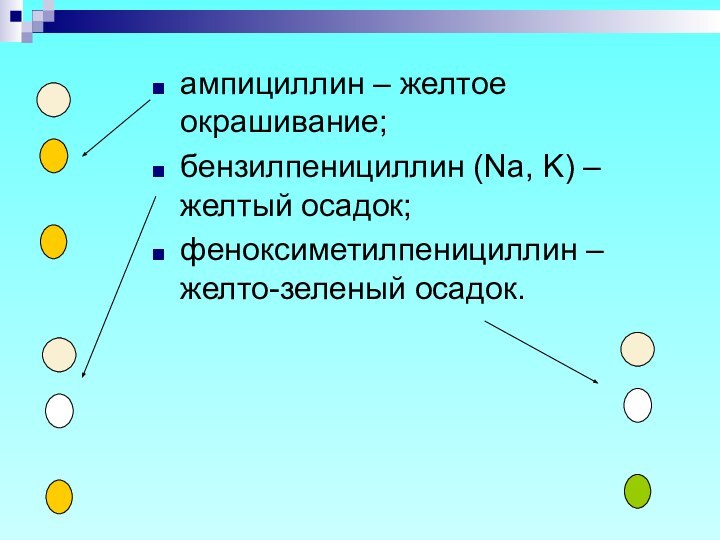
ампициллин – желтое окрашивание;
бензилпенициллин (Na, K) – желтый
осадок;
феноксиметилпенициллин – желто-зеленый осадок.
Слайд 28 Взаимодействие с реактивом Марки (формальдегид в концентрированной серной
кислоте).
Феноксиметилпенициллин + р-в Марки - красно-коричневое окрашивание (ауриновый краситель).
Реакция
идет без нагревания только для феноксиметилпенициллина.H+
Препарат
гидролиз
H+
гидролиз
феноксиуксусная кислота
+
Слайд 29 Взаимодействие с реактивом Марки (формальдегид в концентрированной серной
кислоте).
Соли бензилпенициллина + р-в Марки - красно-коричневое окрашивание
Ампициллин +
р-в Марки - темно-желтое окрашиваниеАмоксициллин + р-в Марки - темно-желтое окрашивание
Слайд 30
Частные реакции
1. Бензилпенициллина Na и K соли
Осаждение свободной
кислоты при добавлении соляной кислоты – белый осадок, растворимый
в избытке кислоты.
Слайд 33
Обнаружение катионов
Na и K
1) окраска пламени
2) с
кобальтинитритом Na на К+ - оранжево-желтый
осадок.
Слайд 34
Реакция Витали-Морена:
Препарат выпаривают в смеси с дымящей HNO3,
а затем прибавляют спиртовый раствор KOH и ацетон –
фиолетовое окрашивание.Слайд 35 Выделение фенилуксусной кислоты после кипячения в 4% NaOH
и последующего добавления избытка разбавленной H2SO4 (по запаху)
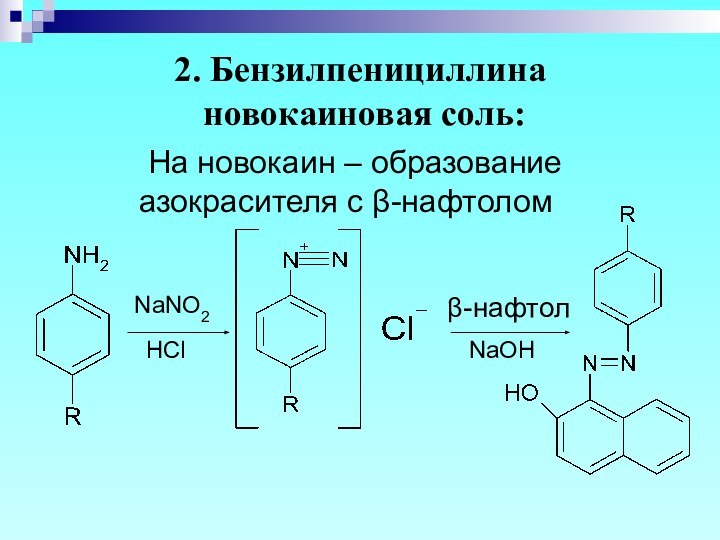
Слайд 36
2. Бензилпенициллина
новокаиновая соль:
На новокаин – образование
азокрасителя с β-нафтолом
NaOH
HCl
β-нафтол
NaNO2
Слайд 37
3. Бициллин-I (бензатин-бензилпенициллин):
Обнаружение N,N – дибензилэтилендиамина.
После добавления NaOH и извлечения эфиром реакция с
пикриновой кислотой – желтые кристаллы.Определяют tпл
Слайд 38
Окислительное разложение:
Препарат + NaOH + KMnO4 –
зеленое окрашивание
При нагревании появляется запах бензальдегида.
Действуют K2Cr2O7 и ледяной
CH3COOH – образуется золотисто-желтый осадок
Слайд 39
4. Ампициллина тригидрат:
с реактивом Фелинга – красно-фиолетовое окрашивание
(образование медных комплексов).
нагревание с нингидрином – вишневое окрашивание за
счет фениламиноуксусной кислоты.
Слайд 40
5. Карбенициллина натриевая соль:
реакция декарбоксилирования:
добавляют
Na2CO3 и фенолфталеин – розовое окрашивание, нагревают - окраска
фенолфталеина исчезает.
Слайд 41
6. Амоксициллин
Амоксициллин имеет свободный фенольный гидроксил и реагирует
с реактивом Миллона:
(р-р HNO3,содержащий NO2,NO3,Hg+2,Hg+)
Hg2+
HNO2
Слайд 42
Чистота:
кислотность или щелочность (рН = 5,5; 7,5);
потеря в
массе при высушивании;
испытания на токсичность, пирогенность, стерильность;
термостабильность – при
нагревании препарата до 1,5 часов при 1700С допускается снижение содержания суммы пенициллинов не более 10%;
Слайд 43
Чистота:
светопоглощающие примеси;
йодсорбирующие примеси не более 6% (обратная йодметрия);
остаточные
растворители - ГЖХ;
триметиламин, диметиланилин (ампициллин) – ГЖХ;
феноксиуксусная кислота (феноксиметилпенициллин)
- ВЭЖХ.
Слайд 44
Устойчивость бензилпенициллина
устойчив на холоду только в сухом
состоянии, при повышенной температуре в присутствии влаги, следов тяжелых
металлов в кислой и щелочной среде разлагается. Производные полиэтиленгиколя, ПАВ и других вспомогательные вещества снижают устойчивость. Наиболее устойчив при рН 6,0-7,0.Слайд 47 В сильно кислых растворах рН
к-та + пенициламин
H+
H2O
-CO2
пенициллоальдегид
пеницилленовая кислота
Слайд 49
Количественное определение
Состоит из двух этапов: определение суммы пенициллинов
и определение соответствующего препарата.
1. Обратная йодометрия (ГФХ)
продукты
последовательного щелочного, а затем кислотного гидролиза окисляют избытком стандартного раствора йода J2 при рН 4,5
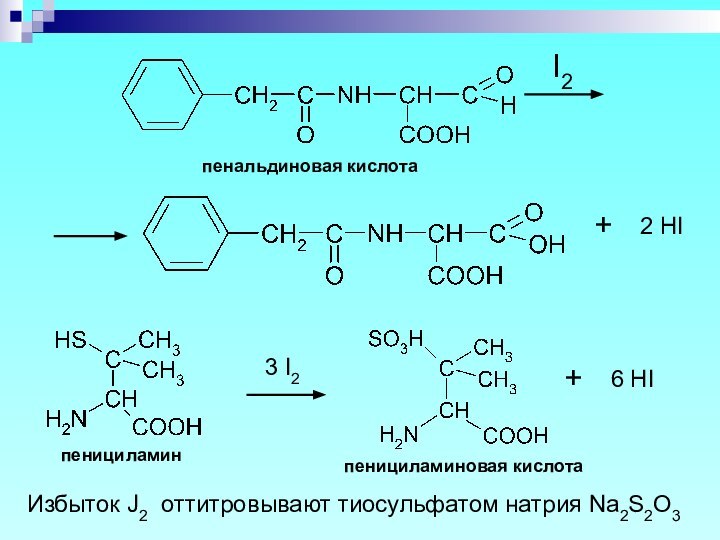
Слайд 51
пенальдиновая кислота
пенициламин
пенициламиновая кислота
Избыток J2 оттитровывают тиосульфатом натрия Na2S2O3
+
I2
2 HI
+
6 HI
3 I2
Слайд 52 2. Меркуриметрический метод после последовательного щелочного и кислотного гидролиза
титруют Hg(NO3)2
Точка эквивалентности регистрируется потенциометрически
НД (амоксициллин)
Hg(NO3)2
Hg(NO3)2
Слайд 53
определяют Na, K, новокаиновую соли
Бензилпенициллин извлекают амилацетатом и
осаждают в виде N-этилпиперидиновой соли.
3. Гравиметрический метод
Слайд 54 В новокаиновой соли бензилпенициллина новокаин определяют
обратной нейтрализацией. Новокаин извлекают хлороформом и титруют серной кислотой,
избыток которой оттитровывают NaOH. (МФ)Na2SO4 + 2H2O
H2SO4 + 2NaOH
H2SO4
Или СФ в водно-метанольном растворе при λ 290 нм
Слайд 55
Определение бензатина после извлечения эфиром методом неводного титрования
2HClO4
СH3COOH
Растворитель – ледяная уксусная
кислота, индикатор – 1-нафтолбензеинСлайд 56 Na - соль оксациллина, динатриевую соль карбенициллина определяют
методом обратной нейтрализации
NaOH
изб. NaOH + HCl → NaCl +
H2Oиндикатор - фенолфталеин
Слайд 57
Спектрофотометрический метод (ФС, МФ)
а) Феноксиметилпенициллин в NaOH при
λ 269 нм
б) МФ – (препарат взаимодействует с раствором
имидазола и HgCl2 – образуется соль пеницилленовой кислоты R-S-HgCl) λ=325 нмФЭК
Слайд 58
Активность пенициллинов – метод диффузии в агар
1 ЕД
= 0,5988 мкг химически чистой Na-соли бензилпенициллина
Слайд 59
Применение: антибактериальные препараты.
Совместимость: пенициллины нельзя объединять с аминогликозидами
в одном шприце, т.к. образующиеся пенициллоиновые кислоты дают соли
с основными аминогликозидамиХранение: в сухом месте при комнатной температуре, флаконы.
Слайд 60 Фармакокинетика: выводятся с мочой 90% в неизменном виде,
остальное в виде неактивных продуктов: пенициллоиновая кислота и диметилцистеин.
Феноксиметилпенициллин:
30-35% превращается в п-оксифеноксиметилпенициллин, в большей степени связывается с белками.
Слайд 61
Цефалоспорины
Структурная основа – конденсированная система, состоящая из
ß
– лактамного кольца и дигидротиазинового цикла
Слайд 62
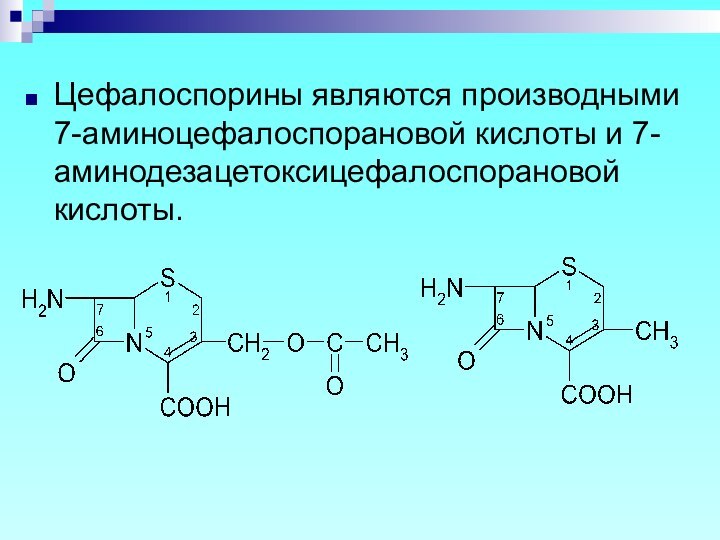
Цефалоспорины являются производными 7-аминоцефалоспорановой кислоты и 7-аминодезацетоксицефалоспорановой кислоты.
Слайд 63
Получение:
природный цефалоспорин С – продукт жизнедеятельности плесневого гриба
Cephalosporium salmosynnematum. Цефалоспорин С – токсичен и малоэффективен и
является источником получения полусинтетических цефалоспоринов, а именно 7- аминоцефалоспорановой кислоты.Слайд 64 Из пенициллинов с помощью химической трансформации можно получить
7 –аминодезацетоксицефалоспорановую кислоту.
[O]
7АДЦК
Слайд 65
Цефалексин (кефлекс)
Cefalexinum
7(α-D-фенилглициламин) –3-метил-3-цефем-4 карбоновая кислота
Слайд 66
Цефалотина натриевая соль
Cefalotinum natrium
Натриевая соль –7-(тиенилацетамидо) цефалоспорановой кислоты
Слайд 67 Описание: белые кристаллические порошки, практически не растворимы в
хлороформе и эфире. Цефалотина натриевая соль – легко растворима
в воде, мало растворим в этаноле. Цефалотин – трудно растворим в воде, практически не растворим в этаноле. Цефалексин – амфотерен (-NH2, -СООН).
Слайд 68
Идентификация
1.Спектрофотометрия в УФ и ИК областях.
λ
= 260 нм, 4000-400 см-1, ЯМР.
2.ТСХ.
3.Удельное вращение.
Слайд 71 6. Цефалексин - на аминокислоту: нингидриновая проба и
реакция комплексообразования с ионами Cu2+ в среде уксусной кислоты
- после прибавления гидроксида натрия образуется оливково-зеленое окрашивание.7. С реактивом Марки.
8. Со смесью 80% H2SO4 и 1% HNO3:
цефалексин – желтое окрашивание;
цефалотина натриевая соль – оливково-зеленое окрашивание.
9. Реакция на Na+.
10. Реакция на органически связанную S.
Слайд 73
Количественное определение:
1. Обратная йодометрия: 1 эквивалент цефалоспорина требует
4 эквивалента J2.
2. Меркуриметрия.
3. Цефалоспорин – неводное титрование:
растворитель –
смесь муравьиной и ледяной уксусной кислот и ацетона;титрант – диоксановый раствор HClO4;
точка эквивалентности регистрируется потенциометрически.
4. СФМ.
5. ВЭЖХ.
Слайд 75
Хранение: в хорошо укупоренной таре.
Применение: антибактериальные (грамположительные и
грамотрицательные микроорганизмы).
Слайд 78
Ингибиторы ß- лактамаз.
Пенициллины и цефалоспорины ингибируются ß-лактамазами, для
увеличения их активности используют ингибиторы ß-лактамаз: клавулановую кислоту и
сульбактам.