- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Хронические миелопролиферативные заболевания
Содержание
- 2. Хронические миелопролиферативные заболевания группа заболеваний,
- 3. Для группы хронических миелопролиферативных заболеваний характерны следующие
- 5. Классификация хронических миелопролиферативных заболеваний ( ВОЗ, 2001)Хронический
- 6. Классификация хронических миелопролиферативных заболеваний с миелодисплазией, ВОЗ,
- 7. ХРОНИЧЕСКИЙ МИЕЛОЛЕЙКОЗ – клональное заболевание кроветворной ткани,
- 8. ЭПИДЕМИОЛОГИЯ ХРОНИЧЕСКОГО МИЕЛОЛЕЙКОЗА 15% ЛЕЙКОЗОВ ВЗРОСЛОГО ВОЗРАСТАВСТРЕЧАЕМОСТЬ:
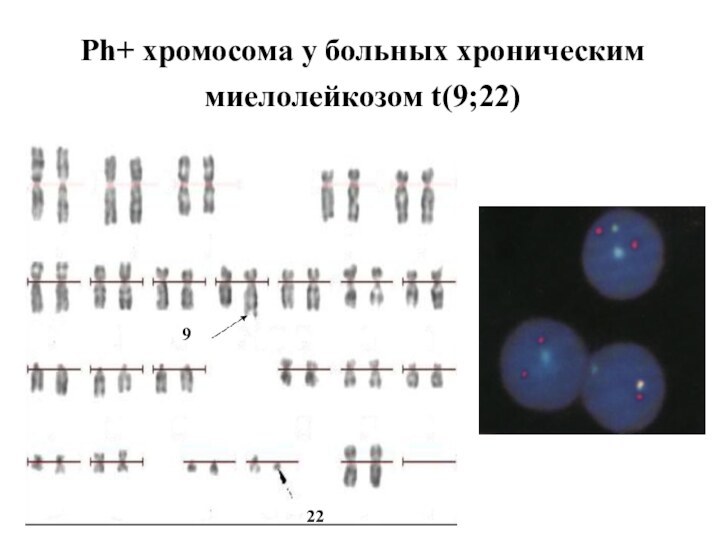
- 9. Ph+ хромосома у больных хроническим миелолейкозом t(9;22)229
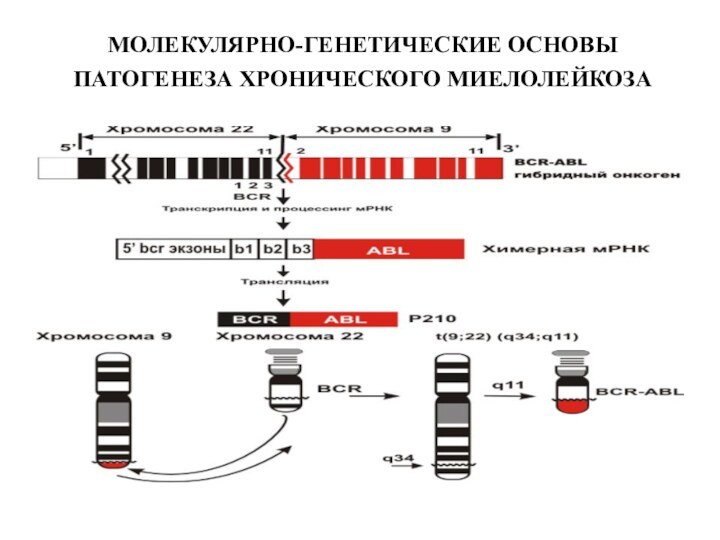
- 10. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ ОСНОВЫ ПАТОГЕНЕЗА ХРОНИЧЕСКОГО МИЕЛОЛЕЙКОЗА
- 11. 3 КЛИНИЧЕСКИЕ ФАЗЫ ДИАГНОЗХРОНИЧЕСКАЯ ФАЗА (85%)ФАЗА АКСЕЛЕРАЦИИ (10%) (ПРОГРЕССИРУЮЩАЯ)БЛАСТНЫЙ КРИЗ (5%)
- 12. Дифференциальный диагнозДругие хронические миелопролиферативные заболевания и хронические
- 13. 21% 5% Кровоизлияния в сетчатку глаз 48%
- 14. Алгоритм диагностики ХМЛКлинический анализ кровиМиелограммаЦитогенетический анализ Молекулярно-генетическое исследование Гистологическое исследование костного мозгаКлиническая симптоматика
- 15. ЛАБОРАТОРНЫЕ ПРИЗНАКИ ХМЛ В ХРОНИЧЕСКОЙ ФАЗЕ ЗАБОЛЕВАНИЯ26%
- 16. Критерии прогрессирующей стадии ХМЛБласты крови или костного
- 17. Критерии диагностики бластного криза ХМЛ≥ 20% бластных
- 18. Прогностические факторы у больных ХМЛ(Кantarjian H.M. et
- 19. Прогностические факторы в эру терапии ингибиторами тирозинкиназДополнительные
- 20. Терапевтические подходы к лечению больных хроническим миелолейкозомМиелосангидроксимочевинаТрансплантация
- 21. Цель лечения - индукция ремиссии заболевания, улучшение
- 22. Хроническая фаза ХМЛ. Лечение.Лечение хронической фазы ТрансплантацияЛекарственная
- 23. Первая линия терапии ХМЛ - Гливек Гливек
- 24. Лечение больных хроническим миелолейкозом препаратом Гливек (Imatinib)Хроническая
- 25. Оценка эффективности терапии Гливеком≥0%Ph+≥3 log BCR-ABL транскрипта0%Ph+≥3 log BCR-ABL транскрипта35% Ph+> 95% Ph+Нет гематологи-ческого ответаОтсутствиеэффекта18-ймесяц12-ймесяц6-ймесяц3-ймесяцЭффектив-ность
- 26. Резистентность к ИматинибуПричиныПоявление точечных мутаций в домене
- 27. Подходы к лечению больных ХМЛ, резистентных к
- 28. Факторы, определяющие эффективность аллогенной трансплантации стволовых клеток
- 29. менее 1 балла - прогноз наиболее благоприятен,
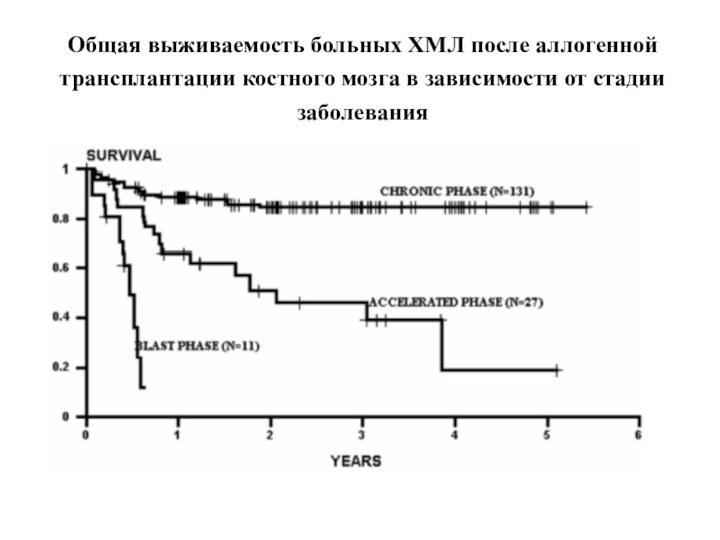
- 30. Общая выживаемость больных ХМЛ после аллогенной трансплантации костного мозга в зависимости от стадии заболевания
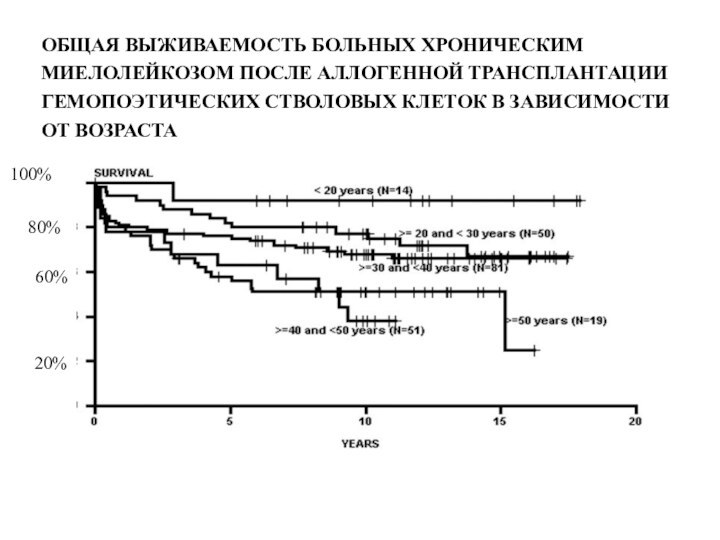
- 31. ОБЩАЯ ВЫЖИВАЕМОСТЬ БОЛЬНЫХ ХРОНИЧЕСКИММИЕЛОЛЕЙКОЗОМ ПОСЛЕ АЛЛОГЕННОЙ ТРАНСПЛАНТАЦИИГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК В ЗАВИСИМОСТИ ОТ ВОЗРАСТА100%20%80%60%
- 32. Лечение больных хроническим миелолейкозом α-интерферономα-интерферон (реаферон, роферон,
- 33. Эффективность лечения больных ХМЛ α-интерферон ± Ara-CПолный
- 34. Эффективность лечения больных ХМЛ α-интерфероном 5-летняя выживаемость
- 35. Лечение больных ХМЛ пожилого возраста в хронической
- 36. Лечение больных ХМЛ в прогрессирующей стадии и
- 37. Хронический нейтрофильный лейкозцитогенетические изменения (Ph хромосома) обычно
- 38. Причины вторичных нейтрофилийХроническая идиопатическая нейтрофилия, циклическая нейтрофилия,
- 39. Хронический эозинофильный лейкоз/гиперэозинофильный синдром Ph хромосома BCR-ABL
- 40. Хронический эозинофильный лейкоз/гиперэозинофильный синдромэозинофилы зрелые и незрелые
- 41. Лечение хронического эозинофильного лейкоза ГливекгидроксимочевинаПреднизолонПолихимиотерапияТрансплантация стволовых клеток
- 42. Идиопатический миелофиброз (агногенная миелоидная метаплазия, сублейкемический миелоз)
- 43. Схема патогенеза миелофиброза
- 44. Патоморфология идиопатического миелофиброзаСтадииКлеточно-пролиферативнаяКоллагенового миелофиброзаКлеточного истощения и гипоплазииОстеомиелосклероза и неоангиогенеза
- 45. лейкоэритробластическая картина периферической крови (миелофтиз): умеренный нейтрофильный
- 46. Диагностические критерии (Michiels and Thiele)/ ВОЗ.МФ. Гистологические
- 47. Прогностически неблагоприятные признаки, характерные для развернутой клинической
- 48. Наличие критериев А1 и В1 является обязательным
- 49. Итальянские критерии диагноза хронического идиопатического миелофиброза (Barosi
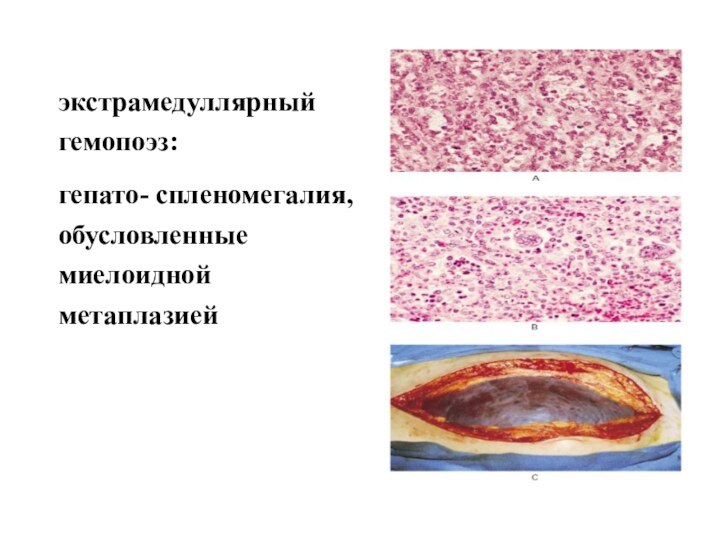
- 50. экстрамедуллярный гемопоэз: гепато- спленомегалия, обусловленные миелоидной метаплазией
- 51. Симптомы идиопатического миелофиброзаСимптомы, ассоциированные с экстрамедуллярными очагами
- 52. Симптомы идиопатического миелофиброзаСимптомы, ассоциированные с усиленным клеточным катаболизмомСнижение массы телаПовышение температурыГиперурикемия
- 53. Симптомы идиопатического миелофиброзаСимптомы, ассоциированные с недостаточностью костного мозга и изменением количества и функции клеток кровиАнемияГеморрагический синдромТромбозы
- 54. Прогностически неблагоприятные факторыВозраст > 64 летАнемия (Hb
- 55. Дифференциальный диагноз миелофиброзаОстрые лейкозы (М7) и МДСДругие
- 56. Лечение идиопатического миелофиброзаТрансплантация аллогенных стволовых клеток (больным
- 57. Эссенциальная тромбоцитемия – хроническое миелопролиферативное заболевание, характеризующееся
- 58. Диагностические критерии эссенциальной тромбоцитемииКоличество тромбоцитов в периферической
- 59. Основные причины реактивного тромбоцитозаЖелезодефицитная анемияСостояние после спленэктомии
- 60. Условия диагностики эссенциальной тромбоцитемииНормальное значение СОЭНормальное содержание
- 61. Клиническая картина эссенциальной тромбоцитемии обусловлена:микроциркуляторными расстройствами(эритромелалгия, головные боли, нарушение зрения, стенокардия)тромбозамикровотечениямивторичным миелофиброзомвторичными лейкозами
- 62. Причины начала терапии эссенциальной тромбоцитемии появление клиники
- 63. Терапевтическая тактика при эссенциальной тромбоцитемииВыжидательная тактика, дезагреганты
- 64. Почему выжидательная тактика?5-летнее наблюдение за лицами с
- 65. Истинная полицитемия- хроническое миелопролиферативное заболевание, характеризующееся пролиферацией
- 66. Стадии эритремии1 стадия – малосимптомного течения2А стадия
- 67. Клинические симптомы у больных истинной полицитемиейэритроцианотическая окраска
- 68. Диагностические критерии истинной полицитемииНормальные значения насыщения артериальной
- 69. Лечение истинной полицитемии Эритроцитоферез раз в 3-6 месяцев с поддержанием уровня гематокрита < 0,41
- 70. Терапевтические опции при истинной полицитемииаллопуринолСимптомы гиперурикемииАспирин, анагрелид,
- 71. Хронический миеломоноцитарный лейкозХроническое миелопролиферативное заболевание, характеризующееся признаками
- 72. Диагностические критерии хронического миеломоноцитарного лейкоза количество
- 73. клиническая картина ХММЛ вариабельна:- отсутствие симптомов- слабость,
- 74. Ювенильный миеломоноцитарный лейкозКлональное заболевание, обусловленное дисрегуляцией системы
- 75. Скачать презентацию
- 76. Похожие презентации



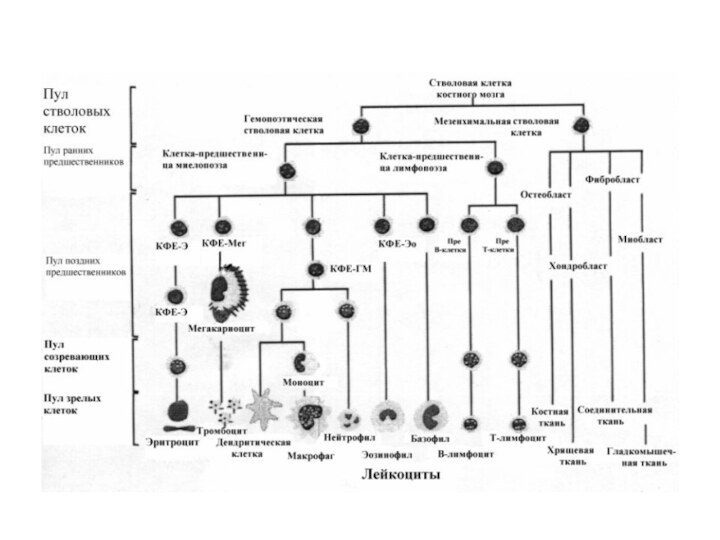

























































Слайд 2 Хронические миелопролиферативные заболевания группа заболеваний, характеризующихся клональными нарушениями
Слайд 3
Для группы хронических миелопролиферативных заболеваний характерны следующие признаки:
Вовлечение
в опухолевый процесс полипотентной гемопоэтической клетки;
Преобладание клонального гемопоэза над
нормальным;2. Повышенная продукция форменных элементов одного или более ростка гемопоэза при отсутствии физиологических стимулов;
3. 4. Способность к развитию экстрамедуллярного гемопоэза;
5. Способность к клональной эволюции и трансформации в острый лейкоз.
Слайд 5
Классификация хронических миелопролиферативных заболеваний ( ВОЗ, 2001)
Хронический миелолейкоз
Эссенциальная
тромбоцитемия
Истинная полицитемия
Идиопатический миелофиброз
Хронический эозинофильный лейкоз
Хронический нейтрофильный лейкоз
Хроническое миелопролиферативное заболевание
неклассифицируемое
Слайд 6
Классификация хронических миелопролиферативных заболеваний с миелодисплазией, ВОЗ, 2001
Хронический
миеломоноцитарный лейкоз
Атипичный хронический миелолейкоз
Ювенильный хронический миеломоноцитарный лейкоз
Хроническое миелопролиферативное
заболевание с миелодиспластическими изменениями неклассифицируемое
Слайд 7
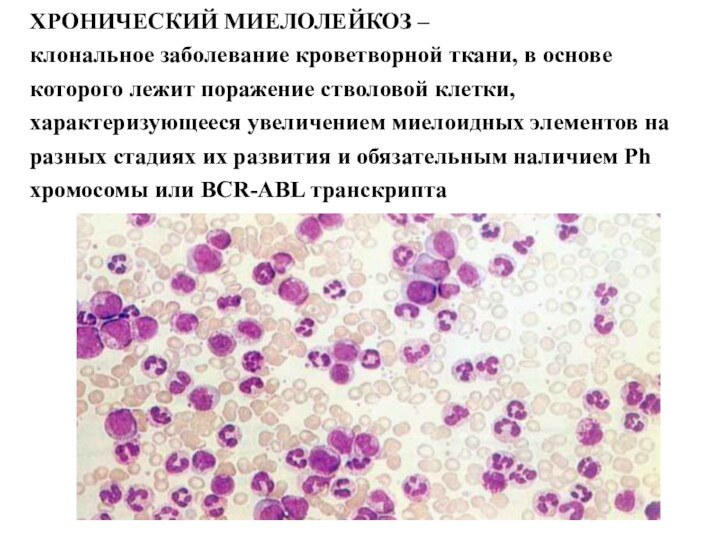
ХРОНИЧЕСКИЙ МИЕЛОЛЕЙКОЗ –
клональное заболевание кроветворной ткани, в
основе которого лежит поражение стволовой клетки, характеризующееся увеличением миелоидных
элементов на разных стадиях их развития и обязательным наличием Ph хромосомы или BCR-ABL транскрипта
Слайд 8
ЭПИДЕМИОЛОГИЯ ХРОНИЧЕСКОГО МИЕЛОЛЕЙКОЗА
15% ЛЕЙКОЗОВ ВЗРОСЛОГО ВОЗРАСТА
ВСТРЕЧАЕМОСТЬ: 1-2 :
100 000 НАСЕЛЕНИЯ
М/Ж 3:2
МЕДИАНА ВОЗРАСТА БОЛЬНЫХ – 45-55 ЛЕТ
Слайд 11
3 КЛИНИЧЕСКИЕ ФАЗЫ ДИАГНОЗ
ХРОНИЧЕСКАЯ ФАЗА (85%)
ФАЗА АКСЕЛЕРАЦИИ (10%)
(ПРОГРЕССИРУЮЩАЯ)
БЛАСТНЫЙ КРИЗ (5%)
Слайд 12
Дифференциальный диагноз
Другие хронические миелопролиферативные заболевания и хронические миелопролиферативные
заболевания с миелодисплазией
Миелодиспластический синдром и острые лейкозы
Лейкемоидные реакции
Вторичные нейтрофилезы
Слайд 13
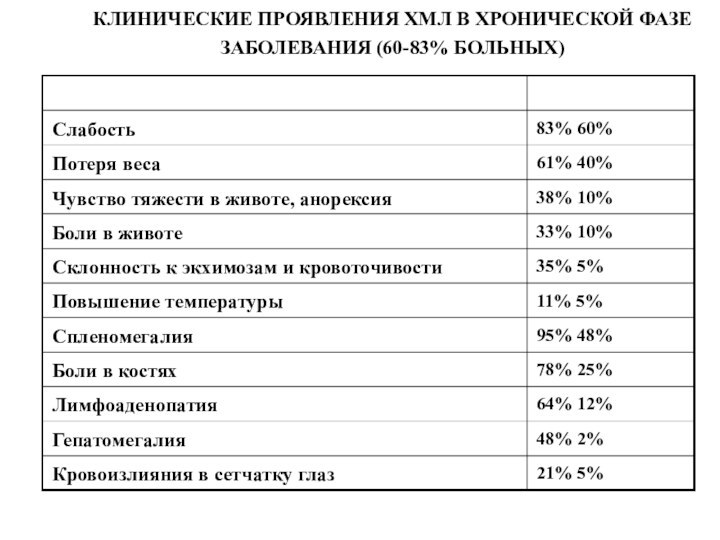
21% 5%
Кровоизлияния в сетчатку глаз
48% 2%
Гепатомегалия
64% 12%
Лимфоаденопатия
78% 25%
Боли в костях
95% 48%
Спленомегалия
11%
5% Повышение температуры
35% 5%
Склонность к экхимозам и кровоточивости
33% 10%
Боли в животе
38% 10%
Чувство тяжести в животе, анорексия
61% 40%
Потеря веса
83% 60%
Слабость
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ХМЛ В ХРОНИЧЕСКОЙ ФАЗЕ ЗАБОЛЕВАНИЯ (60-83% БОЛЬНЫХ)
Слайд 14
Алгоритм диагностики ХМЛ
Клинический анализ крови
Миелограмма
Цитогенетический анализ
Молекулярно-генетическое исследование
Гистологическое исследование костного мозга
Клиническая симптоматика
Слайд 15
ЛАБОРАТОРНЫЕ ПРИЗНАКИ ХМЛ В ХРОНИЧЕСКОЙ ФАЗЕ ЗАБОЛЕВАНИЯ
26%
Базофилы
в костном мозге > 3%
14%
Базофилы в крови
> 7% 6%
Бласты в костном мозге > 5%
52%
Появление бластов в периферической крови
15-34%
Тромбоциты > 700х109/л
45-62%
Гемоглобин <120 г/л
52-72%
Лейкоциты >100х109/л
Слайд 16
Критерии прогрессирующей стадии ХМЛ
Бласты крови или костного мозга
≥10%, < 19%
Бласты + промиелоциты крови или костного мозга
≥ 20%Базофилы ± эозинофилы в крови ≥ 20%
Появление дополнительных хромосомных нарушений
Прогрессирующий миелофиброз ± пролиферпция мегакариоцитов, дисплазия гранулоцитов)
Увеличение количества лейкоцитов в крови несмотря на проводимое лечение
Удвоение количества лейкоцитов в крови < 5 дней
Нарастающая спленомегалия
Прогрессирующая анемия или тромбоцитопения на фоне терапии
Персистирующий или прогрессирующий тромбоцитоз на фоне терапии
IBMTR,2000; J.W.Vardiman,2002
Слайд 17
Критерии диагностики бластного криза ХМЛ
≥ 20% бластных клеток
в крови или костном мозге
Экстрамедуллярная бластная пролиферация
Крупные скопления бластных
клеток в костном мозге по данным трепанобиопсии(ВОЗ 2002)
≥ 30% бластных клеток в крови или костном мозге
Экстрамедуллярная бластная пролиферация
(ESMO 2008)
лимфоидный вариант ( 30%)
миелоидный вариант ( 70%)
В случае достижения ремиссии при бластном
кризе - 2-я хроническая фаза
Слайд 18 Прогностические факторы у больных ХМЛ(Кantarjian H.M. et al.,
Blood,1993,v.82,p.691-703)
Характеристики плохого прогноза
Возраст ≥ 60 лет
Селезенка ≥ 10 см
ниже реберной дугиБласты ≥ 3% в костном мозге
Базофилы ≥ 7% в крови или ≥ 3% в костном мозге
Тромбоциты ≥ 700 х 109/л
Характеристики прогрессирующей стадии
Дополнительные цитогенетические изменения
Бласты крови ≥ 15%
Бласты + промиелоциты в крови или костном мозге ≥ 30%
Базофилы в крови ≥ 20%
Тромбоциты <100 х 109/л
4 Группы риска: 1 – 0-1 характеристики плохого прогноза, 2 – 2 характе-
ристики плохого прогноза, 3- ≥ 3 характеристик плохого прогноза,
4 – 1 характеристика прогрессирующей стадии в независимости от
характеристик плохого прогноза
Слайд 19
Прогностические факторы в эру терапии ингибиторами тирозинкиназ
Дополнительные цитогенетические
нарушения (Делеция измененной 9 хромосомы)
Мутации в регионе BCR-ABL, определяющие
резистентность к иматинибу (T3151, E255K, H253F и другие)Степень и время достижения гематологической, цитогенетической и молекулярно-генетической ремиссии
Возможность достижения полной цитогенетической ремиссии (на фоне терапии иматинибом (гливеком) или
α–интерфероном)
ESMO 2008
Слайд 20
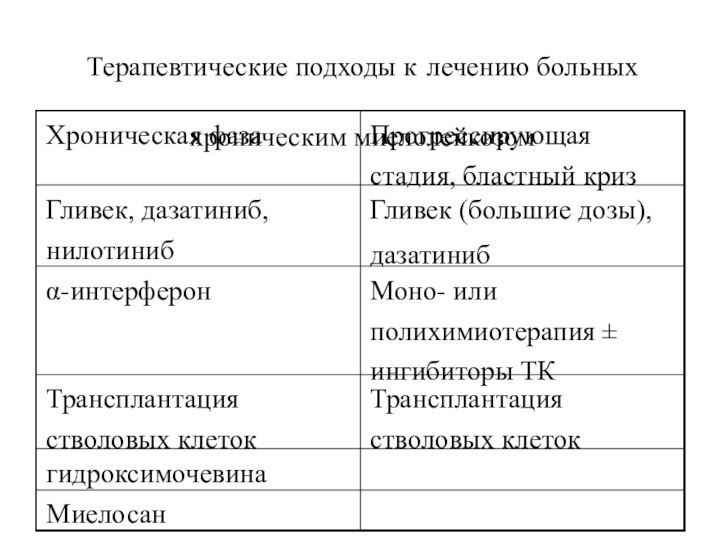
Терапевтические подходы к лечению больных хроническим миелолейкозом
Миелосан
гидроксимочевина
Трансплантация стволовых
клеток
Трансплантация стволовых клеток
Моно- или полихимиотерапия ± ингибиторы ТК
α-интерферон
Гливек (большие
дозы),дазатиниб
Гливек, дазатиниб, нилотиниб
Прогрессирующая стадия, бластный криз
Хроническая фаза
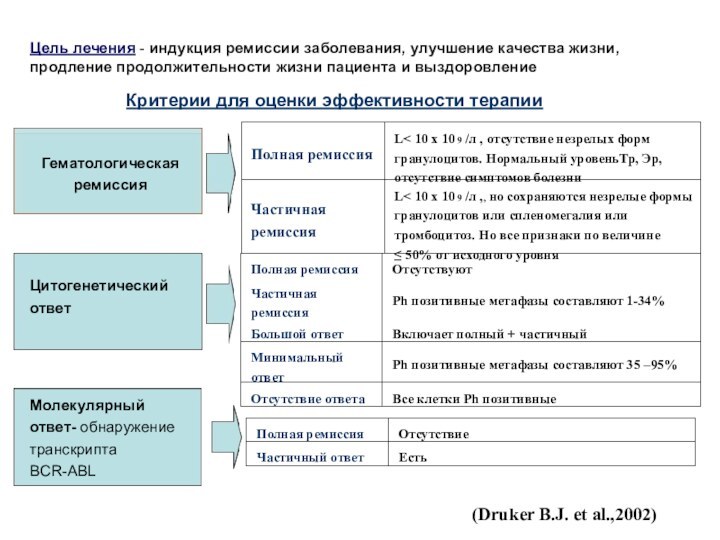
Слайд 21 Цель лечения - индукция ремиссии заболевания, улучшение качества
жизни,
продление продолжительности жизни пациента и выздоровление
Критерии для оценки
эффективности терапииЦитогенетический ответ
Включает полный + частичный
Большой ответ
Все клетки Рh позитивные
Отсутствие ответа
Рh позитивные метафазы составляют 35 –95%
Минимальный ответ
Рh позитивные метафазы составляют 1-34%
Частичная ремиссия
Отсутствуют
Полная ремиссия
L< 10 х 10 9 /л ,, но сохраняются незрелые формы гранулоцитов или спленомегалия или тромбоцитоз. Но все признаки по величине
≤ 50% от исходного уровня
Частичная ремиссия
L< 10 х 10 9 /л , отсутствие незрелых форм гранулоцитов. Нормальный уровеньТр, Эр, отсутствие симптомов болезни
Полная ремиссия
Молекулярный ответ- обнаружение транскрипта BCR-ABL
Есть
Частичный ответ
Отсутствие
Полная ремиссия
Гематологическая
ремиссия
(Druker B.J. et al.,2002)
Слайд 22
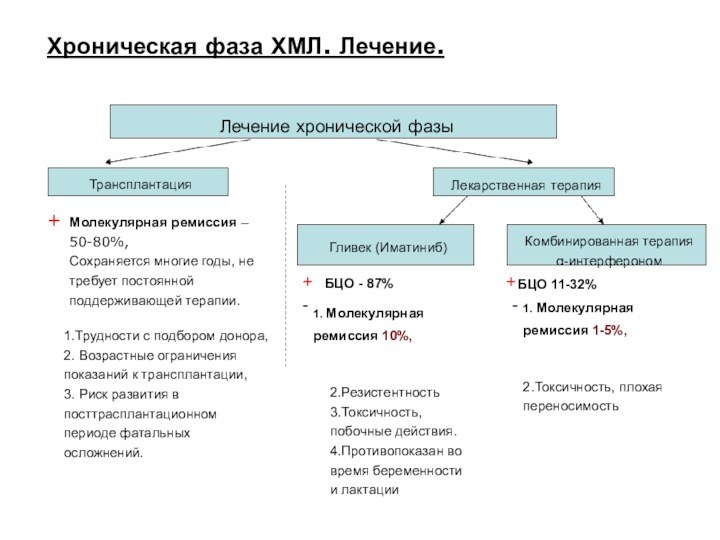
Хроническая фаза ХМЛ. Лечение.
Лечение хронической фазы
Трансплантация
Лекарственная терапия
+
Молекулярная
ремиссия – 50-80%,
Сохраняется многие годы, не требует постоянной
поддерживающей терапии.1.Трудности с подбором донора,
2. Возрастные ограничения показаний к трансплантации,
3. Риск развития в посттрасплантационном периоде фатальных осложнений.
Гливек (Иматиниб)
Комбинированная терапия
α-интерфероном
+
БЦО - 87%
+
БЦО 11-32%
1. Молекулярная ремиссия 10%,
-
-
1. Молекулярная ремиссия 1-5%,
2.Резистентность
3.Токсичность, побочные действия.
4.Противопоказан во время беременности
и лактации
2.Токсичность, плохая переносимость
Слайд 23
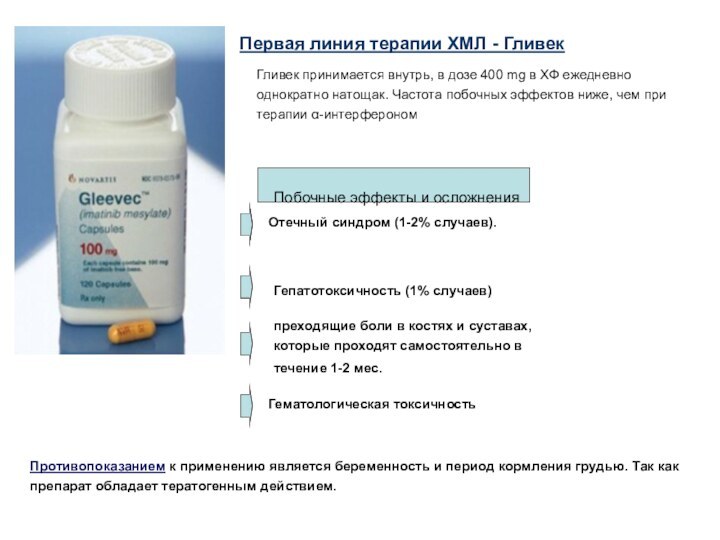
Первая линия терапии ХМЛ - Гливек
Гливек принимается
внутрь, в дозе 400 mg в ХФ ежедневно однократно
натощак. Частота побочных эффектов ниже, чем при терапии α-интерферономПобочные эффекты и осложнения
Отечный синдром (1-2% случаев).
Гепатотоксичность (1% случаев)
преходящие боли в костях и суставах, которые проходят самостоятельно в течение 1-2 мес.
Гематологическая токсичность
Противопоказанием к применению является беременность и период кормления грудью. Так как препарат обладает тератогенным действием.
Слайд 24
Лечение больных хроническим миелолейкозом препаратом Гливек (Imatinib)
Хроническая фаза
Гливек
400 мг/сутки per os
полный гематологический ответ – 98%
полная цитогенетическая
ремиссия - 87%токсичность требующая отмены – 4%
Прогрессирующая стадия, Бластный криз
Гливек 600-800 мг/сутки
полный гематологический ответ – 15-31%
частичный гематологический ответ – 58%
Слайд 25
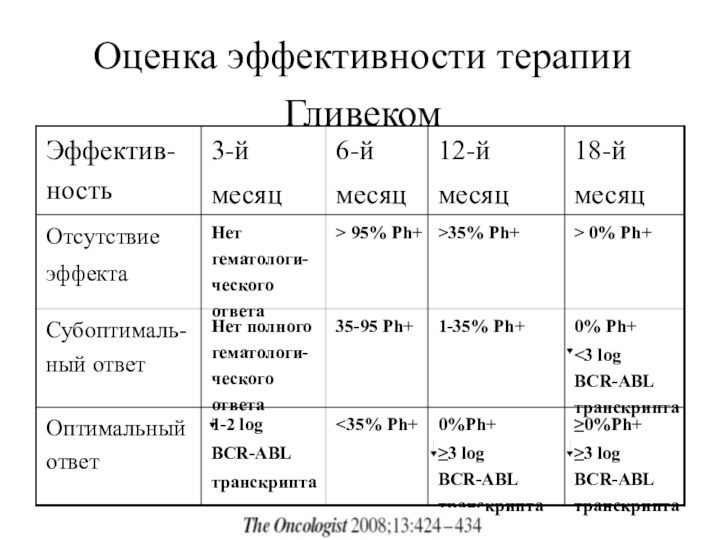
Оценка эффективности терапии Гливеком
≥0%Ph+
≥3 log BCR-ABL транскрипта
0%Ph+
≥3 log
BCR-ABL транскрипта
BCR-ABL транскрипта1-35% Ph+
35-95 Ph+
Нет полного гематологи-ческого ответа
Субоптималь- ный ответ
> 0% Ph+
>35% Ph+
> 95% Ph+
Нет гематологи-ческого ответа
Отсутствие
эффекта
18-й
месяц
12-й
месяц
6-й
месяц
3-й
месяц
Эффектив-ность
Слайд 26
Резистентность к Иматинибу
Причины
Появление точечных мутаций в домене ABL
киназы. Эти мутации нарушают связывание Иматиниба с ABL киназой.
Однако не все мутации приводят к потере чувствительности Гливеком, а только те, что располагаются в районе связывания с АТФ. Наибодьшее значение имеет мутация T3151 .
Амплификаия гена BCR ABL. Увеличивается экспрессия BCR-ABL транскрипта примерно в 10 - 15 раз.
Появление добавочных хромосомных изменений, которые могут быть причиной включения иных , чем активность тирозинкиназы механизмов клеточной пролиферации.
Повышенная продукция ответственного за возникновения множественной лекарственной устойчивости белка pgp у больных с вторичной резестентностю.
Высокие дозы Иматиниба
Дазатиниб (Sprycel)
Нилотиниб
Устранение резистентности
Трансплантация костного мозга
Слайд 27
Подходы к лечению больных ХМЛ, резистентных к Гливеку
Дазатиниб
50-70 мг х 2 раза или 100 мг х
1 раз ПЦО – 49% , токсичность, требующая отмены – 19%Нилотиниб 400 мг х 1-2 раза
ПЦО – 40% токсичность, требующая отмены – 15% , прогрессия – 16%
Бозутиниб 100 мг х 1 раз или 50 мг х 2 раза
ПЦО 32% токсичность 3-4ст у 50%, требующая отмены – 9%.
Трансплантация костного мозга
Слайд 28 Факторы, определяющие эффективность аллогенной трансплантации стволовых клеток больным
ХМЛ (ЕВМТ 1998)
фаза ХМЛ
длительность заболевания (ранняя хроническая фаза, до
и больше года)возраст больного (< 20, 20-39, >40 лет)
cтепень совместимости пары донор-реципиент
степень родства пары донор-реципиент
Слайд 29
менее 1 балла - прогноз наиболее благоприятен,
низкий
риск, 5 летняя выживаемость
при трансплантации в этом случае
75%, сумма баллов 2 - 5 летняя выживаемость 65% ,
сумма баллов 3 – 5 летняя выживаемость 50%
сумма баллов 4 - 5 летняя выживаемость 35%,
более баллов 5 и выше лишь 12%.
Система прогноза исхода трансплантации по факторам риска
(1998, A. Gratwohl)
Тип донора
ст акселерации – 1 балл
неродственный или
не идентичный донор – 2 балла
Возраст
Стадия болезни
хроническая ст – 0 баллов
HLA идентичный сиблинг- 0 баллов
ст бластного криза - 2 балла
моложе 20 лет – 0 баллов
от 20 до 40 – 1 балл
старше 40 лет – 2 балла
Соотношение пола
между донором и реципиентом
донор – женщина, реципиент – мужчина –
1 баллов
остальные соотношения – 0 баллов
Возраст
Период от диагноза до
трансплантации
менее 12 мес - 0 баллов
более 12 мес – 1 балл
Слайд 30 Общая выживаемость больных ХМЛ после аллогенной трансплантации костного
мозга в зависимости от стадии заболевания
Слайд 31
ОБЩАЯ ВЫЖИВАЕМОСТЬ БОЛЬНЫХ ХРОНИЧЕСКИМ
МИЕЛОЛЕЙКОЗОМ ПОСЛЕ АЛЛОГЕННОЙ ТРАНСПЛАНТАЦИИ
ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ
КЛЕТОК В ЗАВИСИМОСТИ
ОТ ВОЗРАСТА
100%
20%
80%
60%
Слайд 32
Лечение больных хроническим миелолейкозом α-интерфероном
α-интерферон (реаферон, роферон, интрон
А) 3-5 млн.ед/м2/сутки
Пэг-интрон, Пегасис
( пролонгированные формы ) 0,75-7,5
мкг/кг раз в неделюα-интерферон + гидроксимочевина
α-интерферон + цитозин-арабинозид
Пэг-интрон + цитозин-арабинозид
Слайд 33
Эффективность лечения больных ХМЛ α-интерферон ± Ara-C
Полный гематологический
ответ -
67-87%
Большой цитогенетический ответ –
35-49%
Цитогенетическая ремиссия -
11-32%
Слайд 34
Эффективность лечения больных ХМЛ α-интерфероном
5-летняя выживаемость –
70%
10-летняя выживаемость больных с цитогенетической ремиссией
группа низкого риска –
90%группа промежуточного риска – 75%
группа высокого риска – 50%
67% больных остаются в полной цитогенетической ремиссии
Слайд 35 Лечение больных ХМЛ пожилого возраста в хронической фазе
заболевания
гидроксимочевина 1,0 – 4,0 г/сутки
миелосан 2-8 мг/сутки
Слайд 36 Лечение больных ХМЛ в прогрессирующей стадии и в
период бластного криза
Гливек 600-800 мг в сутки, дазатиниб или
комбинация с полихимиотерапиейПри достижении 2-й хронической фазы – принципы лечения в хронической фазе, скорейшее решение вопроса о трансплантации стволовых клеток
При невозможности достижения 2-й хронической фазы – решение вопроса о трансплантации стволовых клеток
Слайд 37
Хронический нейтрофильный лейкоз
цитогенетические изменения (Ph хромосома) обычно отсутствуют
(μ -BCR-ABL, p230)
количество лейкоцитов в крови увеличено
за счет
зрелых нейтрофилов,отсутствует левый сдвиг в лейкоцитарной формуле,
отсутствует увеличение базофилов и эозинофилов в крови,
клеточность костного мозга увеличена за счет гранулоцитов,
щелочная фосфатаза нейтрофилов обычно увеличена,
увеличение уровня витамина В12 в сыворотке
умеренная спленомегалия ± гепатомегалия,
жалобы у больных обычно отсутствуют
диагноз устанавливается при исключении инфекций и вторичных нейтрофилезов
Слайд 38
Причины вторичных нейтрофилий
Хроническая идиопатическая нейтрофилия, циклическая нейтрофилия, семейная
нейтрофилия
Врожденные заболевания
Острые кровотечения, гемолиз, миелопролиферативные заболевания
Гематологические причины
Хлорпропамид, кортикостероиды, сердечные
гликозиды, эпинефрин, гепарин, препараты лития, вакцины Применение лекарств
Диабетический ацидоз, уремия, эклампсия
Метаболические нарушения
Инфаркт миокарда, травма, хирургическое вмешательство, аноксия, тромбозы и инфаркты, химическое или электрическое повреждение тканей, ожоги, реакции гиперчувствительности на лекарства, подагра, дерматиты, тиреоидиты, васкулиты, заболевания соединительной ткани
Воспаление и повреждение тканей
Бактериальные, грибковые, вирусные (первые дни), рикетсиозные, вызванные спирохетами; на фоне выброса эндотоксина.
Инфекции
беременность (третий триместр),
эмоциональный стресс, выраженная физическая нагрузка, чрезмерное переохлаждение или тепловое воздействие, гиперкатехоламинемия, судороги, тошнота и рвота
Физиологический нейтрофилез
Состояния и заболевания
Группы по этиологическому принципу
Слайд 39
Хронический эозинофильный лейкоз/гиперэозинофильный синдром
Ph хромосома BCR-ABL транскрипт отсутствуют
Количество
эозинофилов в крови > 1.5 x 109/L
Диагноз устанавливается
после исключения инфекций, воспалительных или неопластических причин эозинофилии ( ХМЛ, ОМЛ с inv(16), лимфомы, лимфогрануломатоз)Признаки клонального заболевания - хронический эозинофильный лейкоз (Хромосомные нарушения с вовлечением локуса 4q12 (PDGFRA – platelet derived growth factor receptor α gene) и KIT тирозин киназ : t(3;4)(p13;q12), t(4;7)(q11;q23), t(4;7)(q11;p13).
Наиболее характерно наличие слитного гена FIP1L1- PDGFRA).
Отсутствие признаков клональности – гиперэозинофильный синдром
Слайд 40
Хронический эозинофильный лейкоз/гиперэозинофильный синдром
эозинофилы зрелые и незрелые в
периферической крови и костном мозге увеличены
часто >2% бластов в
крови и 5-19% в костном мозгеотсутствие диспластических изменений
ассоциированные с инфильтрацией костного мозга незрелыми эозинофилами анемия и тромбоцитопения
быстро нарастающая слабость, потливость, похудание
кожная сыпь
спленомегалия почти 100%
возможно вовлечение органов-мишеней
возможно обнаружение хромосомных нарушений
эозинофилы зрелые и незрелые в периферической крови и костном мозге увеличены > 6 месяцев
количество бластов в костном мозге <5%
поражение внутренних органов
(эндомиокардиальный фиброз, поражение легких, центральной нервной системы)
поражение кожи (сыпь в виде крапивницы, ангионевротический отёк, отёк Квинке)
тромбоэмболические осложнения
поликлоновое увеличение иммуноглобулинов (IgE)
спленомегалия реже (40%)
анемия (50%)
повышенная клеточность костного мозга (25-75%)
Слайд 41
Лечение хронического эозинофильного лейкоза
Гливек
гидроксимочевина
Преднизолон
Полихимиотерапия
Трансплантация стволовых клеток
Слайд 42 Идиопатический миелофиброз (агногенная миелоидная метаплазия, сублейкемический миелоз) –
хроническое миелопролиферативное заболевание, характеризующееся ранним и значительным развитием фиброза
костного мозга
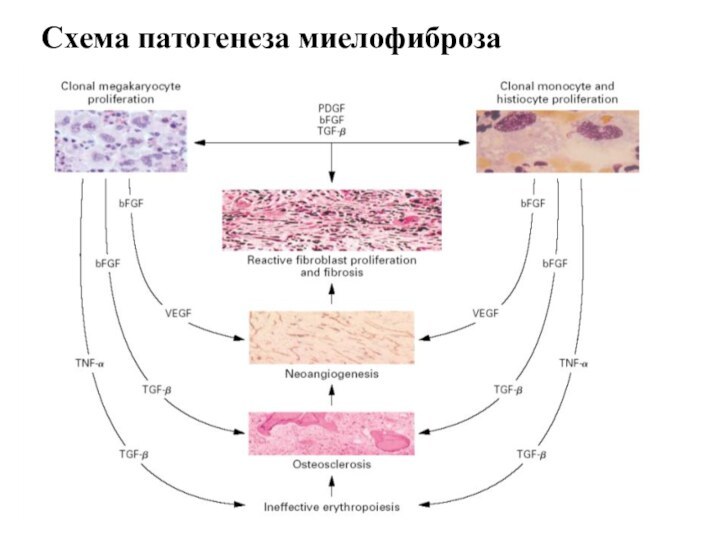
Слайд 44
Патоморфология идиопатического миелофиброза
Стадии
Клеточно-пролиферативная
Коллагенового миелофиброза
Клеточного истощения и гипоплазии
Остеомиелосклероза и
неоангиогенеза
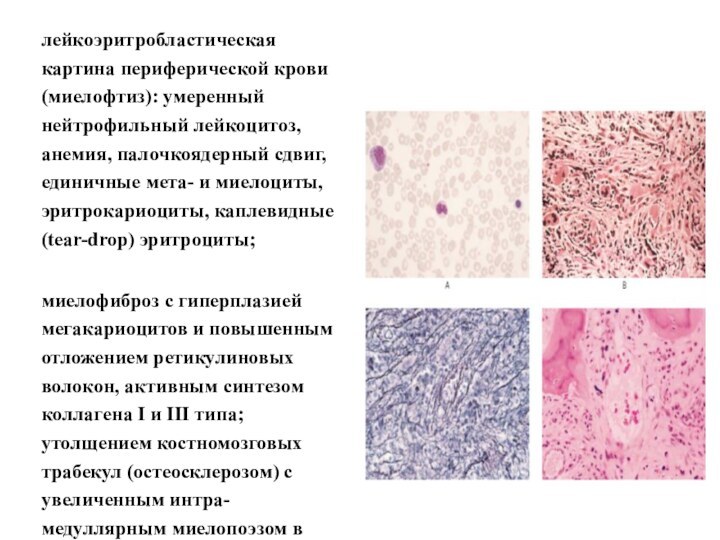
Слайд 45
лейкоэритробластическая картина периферической крови (миелофтиз): умеренный нейтрофильный лейкоцитоз,
анемия, палочкоядерный сдвиг, единичные мета- и миелоциты, эритрокариоциты, каплевидные
(tear-drop) эритроциты;миелофиброз с гиперплазией мегакариоцитов и повышенным отложением ретикулиновых волокон, активным синтезом коллагена I и III типа; утолщением костномозговых трабекул (остеосклерозом) с увеличенным интра-медуллярным миелопоэзом в костномозговых синусах
Слайд 46
Диагностические критерии (Michiels and Thiele)/ ВОЗ.
МФ. Гистологические стадии
ХрИМФ.
МФ0. Префиброзная стадия (отсутствие ретикулинового фиброза в гистологических препаратах
костного мозга)МФ1. Ранняя стадия миелофиброза (слабопроявляющийся ретикулиновый фиброз)
МФ2. Стадия явного миелофиброза (явное увеличение ретикулиновых и/или коллагеновых волокон)
МФ3. Стадия распространенного выраженного миелофиброза (распространенный коллагеновый фиброз – остеосклероз с очагами остео- и ангиогенеза )
В1 Признаки избыточной пролиферации мегакариоцитарного и гранулоцитарного ростков, относительное уменьшение эритроидных предшественников по данным цитологического и гистологического исследования костного мозга. Патологические скопления и увеличение числа атипичных гигантских мегакариоцитов со складчатыми, неправильной формы, дольчатыми ядрами и признаками нарушения созревания.
А1 Отсутствие данных за ХМЛ и другие хронические миелопролиферативные заболевания, МДС
А2 Ранняя клиническая стадия:
- нормальный гемоглобин или анемия 1 ст. (гемоглобин < 130 г/л, но ≥ 120 г/л);
- незначительная или умеренная сплено-мегалия при пальпации или размеры селезенки > 11 см при УЗИ или КТ;
- количество тромбоцитов > 400х109/л
А3. Промежуточная (переходная) клиническая стадия
- Анемия 2 ст. (гемоглобин <120 г/л, но ≥ 100 г/л)
- Лейкоэритробластическая картина крови и каплевидные эритроциты
- Спленомегалия,
- Отсутствие прогностически неблагоприятных признаков*
А4. Развернутая клиническая стадия
- Анемия 3 ст. (гемоглобин < 100 г/л)
- Наличие одного или более прогностически неблагоприятных признаков
Патоморфологические критерии
Клинические критерии
Слайд 47 Прогностически неблагоприятные признаки, характерные для развернутой клинической стадии
хронического идиопатического миелофиброза (А4)
возраст старше 70 лет,
уровень гемоглобина
крови < 100 г/л, количество миелобластов в периферической крови > 2%, количество эритробластов и нормобластов в периферической крови > 2%,
количество лейкоцитов в крови > 20х109/л, количество тромбоцитов в крови < 300х109/л,
наличие симптомов опухолевой интоксикации,
выраженная спленомегалия,
наличие цитогенетических нарушений.
Слайд 48 Наличие критериев А1 и В1 является обязательным условием
для установления диагноза хронического идиопатического миелофиброза, остальные критерии подтверждают
диагноз и позволяют верифицировать клиническую стадию заболевания.Начальная (префиброзная) стадия: А1+А2, В1+ МФ0
Ранняя стадия : А1+А3, В1+МФ1, МФ2
Стадия выраженного миелофиброза : А1+А4, В1+МФ3
Слайд 49 Итальянские критерии диагноза хронического идиопатического миелофиброза (Barosi G
et al,1999)
I. Необходимые критерии.
А. Диффузный фиброз костного мозга
В.
Отсутствие Филадельфийской хромосомы (t 9;22) и BCR-ABL транскрипта II. Дополнительные критерии.
1. Спленомегалия в независимости от выраженности
2. Анизоцитоз, пойкилоцитоз, каплевидные эритроциты
3.Наличие незрелых миелоидных клеток в периферической крови
4. Наличие эритробластов в крови
5. Кластерное расположение мегакариобластов и измененные мегакариоциты в гистологических препаратах костного мозга
6. Миелоидная метаплазия
2 х 2
Слайд 51
Симптомы идиопатического миелофиброза
Симптомы, ассоциированные с экстрамедуллярными очагами гемопоэза
(селезенка, печень, трубчатые кости …)
увеличение селезенки (100%)
увеличение печени (50%)
портальная
гипертензия (15%)увеличение лимфоузлов (20%)
боли в трубчатых костях (20%)
Слайд 52
Симптомы идиопатического миелофиброза
Симптомы, ассоциированные с усиленным клеточным катаболизмом
Снижение
массы тела
Повышение температуры
Гиперурикемия
Слайд 53
Симптомы идиопатического миелофиброза
Симптомы, ассоциированные с недостаточностью костного мозга
и изменением количества и функции клеток крови
Анемия
Геморрагический синдром
Тромбозы
Слайд 54
Прогностически неблагоприятные факторы
Возраст > 64 лет
Анемия (Hb
100 г/л)
Симптомы повышенного катаболизма
Лейкоцитоз ( лейкоциты > 30000 в
1 мкл)Лейкопения ( лейкоциты < 4000 в 1 мкл)
Появление бластов в крови (≥ 1%)
Цитогенетические нарушения (+8, 12р-)
2 и более фактора - группа высокого риска с медианой выживаемости 2 года
Отсутствие факторов (низкий риск) - медиана выживаемости 10 лет
Слайд 55
Дифференциальный диагноз миелофиброза
Острые лейкозы (М7) и МДС
Другие хронические
миелопролиферативные заболевания
Миелопролиферативные заболевания с миелодисплазиями
Волосатоклеточный лейкоз
Лимфомы
Множественная миелома
Метастазирующий рак
Хронические
инфекции (туберкулез)Заболевания соединительной ткани
Слайд 56
Лечение идиопатического миелофиброза
Трансплантация аллогенных стволовых клеток (больным моложе
45 лет при наличии донора, 5 летняя выживаемость -
60%)Химиотерапия гидроксимочевиной, бусульфаном, мелфаланом
Андрогены (тестостеронэнантат 600 мг/неделю), эритропоэтин
Спленэктомия, облучение селезенки
Экспериментальные методы (α-интерферон, талидомид+преднизолон, анагрелид, сурамин (ингибитор TGFβ рецептора фибробластов)
Слайд 57
Эссенциальная тромбоцитемия –
хроническое миелопролиферативное заболевание, характеризующееся значительной
гиперплазией мегакариоцитарного ростка кроветворения с устойчивым тромбоцитозом в периферической
крови
Слайд 58
Диагностические критерии эссенциальной тромбоцитемии
Количество тромбоцитов в периферической крови
> 600 х 109/л при неоднократном исследовании
Исключение вторичных тромбоцитозов
и других хронических миелопролиферативных заболеванийПри цитологическом и гистологическом исследовании костного мозга выявляется увеличение числа миелокариоцитов, активных мегакариоцитов, в клетках отсутствуют признаки миелодисплазии
При цитогенетическом исследовании
не выявляется Ph хромосома и BCR-ABL транскрипт. Отсутствуют хромосомные нарушения, характерные для МДС
Слайд 59
Основные причины реактивного тромбоцитоза
Железодефицитная анемия
Состояние после спленэктомии или
функциональная аспления
Метастатический рак, лимфомы
Воспалительный процесс (ревматоидный артрит, васкулиты, аллергические
реакции)Почечная недостаточность, нефротический синдром
Сразу после хирургического вмешательства
Кровотечение
Гемолиз
Инфекции
Повреждения тканей (острый панкреатит, инфаркт миокарда, травма, ожоги)
Аортокоронарное шунтирование
Период восстановления после химиотерапии или иммунной тромбоцитопении
Хронические причины
Острые состояния
Слайд 60
Условия диагностики эссенциальной тромбоцитемии
Нормальное значение СОЭ
Нормальное содержание сывороточного
железа, трансферрина, ферритина
Отсутствием выявленной патологии при рентгенографии легких, УЗИ
брюшной полости
Слайд 61
Клиническая картина эссенциальной тромбоцитемии обусловлена:
микроциркуляторными расстройствами
(эритромелалгия, головные боли,
нарушение зрения, стенокардия)
тромбозами
кровотечениями
вторичным миелофиброзом
вторичными лейкозами
Слайд 62
Причины начала терапии эссенциальной тромбоцитемии
появление клиники тромбозов или
наличие рецидивирующих тромбоэмболических осложнений в анамнезе;
появление клинически значимого (опасного
для жизни) геморрагического синдрома;возраст старше 60 лет
количество тромбоцитов более 1500х109/л;
наличие факторов риска сердечно-сосудистых заболеваний (артериальная гипертензия, ожирение, курение).
Слайд 63
Терапевтическая тактика при эссенциальной тромбоцитемии
Выжидательная тактика, дезагреганты –
у молодых до уровня тромбоцитов в крови 1000-1500 х
109/лАнагрелид (имидазол-хинозолин) (0,5-5 мг/день) – полный ответ 96,7%
Бусульфан – полный ответ 75%
Гидроксимочевина – полный ответ 57%
α-интерферон - полный ответ 50%
Слайд 64
Почему выжидательная тактика?
5-летнее наблюдение за лицами с гипертромбоцитозом
в периферической крови показало, что эссенциальная тромбоцитемия диагностируется только
у 3,4% пациентовПри достижении полной ремиссии с помощью химиопрепаратов ее длительность в среднем 2 года
Высокая частота (36%) вторичных лейкозов и МДС после использования алкилирующих препаратов (гидроксимочевина и бусульфан)
Слайд 65
Истинная полицитемия-
хроническое миелопролиферативное заболевание, характеризующееся пролиферацией 3-х
ростков кроветворения, повышенным образованием эритроцитов и, в меньшей степени,
лейкоцитов и тромбоцитов
Слайд 66
Стадии эритремии
1 стадия – малосимптомного течения
2А стадия –
эритремическая без миелоидной метаплазии селезенки
2Б стадия – эритремическая с
миелоидной метаплазией селезенки3 стадия – постэритремической миелоидной метаплазии с миелофиброзом и без него
Слайд 67
Клинические симптомы у больных истинной полицитемией
эритроцианотическая окраска кожи
и слизистых
кожный зуд
артериальная гипертензия
гиперурикемия
сосудистые тромбофилические осложнения
(эритромелалгия, головные боли,
нарушения зрения, стенокардия)тромбозы артериальных и венозных сосудов
геморрагии и кровотечения
спленомегалия
гепатомегалия (цирроз, портальная гипертензия)
Слайд 68
Диагностические критерии истинной полицитемии
Нормальные значения насыщения артериальной крови
кислородом (>92%)
Увеличение объема циркулирующих эритроцитов (метод метки с Cr51)
(>36 мл/кг для мужчин и > 32 мл/кг для женщин)спленомегалия
Повышенный гематокрит (>0,51 у М, >0,48 у Ж)
Нормальное или сниженное содержание эритропоэтина в сыворотке крови (< 30 eд/л) или характерный рост BFU-E
Увеличение щелочной фосфатазы нейтрофилов (≥100)
увеличение витамина В12 в сыворотке > 900 пг/мл, витамин В12-связывающей способности сыворотки крови (> 2200 пг/л)
Количество лейкоцитов в крови > 12х109/л (нейтрофилов > 10х109/л), тромбоцитов более 400х109/л
3 х 2
JAK2 мутация – 100% специфичность
Слайд 69
Лечение истинной полицитемии
Эритроцитоферез раз в 3-6 месяцев с
поддержанием уровня гематокрита < 0,41
Слайд 70
Терапевтические опции при истинной полицитемии
аллопуринол
Симптомы гиперурикемии
Аспирин, анагрелид, α-интерферон,
гидроксимочевина
Эритромелалгии, головная боль
Редукция тромбоцитоза и лейкоцитоза α-интерфероном или гидроксимочевиной,
Геморрагии
Анагрелид, α-интерферон, гидроксимочевина
Тромбоцитоз
α-интерферон, гидроксимочевина, спленэктомия, облучение селезенки
Спленомегалия
Антигистаминные, PUVA-терапия (псорален+УФО), α-интерферон, гидроксимочевина
Зуд
флеботомия
Эритроцитоз
Слайд 71
Хронический миеломоноцитарный лейкоз
Хроническое миелопролиферативное заболевание, характеризующееся признаками повышенной
пролиферативной способности гранулоцитарного и моноцитарного ростков кроветворения, наличием диспластических
изменений в 1-3-х ростках гемопоэза
Слайд 72
Диагностические критерии хронического миеломоноцитарного лейкоза
количество моноцитов в
крови >1.0 X 109/L
(100% !) более 3-х месяцев
количество
лейкоцитов в крови >12 x 109/L (50%)анемия
клеточность костного мозга увеличена, бластов и промиелоцитов <20%
хромосомные нарушения у большинства больных (как при МДС),
Ph хромосома и BCR-ABL отсутствуют
увеличение лизоцима в сыворотке и моче
гипокалиемия
возраст больных >60 лет
исключение реактивных моноцитозов
Слайд 73
клиническая картина ХММЛ вариабельна:
- отсутствие симптомов
- слабость, ночные
поты, похудание
- специфическое поражение кожи и слизистых
- спленомегалия (>50%)
-
гепатомегалия- накопление жидкости в серозных полостях (перикард, плевра, брюшная полость, суставы) за счет специфической инфильтрации
Лечение в зависимости от агрессивности течения (наблюдение, гидроксимочевина, этопозид, полихимиотерапия, трансплантация стволовых клеток)
Слайд 74
Ювенильный миеломоноцитарный лейкоз
Клональное заболевание, обусловленное дисрегуляцией системы Ras,
приводящей к селективной гиперчувствительности стволовых клеток к GM-CSF
возраст
<5 летмоноцитоз, нейтрофилез, анемия и тромбоцитопения
выраженная гепатоспленомегалия,
увеличение в крови фетального гемоглобина
отсутствие хромосомных нарушений >80% больных
отсутствие Ph хромосомы и BCR-ABL
злокачественное течение, низкая эффективность терапии
(рецидив после аллогенной трансплантации стволовых клеток 55%)