- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Иммунитет и иммунопатологические состояния
Содержание
- 2. Клиническая иммунология — это клиническая и лабораторная
- 3. У истоков познания вопросов клеточного иммунитета стоял
- 4. Параллельно с Мечниковым разрабатывал свою теорию иммунной
- 5. Две теории - клеточная (фагоцитарная) и гуморальная
- 6. Иммунитет (лат. immunitas - свободный от чего-либо) — способ обеспечения и поддержания антигенного гомеостаза.
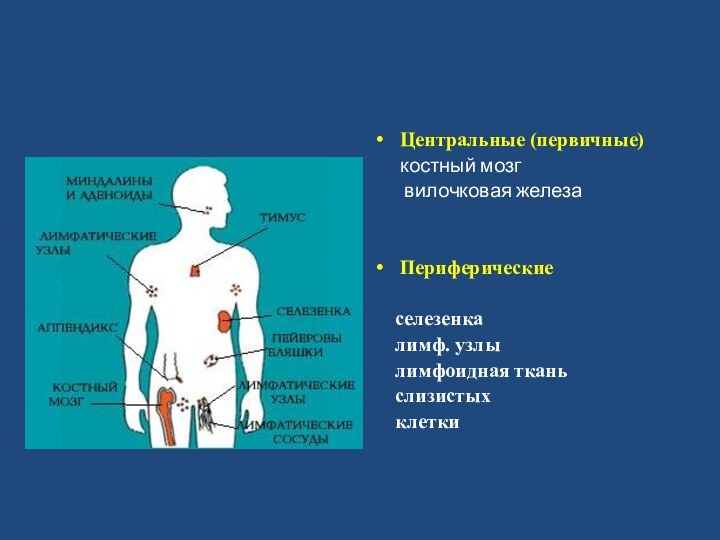
- 7. Центральные (первичные) костный мозг вилочковая железаПериферическиеселезенкалимф. узлылимфоидная ткань слизистыхклетки
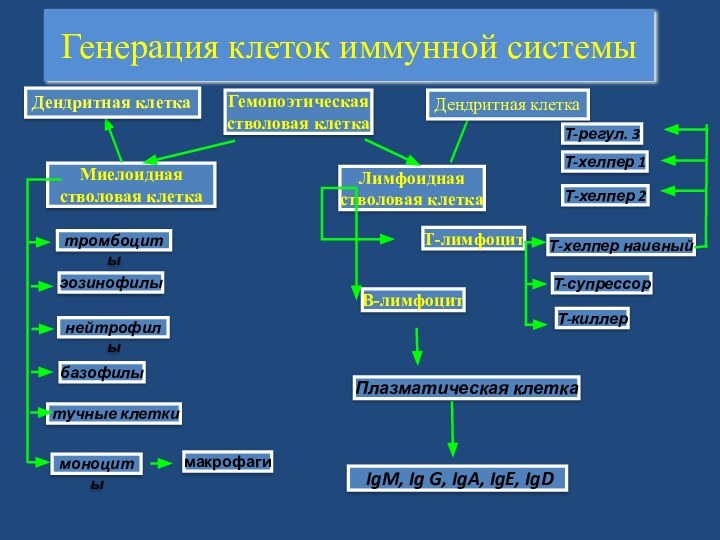
- 8. Генерация клеток иммунной системыГемопоэтическая стволовая клеткаМиелоидная стволовая
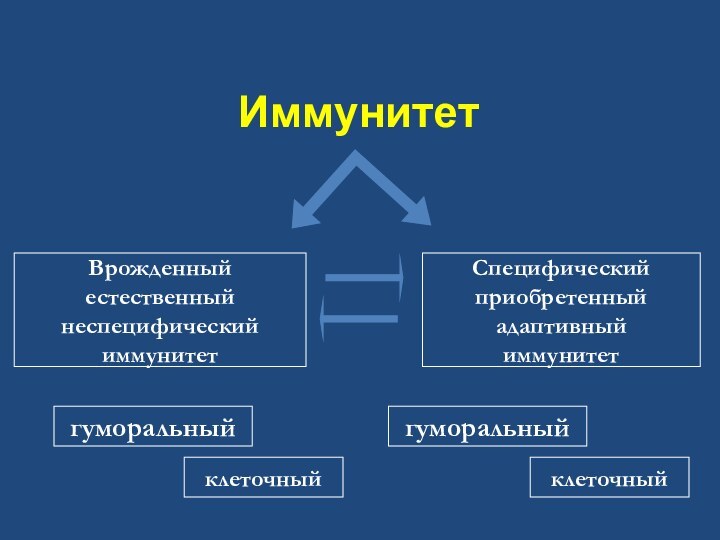
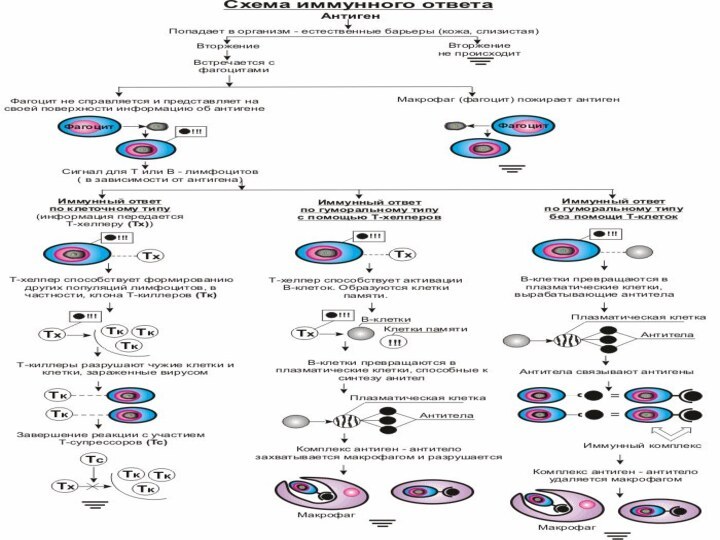
- 9. Иммунитет Врожденный естественныйнеспецифическийиммунитетСпецифическийприобретенный адаптивныйиммунитетгуморальныйклеточныйгуморальныйклеточный
- 10. В основе лежат разные принципы: врожденный иммунитет
- 11. Врожденный / естественный / неспецифический/ иммунитет
- 12. Врожденный / естественный / неспецифический/ иммунитет
- 13. Неспецифические факторы защиты Механические и
- 14. Неспецифические факторы резистентностиФизиологические функции – чихание, рвота,
- 15. Клетки, участвующие в неспецифическом иммунитетеМоноциты (тканевые макрофаги),
- 16. Фагоцитирующие клеткиМикрофаги – это полиморфноядерные лейкоциты (нейтрофилы,
- 17. Стадии фагоцитозаАктивация фагоцитирующей клетки Хемотаксис (приближение к
- 18. Фагоцитоз бактерий макрофагом
- 19. При отсутствии последнего этапа фагоцитоз нарушается и
- 20. МакрофагиКлетки системы мононуклеарных фагоцитов (моноцитарно-макрофагальной системы) выполняют
- 21. Длительность жизни тканевых макрофагов от 40 до
- 22. Тканевые макрофаги – производные моноцитов1. Звездчатые ретикулоэндотелиоциты
- 23. На макрофагах находятся рецепторы к Fc-фрагменту иммуноглобулинов
- 24. Метаболические изменения, которые развиваются в клетке, вовлеченной
- 25. Особенность тканевых макрофагов является наличие гранул –
- 26. Саморегуляторный механизм воспаления заключается в том, что
- 27. ЛейкоцитыЛейкоциты секретируют большое количество цитокинов — биологически
- 28. Базофильные гранулоциты (базофилы) периферической крови и тканевые
- 29. Эта реакция антиген — антитело, происходящая на
- 30. Киллерные клеткиМорфологически естественные киллерные клетки большого размера,
- 31. Лимфокинактивированные киллерные — ЛАК-клетки. К ним относятся
- 32. ОпсонизацияВещества, которые усиливают фагоцитоз, опсонины: активированный 3-й
- 33. Процессинг - процесс переработки антигена макрофагами и другими антигенпредставляющими клетками
- 34. Презентация антигеназахватывая антиген, макрофаграсщепляет и перерабатывает (процессирует)
- 35. ТерминологияМНС – Major Histocompatebility Complex – Главный
- 36. Молекулы ГКГ класса I-Экспрессируются на всех ядерных
- 37. Молекулы ГКГ класса II-Экспрессируются на антиген-презентирующих клетках
- 38. Врожденный / естественный / неспецифический/
- 39. Врожденный / естественный / неспецифический/
- 40. Эффекты цитокинов ФНО способствует остановке и выходу фагоцитирующих
- 41. ИнтерфероныБелки, продуцируются вирусинфицированными клеткамиИндуцируют у клеток-соседей продукцию
- 42. ИнтерфероныРазличают три типа интерферонов: • альфа-интерферон,
- 43. ЛизоцимВ слюне и материнском (грудном) молоке имеется
- 44. КомплементКомплемент – это целая система сывороточных белков и нескольких белков клеточных мембран
- 45. Функции системы комплементаЛизис клетокРастворение ИКУчастие в фагоцитозеУчастие в воспалительной реакцииОбразование хемотаксиновНейтрализация веществ
- 46. В настоящее время известно, что систему комплемента
- 47. Белки острой фазы: - C-реактивный протеин
- 48. Лактоферрин Фактор, определяющий антимикробную гуморальную активность Белок, обладающий
- 49. Врожденный (естественный) иммунитетОсновная функция – защита от
- 50. Особенности врождённого иммунитета, предрасполагающие к развитию инфекций
- 51. Показники вродженого імунітету
- 52. Фагоцитарный показатель: норма — 65—95 %.
- 53. Каким образом система врождённого иммунитета подаёт знак системе приобретённого иммунитета на выработку специфических антител?
- 54. Дендритные клеткиВ 1973 году Ральф Штайнман открыл
- 55. Дендритные клетки в мукозальном иммунитетеДендритные клетки проникают
- 56. Система врождённого иммунитета реагирует на молекулярные структуры,
- 57. PAMPНесмотря на химические различия, все эти структуры
- 58. Толл-подобные рецепторыTLR представляют собой семейство мембранных гликопротеинов
- 59. Толл-подобные рецепторы (Toll-like receptorкласс клеточных рецепторов с
- 60. Дендритная клетка обменивается с Т-клеткой об антигенеДендритная клетка оказывает глубокое влияние на свойства развивающейся Т-клетки
- 61. При взаимодействии РАМР с Toll-подобным рецептором на
- 62. Дендритная клетка взаимодействует с Т-лимфоцитом
- 63. В 2011г. году Нобелевская премия по физиологии
- 64. Неспецифический иммунитетСпецифический иммунитетклеточныйчасыдни, недели
- 65. Приобретенный иммунитет
- 66. Приобретенный иммунитет человек приобретает в течение жизни.
- 67. Приобретенный (адаптивный) иммунитет. Иммунитет, развивающийся по отношению
- 68. Иммунная система сохраняет память о каждом антигене,
- 69. ПРИОБРЕТЕННЫЙ СПЕЦИФИЧЕСКИЙ (АДАПТИВНЫЙ) ИММУНИТЕТПриобретенный специфический (адаптивный) иммунитет
- 70. Морфологическим субстратом специфического иммунного ответа является лимфоидная
- 71. ЛИМФОИДНАЯ ТКАНЬАссоциированная с ЖКТ (GALT – gut-associated
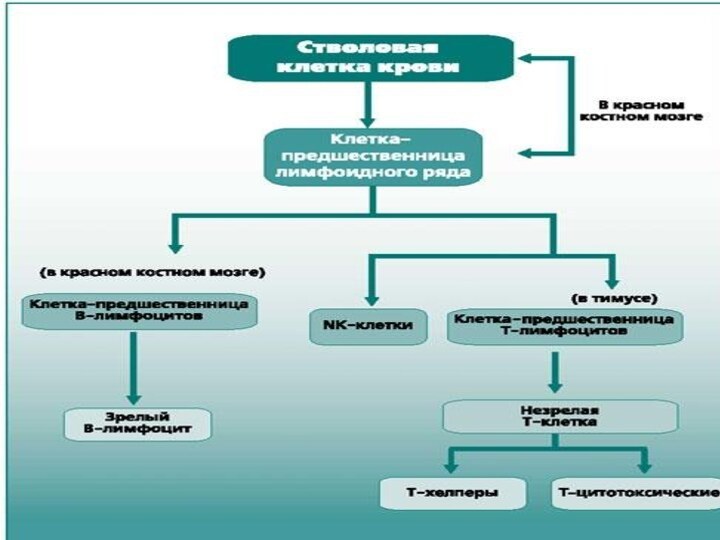
- 73. Лимфоциты. Лимфоциты разделены на популяции: Т-, B-клетки, а также естественные киллеры(NK).
- 74. Все клетки иммунной системы (так же, как
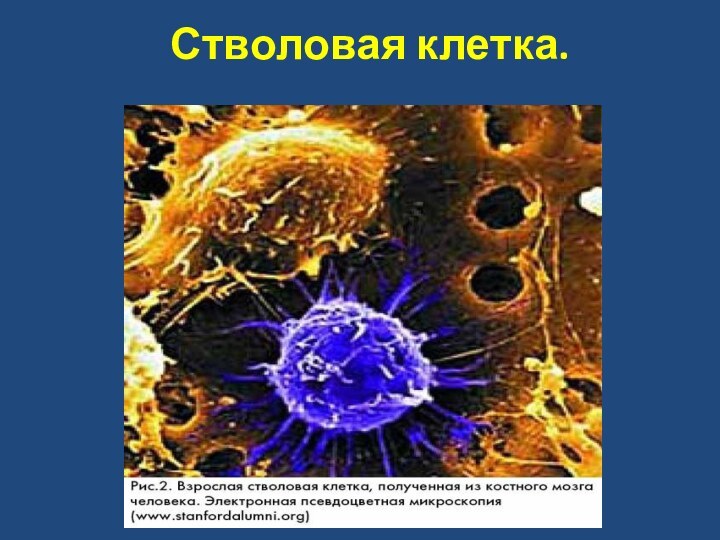
- 75. Стволовая клетка.
- 77. Клонально-селекционная теория: MacFarlane Burnet 1957Каждый лимфоцит имеет
- 78. Т-ЛИМФОЦИТЫЧасть иммунологически незрелых стволовых клеток мигрирует из
- 79. Тимус продуцирует несколько гормонов:Тимозин (фракция 5)Тимопоэтин —Тимический
- 80. На этапе индукции толерантности в вилочковой железе
- 81. Все основные антигенные маркеры лимфоцитов и других
- 82. Т-клетки по их поверхностным гликопротеинам CD4 и
- 83. Встреча Т-лимфоцита со специфическим антигеном включает новый
- 84. CD-4 хелперыВыполняя свою основную хелперную функцию, они
- 85. ТН1T-хелперы CD4+ в зависмости от локализации антигена
- 86. Т-Лимфоциты-хелперы 1-го типа (Txl) продуцируют гамма-интерферон (ИНФ),
- 87. ТН2Если наивная Т-клетка распознает антиген, презентирующийся на
- 88. Обнаружено, что Txl и Тх2 ответственны за
- 89. ДИФФЕРЕНЦИРОВКА Т-ХЕЛПЕРОВ Th2
- 90. CD-8 супрессоры/киллерыДругая субпопуляция Т-лимфоцитов, меньшая по количеству,
- 91. CD-8 цитотоксическиеCD8+ лимфоциты, выполняющие цитотоксические функции. Эти
- 92. Механизмы цитотоксичностиПосле специфического распознавания CD8+ Т-клеткой за
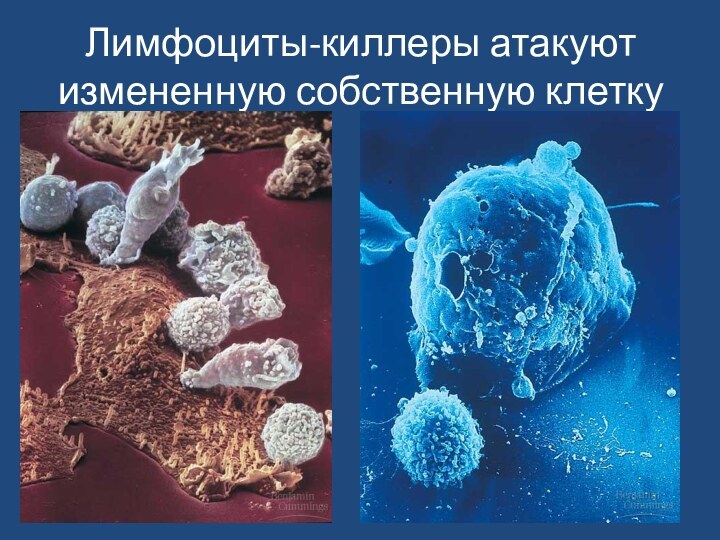
- 93. Лимфоциты-киллеры атакуют измененную собственную клетку
- 94. CD4/CD8Индекс CD4 / CD8 1,5—2,5 соответствует нормергическому
- 95. CD 19, 20 (В-лимфоциты)Клетки гуморального иммунитета, без
- 96. В-ЛИМФОЦИТЫВ-лимфоциты способны выполнять две важные функции: 1)
- 97. Гуморальный иммунный ответ обеспечивается антителами, или иммуноглобинами.
- 98. ИММУНОГЛОБУЛИНЫВначале В-клетки продуцируют и секретируют только IgM.
- 99. Функции антител:Первая линия обороны против инфекций;Удаление из
- 100. Иммуноглобулины класса МГамма глобулины, 5% от всей
- 101. По мере увеличения синтеза IgG и нарастания
- 102. Длительный синтез исключительно (или преимущественно) IgM —признак
- 103. Грамотрицательныемикробы (например все возбудители кишечных инфекций) вызываютвыработку
- 104. Иммуноглобулины класса GУ человека являются наиболее важными.
- 105. Иммуноглобулины класса А15% от всей фракцииДелят на
- 106. Секреторный IgA преобладает в слюне, слезах, секретах
- 107. ИММУНОГЛОБУЛИН ЕКонцентрация IgE в сыворотке крови
- 108. Иммуноглобулин Е быстро и прочно связывается с
- 109. Иммуноглобулин Е продуцируется плазматическими клетками селезенки, миндалин, аденоидов, слизистых оболочек дыхательных путей, желудка и кишок.
- 110. Повышение уровня иммуноглобулинов класса IgE наблюдается у
- 111. ИММУНОГЛОБУЛИН DИммуноглобулин D был обнаружен в 1965
- 112. ЦитокиныМежклеточная сигнализация осуществляется либо путем непосредственного контактного
- 113. Эффекторные механизмыИЛ обеспечивают взаимосвязь отдельных видов лейкоцитов
- 114. Функциональные группы цитокиновГематопоэтические цитокиныЦитокины доиммунного воспаления (провоспалительные)
- 115. БИОЛОГИЧЕСКИЕ ЭФФЕКТЫ ЦИТОКИНОВ. 1. Пролиферация (деление клеток
- 116. Классификация цитокинов
- 120. РОСТОВЫЕ ФАКТОРЫгранулоцитарный колониестимулирующий фактор.гранулоцитарно-моноцитарный колониестимулирующий фактор.трансформирующий фактор роста
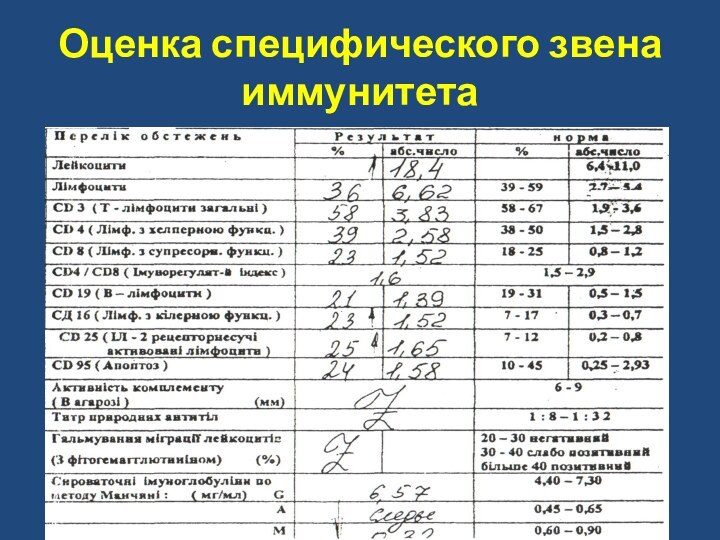
- 121. Оценка специфического звена иммунитета
- 123. От чего зависит результат первичного иммунного ответа?от
- 124. Возрастные особенности иммунитета у детей Механизмы толерантности
- 125. К онтогенетическим особенностям клеточного иммунитета новорождённых относят:усиление
- 126. К онтогенетическим особенностям гуморального иммунитета новорождённых относят:малая
- 127. Критические периоды развития иммунобиологической реактивности Первый такой
- 128. Второй критический период (3—6 мес.)Ослабление пассивного гуморального
- 129. Второй критический период (3—6 мес.)Вакцинация может не
- 130. Третий критический период (второй год жизни)Значительно расширяются
- 131. Четвертый критический период — подростковый возраст
- 132. В критические периоды становления иммунной системы особенно часто проявляются наследственные вариации силы иммунного ответа
- 133. Поздний иммунологический стартНизкая масса тела при рождении;
- 134. Первичные иммунодефицитные состояния: 10 настораживающих признаков
- 135. ИДС по частоте встречаемости Дефицит
- 136. Показания к назначению иммунограммы Подозрение на наличие
- 137. Проточная цитометрия Проточная цитометрия — метод оптического измерения параметров
- 138. Скачать презентацию
- 139. Похожие презентации
Клиническая иммунология — это клиническая и лабораторная дисциплина, которая занимается обследованием, диагностикой и лечением больных с заболеваниями или патологическими процессами, развивающимися в результате нарушения иммунных механизмов, а также теми случаями, когда иммунологические манипуляции являются важной частью

























































































































Слайд 3 У истоков познания вопросов клеточного иммунитета стоял русский
биолог-эволюционист Илья Мечников. В 1883 году он сделал первое
сообщение по фагоцитарной (клеточной) теории иммунитета.Слайд 4 Параллельно с Мечниковым разрабатывал свою теорию иммунной защиты
от инфекции немецкий фармаколог Пауль Эрлих. В сыворотке крови
животных, зараженных бактериями, появляются белковые вещества " антитела", способные убивать патогенные микроорганизмы.Характерное свойство антител - это их ярко выраженная специфичность.
Слайд 5 Две теории - клеточная (фагоцитарная) и гуморальная -
в период своего возникновения стояли на антагонистических позициях.
В
1908г. обоим ученым одновременно была присуждена Нобелевская премия.
Слайд 6
Иммунитет (лат. immunitas - свободный от чего-либо) —
способ обеспечения и поддержания антигенного гомеостаза.
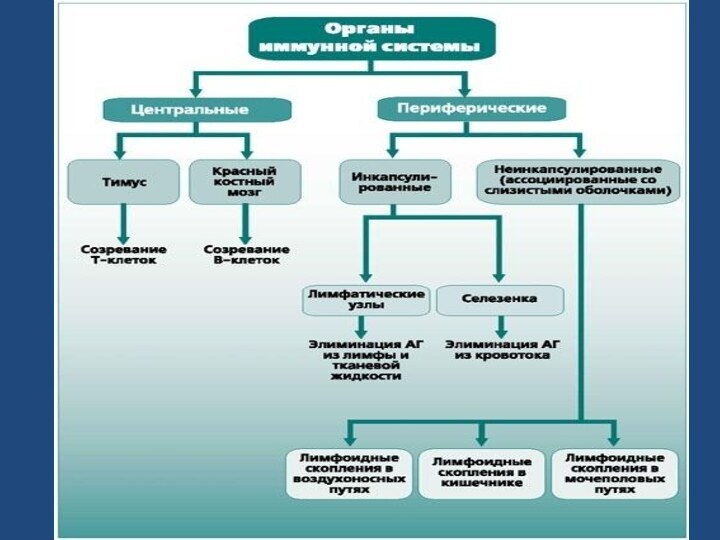
Слайд 7
Центральные (первичные)
костный мозг
вилочковая
железа
Периферические
селезенка
лимф. узлы
лимфоидная ткань
слизистых
клетки
Слайд 8
Генерация клеток иммунной системы
Гемопоэтическая
стволовая клетка
Миелоидная
стволовая клетка
тромбоциты
эозинофилы
базофилы
нейтрофилы
моноциты
макрофаги
тучные клетки
Лимфоидная
стволовая клетка
В-лимфоцит
Плазматическая клетка
IgM, Ig G, IgA,
IgE, IgDТ-лимфоцит
Т-киллер
Т-хелпер наивный
Т-супрессор
Т-хелпер 1
Т-хелпер 2
Т-регул. 3
Дендритная клетка
Дендритная клетка
Слайд 9
Иммунитет
Врожденный
естественный
неспецифический
иммунитет
Специфический
приобретенный
адаптивный
иммунитет
гуморальный
клеточный
гуморальный
клеточный
Слайд 10
В основе лежат разные принципы:
врожденный иммунитет функционирует
опираясь на воспаление и фагоцитоз
приобретенный использует антитела и иммунные
лимфоциты.
Слайд 12
Врожденный
/ естественный / неспецифический/
иммунитет
Компоненты естественной защиты реагируют
на все чужеродные вещества сходным образом, и поэтому распознавание
антигенов происходит у разных людей одинаково.
Слайд 13
Неспецифические факторы защиты
Механические и физические факторы защиты:
кожа, слизистые, секреты (слизь,слезы, моча, слюна и т.д.),
Химические
и биохимические реакции: молочная и жирные кислоты, обеспечивающие рН, лизоцим (естественный антибиотик)Белки острой фазы: СРБ, кинины
Интерфероны
Цитокины
Неспецифическая активация комплемента
Неспецифический фагоцитоз (мононуклеарные фагоциты, гранулоциты, киллерные клетки (естественные киллерные клетки, киллерные, ЛАКклетки)
Слайд 14
Неспецифические факторы резистентности
Физиологические функции – чихание, рвота, понос,
которые способствуют элиминации патогенных агентов из организма.
Физиологические факторы
– температура тела, концентрация кислорода, гормональный баланс. гормональный баланс имеет большое значение для иммунного ответа. Например, увеличение продукции кортикостероидов подавляет воспалительные процессы и снижает резистентность организма к инфекции
Слайд 15
Клетки, участвующие в неспецифическом иммунитете
Моноциты (тканевые макрофаги), гранулоциты
Лимфоциты
- киллерные клетки – естественные (ЕК-клетки), просто киллерные (К)
и лимфокин-активированные киллерные клетки (ЛАК-клетки).Дендритные клетки
Слайд 16
Фагоцитирующие клетки
Микрофаги – это полиморфноядерные лейкоциты (нейтрофилы, базофилы,
эозинофилы), эффективны против условнопатогенных микроорганизмов
Нейтрофилы способны элиминировать Гр(–) и
Гр(+) бактерии, грибы и даже некоторые оболочечные вирусы.Макрофаги – мононуклеарные фагоциты (1-6 %)
Макрофаги поглощают и разрушают в основном Гр(–) бактерии
Слайд 17
Стадии фагоцитоза
Активация фагоцитирующей клетки
Хемотаксис (приближение к объекту)
Стадия
опсонизации (опсоны -растворимые белки, способные одной своей стороной связать
микроб, а второй стороной – специальный рецептор (к себе) на клетке - фагоците)Прикрепление опсонизирующей частицы на поверхности фагоцита
Стадия захвата
Образование фагоцитосомы (собственно заглатывание)
Стадия умерщвления и переваривания
Стадия исхода - переваривание поглощенного объекта.
Слайд 19
При отсутствии последнего этапа фагоцитоз нарушается и носит
название незавершенного.
Фагоцитированные микроорганизмы выживают и могут длительно оставаться
во вторичных лизосомах.
Слайд 20
Макрофаги
Клетки системы мононуклеарных фагоцитов (моноцитарно-макрофагальной системы) выполняют в
организме двоякую функцию.
Фагоцитоз в рамках врожденного неспецифического иммунитета
Способность
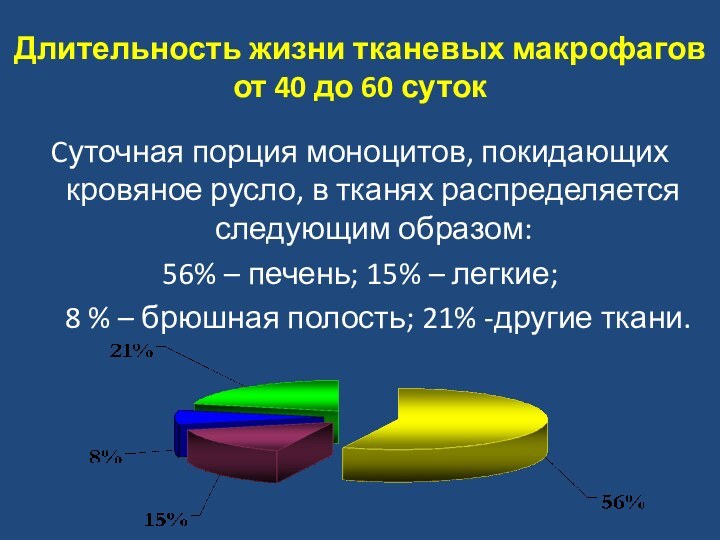
взаимодействовать с лимфоидными, "включая" и регулируя механизмы специфического адаптивного иммунитета. Эти функции моноцитарно-макрофагальные клетки выполняют за счет способности презентировать (представлять) чужеродный антигенный материал для распознавания Т-лимфоцитам и продуцировать цитокины.Слайд 21 Длительность жизни тканевых макрофагов от 40 до 60
суток
Cуточная порция моноцитов, покидающих кровяное русло, в тканях распределяется
следующим образом: 56% – печень; 15% – легкие;
8 % – брюшная полость; 21% -другие ткани.
Слайд 22
Тканевые макрофаги – производные моноцитов
1. Звездчатые ретикулоэндотелиоциты (купферовские
клетки) печени.
2. Плевральные и перитонеальные макрофаги.
3. Альвеолярные
макрофаги. 4. Интердигитирующие клетки лимфатических узлов.
5. Макрофаги вилочковой железы (тимические).
6. Костномозговые макрофаги.
7. Остеокласты.
8. Синовиальные клетки (тип А).
9. Глиальные макрофаги (микроглиоциты) мозга.
10. Мезангиальные клетки почек.
11. Поддерживающие клетки (клетки Sertoli) яичка.
12. Дендритные клетки лимфатических узлов и селезенки.
13. Клетки Лангерганса кожи и слизистых.
Слайд 23
На макрофагах находятся рецепторы к
Fc-фрагменту иммуноглобулинов классов
А, М, Е и разным субклассам иммуноглобулина G,
различным
лимфокинам, гормонам и регуляторным пептидам,
ко многим компонентам комплемента — СЗ, Clq, C4b, C5b, C5a.
Слайд 24 Метаболические изменения, которые развиваются в клетке, вовлеченной в
процесс фагоцитоза, получили название респираторного взрыва
Характеризуется следующими моментами: увеличением потребления кислорода,
увеличением продукции перекиси водорода, супероксидного аниона и синглетного кислорода.
Супероксидный анион является чрезвычайно токсичным для бактерий и тканей, однако он очень нестабилен и под влиянием супероксиддисмутазы быстро превращается в перекись водорода, которая все еще продолжает быть токсичной по отношению к бактериям.
Перекись водорода разрушается под действием фермента каталазы. Вещества, реализующие кислородзависимый механизм разрушения микроорганизмов, могут действовать как сами по себе, так и синергически, образуя в конечном итоге гипохлорит, который является одним из наиболее сильных антимикробных агентов.
Слайд 25 Особенность тканевых макрофагов является наличие гранул – лизосом
диаметром 0,25-0,5 мкм с ферментами: кислые гидролазы, кислая фосфатаза,
альфа-нафтилэстераза, кислая и другие эстеразы, липаза, катепсины, эластаза, лизоцим, миелопероксидаза, коллагеназа, катионные белки и лактоферин.
Слайд 26
Саморегуляторный механизм воспаления заключается в том, что одновременно
с хемотаксическим привлечением макрофагов в очаг воспаления и их
иммобилизацией начинается накопление ингибиторов хемотаксиса и миграции макрофагов.
Слайд 27
Лейкоциты
Лейкоциты секретируют большое количество цитокинов — биологически активных
веществ, обладающих регуляторными и защитными свойствами.
гранулоцитарно-моноцитарный колониестимулирующий фактор.
опухольнекротизирующий,
или фактор некроза опухолей (ФНО). интерлейкин-1
компоненты комплемента.
альфа-интерферон,
Слайд 28 Базофильные гранулоциты (базофилы) периферической крови и тканевые базофилы (тучные
клетки).
Базофилы циркулируют в крови, где они составляют 0,1—1% лейкоцитов.
Тканевые базофилы расположены преимущественно в слизистых оболочках и соединительной ткани, особенно вблизи сосудов.Базофилы обоих типов являются основным депо гистамина, который содержится в них в специальных гранулах в комплексе с гепарином. Кроме гистамина и гепарина, в базофильных гранулоцитах и тканевых базофилах содержатся серотонин, медленно реагирующее вещество анафилаксии и факторы хемотаксиса нейтрофилов.
Оба типа клеток обладают способностью к хемотаксису и фагоцитозу. Основной характерной особенностью этих клеток является наличие на их поверхности рецепторов для Fc-фрагмента IgE. Вырабатывающиеся в организме IgE связываются с этими рецепторами и, при последующем попадании в организм специфического антигена, вступают с ним во взаимодействие
Слайд 29 Эта реакция антиген — антитело, происходящая на мембране
базофилов обоих типов, приводит к их активации и высвобождению
активных компонентов гранул во внеклеточную среду (реакция дегрануляции).Так запускается один из мощнейших защитных механизмов —реакция гиперчувствительности немедленного типа( JgЕ – зависимая)
В результате дегрануляции тканевых базофилов нарушается сосудисто-тканевая проницаемость с выходом из сосудистого русла через образовавшиеся в микрососудах "поры" форменных (клеточных) элементов и жидкой части крови, что
приводит к появлению отека, гиперемии кожи, а также к возникновению зуда и боли.
Слайд 30
Киллерные клетки
Морфологически естественные киллерные клетки большого размера, с
зернистостью и низкой плотностью, на основании чего их относят
к большим гранулярным лимфоцитам.Естественные киллерные (ЕК-клетки),
Киллерные (К-клетки)
Лимфокин-активированные киллерные (ЛАК-клетки)
Наибольшую активность ЕК-клетки проявляют по отношению к опухолевым и пораженным вирусом клеткам.
Слайд 31
Лимфокинактивированные киллерные — ЛАК-клетки.
К ним относятся обычные лимфоциты,
которые были активированы под влиянием ИЛ-2 и приобрели способность
осуществлять киллинговый эффект.
Слайд 32
Опсонизация
Вещества, которые усиливают фагоцитоз, опсонины: активированный 3-й компонент
комплемента — СЗв. Если бактерии или какие-то чужеродные частицы
имеют на своей поверхности комплемент, в частности активированный СЗв, то это будет способствовать более тесному взаимодействию фагоцитов с такими микроорганизмами
Слайд 33
Процессинг - процесс переработки антигена макрофагами и другими
антигенпредставляющими клетками
Слайд 34
Презентация антигена
захватывая антиген, макрофаг
расщепляет и перерабатывает (процессирует) его,
затем презентирует (представляет) иммуногенный фрагмент антигена в виде пептида
на своей поверхности вместе с молекулами главного комплекса гистосовместимости. Только при таких условиях антиген будет распознан Т-лимфоцитами.
Слайд 35
Терминология
МНС – Major Histocompatebility Complex – Главный Комплекс
Гистосовместимости –для всех млекопитающих
HLA – Human Leukocyte Antigens –
Лейкоцитарные Антигены ЧеловекаРоль этих белков — служить маркёрами идентичности на поверхности различных клеток, с которыми Т-лимфоциты взаимодействуют через собственные рецепторы в иммунной реакции.
Слайд 36
Молекулы ГКГ класса I
-Экспрессируются на всех ядерных клетках
организма
-В «бороздке» молекул ГКГ класса I присутствуют эндогенные пептиды
(собственного организма или «сделанные» из внутриклеточных возбудителей, например, вирус,хламидия)-Эндогенные пептиды в молекуле ГКГ класса I распознаются наивными СД8+ Т-лимфоцитами киллерами
Слайд 37
Молекулы ГКГ класса II
-Экспрессируются на антиген-презентирующих клетках (дендритные
клетки,макрофаги.В-лимфоциты)
-В «бороздке» молекулы ГКГ присутствуют экзогенные пептиды
-Экзогенные пептиды в
молекуле ГКГ класса II рапознаются наивными СД4+ Т-лимфоцитами хелперами
Слайд 38
Врожденный
/ естественный / неспецифический/ иммунитет
Гуморальный компонент
Тканевые
макрофаги способны секретировать большое количество биологически активных веществ -
цитокиновСлайд 39 Врожденный / естественный / неспецифический/ иммунитет Гуморальный
компонент
Цитокины — это белковые молекулы (протеины, или пептиды, в
т.ч. гликозилированные), с помощью которых клетки иммунной системы могут обмениваться друг с другом информацией и осуществлять координацию действий. К настоящему времени открыты около 200 разнообразных цитокинов.
Интерфероны (IFN, ИФН)
Интерлейкины (IL, ИЛ)
Хемокины
Колониестимулирующие факторы (CSF, КСФ)
Факторы некроза опухоли (TNF, ФНО)
Трансформирующие факторы роста (TGF, ТФР)
Слайд 40
Эффекты цитокинов
ФНО способствует остановке и выходу фагоцитирующих клеток
из капилляров в очаг воспаления, а также сам активирует
макрофаг;IL-1, действуя на гипоталамус, вызывает повышение температуры и озноб.
Слайд 41
Интерфероны
Белки, продуцируются вирусинфицированными клетками
Индуцируют у клеток-соседей продукцию антивирусных
белков, которые воздействуют на транскрипцию вирусной матричной РНК, подавляя
репликацию вируса.Интерфероны усиливают активность макрофагов, цитотоксическую активность естественных киллерных клеток, Т-клеток.
Слайд 42
Интерфероны
Различают три типа интерферонов:
• альфа-интерферон, который
секретируется лейкоцитами и индуцируется вирусами или синтетическими полинуклеотидами;
•
бета-интерферон, секретируемый фибробластами и продуцируемый под влиянием вирусов или синтетических полинуклеотидов; • гамма-интерферон, или иммунный, который секретируется Т-лимфоцитами хелперами 1 типа после стимуляции специфическим антигеном.
Слайд 43
Лизоцим
В слюне и материнском (грудном) молоке имеется также
лактопероксидаза,, являющейся микробицидным агентом.
Лизоцим, который имеется не только в
клетках, но и в жидких средах организма — слезах, слюне, назальном секрете и др., и, как известно, обладает большой активностью по отношению к различным бактериям ( природный антибиотик)
Слайд 44
Комплемент
Комплемент – это целая система сывороточных белков и
нескольких белков клеточных мембран
Слайд 45
Функции системы комплемента
Лизис клеток
Растворение ИК
Участие в фагоцитозе
Участие в
воспалительной реакции
Образование хемотаксинов
Нейтрализация веществ
Слайд 46
В настоящее время известно, что систему комплемента составляют
9 основных белков и 3 ингибитора.
Эта система белков
активируется по типу ферментативно-каскадной реакции с образованием растворимых и нерастворимых ферментов и комплексов, способных вызывать различные биологические феномены. Компоненты, входящие в состав системы комплемента обозначаются прописной (большой) буквой С с порядковым номерами от 1 до 9.
Слайд 47
Белки острой фазы:
- C-реактивный протеин (СРБ)
- фибриноген
Главное
анатомическое место синтеза белков острой фазы – печень.
Слайд 48
Лактоферрин
Фактор, определяющий антимикробную гуморальную активность
Белок, обладающий способностью
связывать железо, необходимое для метаболизма бактериальной клетки.
Подобным образом
«работает» и трансферрин – сывороточный бета-глобулин, который содержится в фагоцитах.
Слайд 49
Врожденный (естественный) иммунитет
Основная функция – защита от инфекций
•
существует с момента рождения
• не обладает специфичностью по отношению
к микробным антигенам• не усиливается при повторном контакте с антигеном
• не обладает памятью
• имеет клеточные и гуморальные компоненты
• слабо эффективен при отсутствии приобретенного иммунного ответа
Слайд 50 Особенности врождённого иммунитета, предрасполагающие к развитию инфекций у
новорождённого
Анатомические Вероятность травматизации кожи и слизистых оболочек во время
родов,барьеры Нарушения естественных барьеров при инвазивных манипуляциях в ходе реанимации (катетеризация пупочных и центральных вен, интубация трахеи).
Фагоцитоз Ограниченный объём резервного пула полиморфноядерных лейкоцитов.
Сниженная способность к адгезии и хемотаксису нейтрофилов и моноцитов.
Сниженные показатели микробоцидности и внутриклеточного киллинга бактерий гранулоцитами новорождённых при осложнённом течении неонатального периода.
Подавление фагоцитоза как следствие перинатальной гипоксии и стресса.
Система Сниженные уровни различных компонентов комплемента,
комплемента Сниженная экспрессия рецепторов к компонентам комплемента
Цитокины Низкий уровень продукции фактора некроза опухоли, ИЛ-12 и интерферона-у. Низкий уровень экспрессии рецепторов к цитокинам на поверхности Т- и В-лимфоцитов ( рецепторов к ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-7 и интерферону-у)
Естественные Большое количество естественных киллерных клеток по сравнению
киллерные клетки с таковыми у взрослых доноров, Сниженная цитотоксическая активность естественных киллеров в периоде новорождённости
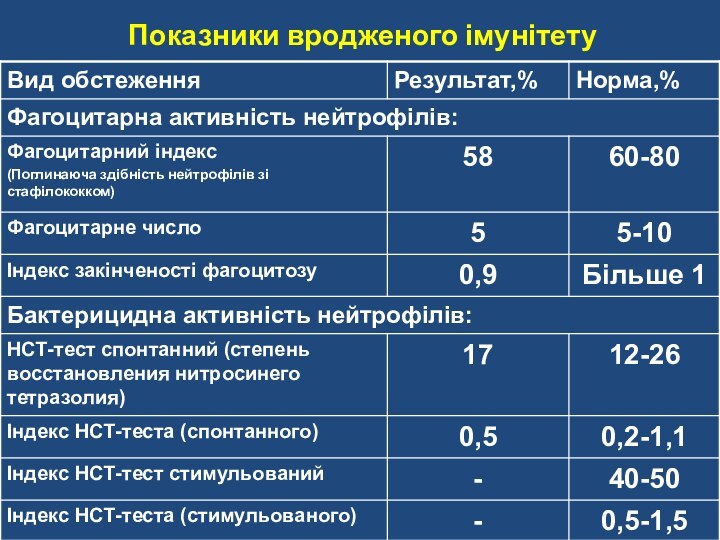
Слайд 52 Фагоцитарный показатель: норма — 65—95 %. Фагоцитарный
показатель – количество нейтрофилов, участвующих в фагоцитозе.
Количество активных фагоцитов:
норма — 1,6—5,0 10^9 в 1 л крови Абсолютное число фагоцитирующих нейтрофилов в 1 л крови.
Индекс завершенности фагоцитоза: норма > 1,0.
Индекс завершенности фагоцитоза - переваривающая способность фагоцитов.
Слайд 53
Каким образом система врождённого иммунитета подаёт знак системе
приобретённого иммунитета на выработку специфических антител?
Слайд 54
Дендритные клетки
В 1973 году Ральф Штайнман открыл новый
вид клеток, которые назвал дендритными, поскольку внешне они напоминали
дендриты нейронов.Клетки обнаружились во всех тканях организма, которые соприкасались с внешней средой: в коже, лёгких, слизистой оболочке желудочно-кишечного тракта.
Слайд 55
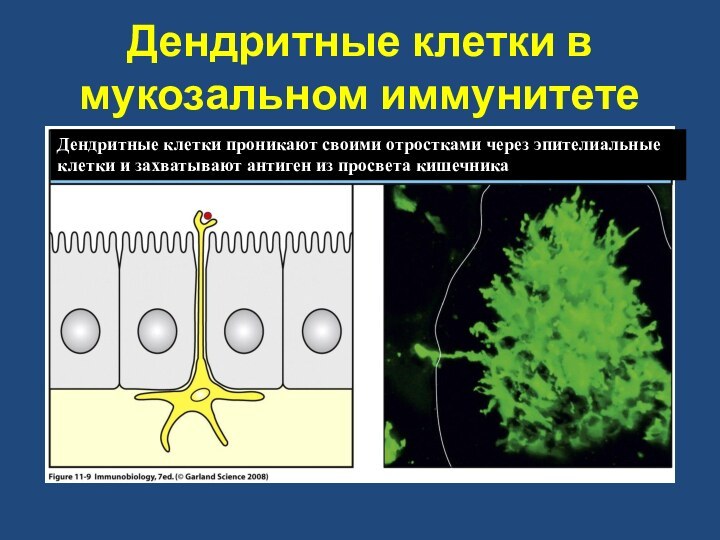
Дендритные клетки в мукозальном иммунитете
Дендритные клетки проникают своими
отростками через эпителиальные клетки и захватывают антиген из просвета
кишечника
Слайд 56
Система врождённого иммунитета реагирует на молекулярные структуры, присущие
всем патогенным микроорганизмам. Эти структуры получили название «патоген-ассоциированные молекулярные
образы» (pathogen-associated molecular patterns — PAMP).Такими PAMP служат молекулы, входящие в состав клеточной мембраны бактерий.
Слайд 57
PAMP
Несмотря на химические различия, все эти структуры обладают
следующими свойствами:
они синтезируются только микроорганизмами (в клетках животных
их нет, поэтому распознавание PAMP расценивается иммунной системой как сигнал к началу борьбы с чужаком); они характерны для целого ряда патогенов, а не только для одного;
эти структуры являются важными для жизнедеятельности бактерии, поэтому в процессе эволюции они меняются очень медленно (иначе иммунная система просто не успевала бы настраивать распознавание )
Слайд 58
Толл-подобные рецепторы
TLR представляют собой семейство мембранных гликопротеинов присутствующих
прежде всего на дендритных клетках, макрофагах и полиморфноядерных гранулоцитах.
Слайд 59
Толл-подобные рецепторы (Toll-like receptor
класс клеточных рецепторов с одним
трансмембранным фрагментом, которые распознают консервативные структуры микроорганизмов и активируют
клеточный иммунный ответ.Играют ключевую роль во врождённом иммунитете.
У человека существует 10 толл-подобных рецепторов (от TLR1 до TLR10)
Слайд 60
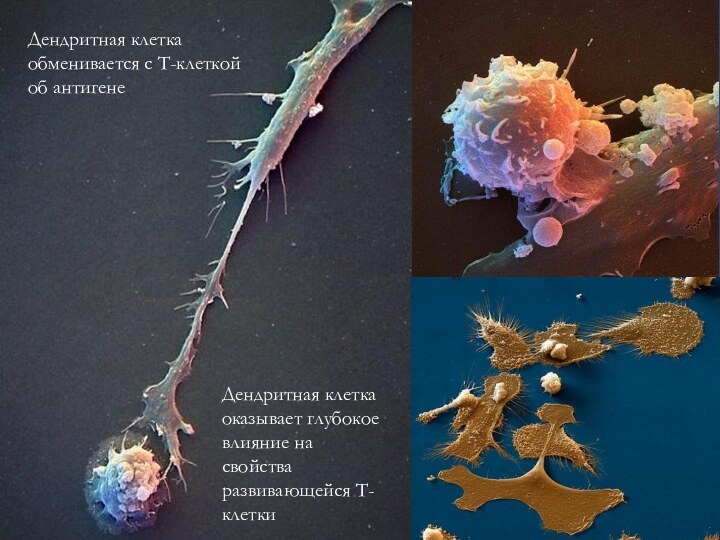
Дендритная клетка обменивается с Т-клеткой об антигене
Дендритная клетка
оказывает глубокое влияние на свойства развивающейся Т-клетки
Слайд 61
При взаимодействии РАМР с Toll-подобным рецептором на поверхности
дендритной клетки появляются белки-антигены, которые и запускают адаптивный иммунный
ответ T-клеток.дендритные клетки служат посредниками между врождённым и приобретённым иммунитетом.
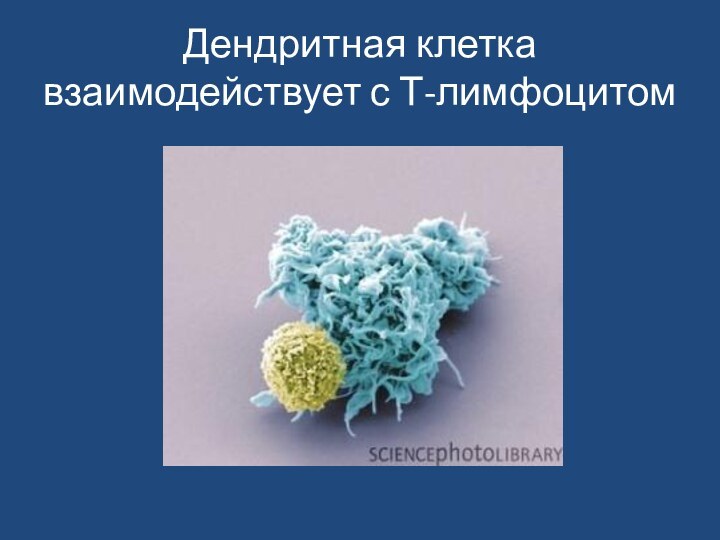
Слайд 63
В 2011г. году Нобелевская премия по физиологии и
медицине присуждена Брюсу Бойтлеру и Жюлю Хоффманну за открытие
механизмов активации врождённого иммунитета, и Ральфу Штайнману за открытие дендритных клеток и их роли в активации адаптивного иммунитета.
Слайд 66
Приобретенный иммунитет человек приобретает в течение жизни.
При
рождении человека иммунная система еще не контактировала с внешним
миром и не имеет памяти о разнообразных антигенах. Она учится реагировать на каждый новый антиген, с которым сталкивается конкретный человек, и запоминать его, поэтому приобретенный иммунитет очень специфичен.
Слайд 67
Приобретенный (адаптивный) иммунитет.
Иммунитет, развивающийся по отношению к конкретной
инфекции (специфический)
развивает патоген-специфический иммунный ответ;
обладает памятью;
быстрее реагирует при повторном
контакте с патогеном;состоит из клеточного и гуморального компонентов;
мало эффективен при нарушении врожденного иммунитета.
Специфические антитела, развивающиеся против патогена, можно использовать для диагностики инфекции.
Слайд 68
Иммунная система сохраняет память о каждом антигене, независимо
от того, попадал ли он в организм через легкие
(при дыхании), кишечник (с пищей) или кожу. Это возможно благодаря тому, что лимфоциты живут долго. Когда эти клетки сталкиваются с антигеном во второй раз, они запускают быстрый, энергичный, специфический ответ на него.
Слайд 69
ПРИОБРЕТЕННЫЙ СПЕЦИФИЧЕСКИЙ
(АДАПТИВНЫЙ) ИММУНИТЕТ
Приобретенный специфический (адаптивный) иммунитет реализуется лимфоцитами,
и его также можно разделить на два компонента(звена): гуморальный
и клеточный.Гуморальный специфический иммунитет реализуется В-лимфоцитами и продуцируемыми ими иммуноглобулинами.
Клеточный специфический иммунитет представлен популяцией Т-лимфоцитов, среди которых выделяют хелперы, киллеры и супрессоры.
Слайд 70 Морфологическим субстратом специфического иммунного ответа является лимфоидная ткань,
представленная центральными лимфоидными органами (тимус, костный мозг) и периферическими
(лимфоузлы, селезенка и ассоциированные с кишечником лимфоидные образования).
Слайд 71
ЛИМФОИДНАЯ ТКАНЬ
Ассоциированная с ЖКТ (GALT – gut-associated lymphoid
tissues) – миндалины, аденоиды, аппендикс, пейеровы бляшки, внутриэпителиальные лимфоциты
слизистой оболочки кишкиЛимфоидная ткань других слизистых оболочек (MALT – mucosal-associated lymphoid tissue)
Ассоциированная с бронхами/бронхиолами (BALT – bronchial associated lymphoid tissue). IEL слизистой оболочки дыхательной системы
Лимфоидная подсистема кожи, включающая в себя субпопуляцию внутриэпителиальных лимфоцитов кожи и регионарные лимфатические узлы и сосуды лимфодренажа
Особые субпопуляции лимфоцитов в печени
Периферическая кровь
Слайд 73
Лимфоциты.
Лимфоциты разделены на популяции:
Т-, B-клетки, а
также естественные киллеры(NK).
Слайд 74
Все клетки иммунной системы (так же, как и
все клетки крови) происходят из единого предшественника — гемопоэтической
полипотентной стволовой клетки
Слайд 77
Клонально-селекционная теория: MacFarlane Burnet 1957
Каждый лимфоцит имеет один
рецептор с уникальной специфичностью.
Взаимодействие с антигеном приводит к активации
лимфоцитовДочерние клетки наследуют уникальную антигенную специфичность
родительской клетки
Слайд 78
Т-ЛИМФОЦИТЫ
Часть иммунологически незрелых стволовых клеток мигрирует из костного
мозга в вилочковую железу (тимус), где под влиянием тимического
микроокружения, прежде всего эпителиальных клеток и гормонов тимуса, созревают до иммунокомпетентных Т-лимфоцитов.
Слайд 79
Тимус продуцирует несколько гормонов:
Тимозин (фракция 5)
Тимопоэтин —
Тимический гуморальный
фактор
Тимулин, или сывороточный тимический фактор
общим для всех перечисленных гормонов
тимуса является их участие в процессах дифференцировки Т-лимфоцитов
Слайд 80
На этапе индукции толерантности в вилочковой железе из
тимоцитов, которые несут два дифференцировочных антигена CD4 и CD8
являются так называемыми CD4+CD8+ клетками, образуются субпопуляции Т-лимфоцитов: Т-хелперы (CD4+CD8- клетки) и Т-киллеры/супрессоры (CD4-CD8+ клетки).На этом заканчивается период антигеннезависимой дифференцировки Т- и В-лимфоцитов, они покидают вилочковую железу и костный мозг и расселяются в Т- и В-зонах (соответственно) периферических органов иммунной системы.
Расселяющиеся лимфоциты называются зрелыми покоящимися клетками, готовыми к иммунному ответу
Слайд 81
Все основные антигенные маркеры лимфоцитов и других клеток
иммунной системы сведены в группу и обозначены как кластеры
дифференцировки, или CD (claster of differentiation).Набор различных CD на поверхности отдельной клетки составляет ее фенотип (поверхностную характеристику).
Слайд 82
Т-клетки по их поверхностным гликопротеинам CD4 и CD8
под-
разделяют на две большие категории
CD4+ Лимфоциты получили название
Т-лимфоциты-хелперы/индукторы, их количество в периферической крови достигает 55—60% от общего числа Т-лимфоцитов.CD8+ Лимфоциты названы Т-лимфоцитами-
киллерами/супрессорами, их содержание в периферической крови составляет 20—30%.
Слайд 83
Встреча Т-лимфоцита со специфическим антигеном включает новый этап
в жизни Т-лимфоцита— этап антигензависимой дифференцировки (в отличие от
антигеннезависимой, которая прошла тимусе);Распознавание специфического антигена приводит к активации Т-лимфоцита и последующей его пролиферации, заканчивающейся появлением в организме большого количества (клона) Т-лимфоцитов определенной специфичности, способной реализовывать иммунный ответ.
Слайд 84
CD-4 хелперы
Выполняя свою основную хелперную функцию, они помогают,
во-первых, В-клеткам превращаться в антителопродуцирующую плазматическую клетку;
во-вторых, CD8+ лимфоцитам
— в зрелую цитотоксическую Т-клетку;в-третьих, макрофагам осуществлять эффекты гиперчувствительности замедленного типа.
Слайд 85
ТН1
T-хелперы CD4+ в зависмости от локализации антигена (
макрофаги , В-клетки и др.) трансформируются в две субпопуляции:
ТН1 и ТН2.Если наивная Т-клетка распознает антиген, презентирующийся макрофагом , то она трансформируется в ТН1-клетки воспаления. Функция таких клеток - усиление активности макрофагов, направленной на уничтожение захваченного антигена, или приведение его в иммуногенную форму.
Слайд 86
Т-Лимфоциты-хелперы 1-го типа (Txl) продуцируют гамма-интерферон (ИНФ), ИЛ-2
и альфа-опухольнекротизирующий фактор
(ОНФ).
Указанные цитокины активируют макрофаги,
ЕК-клетки, созревание цитотоксических Т-лимфоцитов-киллеров, обеспечивая преимущественное развитие клеточного иммунного ответа, в том числе, при внутриклеточной инфекции и реакции гиперчувствительности замедленного типа
Слайд 87
ТН2
Если наивная Т-клетка распознает антиген, презентирующийся на поверхности
В-лимфоцитов , то это распознавание является сигналом к трансфомации
в ТН2 , которые обеспечивают усиление продукции антител .Клетки TH2 синтезируют ИЛ-4 , ИЛ5 , ИЛ-6, ИЛ-9 , ИЛ-10 и ИЛ-13 и усиливают образование антител , особенно класса IgE . В этом случае возможна стимуляция гиперпродукции антител и аллергических реакций .
Цитокины, выделяемые TH1, подавляют активность TH2, и наоборот.
Th2 вырабатывают интерлейкин-4 , интерлейкин-5 , интерлейкин-6, IL-3 и ГМ-КСФ .стимулируют пролиферацию и дифференцировку В-лимфоцитов , а также синтез антител разных классов.
Слайд 88 Обнаружено, что Txl и Тх2 ответственны за развитие
различных иммунопатологических реакций у человека.
Так, например, функция Txl
преобладает при развитии аутоиммунной патологии - множественного (рассеянного) склероза, инсулинозависимого сахарного диабета, аутоиммунного тиреоидита, болезни Крона, острого отторжения аллотрансплантата, привычного невынашивания плода и др.В свою очередь, функция Тх2 преобладает при нормально протекающей беременности, трансплантационной толерантности, идиопатическом легочном фиброзе, прогрессирующем системном склерозе, у ВИЧ-инфицированных больныхс быстрым прогрессированием заболевания, а также при аллергической патологии.
Слайд 89
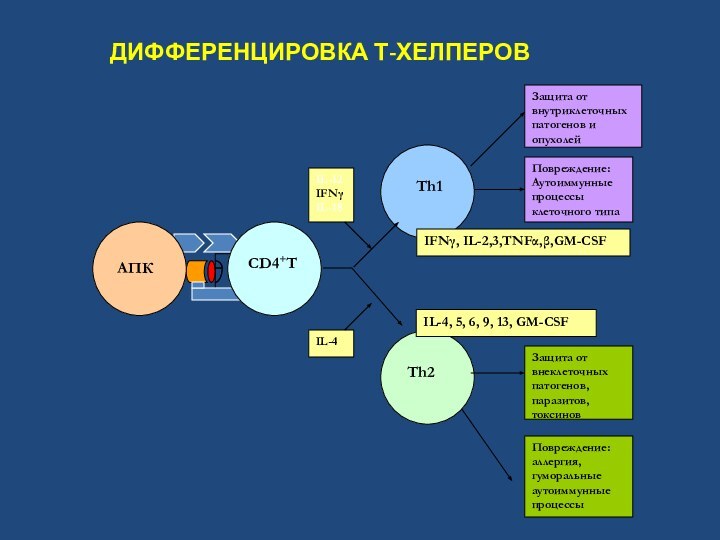
ДИФФЕРЕНЦИРОВКА Т-ХЕЛПЕРОВ
Th2
Th1
Повреждение:
Аутоиммунные процессы
клеточного типа
Защита от внутриклеточных патогенов и опухолей
Защита от
внеклеточных патогенов, паразитов, токсиновПовреждение:
аллергия, гуморальные аутоиммунные процессы
IL-12
IFNγ
IL-18
IL-4
IFNγ, IL-2,3,TNFα,β,GM-CSF
IL-4, 5, 6, 9, 13, GM-CSF
AПК
CD4+T
Слайд 90
CD-8 супрессоры/киллеры
Другая субпопуляция Т-лимфоцитов, меньшая по количеству, несет
на своей поверхности отличительный признак в виде молекулы CD8
и относится к Т-лимфоцитам-киллерам/супрессорам.Такое двойное название означает, что эта субпопуляция Т-лимфоцитов может дифференцироваться либо в Т-киллер (цитотоксический Т-лимфоцит), либо в Т-супрессор и выполнять различные функции в зависимости от потребностей организма.
Слайд 91
CD-8 цитотоксические
CD8+ лимфоциты, выполняющие цитотоксические функции. Эти лимфоциты
реализуют специфические клеточные реакции иммунитета: участвуют в механизмах отторжения
аллотрансплантатов, реакциях аутоиммунитета, разрушают вирусинфицированные и опухолевые клетки.Таким образом, Т-лимфоцит-киллер — основная эффекторная клетка клеточно-опосредованного иммунитета, которая осуществляет лизис мишеней, обеспечивает генетическое постоянство внутренней среды организма.
Слайд 92
Механизмы цитотоксичности
После специфического распознавания CD8+ Т-клеткой за счет
сво-
его антигенраспознающего рецептора чужеродного пептида, который
находится на мембране клетки-мишени
в составе молекулы гистосов-местимости класса I, в CD8+ клетке (киллере) образуется специаль-
ный белок перфорин, способный формировать поры в мембране клет-
ки-мишени. Кроме того, в CD8+ клетке образуется целое семейство
сериновых протеаз, собранных в гранулы и названных гранзимами;
наиболее важную роль из них играет гранзим В.
На этапе летального удара ("поцелуя смерти") при взаимодействии Т-киллера и клетки-мишени перфорин повреждает ("пунктирует") мембрану клетки-мишени и растворимые гранзимы попадают внутрь клетки. Здесь они активируют целую серию цистеиновых протеаз — каспаз (сегодня их известно10). В результате включается механизм апоптоза, который заканчивается активацией эндонуклеаз и фрагментацией ядра
Слайд 94
CD4/CD8
Индекс CD4 / CD8 1,5—2,5 соответствует нормергическому состоянию,
более 2,5 — гиперактивности,
менее 1,0 — иммунодефициту.
При
тяжелом течении воспалительного процесса соотношение CD4/CD8 < 1.
Слайд 95
CD 19, 20 (В-лимфоциты)
Клетки гуморального иммунитета, без Т
клеток не способны распознавать чужое
Ведут оседлый образ жизни в
лимфоидных тканяхВ периферической крови – 15-20 %
Для оценки ГИ важное знчение имеет кол-во В клеток, продуцирующих ИГ А, М, G (1-3, 3-10, 2-6 %, соответственно).
Повышение относительного количества CD 19 происходит во второй половине инфекционного процесса, наиболее часто при вирусных заболеваниях,.
Полное разрешение сопровождается нормализацией CD 19.
Слайд 96
В-ЛИМФОЦИТЫ
В-лимфоциты способны выполнять две важные функции:
1) дифференцироваться
в плазматические клетки и продуцировать антитела;
2) выступать в роли
антигенпредставляющих клеток.
Слайд 97
Гуморальный иммунный ответ обеспечивается антителами, или иммуноглобинами. У
человека различают 5 основных классов иммуноглобинов: IgA, IgG, IgM,
IgE, IgD. Все они имеют как общие, так и специфические детерминанты.
Слайд 98
ИММУНОГЛОБУЛИНЫ
Вначале В-клетки продуцируют и секретируют только IgM. При
Тх-стимуляции В-лимфоциты переключают синтез с IgM на IgG и
далее на IgA и IgE.Таким образом,при Т-зависимом иммунном ответе индуцируется продукция иммуноглобулинов всех классов.
Кроме того, важной отличительной чертой Т-зависимого иммунного ответа является то, что он оставляет после себя иммунологическую память.
Слайд 99
Функции антител:
Первая линия обороны против инфекций;
Удаление из организма
отживших клеток и продуктов катаболизма;
Представление (презентация) антигенов для Т-лимфоцитов;
Поддержание
гомеостаза аутоиммунной реактивности;Противовоспалительное действие (нейтрализация суперантигенов, индукция синтеза противовоспалительных цитокинов)
Слайд 100
Иммуноглобулины класса М
Гамма глобулины, 5% от всей фракции
Вырабатываются
первыми на острую инфекцию
Длительность полужизни – 5 суток
Находятся в
сосудистом руслеПринимают участие в нейтрализации токсинов, опсонизации, агглютинации и бактериолизисе, осуществляемом комплементом. К этому классу также относятся некоторые природные антитела, например к чужеродным эритроцитам.
Слайд 101
По мере увеличения синтеза IgG и нарастания его
титра резко тормозится синтез малоспецифичных IgM , который регулируется
только уровнем соответствующего ему по специфичности IgG.
Слайд 102
Длительный синтез исключительно (или преимущественно) IgM —признак нарушения
регуляторной функции Т-лимфоцитов-хелперов.
Гипериммуноглобулинемия М — один из первичных иммунодефицитов,
обусловленный отсутствием на Т-лимфоцитах-хелперах CD40 лиганда и в связи с этим — невозможностью передачи костимуляционного сигнала В-лимфоцитам для переключения синтеза IgM на синтез Ig другого класса.
Слайд 103
Грамотрицательные
микробы (например все возбудители кишечных инфекций) вызывают
выработку только
IgM без последующего образования клеток иммунологической памяти. Это позволяет
понять, почему вакцинация препаратами, полученными из этих микроорганизмов, не дает длительногоиммунитета.
Слайд 104
Иммуноглобулины класса G
У человека являются наиболее важными. Концентрация
- 9-18 г/л.
Иммуноглобулины этого класса обеспечивают
противоинфекционную защиту,
связывают токсины,
усиливают фагоцитарную активность,
активируют систему комплемента,
вызывают агглютинацию бактерий и вирусов,
способны переходить через плаценту, обеспечивая новорожденному так называемый пассивный иммунитет.
Слайд 105
Иммуноглобулины класса А
15% от всей фракции
Делят на 2
разновидности: сывороточные (50 %) и секреторные. Первые из них
находятся в крови, вторые - в различных секретах. Соответственно этому сывороточный иммуноглобулин А принимает участие в общем, иммунитете, а секреторный обеспечивает местный иммунитете (в слюне, слизи трахеобронхиального дерева, мочеполовых путей, молоке), создавая барьер на пути проникновения инфекций и токсинов в организм.Длительность полужизни - 6 -7 суток
Слайд 106 Секреторный IgA преобладает в слюне, слезах, секретах желудка
и
кишок (особенно тонкой кишки), желчи, во влагалищном секрете и
вамниотической жидкости, в содержимом легких, бронхов, мочеполовых
путей. Богатым источником секреторного IgA является грудное моло-
ко и, особенно, молозиво, где его количество значительно превышает
содержание в крови. Благодаря этому обеспечивается достаточно вы-
раженная защита детей первых месяцев жизни при естественном вскар-
мливании.
IgA относится к тимусзависимым Ig и самостоятельный его синтез в самом раннем возрасте недостаточен для полноценной защиты. Поступление
IgA с молозивом и грудным молоком матери предупреждает раннее за-
селение кишечника ребенка грамотрицательными бактериями, в част-
ности кишечной палочкой, и способствует формированию грамположи-
тельной микрофлоры кишок, более благоприятной для новорожденного.
Слайд 107
ИММУНОГЛОБУЛИН Е
Концентрация IgE в сыворотке крови здоровых
людей составляет в сред-
нем 0,25 мг/л, а у больных
с атопическими заболеваниями — в десяткии даже сотни раз больше . Период полужизни IgE — 2—3
дня, скорость биосинтеза — 0,02 мг/кг массы тела в сутки. IgE являет-
ся белком (гамма 1-гликопротеидом) с молекулярной массой 1,9 • 105 D.
Способность к образованию IgE в большей степени, чем других Ig,
связана с наследственными факторами. Принято считать, что услови-
ем развития атопического заболевания является наследственно пере-
дающаяся предрасположенность к повышенной продукции IgE.
Слайд 108
Иммуноглобулин Е быстро и прочно связывается с тканевыми
базофилами и с Fc-рецепторами на других "клетках воспаления". В
результате взаимодействия фиксированного на поверхности этих клеток IgE со специфическим антигеном происходит их дегрануляция с выделением во внеклеточное пространство биологически активных веществ, обусловливающих клинические проявления аллергического воспаления. Доказано, что IgE-антитела принимают участие в связывании антигенов на слизистой оболочке.
Слайд 109
Иммуноглобулин Е продуцируется плазматическими клетками селезенки, миндалин, аденоидов,
слизистых оболочек дыхательных путей, желудка и кишок.
Слайд 110
Повышение уровня иммуноглобулинов класса IgE наблюдается у больных
с глистными инвазиями и у больных с аллергией.
Слайд 111
ИММУНОГЛОБУЛИН D
Иммуноглобулин D был обнаружен в 1965 г.
в виде миеломного белка. Он имеет молекулярную массу 1,8
• 105 D, концентрация в сыворотке крови в среднем составляет от 3 до 170 мг/л, период полужизни — 3 дня (см. табл. 3). IgD не связывает комплемент, не проходит через плаценту, не обладает тропностью к тканям. По современным данным, IgD может выполнять роль антигенраспознающего рецептора В-лимфоцитов и играть важную роль в процессе их дифференцировки под влиянием антигенной стимуляции. До настоящего времени биологическая функция этого Ig не изучена.
Слайд 112
Цитокины
Межклеточная сигнализация осуществляется либо путем непосредственного контактного взаимодействия
клеток, в котором участвуют их поверхностные молекулы, или с
помощью цитокинов ( интерлейкинов), называемых «белками связи»
Слайд 113
Эффекторные механизмы
ИЛ обеспечивают взаимосвязь отдельных видов лейкоцитов в
иммунном ответе. Они представляют собой малые белковые молекулы с
молекулярной массой 15000-30000.
Слайд 114
Функциональные группы цитокинов
Гематопоэтические цитокины
Цитокины доиммунного воспаления (провоспалительные) привлекают
в очаг воспаления лимфоциты и лейкоциты из циркулирующей крови)
Цитокины
– организаторы лимфоцитарного иммунного ответаЦитокины – медиаторы иммунного воспаления
Противовоспалительные (иммуносупрессивные) цитокины
Слайд 115
БИОЛОГИЧЕСКИЕ ЭФФЕКТЫ ЦИТОКИНОВ.
1. Пролиферация (деление клеток – ИЛ-2;
эпидермальный, эндотелиальный, инсулин-подобный и др. факторы роста).
2. Дифференцировка (созревание
клеток – Тх1, Тх2, В-лимфоциты и др.).3. Апоптоз (программированная гибель клеток – ОНФα и др.).
4. Жизнеспособность клеток (анти-апоптотический сигнал – bcl-2; ИЛ-2 и др.).
5. Адгезия (миграция).
6. Индукция воспаления.
Слайд 120
РОСТОВЫЕ ФАКТОРЫ
гранулоцитарный колониестимулирующий фактор.
гранулоцитарно-моноцитарный колониестимулирующий фактор.
трансформирующий фактор роста
Слайд 123
От чего зависит результат первичного иммунного ответа?
от наследственных
факторов, в том числе и наличия определенных аллелей и
гаплотипов HLA .От химической структуры АГ, его молекулярной массы, дозы, пути проникновения (через естественные барьеры или непосредственно в кровь), участии адъювантов.
На характер и силу иммунологического ответа влияют:
эндокринный статус,
питание,
сопутствующие инфекции,
стресс, лекарственные препараты.
Несостоятельность фагоцитарного звена препятствует эффективной элиминации АГ и способствует накоплению ЦИК.
Слайд 124
Возрастные особенности иммунитета у детей
Механизмы толерантности
к антигенным структурам плода:
Наличие плацентарного барьера,
Низкая плотность антигенов гистосовместимости
на клетках трофобласта, Подавляют реакции отторжения:
альфа-фетопротеин, уромодулин, белки трофобласта
небелковые соединения (эстрогены, прогестерон, простагландины Е 1 и Е 2 )
Слайд 125
К онтогенетическим особенностям клеточного иммунитета новорождённых относят:
усиление цитотоксичности
Т-лимфоцитов и естественных киллерных клеток в ответ на добавление
экзогенного ИЛ-2, высокую функциональную активность лимфокин-активированных киллеров;отсутствие клеток иммунной памяти;
способность В-лимфоцитов плода и недоношенного ребёнка к синтезу IgM.
Слайд 126
К онтогенетическим особенностям гуморального иммунитета новорождённых относят:
малая трансплацентарная
передача материнских IgG до 35-36-й недели гестации;
трансплацентарная передача только
IgG1 и IgG3 субклассов;неспособность В-лимфоцитов плода и новорождённого к переключению синтеза иммуноглобулинов с класса IgM на IgG;
повышенное потребление иммуноглобулинов в раннем периоде адаптации при колонизации кожи и слизистых оболочек микрофлорой окружающей среды;
апоптоз неонатальных В-лимфоцитов при массивной микробной инвазии.
Слайд 127
Критические периоды развития иммунобиологической реактивности
Первый такой период
охватывает первые 29 дней жизни (период новорожденности).
На 5—7-е
сутки происходит первый перекрест в лейкоцитарной формуле крови, нейтрофилез сменяется относительным и абсолютным лимфоцитозом. Пассивный гуморальный иммуниттет обеспечивается в основном материнскими антителами.
Характерны незавершенность фагоцитоза, низкая функциональная активность системы комплемента и опсонизация микробов.
Хемотаксис и миграция фагоцитов ограничены.
Ребенок проявляет слабую резистентность к условно-патогенной, гноеродной, грамотрицательной микрофлоре, некоторым вирусам.
Проявляется склонность к генерализации микробно-воспалительного процесса, септическим состояниям.
Слайд 128
Второй критический период (3—6 мес.)
Ослабление пассивного гуморального иммунитета
в связи с элиминацией материнских антител.
Сохраняется супрессорная направленность иммунных
реакций при выраженном лимфоцитоза в крови.На большинство антигенов развивается первичный иммунный ответ с преимущественным синтезом антител класса lgM, не оставляющим иммунологической памяти. Такой тип иммунного ответа наблюдается при вакцинации против столбняка, дифтерии, коклюша, полиомиелита, кори, и только после 2—3 ревакцинаций формируется вторичный иммунный ответ с образованием антител класса lgG и стойкой иммунологической памяти.
Слайд 129
Второй критический период (3—6 мес.)
Вакцинация может не повлечь
иммунного ответа, если в крови детей еще циркулируют материнские
антитела или дети по показаниям получали препараты крови, гамма-глобулин, плазму.Дети сохраняют очень высокую чувствительность к респираторному синцитиальному вирусу, вирусам парагриппа, аденовирусам. Вирус гепатита В редко вызывает желтушные формы болезни
Атипично протекают коклюш, корь, которые не сопровождаются развитием иммунитета.
Проявляется недостаточность системы местного иммунитета. (повторные острые респираторные вирусные инфекции); выявляются многие наследственные иммунодефициты; нарастает частота пищевой аллергии.
Слайд 130
Третий критический период (второй год жизни)
Значительно расширяются контакты
ребенка с внешним миром.
Система местного И. остается неразвитой, дети
по-прежнему чувствительны к вирусным инфекциям. Дети особенно склонны к повторным вирусным и микробно-воспалительным заболеваниям органов дыхания, ЛОР-органов.
Супрессорная направленность иммунной системы сменяется преобладанием хелперной функции по отношению к клонам В-лимфоцитов, синтезирующим lgM.
Слайд 131 Четвертый критический период — подростковый возраст (у девочек
с 12—13 лет, у мальчиков с 14—15 лет)
Пубертатный скачок
роста сочетается с уменьшением массы лимфоидных органов. Стимуляция секреции половых гормонов (андрогенов) ведет к подавлению клеточного звена иммунитета и стимуляции его гуморального звена.
Содержание lgE в крови снижается.
Окончательно формируются типы иммунного ответа (сильный и слабый).
Нарастает воздействие на иммунную систему экзогенных факторов, например курения.
Отмечается новый подъем частоты хронических, воспалительных, аутоиммунных и лимфопролиферативных заболеваний
Тяжесть атопических болезней (бронхиальной астмы и др.) у многих детей ослабевает.
Слайд 132
В критические периоды становления иммунной системы особенно часто
проявляются наследственные вариации силы иммунного ответа
Слайд 133
Поздний иммунологический старт
Низкая масса тела при рождении;
Внутриутробное
инфицирование лимфотропными ДНК-вирусами (цитомегалии, Эпштейна — Барр, герпеса);
Гипербилирубинемия
; Малые наследственные аномалии иммунитета (дефицит lgA, отдельных субклассов lgG, отдельных компонентов системы комплемента, интерферона, дефекты хемотаксиса фагоцитов, опсонизации):
Экзогенные, в т.ч. ятрогенные, влияния (введение интерферонов без достаточных на то оснований, длительное применение кортикостероидов, воздействия диоксинов и фенолов атмосферного воздуха и др.).
Повторные инфекции (острые респираторные вирусные заболевания и др.) также вызывают вторичную депрессию иммунной системы.
При ВИЧ-инфекции резко угнетается хелперная функция лимфоцитов и становление иммунной системы в целом происходит на фоне дистрофии и вялотекущих воспалительных процессов в легких, кишечнике, коже.
Лимфоцитотропные вирусы у детей могут вызвать сходное состояние, получившее название псевдо-ВИЧ-синдрома (например, врожденная Эпштайна — Барр вирусная инфекция).
Слайд 135
ИДС по частоте встречаемости
Дефицит субклассов IgG.
Транзиторная, младенческая гипогаммаглобулинемия.
Селективная
недостаточность IgA (1- 300-700)
Дефекты комплемента (1 - 1500-3000)
Дефект фагоцитоза
(1 - 2000-3000)ОВИН (1 – 50000)
ТКИН (1 - 20000-50000)
Агаммаглобулинемия (1 -100000)
Частота ПИД - 200 человек на 1 млн населения
Слайд 136
Показания к назначению иммунограммы
Подозрение на наличие генетически обусловленных
дефектов иммунной системы, в том числе наличие у ближайших
родственников аллергических, аутоиммунных, онкологических заболеваний, случаи смерти в детском и молодом возрасте.Аутоиммунные заболевания.
Аллергические состояния и заболевания.
Инфекционные заболевания с затяжным и хроническим течением.
Злокачественные новообразования.
Проведение цитостатической, иммунодепрессивной и иммуномодулирующей терапии.
Подготовка к полостным операциям.
Осложненное течение послеоперационного и/или послеродового периода.
Подготовка к ЭКО, наличие в анамнезе «неудачного» ЭКО и ранних репродуктивных потерь.