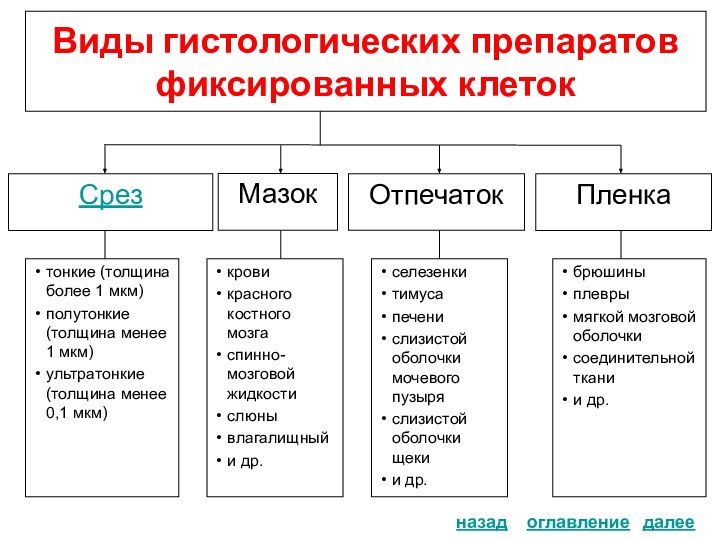
фиксированных клеток
Изготовление гистологического препарата
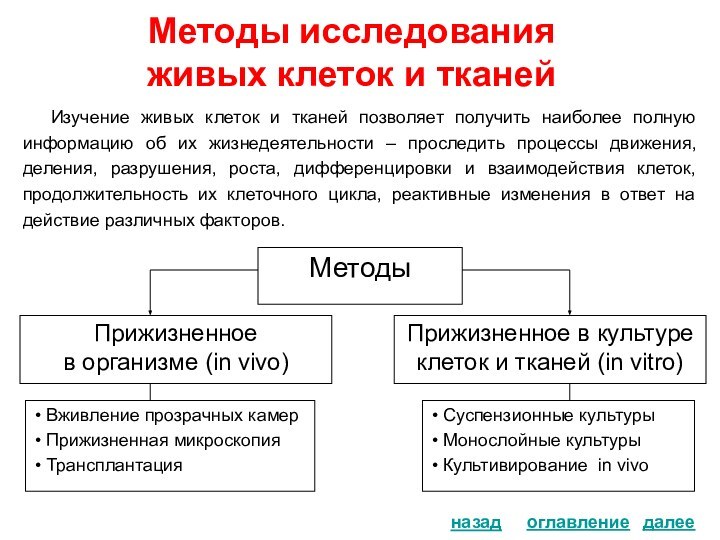
Гистологический препарат
Взятие материала
Фиксация материала
Уплотнение материала
Приготовление срезов
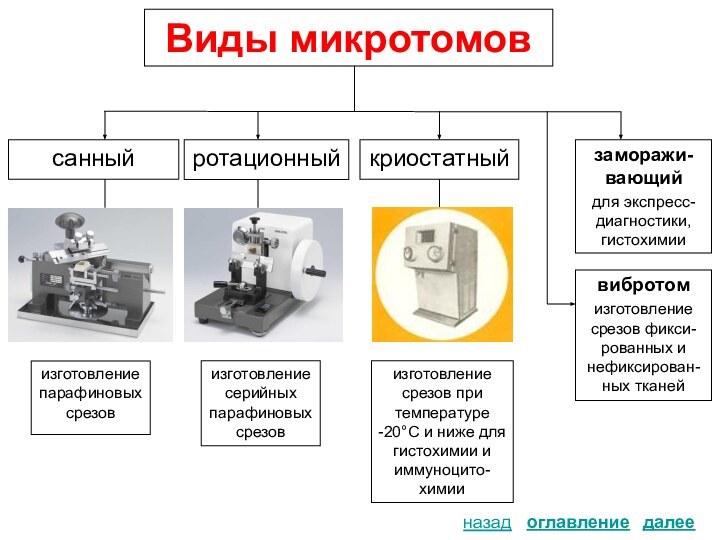
Виды
микротомовОкрашивание срезов
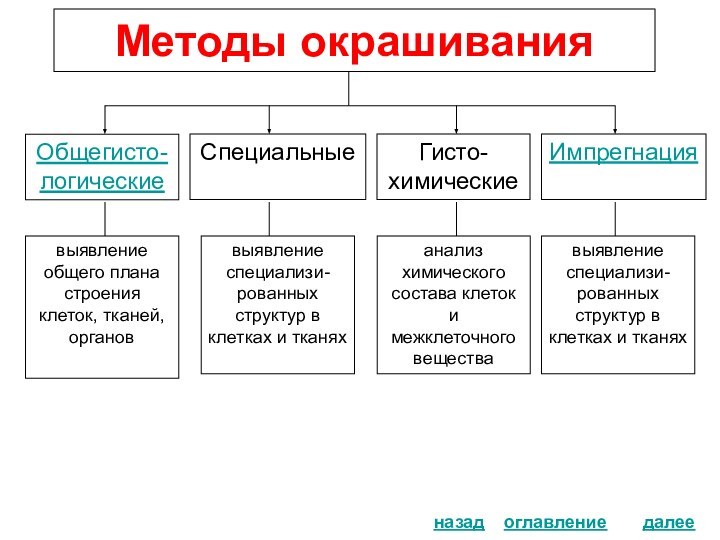
Методы окрашивания
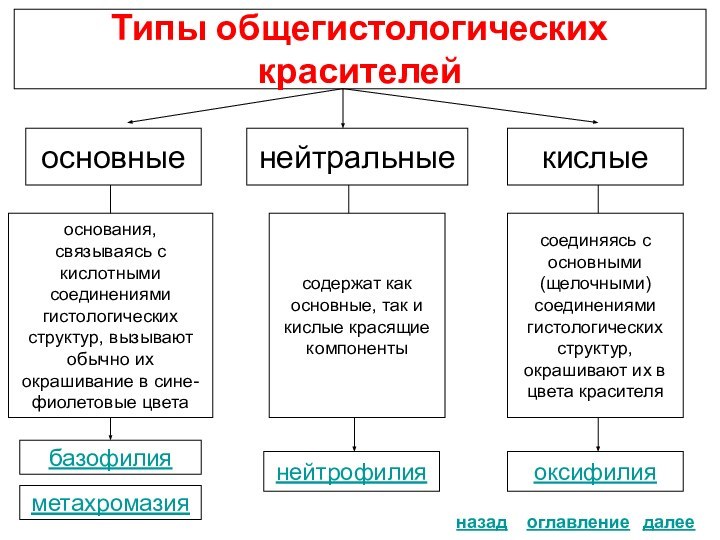
Типы красителей
Заключение срезов в консервирующую среду
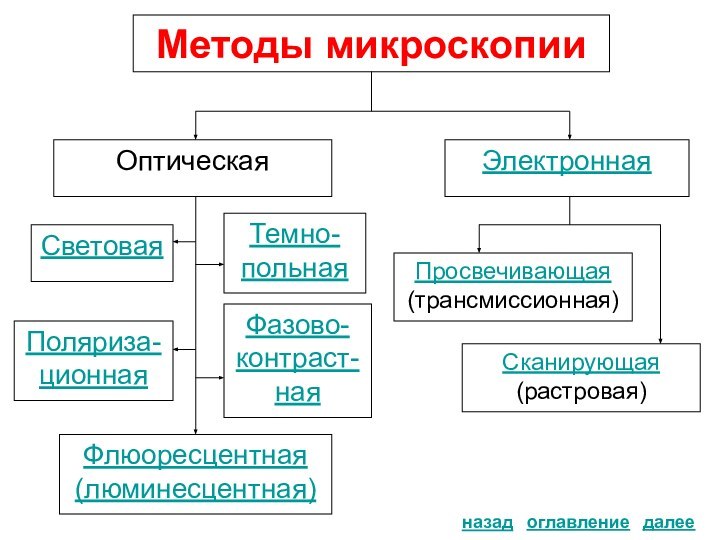
Методы микроскопии
Световая микроскопия
Устройство светового микроскопа
Техника микроскопирования
Темнопольная микроскопия
Поляризационная микроскопия
Фазово-контрастная микроскопия
Флюоресцентная (люминесцентная) микроскопия
Электронная микроскопия
Рекомендуемая литература
далее
назад