- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Методы определения чувствительности к антибактериальным препаратам
Содержание
- 2. Основные этапы проведения тестирования на антибиотикочувствительность микроорганизмов.
- 3. Приготовление питательных сред для определения чувствительностиВид питательной
- 4. Приготовление питательных сред для определения чувствительностиПлотную питательную
- 5. Приготовление питательных сред для определения
- 6. Приготовление суспензии исследуемых микроорганизмов (инокулюма) Общим и
- 7. Приготовление инокулюма
- 8. Приготовление инокулюма из агаровой культурыДля приготовления инокулюма
- 9. Приготовление инокулюма из бульонной культуры При определении
- 10. Приготовление стандарта 0,5 по Мак-Фарланду К
- 11. Методы серийных разведенийОбщим и крайне важным этапом
- 12. Методы серийных разведенийОсновные растворы АБП готовят в
- 13. Методы серийных разведенийВзвесить точно расчётное количество порошка
- 14. Метод серийных разведений в бульоне.Макрометод (пробирочный) Микрометод
- 15. МакрометодПриготовление серийных разведений АБП (рис. 1).Рабочий раствор
- 16. МакрометодПриготовление инокулюма и инокуляция.Для инокуляции используют стандартную
- 17. МакрометодИнкубация.Пробирки закрывают стерильными ватно-марлевыми пробками или металлическим
- 18. Метод серийных разведений в бульонеИнокулюм плотностью
- 19. Метод серийных разведений в бульоне
- 20. МикрометодПреимуществами микрометода является высокая производительность и возможность
- 21. МикрометодПервым этапом является изготовление планшет, пригодных для
- 22. Микрометод
- 23. Методы серийных разведенийКонтроль качества.При постановке методов серийных
- 24. Метод серийных разведений в агаре Метод серийных
- 25. Метод серийных разведений в агареПриготовление серийных разведений
- 26. Метод серийных разведений в агареПитательная среда.Сухую агаризованную
- 27. Метод серийных разведений в агареПриготовление инокулюма и
- 28. Метод серийных разведений в агареДля контроля качества
- 29. Метод серийных разведений в агареУчет результатов. Учет
- 30. Общие замечания по методам серийных разведений Несмотря
- 31. E-test
- 32. Минимальная ингибирующая концентрация (MIC) E-test
- 33. Минимальная ингибирующая концентрация (MIC) E-test
- 34. Минимальная ингибирующая концентрация (MIC) E-test
- 35. MIC - E-testЕсли рост культуры пересекается на
- 37. MIC - E-testМИК оцениваем по нижнему значению.Высокий показатель МИК .МИК оцениваем как минимальный.333222111
- 38. E-test
- 39. MIC - E-test
- 40. MIC - E-test
- 41. Диско-диффузионный метод (ДДМ)Принцип методаДДМ определения чувствительности основан
- 42. Диски с антибиотиками Использовать только стандартизированные качественные
- 43. Способы иннокуляцииПервый способ:Наиболее удобным способом инокуляции является
- 44. Инокуляция с помощью тампона
- 45. Аппликация дисков Не позднее чем через
- 46. Аппликация дисков Расстояние от диска до
- 47. Инкубация Непосредственно после аппликации дисков чашки Петри
- 48. Учет результатов После окончания инкубации чашки помещают
- 49. Учет результатов При измерении зон задержки роста
- 50. Учет результатов Крупные колонии, выявляемые в пределах
- 51. Учет результатов
- 52. Учет результатов При определении чувствительности ДДМ роящихся
- 53. ДДМ
- 54. ДДМ
- 55. Определение чувствительности к противогрибковыми препаратами Диски предназначены
- 56. Определение чувствительности к противогрибковыми препаратами Диски подлежат
- 57. Техника постановки анализа Питательная средаРекомендуется использовать агаризованную
- 58. Техника постановки анализа Приготовление инокулюмаГотовят взвесь
- 59. Техника постановки анализа Нанесение дисковДиски располагают по
- 60. Учет результатов по диаметру зоны подавления роста культуры *Предварительные данные
- 61. Определение чувствительности анаэробных бактерий (методом элюции
- 62. Необходимое количество дисков
- 63. Учет результатов Чувствительными считают
- 64. Определение чувствительности микроорганизмов со сложными питательными
- 65. Определение чувствительности Streptococcus spp Питательные средыДля определения
- 66. АБП для S.pneumoniae, группы “viridans” и β-гемолитических стрептококков
- 67. АБП для S.pneumoniae, группы “viridans” и β-гемолитических стрептококков
- 68. Streptococcus pneumoniaeБета-лактамные антибиотики (пенициллин) являются препаратами выбора
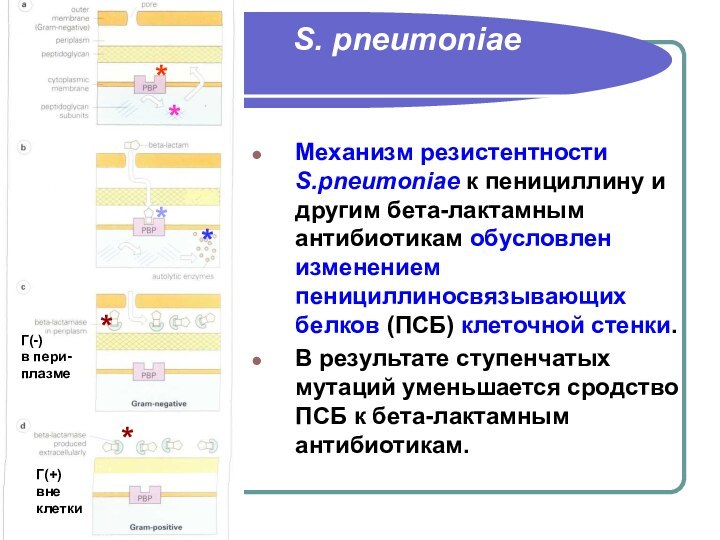
- 69. S. pneumoniaeМеханизм резистентности S.pneumoniae к пенициллину и
- 70. Streptococcus pneumoniaeПри лечении инфекций дыхательных путей, вызванных
- 71. Streptococcus pneumoniaeСледует обратить внимание на несколько важных
- 72. Streptococcus pneumoniaeОпределение чувствительности пневмококков к пенициллину и
- 73. Критерии чувствительности S.pneumoniae
- 74. Критерии чувствительности S.pneumoniae
- 75. Критерии чувствительности S.pneumoniaeПри оценке чувствительности к
- 76. Критерии чувствительности S.pneumoniae
- 77. Критерии чувствительности S.pneumoniae
- 78. Скрининг пенициллинорезистентности S. pneumoniaeПостановка тестаМетодика проведения
- 79. Скрининг резистентности S. pneumoniaeМакролиды и линкозамиды.
- 80. Скрининг резистентности S. pneumoniaeОднако в практических
- 81. Скрининг резистентности S. pneumoniaeФторхинолоны. Традиционные фторхинолоны
- 82. Скрининг резистентности S. pneumoniaeАБП других групп.
- 83. Streptococcus spp. группа «viridans”Проводить определение чувствительности штаммов
- 84. Streptococcus spp. группа «viridans”Определенный интерес может представлять
- 85. Определение чувствительности бета-гемолитических стрептококковСреди стрептококков выделяют различные
- 86. Определение чувствительности бета-гемолитических стрептококковПри выделении из нестерильных
- 87. Критерии чувствительности Streptococcus spp. (кроме S.pneumoniae)
- 88. Критерии чувствительности Streptococcus spp. (кроме S.pneumoniae)
- 89. Критерии чувствительности Streptococcus spp. (кроме S.pneumoniae)3
- 90. Определение чувствительности Haemophilus influenzae Питательные средыДля определения
- 91. Определение чувствительности Haemophilus influenzaeВ подготовленную для автоклавирования
- 92. Определение чувствительности Haemophilus influenzaeHaemophilus spp. характеризуются природной
- 93. Определение чувствительности Haemophilus influenzaeИзвестны штаммы H.influenzae, устойчивость
- 94. Выявление ампициллинорезистентности H.influenzaeДля выявления ампициллинорезистентности у гемофильной
- 95. Определение резистентности Haemophilus influenzaeМакролидные антибиотики отличаются невысоким
- 96. Определение резистентности Haemophilus influenzaeУстойчивость к фторхинолонам среди
- 97. АБП для определения чувствительности H.influenzae
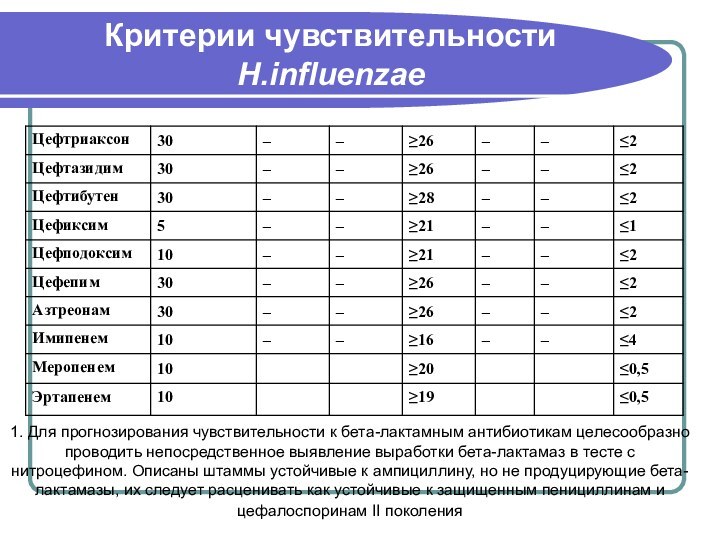
- 98. Критерии чувствительности H.influenzae
- 99. Критерии чувствительности H.influenzae1. Для прогнозирования чувствительности к
- 100. Критерии чувствительности H.influenzae
- 101. Критерии чувствительности H.influenzae2 – Критерии интерпретации результатов
- 102. Определение чувствительности Neisseria gonorrhoeae Оценка антибиотикочувствительности N.gonorrhoeae
- 103. Определение чувствительности Neisseria gonorrhoeaeВ КПД входят следующие
- 104. Определение чувствительности Neisseria gonorrhoeaeВсе ингредиенты растворяют в
- 105. Определение чувствительности Neisseria gonorrhoeaeОценивать антибиотикочувствительность гонококков следует
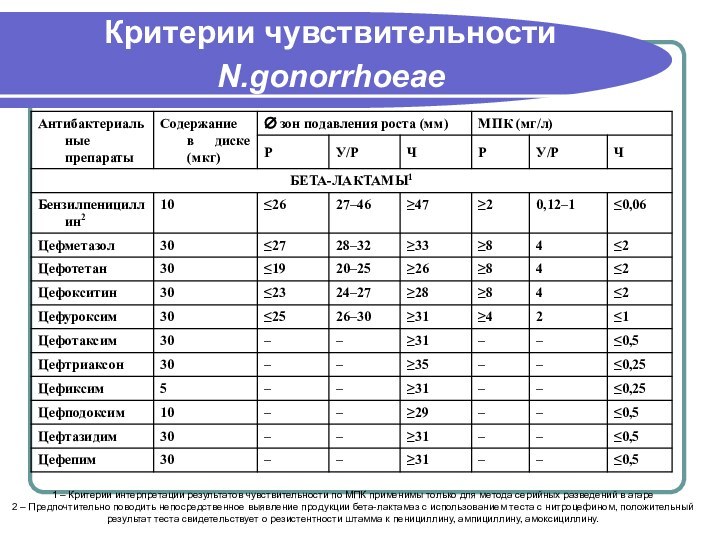
- 106. Критерии чувствительности N.gonorrhoeae 1 – Критерии интерпретации
- 107. Критерии чувствительности N.gonorrhoeae3 – Выявление устойчивости к тетрациклину свидетельствует о резистентности к доксициклину
- 108. Определение чувствительности Enterococcus sppЭнтерококки характеризуются природной устойчивостью
- 109. Определение чувствительности Enterococcus sppПри решении вопроса о
- 110. АБП для определения чувствительности Enterococcus spp
- 111. Определение чувствительности Enterococcus sppПенициллин и ампициллин. Данные
- 112. Определение чувствительности Enterococcus sppАминогликозиды. Несмотря на то,
- 113. Определение чувствительности Enterococcus sppВанкомицин. Ванкомицин является препаратом
- 114. Определение чувствительности Enterococcus sppДругие препараты. В отношении
- 115. Критерии чувствительности Enterococcus spp.
- 116. Критерии чувствительности Enterococcus spp.
- 117. Критерии чувствительности Enterococcus spp.1 – критерии
- 118. Скрининг резистентности к аминогликозидам у энтерококков. Питательная
- 119. Скрининг резистентности к аминогликозидам у энтерококковПриготовление микробной
- 120. Скрининг резистентности к аминогликозидам у энтерококковУчет результатов
- 121. Определение ванкомицинрезистентных Enterococcus spp.Скрининг осуществляется на агаре.
- 122. Определение ванкомицинрезистентных Enterococcus spp.Приготовление микробной взвеси, инокуляция
- 123. Определение ванкомицинрезистентных Enterococcus spp.Учет результатов.Исследуемый штамм рассматривается
- 124. Определение чувствительности Staphylococcus spp При оценке чувствительности
- 125. Определение чувствительности Staphylococcus sppУстойчивость стафилококков связана либо
- 126. Определение чувствительности Staphylococcus spp- Чувствительность или резистентность
- 127. Определение чувствительности Staphylococcus sppОпределение чувствительности Staphylococcus spp.
- 128. АБП для определения чувствительности Staphylococcus spp. 1)
- 129. Критерии чувствительности Staphylococcus spp 1) В
- 130. Критерии чувствительности Staphylococcus spp
- 131. Критерии чувствительности Staphylococcus spp
- 132. Критерии чувствительности Staphylococcus spp
- 133. Критерии чувствительности Staphylococcus spp
- 134. Критерии чувствительности Staphylococcus spp
- 135. Выявление продукции бета-лактамаз (пенициллиназ) Суть метода:
- 136. Постановка теста с нитроцефином Для проведения исследования
- 137. Определение чувствительности к оксациллину Особенности: для приготовления
- 138. Интерпретация результатов тестированияШтаммы стафилококков, резистентные к оксациллину,
- 139. Выдача клиницистам результатов исследования и рекомендаций по
- 140. Постановка тестаДля проведения скрининга готовят чашки с
- 141. Инокуляция1) Метод I (микропипеткой):готовят разведение
- 142. ИнкубацияШтаммы S. aureus инкубируются при температуре 35
- 143. Скрининг метициллинрезистентностиКонтроль качестваИсследование проводят при обязательном контроле
- 144. Определение резистентности к другим антибиотикамМакролиды и линкозамиды.
- 145. Определение чувствительности Enterobacteriaceae Представители семейства Enterobacteriaceae являются
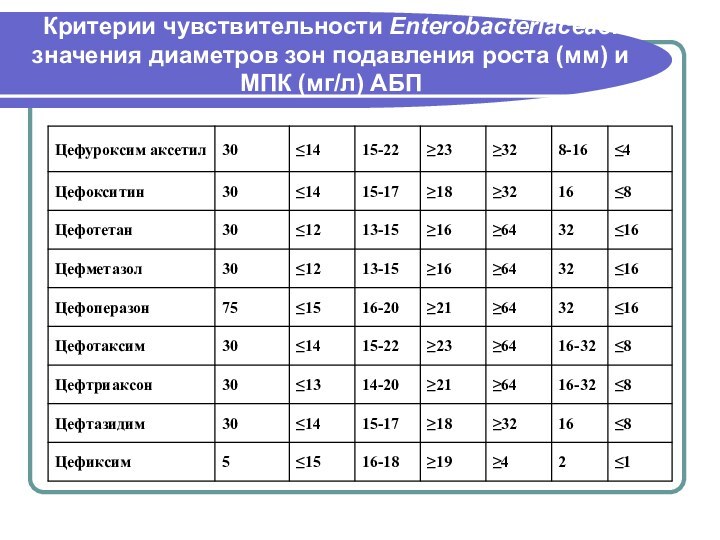
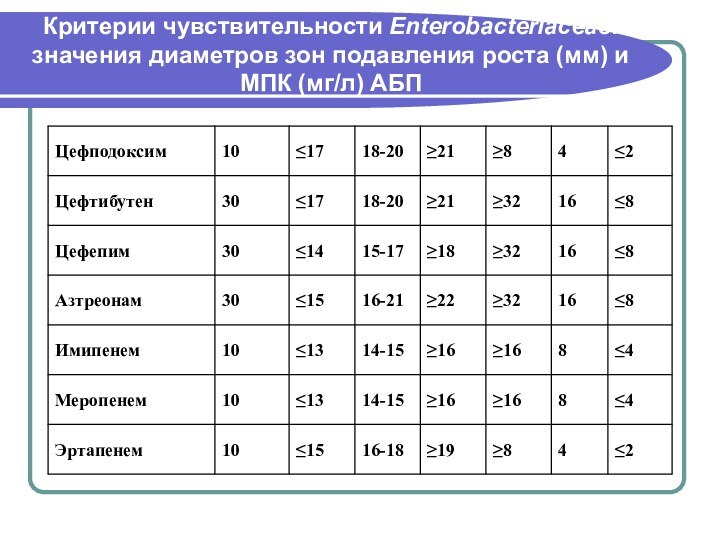
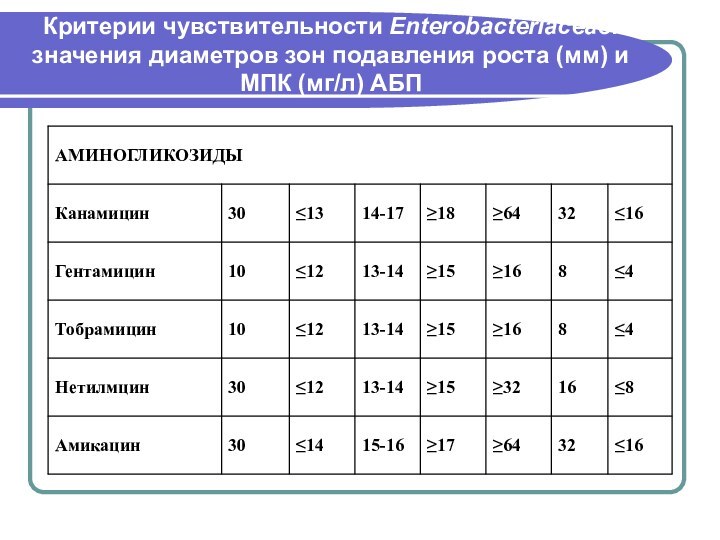
- 146. Критерии чувствительности Enterobacteriaceae: значения диаметров зон подавления роста (мм) и МПК (мг/л) АБП
- 147. Критерии чувствительности Enterobacteriaceae: значения диаметров зон подавления роста (мм) и МПК (мг/л) АБП
- 148. Критерии чувствительности Enterobacteriaceae: значения диаметров зон подавления роста (мм) и МПК (мг/л) АБП
- 149. Критерии чувствительности Enterobacteriaceae: значения диаметров зон подавления роста (мм) и МПК (мг/л) АБП
- 150. Критерии чувствительности Enterobacteriaceae: значения диаметров зон подавления роста (мм) и МПК (мг/л) АБП
- 151. Критерии чувствительности Enterobacteriaceae: значения диаметров зон подавления роста (мм) и МПК (мг/л) АБП
- 152. Enterobacteriaceae – возбудители внекишечных инфекцийОснову лечения внекишечных
- 153. АБП для Enterobacteriaceae, возбудителей внекишечных инфекций
- 154. Enterobacteriaceae – возбудители внекишечных инфекцийХарактеристика препаратов первого
- 155. Enterobacteriaceae – возбудители внекишечных инфекцийЦефотаксим или цефтриаксон.
- 156. Enterobacteriaceae – возбудители внекишечных инфекцийГентамицин. Результаты, получаемые
- 157. Enterobacteriaceae – возбудители внекишечных инфекцийХарактеристика дополнительных препаратов.
- 158. Enterobacteriaceae – возбудители внекишечных инфекцийЦефепим. Антибиотик обладает
- 159. Enterobacteriaceae – возбудители кишечных инфекцийЦефокситин. Антибиотик не
- 160. Enterobacteriaceae – возбудители внекишечных инфекцийПри выдаче результатов
- 161. Enterobacteriaceae – возбудители кишечных инфекцийИнтерпретация результатов оценки
- 162. Enterobacteriaceae – возбудители кишечных инфекцийОсновную роль в
- 163. АБП для Enterobacteriaceae, при кишечных инфекциях
- 164. Enterobacteriaceae – возбудители кишечных инфекцийПри генерализованных инфекциях,
- 165. Тестирование Enterobacteriaceae – возбудителей ИМПС практической точки
- 166. АБП для возбудителей внебольничных уроинфекций
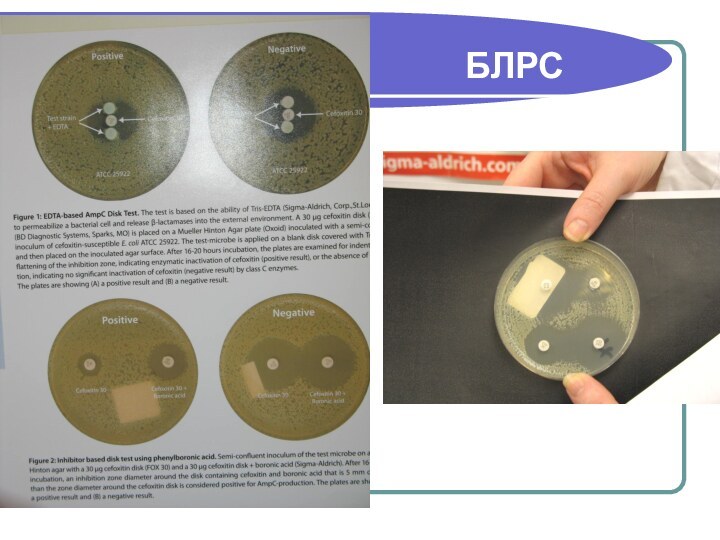
- 167. Выявление БЛРС у штаммов Enterobacteriaceae (фенотипическими методами)Рекомендации
- 168. Выявление БЛРС у штаммов Enterobacteriaceae (фенотипическими методами)Скрининг
- 169. Выявление БЛРС у штаммов Enterobacteriaceae (фенотипическими методами)Чем
- 170. Тесты, подтверждающие продукцию БЛРС Принцип метода:Основан на
- 171. Тесты, подтверждающие продукцию БЛРС Постановка тестаМетодика приготовления
- 172. Тесты, подтверждающие продукцию БЛРС Контроль качестваДля контроля
- 173. Метод двойных дисков Принцип метода
- 174. Метод двойных дисков Постановка тестаМетодика приготовления микробной
- 175. Метод двойных дисков Интерпретация результатовЕсли тестируемый микроорганизм
- 176. Метод двойных дисков
- 177. БЛРС
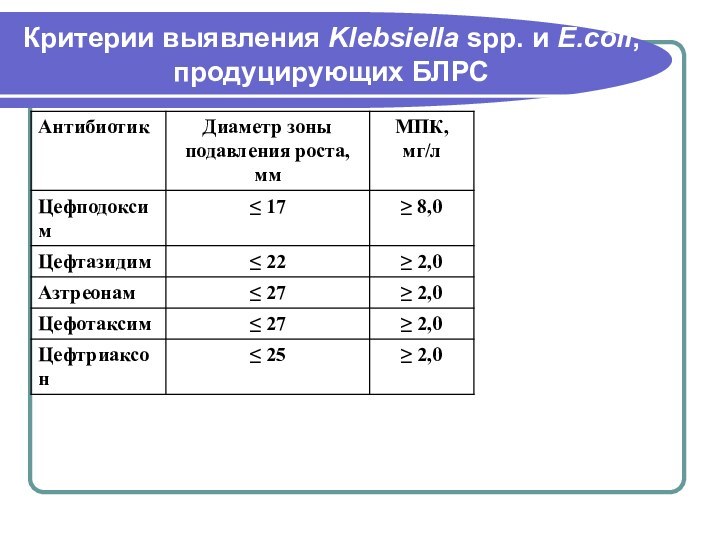
- 178. Критерии выявления Klebsiella spp. и E.сoli, продуцирующих БЛРС
- 179. Определение чувствительности P.aeruginosa,
- 180. Перечень антибиотиков для НГОБ
- 181. Определение чувствительности НГОБПрепараты первого ряда В первую
- 182. Определение чувствительности НГОБЦипрофлоксацин. Среди фторхинолонов ципрофлоксацин является
- 183. Определение чувствительности НГОБДополнительные препараты. Необходимо учитывать, что
- 184. Определение чувствительности НГОБЦефоперазон/сульбактам (а также ампициллин/сульбактам) могут
- 185. Определение чувствительности НГОБОчевидно, что «неферментирующие» микроорганизмы нельзя
- 186. Критерии чувствительности P.aeruginosa, Pseudomonas spp., Acinetobacter spp.
- 187. Критерии чувствительности P.aeruginosa, Pseudomonas spp., Acinetobacter spp. и НГОБ
- 188. Критерии чувствительности P.aeruginosa, Pseudomonas spp., Acinetobacter spp. и НГОБ
- 189. Критерии чувствительности P.aeruginosa, Pseudomonas spp., Acinetobacter spp. и НГОБ
- 190. Критерии чувствительности P.aeruginosa, Pseudomonas spp., Acinetobacter spp. и НГОБ
- 191. Контроль качества Параллельно с анализом исследуемых культур
- 192. Контроль качества определения чувствительностиКонтроль чистоты роста культурыОбразец
- 193. Контроль качества определения чувствительностиКонтроль роста
- 194. Контроль качества определения чувствительностиИз суточных культур указанных
- 195. Контроль качества определения чувствительностиКонтроль стерильностиДля контроля стерильности
- 196. Контроль качества питательных сред Проверка pH агара
- 197. Контроль качества питательных средКонтроль содержания тимина и
- 198. Интегральный контроль качества определения чувствительностисопоставление результатов определения
- 199. Хранение контрольных штаммов В условиях лаборатории штаммы
- 200. Хранение контрольных штаммовДля длительного хранения штаммов существуют
- 201. Частота проведения контроля качества Оптимально - ежедневно,
- 202. Интерпретация результатов Интерпретация осуществляется на основании сопоставления
- 203. Эпидемиологический надзор за
- 204. Эпидемиологический надзор за резистентностью к АБПСозданию системы
- 205. Эпидемиологический надзорОбщие принципы При эпидемиологическом
- 206. Эпидемиологический надзор Полученные эпидемиологические данные
- 207. Эпидемиологический надзорИнформирования органов системы здравоохранения соответствующего уровня
- 208. Эпидемиологический надзорВиды эпидемиологического надзораСуществуют два основных временных
- 209. Эпидемиологический надзорВыделяют два типа эпидемиологического надзора по
- 210. Эпидемиологический надзорСигнальный (неполный) эпидемиологический надзор подразумевает сбор
- 211. Эпидемиологический надзорПо методике выполнения: Пассивный, основанный на
- 212. Эпидемиологический надзорВ зависимости от используемого подхода к
- 213. Эпидемиологический надзорЭпидемиологический надзор за возникновением и распространением
- 214. Эпидемиологический надзорВыбор штаммов микроорганизмов для включения в
- 215. Эпидемиологический надзорПринципы проведения эффективного эпидемиологического надзора
- 216. Эпидемиологический надзор Получение достоверных данных зависит
- 217. Эпидемиологический надзорКлинический материалЗабор и последующее исследование клинического
- 218. Эпидемиологический надзорРешение вопроса о возможности использования материалов
- 219. Эпидемиологический надзорВид инфекцииИнфекции часто классифицируют в зависимости
- 220. Эпидемиологический надзорМетоды выделения и идентификации Для получения
- 221. Эпидемиологический надзорМетоды определения чувствительностиПредпочтение должно быть отдано
- 222. Эпидемиологический надзорВыбор набора АБП для тестирования также
- 223. Эпидемиологический надзорПри наличии практической необходимости и возможности,
- 224. Эпидемиологический надзор При получении необычных
- 225. Эпидемиологический надзорМетоды оценки клонального родства штаммовВ настоящее
- 226. Эпидемиологический надзорМетоды типирования, используемые для оценки, родства
- 227. Эпидемиологический надзорПриведенные методы существенно различаются по таким
- 228. Эпидемиологический надзорДля двух из генотипических методов (PFGE
- 229. Эпидемиологический надзорПоддержание стандартов качестваДля обеспечения достоверности результатов
- 230. Эпидемиологический надзорДополнительные сведения Для получения достоверной информации
- 231. Эпидемиологический надзорМинимальный рекомендуемый набор данных для проведения
- 232. Эпидемиологический надзордату поступления пациента;основные симптомы или особенности
- 233. Эпидемиологический надзорАнализ и представление данных по антибиотикорезистентностиПровести
- 234. Эпидемиологический надзорКроме того, существует множество коммерческих компьютерных
- 235. Эпидемиологический надзорПомимо перечисленной выше информации, для проведения
- 236. Эпидемиологический надзорДля лечебных учреждений амбулаторно-поликлинического профиляКоличество врачей,
- 237. Эпидемиологический надзорПеречисленные статистические данные могут использоваться:В качестве
- 238. Эпидемиологический надзорПроцедуры для выявления и исключения из
- 239. Эпидемиологический надзорФенотип чувствительности – при этом в
- 240. Эпидемиологический надзорВиды представления данных по антибиотикорезистентностиДанные по
- 241. Эпидемиологический надзорЧастоты встречаемости резистентных (Р) штаммов, штаммов
- 242. Результаты эпидемиологического надзораПростые: Частота (%) резистентности к
- 243. Эпидемиологический надзорПрактические рекомендации по проведению анализа данных
- 244. Эпидемиологический надзорИспользование полученной информацииОсновной целью эпидемиологического надзора
- 245. Эпидемиологический надзорВ зависимости от уровня проведения эпидемиологического
- 246. Скачать презентацию
- 247. Похожие презентации











































































































































































































































Слайд 2
Основные этапы проведения тестирования на антибиотикочувствительность микроорганизмов.
приготовление питательных
сред
рекомендаций по лечению.
Слайд 3
Приготовление питательных сред для определения чувствительности
Вид питательной среды
для оценки чувствительности определяют выбранным методом проведения исследования (агар
или бульон), а также видом тестируемого микроорганизма.
Слайд 4
Приготовление питательных сред для определения чувствительности
Плотную питательную среду
готовят в соответствии с инструкцией изготовителя.
Важным моментом при
определении чувствительности ДДМ является толщина слоя агара в чашке. Она должна составлять (4,0 +/- 0,5) мм, что достигается при внесении в чашку Петри диаметром 90 мм строго 20 мл агара, диаметром 100 мм - 25 мл агара, а диаметром 150 мм - 60 мл агара. Перед заполнением расплавленной средой чашки Петри устанавливают на строго горизонтальную поверхность (выверенную по уровню, без впадин и выпуклостей).
Соблюдение указанных предосторожностей необходимо в связи с тем, что размер и форма зоны ингибиции роста зависят от глубины и равномерности агарового слоя.
Слайд 5
Приготовление питательных сред для определения чувствительности
После
заполнения чашки оставляют при комнатной температуре для застывания.
Хранить
чашки можно запаянными в полиэтиленовые пакеты при 4 - 8 °С в течение 7 - 10 сут. При использовании свежеприготовленных чашек или чашек после хранения в холодильнике их необходимо подсушить перед инокуляцией, что достигается инкубацией при 35 °С с приоткрытой крышкой в течение 10 - 20 мин.
Перед инокуляцией необходимо проконтролировать отсутствие конденсата жидкости на внутренней поверхности крышек.
Слайд 6
Приготовление суспензии исследуемых микроорганизмов (инокулюма)
Общим и принципиально важным
для всех методов тестирования является стандартизация суспензии исследуемого микроорганизма,
ее концентрация должна составлять 1,5 x 108 КОЕ/мл.Практически наиболее приемлемым методом оценки концентрации бактериальной суспензии является измерение ее оптической плотности. Оптическая плотность бактериальной суспензии с концентрацией 1,5 x 108 КОЕ/мл
при визуальном контроле соответствует стандарту мутности 0,5 по Мак-Фарланду.
Контроль оптической плотности суспензии можно также осуществлять спектрофотометрически
Слайд 8
Приготовление инокулюма из агаровой культуры
Для приготовления инокулюма используют
чистую суточную культуру микроорганизмов, выросших на плотных питательных средах.
Отбирают несколько однотипных, четко изолированных колоний, выросших на неселективных плотных питательных средах.
Петлей переносят незначительное количество материала с верхушек колоний в пробирку со стерильным физиологическим раствором или питательным бульоном, доводя плотность инокулюма точно до 0,5 по стандарту Мак-Фарланда.
Инокулюм следует использовать в течение 15 мин. после приготовления.
Слайд 9
Приготовление инокулюма из бульонной культуры
При определении чувствительности быстро
растущих бактерий с обычными питательными потребностями для приготовления инокулюма
также можно использовать 5 - 6-часовую бульонную культуру микроорганизма.Для этого отбирают несколько однотипных изолированных колоний, петлей переносят незначительное количество материала в пробирку с 4,0 - 5,0 мл жидкой неселективной питательной средин, инкубируют при 35 °С. Через 5 - 6 ч инкубации плотность микробной суспензии приблизительно соответствует необходимой, и ее точно доводят до 0,5 по Мак-Фарланду путем добавления стерильного бульона или физиологического раствора.
Слайд 10
Приготовление стандарта 0,5 по
Мак-Фарланду
К 0,5 мл раствора
ВаСl2 в концентрации 0,048 моль/л (1,175% раствор ВаСl2 x
2 H2O) медленно при тщательном перемешивании добавить 99,5 мл раствора H2SO4 в концентрации 0,18 моль/л (1%) до получения гомогенной суспензии.Правильность приготовления суспензии необходимо проверить на спектрофотометре. Поглощение при использовании кюветы 1 см должно составить 0,08 - 0,10 при длине волны 625 нм.
Полученную суспензию необходимо разлить по 4 - 6 мл в пробирки с герметично закрывающимися крышками. Пробирки должны быть такого же диаметра, как и используемые для приготовления бактериальной суспензии.
Хранить пробирки с суспензией необходимо в темноте при комнатной температуре.
Перед использованием пробирки необходимо тщательно встряхивать и оценивать однородность суспензии. При появлении видимых частиц пробирки изымаются из употребления.
Стандарт мутности необходимо обновлять или проверять его оптическую плотность ежемесячно.
Слайд 11
Методы серийных разведений
Общим и крайне важным этапом для
всех методов серийных разведений является приготовление растворов АБП. Различают
«основные» растворы АБП (пригодные для хранения) и «рабочие» - те, которые необходимо использовать "ex tempore" для приготовления питательных сред.Для приготовления основных растворов АБП необходимо использовать субстанции АБП с известной активностью, лекарственные формы не пригодны. Для взвешивания субстанций необходимо использовать электронные лабораторные весы с точностью до 4 знака, для измерения объёмов – калиброванные дозаторы и пипетки.
Слайд 12
Методы серийных разведений
Основные растворы АБП готовят в концентрации
1000,0 мкг/мл и выше. Навески АБП для приготовления базовых
растворов готовят с учетом их активности. Расчет навески АБП для приготовления базового раствора проводят по формуле:m АБ теор. – расчётная (теоретическая) навеска АБП;
С – необходимая концентрация АБП;
V теор. – объём растворителя для растворения теоретической навески;
А – активность АБП (количество активного вещества, содержащегося в субстанции)
Слайд 13
Методы серийных разведений
Взвесить точно расчётное количество порошка практически
невозможно. Поэтому готовят близкую к расчётной навеску, а затем
пересчитывают количество необходимого растворителя.V практ. – объём растворителя для растворения практической навески;
m АБ практ. –полученная навеска АБП;
m АБ теор. – расчётная (теоретическая) навеска АБП;
V теор. – объём растворителя для растворения теоретической навески;
Слайд 14
Метод серийных разведений в бульоне.
Макрометод (пробирочный)
Микрометод (при
величине конечного объема 0,2 мл и меньше).
Область применения
макрометода из-за низкой производительности ограничивается случаями необходимости оценки чувствительности единичных штаммов. Макрометод.
Процедура.
Тестирование проводят в объеме 1 мл каждого разведения АБП с конечной концентрацией исследуемого микроорганизма примерно 5 x 105 КОЕ/мл.
Питательная среда.
Питательный бульон для определения чувствительности разливают по 0,5 мл в каждую пробирку. Количество пробирок определяют необходимым диапазоном разведений АБП и увеличивают на одну для постановки "отрицательного" контроля.
Слайд 15
Макрометод
Приготовление серийных разведений АБП (рис. 1).
Рабочий раствор АБП
готовят из основного раствора с использованием жидкой питательной среды.
Концентрацию рабочего раствора рассчитывают исходя из необходимой максимальной концентрации в ряду серийных разведений, учитывая фактор разбавления препарата при последующей инокуляции. Затем рабочий раствор в количестве 0,5 мл при помощи микропипетки со стерильным наконечником вносят в первую пробирку, содержащую 0,5 мл бульона. Тщательно перемешивают и новым стерильным наконечником переносят 0,5 мл раствора АБП в бульоне во вторую пробирку, содержавшую первоначально 0,5 мл бульона. Эту процедуру повторяют, пока не будет приготовлен весь необходимый ряд разведений. Из последней пробирки 0,5 мл бульона удаляют.Таким образом, получают ряд пробирок с растворами АБП, концентрации которых отличаются в соседних пробирках в 2 раза. Одновременно готовят дополнительные ряды серийных разведений АБП для тестирования контрольных штаммов. Серия разведений обязательно должна включать в себя пограничные концентрации и допустимые диапазоны МПК для контрольных штаммов.
Слайд 16
Макрометод
Приготовление инокулюма и инокуляция.
Для инокуляции используют стандартную микробную
взвесь, эквивалентную 0,5 по стандарту МакФарланда, разведенную в 100
раз на питательном бульоне, после чего концентрация микроорганизма в ней составит примерно 106КОЕ/мл.По 0,5 мл инокулюма вносят в каждую пробирку, содержащую по 0,5 мл соответствующего разведения АБП, и в одну пробирку с 0,5 мл питательного бульона без антибиотика ("отрицательный" контроль). Конечная концентрация микроорганизма в каждой пробирке достигнет необходимой - примерно 5x105 КОЕ/мл. Инокулюм должен быть внесен в пробирки с разведениями АБП не позднее 15-30 мин. с момента приготовления.
Слайд 17
Макрометод
Инкубация.
Пробирки закрывают стерильными ватно-марлевыми пробками или металлическим колпачками,
и все пробирки с тестируемыми штаммами, кроме пробирки "отрицательный"
контроль, инкубируют в обычной атмосфере при температуре 35оС в течение 16-20 или 20-24 ч (в зависимости от вида тестируемого микроорганизма). Пробирку "отрицательный" контроль помещают в холодильник при +4оС, где хранят до учета результатов.Учет результатов.
Для определения наличия роста микроорганизма пробирки с посевами просматривают в проходящем свете. Рост культуры в присутствии АБП сравнивают с референтной пробиркой ("отрицательный" контроль), содержащей исходный инокулюм и хранившейся в холодильнике. МПК определяют по наименьшей концентрации АБП, которая подавляет видимый рост микроорганизма.
Слайд 18
Метод серийных разведений в бульоне
Инокулюм плотностью
0,5 по
МакФарланду
(1,5 х 108 КОЕ/мл)
по 0,5 мл
Слайд 20
Микрометод
Преимуществами микрометода является высокая производительность и возможность длительного
хранения заранее приготовленных планшет.
Тестирование проводят при величине конечного
объема 0,2 мл и меньше, что позволяет значительно сократить количество расходных материалов. Методика не имеет отличий от макрометода, за исключением используемых объемов питательного бульона с разведениями антибиотиков и инокулюма, но требует дополнительного оснащения лаборатории многоканальными пипетками, 96-луночными планшетами для иммунологических исследований (с плоским дном) со стерильными крышками.
Слайд 21
Микрометод
Первым этапом является изготовление планшет, пригодных для хранения.
После внесения рабочих растворов антибиотиков в лунки, запаянные в
полиэтилен планшеты могут храниться при температуре ниже –600С до момента использования. Повторное замораживание-оттаивание не допускается.Для проведения исследования планшеты после извлечения из холодильника выдерживают до достижения ими комнатной температуры, после чего проводят инокуляцию приготовленной суспензией исследуемого микроорганизма. При проведении инкубации планшет обязательно должен быть закрыт крышкой для предотвращения высыхания содержимого лунок.
Учет результатов проводят визуально или спектрофотометрически, сравнивая рост микроорганизма в присутствии АБП с ростом культуры в ячейке без АБП.
За МПК принимают минимальную концентрацию, обеспечивающую полное подавление видимого роста исследуемого штамма.
Слайд 23
Методы серийных разведений
Контроль качества.
При постановке методов серийных разведений
в бульоне необходимо проводить контроль роста культуры в среде
без АБП.Необходимо также контролировать чистоту суспензии микроорганизма, использованной для инокуляции, путем высева на неселективные среды.
Каждая партия тестируемых штаммов сопровождается внутренним контролем качества исследования с использованием соответствующих контрольных (референтных) штаммов.
Слайд 24
Метод серийных разведений в агаре
Метод серийных разведений
в агаре позволяет одновременно определить МПК партии штаммов (от
15 до 30 клинических штаммов + контрольные штаммы, в зависимости от используемой модели инокулятора).Процедура.
Принцип метода заключается в посеве тестируемых микроорганизмов на чашки Петри с агаром, содержащим последовательные двойные разведения антибиотиков. Одновременно проводят тестирование партии клинических штаммов и соответствующих контрольных штаммов, а также контроль роста микроорганизмов на чашках без АБП и контроль чистоты культуры путем высева образцов инокулюма на неселективные питательные среды.
Слайд 25
Метод серийных разведений в агаре
Приготовление серийных разведений АБП.
Из
основного раствора исследуемого АБП готовят рабочий раствор в концентрации
в 10 раз превосходящей максимальную из используемых в конкретном исследовании.Затем готовят серию двукратных разведений рабочего раствора. Таким образом, концентрация в АБП в каждом последующем разведении должна быть в 2 раза меньшей, чем в предыдущем.
Для приготовления серии разведений используют любые стерильные химически инертные лабораторные ёмкости с завинчивающимися крышками объёмом не менее 10 мл (для удобства размешивания).
Слайд 26
Метод серийных разведений в агаре
Питательная среда.
Сухую агаризованную питательную
среду растворяют и автоклавируют в соответствии с инструкцией изготовителя.
После
автоклавирования колбы с питательной средой помещают на водяную баню при 48 - 500С, где выдерживают до достижения указанной температуры, после чего в них асептически вносят рабочие растворы антибиотиков (1 часть рабочего раствора АБП на 9 частей расплавленного агара) и,
при необходимости, термолабильные питательные добавки.
Затем среду тщательно перемешивают и разливают по чашкам Петри, толщина слоя питательной среды должна быть 3-4 мм.
Слайд 27
Метод серийных разведений в агаре
Приготовление инокулюма и инокуляция.
Конечная
посевная доза исследуемого микроорганизма на поверхности питательной среды должна
составлять 104 КОЕ.Поскольку коммерческие инокуляторы или стандартная бактериологическая петля диаметром 3,0 мм переносят 1-2 мкл жидкости, концентрация микроорганизмов в исходной суспензии должна быть 107 КОЕ/мл.
Такую концентрацию можно получить при разведении стандартной микробной суспензии, соответствующей стандарту 0,5 по МакФарланду, в 10 раз.
Полученную суспензию необходимо инокулировать на поверхность агара в течение 15 мин после приготовления, при этом образуется пятно диаметром 5-8 мм.
Слайд 28
Метод серийных разведений в агаре
Для контроля качества приготовления
суспензий периодически рекомендуется проводить подсчет реальных колониеобразующих единиц путем
высева образца приготовленного инокулюма на неселективные питательные среды.Инкубация.
После инокуляции чашки оставляют при комнатной температуре для подсыхания, далее переворачивают и инкубируют при температуре 35оС в течение 18-24 ч (в зависимости от вида тестируемого микроорганизма).
Слайд 29
Метод серийных разведений в агаре
Учет результатов.
Учет результатов
проводят, поместив чашку на темную не отражающую свет поверхность.
За МПК принимают концентрацию, вызвавшую полную ингибицию видимого роста. Для дифференцировки нежного роста от налета, оставшегося после инокулята, в ряде случаев целесообразно использовать увеличение. Появление единственной колонии на чашке с концентрацией на 1 разведение выше, чем явная МПК, можно не учитывать. Результат оценки антибиотикочувствительности имеет смысл учитывать только при подтверждении чистоты культуры (контроль качества).Контроль качества
При постановке методов серийных разведений в агаре необходимо проводить контроль роста культуры на чашке Петри с питательной средой, не содержащей АБП. Важнейшим требованием контроля качества является высев, использованной для инокуляции суспензии на плотную неселективную среду для подтверждения чистоты культуры!
Каждая партия тестируемых штаммов сопровождается внутренним контролем качества исследования с использованием соответствующих контрольных (референтных) штаммов.
Слайд 30
Общие замечания по методам серийных разведений
Несмотря на
то, что методы серийных разведений являются наиболее точными и
информативными, их постановка в практических лабораториях сопряжена со значительными методическим трудностями. Прежде всего речь идет о необходимости использования субстанций антибиотиков с известным уровнем активности, строгого соблюдения режимов хранения, тщательного выполнения контроля качества питательных сред, трудоемкости приготовления рабочих растворов антибиотиков.Использование тест-систем на основе метода микроразведений позволяет избегать трудоемких процедур по стандартизации подготовительных этапов, но при этом обеспечивает получение достоверных количественных результатов по уровню антибиотикорезистентности. Весьма экономичным и простым в исполнении является также вариант метода серийных микроразведений, основанный на использовании двух пороговых концентраций, позволяющий получить качественные результаты (т.е. распределить штаммы по чувствительности на три категории).
Слайд 35
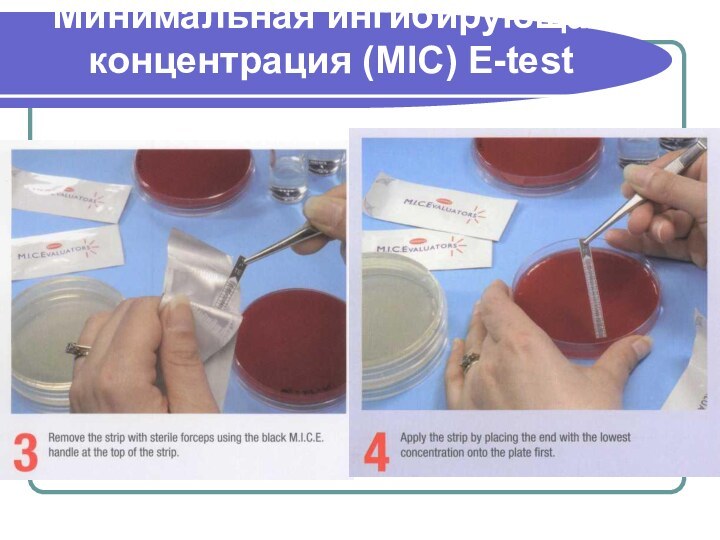
MIC - E-test
Если рост культуры пересекается на линии
между двумя зонами, то МИК читаем по значению меньшей
зоны.Если рост культуры наблюдается на протяжении всей полоски, это раскениваем как высокий показатель МИК.
Если рост культуры ингибируется вокруг полоски, то МИК расцениваем как минимальную.
2
1
3
Слайд 37
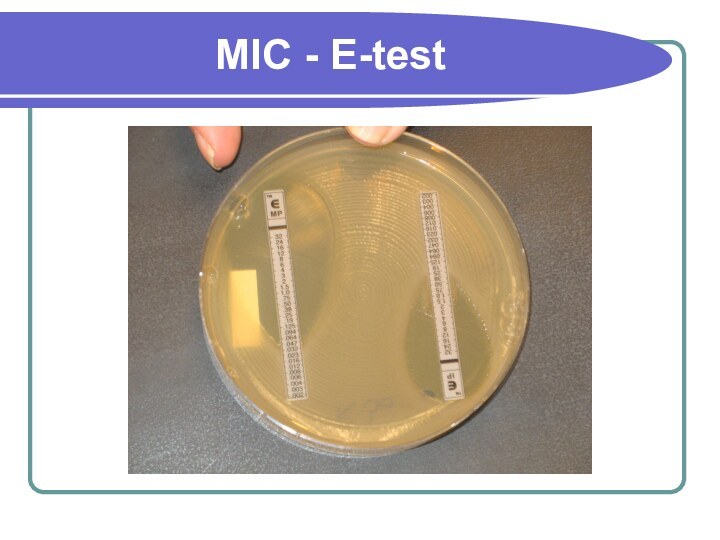
MIC - E-test
МИК оцениваем по нижнему значению.
Высокий показатель
МИК .
МИК оцениваем как минимальный.
3
3
3
2
2
2
1
1
1
Слайд 41
Диско-диффузионный метод (ДДМ)
Принцип метода
ДДМ определения чувствительности основан на
способности АБП диффундировать из пропитанных ими бумажных дисков в
питательную среду, угнетая рост микроорганизмов, посеянных на поверхности агара.
Слайд 42
Диски с антибиотиками
Использовать только стандартизированные качественные диски.
Строго
соблюдать правила хранения дисков ( в целях избежания снижения
содержание в них антибиотиков до истечения срока годности)Долговременное хранение дисков осуществляют в герметичной упаковке в морозильной камере при температуре -18 °С и ниже.
Кратковременное хранение небольших партий дисков, используемых при повседневной работе, можно хранить в холодильнике при температуре 4 - 8 °С, плотно укупоренными со специальным влагопоглотителем (силикагель).
Перед началом работы флаконы (картриджи) с дисками следует извлекать из холодильника за 1 ч и выдерживать герметично закрытыми до достижения ими комнатной температуры, что предотвращает образование конденсата на дисках после открывания флаконов.
Слайд 43
Способы иннокуляции
Первый способ:
Наиболее удобным способом инокуляции является использование
стерильных ватных тампонов. Тампон необходимо погрузить в стандартную суспензию
микроорганизма, затем избыток инокулюма удалить, отжав тампон о стенки пробирки. Инокуляцию проводят штриховыми движениями в трех направлениях, поворачивая чашку Петри на 60°.Второй способ:
При использовании второго способа стандартный инокулюм наносят пипеткой на поверхность чашки Петри с питательной средой в объеме 1 - 2 мл, равномерно распределяют по поверхности покачиванием, после чего удаляют избыток инокулюма пипеткой. Приоткрытые чашки подсушивают при комнатной температуре в течение 10 - 15 мин.
Слайд 45
Аппликация дисков
Не позднее чем через 15 мин.
после инокуляции на поверхность питательной среды наносят диски с
АБП.Аппликацию дисков
проводят с помощью
стерильного пинцета
или автоматического
диспенсера.
Слайд 46
Аппликация дисков
Расстояние от диска до края чашки
и между дисками должно
быть 15 - 20 мм.Таким образом, на одну чашку
диаметром 100 мм следует
помещать не более 6 дисков
с АБП. Диски должны
равномерно контактировать
с поверхностью агара, для
чего их следует аккуратно
прижать пинцетом.
Слайд 47
Инкубация
Непосредственно после аппликации дисков чашки Петри помещают
в термостат кверху дном и инкубируют при температуре 35
°С в течение 18 - 24 ч (в зависимости от вида тестируемого микроорганизма).Увеличение интервала времени между нанесением дисков на поверхность среды и началом инкубации (а соответственно - началом роста исследуемой культуры микроорганизма) приводит к "преддиффузии" АБП в агар и к увеличению диаметра зоны подавления роста.
Слайд 48
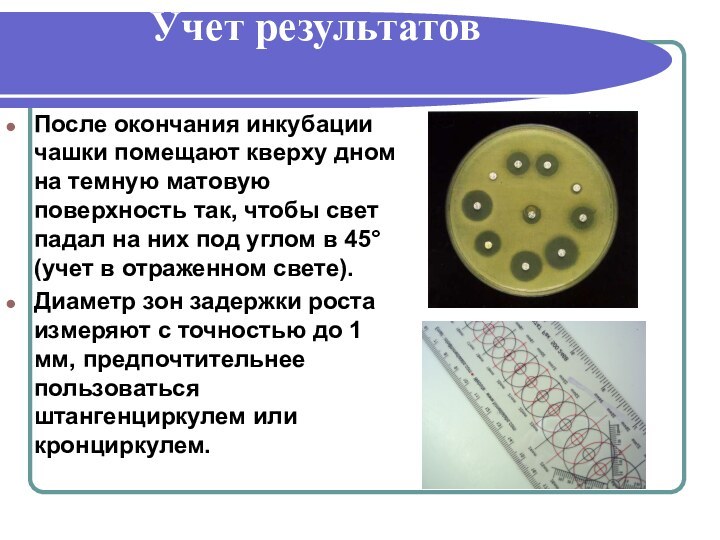
Учет результатов
После окончания инкубации чашки помещают кверху дном
на темную матовую поверхность так, чтобы свет падал на
них под углом в 45° (учет в отраженном свете).Диаметр зон задержки роста измеряют с точностью до 1 мм, предпочтительнее пользоваться штангенциркулем или кронциркулем.
Слайд 49
Учет результатов
При измерении зон задержки роста следует ориентироваться
на зону полного подавления видимого роста. Не следует обращать
внимания на очень мелкие колонии, выявляемые в пределах зоны задержки роста только при особых условиях освещения или увеличении, и едва заметный налет у края зоны. Исключение составляют случаи учета результатов определения чувствительности стафилококков к оксациллину, когда необходимо учитывать и самые мелкие колонии, выявляемые в пределах четкой зоны подавления роста.
Слайд 50
Учет результатов
Крупные колонии, выявляемые в пределах четкой зоны
подавления роста, свидетельствуют о наличии посторонней микрофлоры или о
гетерорезистентности популяции микроорганизмов, в этом случае необходимо повторить идентификацию микроорганизма, формирующего эту колонию, и определение чувствительности этого штамма.
Слайд 52
Учет результатов
При определении чувствительности ДДМ роящихся штаммов протея
зона подавления роста может быть затянута тонкой вуалеобразной пленкой,
которая не мешает установлению границы зоны и не учитывается при регистрации результатов.При определении чувствительности к сульфаниламидам и их комбинации с триметопримом границу зоны подавления роста следует учитывать на уровне ингибиции роста на 80%. Это связано с тем, что под действием этих препаратов перед полным подавлением роста возможно завершение 1 - 2 циклов пролиферации микроорганизма.
Слайд 55
Определение чувствительности к противогрибковыми препаратами
Диски предназначены для определения
чувствительности дрожжеподобных грибов рода Кандида к:
амфотерицину В
нистатину
клотримазолу
флуконазолу
итраконазолу
кетоконазолу
Слайд 56
Определение чувствительности к противогрибковыми препаратами
Диски подлежат хранению в
плотно закрытых флаконах, и сухом, защищенном от света месте,
при температуре 2 - 6°С.Поскольку диски с противогрибными препаратами не являются самостерилизующимися, необходимо бранши пинцета перед извлечением диска провести над пламенем горелки и остудить.
При соблюдении перечисленных правил срок хранения дисков - 12 месяцев (указан на этикетке).
Слайд 57
Техника постановки анализа
Питательная среда
Рекомендуется использовать агаризованную среду Сабуро
с рН не ниже 6,0. Для дисков с амфотерицином
В, нистатином и клотримазолом может быть использована среда МИЛ.Среду расплавляют па водяной бане, охлаждают до 50 ~ 60°С и разливают по 20 мл в чашки Петри. Готовые чашки со средой рекомендуется хранить в холодильнике при температуре 2 - 6°С, чтобы предупредить высыхание среды. Срок хранения - не более 7 суток.
Если па поверхности среды есть конденсат, необходимо подсушить чашки со средой в термостате.
Слайд 58
Техника постановки анализа
Приготовление инокулюма
Готовят взвесь 24 —
48 часовой культуры гриба в изотоническом растворе хлорида натрия
по оптическому стандарту мутности 5 ЕД (без пересчета на размер клетки гриба). Готовую взвесь разводят изотоническим раствором хлорида натрия в 10 разИнокуляция
Около 1 —2 мл взвеси наносят на поверхность чашки с питательной средой и покачиванием чашки равномерно распределяют взвесь по всей поверхности среды. Пипеткой удаляют избыток взвеси и приоткрытые чашки подсушивают при комнатной температуре 15 минут.
Слайд 59
Техника постановки анализа
Нанесение дисков
Диски располагают по поверхности агара
на равном расстоянии друг от друга и плотно прижимают
к среде. Не следует помещать на чашку более 5 дисков.Преддиффузия
При использовании дисков с флуконазолом чашки оставляют закрытыми на 30 минут на столе при комнатной температуре (до 20°С); при использовании дисков с итраконазолом и кетоконазолом чашки с дисками помещают в холодильник (2 - 6°С) на 1 час; при использовании дисков с амфотерицином В, нистатином и клотримазолом в холодильник на 2 часа.
Инкубация
Чашки с дисками инкубируют в термостате при 25 - 27°С в течение 40 - 48 часов.
Слайд 61 Определение чувствительности анаэробных бактерий (методом элюции из диска
с оценкой по пограничной концентрации).
Необходимое количество дисков (табл.) с
антибиотиками вносят в пробирку с 5 мл. тиогликолевой среды. Через 2 часа после завершения диффузии антибиотика в питательную среду в пробирки вносят 2 капли суточной культуры. Пробирки встряхивают, инкубируют 48 часов при 37°С в аэробных условиях и учитывают результаты.Необходимы два контроля:
а) тиогликолевая среда без культуры
в) тиогликолевая среда с культурой
Слайд 63
Учет результатов
Чувствительными считают штаммы,
не выросшие при данной
концентрации антибиотиков или дающие мутность <50% по сравнению с контролем.
Слайд 64
Определение чувствительности микроорганизмов
со сложными питательными потребностями
Определение чувствительности
микроорганизмов со сложными питательными потребностями является методически одной из
наиболее трудных задач, так как в ряде случаев требует одновременного использования метода серийных разведений и ДДМ, особой тщательности в выполнении всех процедур, начиная от приготовления питательных сред и инокулюма и заканчивая проведением контроля качества.В то же время эффективность эмпирической антибактериальной терапии многих инфекций, вызываемых микроорганизмами этой группы, хорошо предсказуема. При оценке необходимости определения чувствительности микроорганизмов этой группы к АБП необходимо объективно оценить соотношение стоимости и эффективности исследований, сопоставить стоимость полноценного материально-технического оснащения с доступными ресурсами.
Попытки даже незначительной модификации стандартных методов (замена дорогостоящих реагентов на более дешевые) могут привести к получению ошибочных, недостоверных результатов, способных ввести в заблуждение и микробиологов, и клиницистов.
Слайд 65
Определение чувствительности Streptococcus spp
Питательные среды
Для определения чувствительности
стрептококков используют следующие питательные среды:
Для методов серийных разведений
в бульоне необходимо использовать бульон Мюллера-Хинтон с добавлением 2,0 – 5,0% лизированной лошадиной крови. Кровь лизируют замораживанием - оттаиванием с последующим центрифугированием для освобождения от теней эритроцитов.Для методов серийных разведений в агаре и ДДМ используют агар Мюллера-Хинтон с добавлением 5% дефибринированной бараньей крови.
Указанные добавки асептически вносят в питательную основу после автоклавирования и охлаждения до 48 – 500С.
Слайд 68
Streptococcus pneumoniae
Бета-лактамные антибиотики (пенициллин) являются препаратами выбора для
терапии пневмококковых инфекций. В то же время критерии интерпретации
результатов определения чувствительности пневмококков к этим препаратам постоянно пересматриваются в связи с появлением новых клинических и экспериментальных данных об эффективности различных бета-лактамов при пневмококковых инфекциях, вызванных штаммами с различным уровнем чувствительности к пенициллину.Механизм резистентности S.pneumoniae к пенициллину и другим бета-лактамным антибиотикам обусловлен изменением пенициллиносвязывающих белков (ПСБ) клеточной стенки. В результате ступенчатых мутаций уменьшается сродство ПСБ к бета-лактамным антибиотикам.
Слайд 69
S. pneumoniae
Механизм резистентности S.pneumoniae к пенициллину и другим
бета-лактамным антибиотикам обусловлен изменением пенициллиносвязывающих белков (ПСБ) клеточной стенки.
В результате ступенчатых мутаций уменьшается сродство ПСБ к бета-лактамным антибиотикам.
*
*
*
*
*
*
Г(-)
в пери-
плазме
Г(+)
вне
клетки
Слайд 70
Streptococcus pneumoniae
При лечении инфекций дыхательных путей, вызванных штаммами
S. pneumoniae с промежуточным уровнем резистентности к пенициллину, бета-лактамные
антибиотики остаются клинически эффективными, но применение их при менингите приводит к неудаче терапии.В связи с этим при разработке критериев интерпретации результатов определения чувствительности S.pneumoniae к бета-лактамным антибиотикам было проведено подразделение штаммов по источникам выделения (инфекции дыхательных путей, ликвор) и пересмотрены критерии оценки чувствительности к амоксициллину, цефотаксиму и цефтриаксону.
Слайд 71
Streptococcus pneumoniae
Следует обратить внимание на несколько важных особенностей
определения чувствительности S.pneumoniae:
невозможность определения чувствительности к бета-лактамным антибиотикам (пенициллину,
аминопенициллинам, цефалоспоринам, карбапенемам) ДДМневозможность определения чувствительности S.pneumoniae к АБП методом разведений в агаре
Слайд 72
Streptococcus pneumoniae
Определение чувствительности пневмококков к пенициллину и другим
бета-лактамным антибиотикам подразумевает последовательное (выделение S.pneumoniae из нестерильных локусов)
или одновременное (при тяжелых инфекциях, выделении пневмококков из крови и ликвора) выполнение двух исследований:Скрининга с диском, содержащим 1,0 мкг оксациллина, с целью выявления возможной пенициллинорезистентности.
Скрининговый метод позволяет разделить микроорганизмы на две группы:
чувствительные и умеренно-резистентные
резистентные штаммы пневмококков.
Определение МПК пенициллина и других бета-лактамных антибиотиков методом разведений в бульоне или с помощью Е-тестов у штаммов, отнесенных ко второй группе по результатам скрининга.
Слайд 75
Критерии чувствительности
S.pneumoniae
При оценке чувствительности к бета-лактамным антибиотикам
ДДМ не позволяет получить воспроизводимые результаты, необходимо использовать метод
серийных разведений в бульоне.ДДМ (с диском, содержащим 1 мкг оксациллина) применим только для скрининга на наличие пенициллинорезистентности у штаммов пневмококков.
Штаммы, чувствительные к пенициллину, следует считать чувствительными ко всем бета-лактамным антибиотикам.
При подозрении на наличие пенициллинрезистентности по результатам теста с оксациллином необходимо определить МПК пенициллина и других бета-лактамных антибиотиков методом серийных разведений в бульоне.
Критерии интерпретации результатов определения МПК применимы только для метода серийных разведений в бульоне.
Слайд 78
Скрининг
пенициллинорезистентности S. pneumoniae
Постановка теста
Методика проведения исследования не
отличается от обычной процедуры определения чувствительности пневмококков к АБП
ДДМ.Интерпретация результатов
При выявлении диаметра зоны подавления роста штамма пневмококка вокруг диска с 1 мкг оксациллина >= 20 мм, S. pneumoniae расценивается как чувствительный ко всем бета-лактамным антибиотикам.
При выявлении диаметра зоны подавления роста < 20 мм необходимо определение МПК всех бета-лактамных антибиотиков (пенициллина, аминопенициллинов, цефалоспоринов II - IV поколений, карбапенемов) методами серийных разведений в бульоне или с помощью Е-тестов.
Слайд 79
Скрининг
резистентности S. pneumoniae
Макролиды и линкозамиды. Вторыми по
значимости в лечении пневмококковых инфекций являются макролидные и линкозамидные
антибиотики.Оценка чувствительности S. pneumoniae к перечисленным антибиотикам возможна как диско-диффузионным методом, так и методом серийных разведений.
В связи с разнообразием механизмов устойчивости S. pneumoniae к макролидам в повседневной практике могут встречаться различные варианты перекрестной резистентности микроорганизмов к АБП этой группы.
Слайд 80
Скрининг
резистентности S. pneumoniae
Однако в практических целях для
характеристики чувствительности S. pneumoniae к рассматриваемой группе АБП достаточно
оценить чувствительность к эритромицину и клиндамицину, что позволяет дифференцировать два основных фенотипа:MLSB – перекрестная устойчивость ко всем макролидам, линкозамидам и стрептограминам В, обусловленная метилированием мишени действия препаратов.
М – устойчивость к 14-ти и 15-членным макролидам (сохранении чувствительности к 16-ти членным макролидам, линкозамидам и стрептограминам), обусловленная активным выведением АБП.
Слайд 81
Скрининг
резистентности S. pneumoniae
Фторхинолоны. Традиционные фторхинолоны (пефлоксацин, офлоксацин,
ципрофлоксацин и ломефлоксацин) не являются адекватными для лечения пневмококковых
инфекций, соответственно оценивать чувствительность к этим препарата нецелесообразно.В последние годы в лечении пневмококковых инфекций важное место заняли антипневмококковые фторхинолоны (левофлоксацин, спарфлоксацин, моксифлоксацин и гатифлоксацин). Частота устойчивости к перечисленным препаратам минимальна, однако поскольку между ними не наблюдают полной перекрестной резистентности возникает необходимость включения в исследование всей группы
Слайд 82
Скрининг
резистентности S. pneumoniae
АБП других групп. Из антибиотиков
других групп, для лечения пневмококковых инфекций применяют ко-тримоксазол, хлорамфеникол,
тетрациклины. Однако роль перечисленных препаратов в последние годы резко снижается в связи нарастанием устойчивости, меньшей клинической эффективностью в сравнении с бета-лактамами, макролидами и антипневмококковыми фторхинолонами, также значительным числом нежелательных эффектов.Для лечения тяжелых пневмококковых инфекций, вызванных штаммами с высоким уровнем устойчивости к антибактериальным препаратам других групп в ряде случаев рекомендуется ванкомицин.
Слайд 83
Streptococcus spp. группа «viridans”
Проводить определение чувствительности штаммов стрептококков
группы “viridans”, выделенных из нестерильных локусов в рутинной практике
нецелесообразно.У штаммов, выделенных из стерильных в норме локусов организма, необходимо, в первую очередь, исследовать чувствительность к пенициллину. Воспроизводимые результаты при определении чувствительности стрептококков группы “viridans” к пенициллину удается получить только при помощи метода серийных разведений, ДДМ не пригоден для этой цели.
Штаммы, чувствительные к этому антибиотику следует расценивать, как чувствительные ко всем бета-лактамным антибиотикам.
Часть штаммов, устойчивых к пенициллину, могут сохранять чувствительность к некоторым цефалоспоринам III поколения (цефотаксиму и цефтриаксону), IV поколения (цефепиму) и карбапенемам. Однако критерии интерпретации результатов определения чувствительности в настоящее время установлены только для цефотаксима и цефтриаксона.
Слайд 84
Streptococcus spp. группа «viridans”
Определенный интерес может представлять изучение
чувствительности стрептококков группы “viridans” к эритромицину и другим макролидам,
клиндамицину, тетрациклину и хлорамфениколу, однако клиническое значение получаемых при этом данных не определено.В случае сниженной чувствительности или резистентности зеленящих стрептококков к пенициллину при выдаче результатов тестирования клиницистам целесообразно рекомендовать проведение комбинированной терапии бета-лактамами с аминогликозидами, которые проявляют синергизм при совместном применении с бета-лактамами, несмотря на отсутствие у аминогликозидов собственной значимой активности в отношении стрептококков.
Слайд 85
Определение чувствительности бета-гемолитических стрептококков
Среди стрептококков выделяют различные серологические
группы по Лансфельд (А, B, C, G). Среди них
наибольшее клиническое значение имеют стрептококки группы А (Streptococcus pyogenes) и группы В (Streptococcus agalactiae).Препаратами выбора для лечения инфекций, вызванных бета-гемолитическими стрептококками являются бета-лактамы, причем достоверные случаи устойчивости к АБП этой группы описаны в последние годы. Не описана устойчивость к ванкомицину.
Слайд 86
Определение чувствительности бета-гемолитических стрептококков
При выделении из нестерильных локусов
необходимость в оценке чувствительности возникает только для S. pyogenes
и S. agalactiae.Примерный перечень препаратов для определения чувствительности этих микроорганизмов включает:
макролиды (эритромицин) и линкосамиды (клиндамицин).
С целью мониторига антибиотикорезистентности возможно определение чувствительности к хлорамфениколу и левофлоксацину.
Для бета-гемолитических стрептококков, выделенных из стерильных локусов необходимо определять чувствительность ко всем вышеперечисленным препаратам одновременно.
Слайд 87
Критерии чувствительности
Streptococcus spp. (кроме S.pneumoniae)
1 –
штаммов S, agalactiae , устойчивых к пенициллину не описано
2
– критерии диско-диффузионного метода применимы только для β-гемолитических стрептококков
Слайд 89
Критерии чувствительности
Streptococcus spp. (кроме S.pneumoniae)
3 – критерии
диско-диффузионного метода и метода серийных разведений применимы только для
β-гемолитических стрептококков
Слайд 90
Определение чувствительности Haemophilus influenzae
Питательные среды
Для определения чувствительности
Haemophilus spp. необходимо использовать только специальную питательную среду HTM
(Haemophilus Test Medium), содержащую необходимые для гемофил факторы роста. Данная среда доступна из коммерческих источников. Однако ее можно приготовить на основе среды Мюллера-Хинтона в лаборатории.Среду готовят на основе бульона или агара Мюллера-Хинтон. После растворения основы в нее добавляют
дрожжевой экстракт (до конечной концентрации 5 мг/мл)
раствор гематина (до конечной концентрации 15 мг/л).
Для приготовления основного раствора гематина 50 мг порошка помещают в 100,0 мл 0,01N NaOH (0.01 моль/л) и нагревают при тщательном перемешивании до полного растворения.
Слайд 91
Определение чувствительности Haemophilus influenzae
В подготовленную для автоклавирования среду
на 1 л вносят 30,0 мл основного раствора гематина.
После
автоклавирования и охлаждения основы до 48–500С в нее асептически вносят раствор никотинамид аденин динуклеотида (НАД) до конечной концентрации 15 мг/л. Раствор НАД стерилизуют фильтрацией через мембранные фильтры с размером пор 0,45 мкмПри определении чувствительности к сульфаниламидам и триметоприму в охлажденную до 48 - 500С среду асептически вносят также раствор тимидина.
Слайд 92
Определение чувствительности Haemophilus influenzae
Haemophilus spp. характеризуются природной чувствительностью
к большинству распространенных антибиотиков, в том числе, и к
бета-лактамам.Практически важным исключением является отсутствие активности в отношении Haemophilus spp. у цефалоспоринов I поколения.
Наибольшее значение имеет приобретенная резистентность к ампициллину, обусловленная продукцией плазмидных бета-лактамаз ТЕМ-1 и ROB-1.
Кроме ампициллина эти ферменты частично гидролизуют цефалоспорины I поколения, но не активны в отношении препаратов II - III поколений.
Слайд 93
Определение чувствительности Haemophilus influenzae
Известны штаммы H.influenzae, устойчивость которых
к ампициллину связана с изменением мишени действия β-лактамных антибиотиков
(ПСБ) или снижением проницаемости наружной клеточной стенки.Эти штаммы получили название бета-лактамазонегативные ампициллинорезистентные (БЛНАР) и считаются нечувствительными к ингибиторозащищенным пенициллинам и таким цефалоспоринам, как цефаклор, цефуроксим, цефиксим, цефтибутен.
До настоящего времени не получено клинических штаммов H.influenzae, устойчивых к цефалоспоринам III–IV поколений и карбапенемам.
Слайд 94
Выявление ампициллинорезистентности H.influenzae
Для выявления ампициллинорезистентности у гемофильной палочки
в рутинной лабораторной практике достаточно определения чувствительности к ампициллину
ДДМ и теста на продукцию β-лактамаз с нитроцефином.Эти два теста позволяют подразделить штаммы на ампициллиночувствительные, бета-лактамазопродуцирующие ампициллинорезистентные (чувствительные к ингибиторозащищенным пенициллинам и цефалоспоринам II–IV поколений) и БЛНАР, которые следует расценивать как резистентные к ингибиторозащищенным пенициллинам и некоторым цефалоспоринам.
Причем тестирование с диском, содержащим ингибиторозащищенные пенициллины, например амоксициллин/клавуланат, не позволяет отличить БЛНАР от ампициллиночувствительных штаммов H.influenzae.
Слайд 95
Определение резистентности Haemophilus influenzae
Макролидные антибиотики отличаются невысоким уровнем
активности в отношении Haemophilus spp., при этом между ними
выявляются незначительные различия (наиболее активен азитромицин).Низкий уровень активности макролидов связан с наличием у этого микроорганизма фоновой активности механизмов активного выведения.
Подавляющее большинство штаммов H. influenzae с микробиологической точки зрения относятся к «дикой» популяции, лишенной дополнительных детерминант резистентности к этим АБП. Однако in vivo при приеме в рекомендуемых дозах концентрации макролидов органах и тканях оказываются недостаточными для обеспечения эрадикации патогена.
Учитывая приведенные факты обоснованность критериев чувствительности H. influenzae к азитромицину и кларитромицину вызывает сомнения.
Слайд 96
Определение резистентности Haemophilus influenzae
Устойчивость к фторхинолонам среди H.
influenzae встречается редко, однако частота встречаемости штаммов с повышенными
значениями МПК фторхинолонов возрастает, что обосновывает необходимость тестирования указанных АБП.Наиболее вероятно, что между отдельными представителями этой группы существует перекрестная резистентность, характерная и для других грамотрицательных бактерий.
Слайд 99
Критерии чувствительности H.influenzae
1. Для прогнозирования чувствительности к бета-лактамным
антибиотикам целесообразно проводить непосредственное выявление выработки бета-лактамаз в тесте
с нитроцефином. Описаны штаммы устойчивые к ампициллину, но не продуцирующие бета-лактамазы, их следует расценивать как устойчивые к защищенным пенициллинам и цефалоспоринам II поколения
Слайд 101
Критерии чувствительности H.influenzae
2 – Критерии интерпретации результатов тестирования
с определением МПК применимы только для метода серийных разведений
в бульоне.
Слайд 102
Определение чувствительности Neisseria gonorrhoeae
Оценка антибиотикочувствительности N.gonorrhoeae представляет
собой достаточно сложную методическую проблему. Методы определения чувствительности гонококков
в бульоне недостаточно надежны, поэтому следует использовать только метод разведений в агаре или ДДМ.Питательные среды
Для определения чувствительности N.gonorrhoeae используют гонококковый агар, состоящий из гонококковой агаровой основы (GC Agar Base, BBL) и 1% комплексной питательной добавки (КПД) (PolyVitex, BioMerieux или собственного приготовления) без гемоглобина. При тестировании карбапенемов и клавулановой кислоты необходимо использовать добавку, не содержащую цистеин.
Слайд 103
Определение чувствительности Neisseria gonorrhoeae
В КПД входят следующие компоненты:
Глюкоза 100
г
L-цистеингидрохлорид 25,9 г
L-глютамин 10 г
L-цистин 1,1 г
Аденин 1 г
Никотинамидадениндинуклеотид 0,25 г
Витамин В12 0,1 г
Тиамина пирофосфат 0,1
гГуанина гидрохлорид 0,03 г
Fe(NO3)3.6H2O 0,02 г
Парааминобензойная кислота 0,013 г
Тиамина гидрохлорид 3 г
Слайд 104
Определение чувствительности Neisseria gonorrhoeae
Все ингредиенты растворяют в небольшом
количестве дистиллированной воды и затем доводят объём до 1
л. КПД стерилизуют фильтрацией через бактериальный фильтр 0,02 мкм. КПД нельзя хранить и автоклавировать, необходимо использовать ex tempore. Полученную смесь асептически вносят в GC агар после автоклавирования и охлаждения до 48–50оС в количестве 1,0% (объем/объем). Агар разливают в чашки Петри без добавления антибиотиков для ДДМ и с добавлением АБП для метода разведения в агаре.Средствами выбора для лечения гонореи являются бета-лактамные антибиотики. Однако, среди штаммов N.gonorrhoeae широко распространена резистентность к пенициллину, тетрациклинам и макролидам. В ряде регионов Земного шара отмечают резкое возрастание частоты резистентности гонококков к фторированным хинолонам. Для практики крайне важно то, что до сих пор достоверно не описано случаев резистентности гонококков к цефалоспоринам III поколения, что позволяют рассматривать цефалоспорины III поколения (цефотаксим и цефтриаксон) как препараты выбора для лечения гонореи.
Слайд 105
Определение чувствительности Neisseria gonorrhoeae
Оценивать антибиотикочувствительность гонококков следует только
в тех случаях, когда для лечения невозможно или нецелесообразно
использовать цефалоспорины III поколения. Такие ситуации складываются при наличии у пациентов аллергии к бета-лактамам или при смешанных гонорейно-хламидийных инфекциях, а также для эпидемиологического мониторинга.В набор для тестирования N.gonorrhoeae рекомендуется включать фторхинолоны (офлоксацин или ципрофлоксацин), тетрациклины, спектиномицин. Дополнительно для более полной характеристики штаммов и эпидемиологического мониторинга целесообразно изучать чувствительность к пенициллину и цефалоспоринам II-III поколений.
Слайд 106
Критерии чувствительности N.gonorrhoeae
1 – Критерии интерпретации результатов
чувствительности по МПК применимы только для метода серийных разведений
в агаре2 – Предпочтительно поводить непосредственное выявление продукции бета-лактамаз с использованием теста с нитроцефином, положительный результат теста свидетельствует о резистентности штамма к пенициллину, ампициллину, амоксициллину.
Слайд 107
Критерии чувствительности N.gonorrhoeae
3 – Выявление устойчивости к тетрациклину
свидетельствует о резистентности к доксициклину
Слайд 108
Определение чувствительности Enterococcus spp
Энтерококки характеризуются природной устойчивостью ко
многим АБП (цефалоспоринам, аминогликозидам), а
клиническое значение наблюдаемой in
vitro чувствительности к тетрациклинам, хлорамфениколу, макролидам и рифампицину окончательно не определено. Перечень препаратов, подлежащих включению в исследование энтерококков, весьма ограничен.
Слайд 109
Определение чувствительности Enterococcus spp
При решении вопроса о необходимости
определения чувствительности Enterococcus spp. к АБП крайне важно оценить
клиническую значимость этих микроорганизмов.Энтерококки, выделенные из нестерильных локусов организма, особенно в составе ассоциаций, чаще всего следует рассматривать как контаминирующие или колонизирующие микроорганизмы, соответственно, определять чувствительность таких штаммов к АБП нецелесообразно.
Проводить определение чувствительности необходимо для штаммов Enterococcus spp., выделенных из крови и других в норме стерильных жидкостей и тканей организма, а также из мочи. При этом подходы к определению чувствительности этих микроорганизмов и наборы АБП для тестирования несколько различаются в зависимости от источника выделения штаммов.
Слайд 111
Определение чувствительности Enterococcus spp
Пенициллин и ампициллин. Данные антибиотики
являются препаратами выбора для лечения энтерококковых инфекций. Между пенициллином
и ампициллином отмечается перекрестная резистентность. Полученные результаты можно экстраполировать на ингибиторо-защищенные аминопенициллины и уреидопенициллины.Поскольку известны случаи резистентности энтерококков к пенициллинам, связанные с продукцией бета-лактамаз, резистентные штаммы следует исследовать на продукцию пенициллиназы в тесте с нитроцефином.
Слайд 112
Определение чувствительности Enterococcus spp
Аминогликозиды. Несмотря на то, что
энтерококки обладают природной устойчивостью к аминогликозидам, данный класс АБП
широко применяются в комбинированной терапии генерализованных энтерококковых инфекций. Целесообразность таких схем лечения объясняется выраженным синергизмом между аминогликозидами и ампициллином или ванкомицином. Однако синергизм проявляется только в том случае, если МПК аминогликозидов не превосходит 500 мкг/мл для гентамицина и 1000 мкг/мл для стрептомицина. Указанное обстоятельство требует проведения скрининга (методом серийных разведений или ДДМ) на наличие у энтерококков высокого уровня резистентности к стрептомицину и гентамицину.
Слайд 113
Определение чувствительности Enterococcus spp
Ванкомицин. Ванкомицин является препаратом выбора
для лечения инфекций, вызванных штаммами, резистентными к бета-лактамам и
аминогликозидам. В ряде географических регионов устойчивость энтерококков к ванкомицину является серьезной клинической проблемой. Имеются сообщения о выделении единичных штаммов ванкомицинорезистентных энтерококков и в России. Для выявления устойчивости энтерококков к ванкомицину целесообразно проводить целенаправленный скрининг.Линезолид. Препарат является средством выбора для лечения инфекций штаммами, устойчивыми к ванкомицину. Линезолид также рассматривается в качестве альтернативы ванкомицину при лечении инфекций, вызываемых штаммами, устойчивыми к бета-лактамам и аминогликозидам.
Слайд 114
Определение чувствительности Enterococcus spp
Другие препараты.
В отношении ванкомицинрезистентных
энтерококков, несмотря на отсутствие убедительных данных, возможно оценивать активность
к тетрациклинов, хлорамфеникола, эритромицина и рифампина.Для штаммов энтерококков, выделенных при инфекциях мочевыводящих путей, целесообразно исследовать чувствительность к следующим антибиотикам:
- пенициллину или ампициллину;
- фторхинолонам ;
- тетрациклинам;
- нитрофуранам;
- фосфомицину.
Слайд 117
Критерии чувствительности
Enterococcus spp.
1 – критерии высокого уровня
резистентности при использовании метода разведения в бульоне
2 – критерии
высокого уровня резистентности при использовании метода разведения в агаре
Слайд 118
Скрининг резистентности к аминогликозидам у энтерококков.
Питательная среда.
Агар
или бульон на сердечно-мозговом экстракте. Питательная среда готовится в
соответствии с инструкцией производителя. После автоклавирования и охлаждения до 450–500С в среду асептически добавляют растворы антибиотиков до следующих конечных концентраций:гентамицин для скрининга в агаре и бульоне: 500 мг/л;
стрептомицин:
для скрининга в агаре: 2000 мг/л;
для скрининга в бульоне: 1000 мг/л.
Слайд 119
Скрининг резистентности к аминогликозидам у энтерококков
Приготовление микробной взвеси,
инокуляция и инкубация
Микробную взвесь готовят путем суспендирования изолированных колоний
из 24-часовой культуры, выращенной на неселективных средах до концентрации 0,5 по Мак-Фарланду. Для скрининга на агаре на поверхность среды наносят 10,0 мкл суспензии.
Для скрининга в бульоне в среду вносят инокулюм до конечной концентрации 5х105КОЕ/мл.
Инкубацию проводят при температуре 350С, для гентамицина – в течение полных 24 ч, для стрептомицина – до 48 ч.
Слайд 120
Скрининг резистентности к аминогликозидам у энтерококков
Учет результатов
Исследуемый штамм рассматривается как резистентный при следующих условиях:
при скрининге
на агаре – рост более 1 колонии;при скрининге в бульоне – любой видимый рост.
Контроль качества.
Для контроля качества используют штаммы чувствительных и резистентных энтерококков
Слайд 121
Определение ванкомицинрезистентных Enterococcus spp.
Скрининг осуществляется на агаре.
Питательная
среда.
Агар на сердечно-мозговом экстракте. Питательная среда готовится в соответствии
с инструкцией производителя. После автоклавирования и охлаждения до 450–500С в среду асептически добавляют раствор ванкомицина до конечной концентрации 6,0 мг/л..
Слайд 122
Определение ванкомицинрезистентных Enterococcus spp.
Приготовление микробной взвеси, инокуляция и
инкубация.
Микробную взвесь готовят путем суспендирования изолированных колоний из 24-часовой
культуры, выращенной на неселективных средах до концентрации 0,5 по Мак-Фарланду. Для скрининга на поверхность агара наносят 10,0 мкл суспензии. Инкубацию проводят при температуре 350С в течение полных 24 ч.
Слайд 123
Определение ванкомицинрезистентных Enterococcus spp.
Учет результатов.
Исследуемый штамм рассматривается как
резистентный при росте более 1 колонии на агаре с
ванкомицином.Контроль качества
Для контроля качества используют штаммы чувствительных и резистентных энтерококков
Слайд 124
Определение чувствительности Staphylococcus spp
При оценке чувствительности Staphylococcus
spp. в первую очередь необходимо тестировать препараты, имеющие основное
клиническое значение: бета-лактамы, макролиды, фторхинолоны, аминогликозиды и ванкомицин.Бета-лактамы. Препаратами выбора для лечения стафилококковых инфекций (вызванных как S.aureus, так и КОС) являются бета-лактамные антибиотики.
Слайд 125
Определение чувствительности Staphylococcus spp
Устойчивость стафилококков связана либо с
продукцией бета-лактамаз, либо с наличием пенициллино-связывающего белка - ПСБ2а.
Выявление и дифференцировка этих двух механизмов резистентности позволяет надежно прогнозировать активность всех бета-лактамных антибиотиков без непосредственной оценки чувствительности к каждому из этих препаратов.
При этом необходимо учитывать:
- штаммы Staphylococcus spp., лишенные механизмов резистентности, чувствительны ко всем бета-лактамным АБП;
- бета-лактамазы (пенициллиназы) Staphylococcus spp. способны гидролизовать природные и полусинтетические пенициллины, за исключением оксациллина и метициллина.
Слайд 126
Определение чувствительности Staphylococcus spp
- Чувствительность или резистентность к
бензилпенициллину является индикатором активности природных и полусинтетических амино-, карбокси-
и уреидопенициллинов. Остальные бета-лактамы с потенциальной антистафилококковой активностью (антистафилококковые пенициллины, цефалоспорины I, II и IV поколений и карбапенемы) сохраняют активность в отношении бета-лактамазпродуцирующих штаммов;- штаммы Staphylococcus spp, обладающие ПСБ2а, клинически устойчивы ко всем бета-лактамным АБП. Маркером наличия ПСБ2а является устойчивость к оксациллину и метициллину (метициллинорезистентные стафилококки).
Слайд 127
Определение чувствительности Staphylococcus spp
Определение чувствительности Staphylococcus spp. к
бета-лактамным АБП должно включать выполнение двух тестов:
- определения
чувствительности к бензилпенициллину или выявления продукции бета-лактамаз (пенициллиназ);- определения чувствительности к оксациллину или выявления ПСБ2а или кодирующего его гена mecA.
Слайд 128
АБП для определения чувствительности Staphylococcus spp.
1) -
рекомендуется тестировать при высокой частоте метициллинорезистентности в ЛПУ, или
при выявлении резистентности к препаратам первого ряда.2) - рекомендуется тестировать при инфекциях мочевыводящих путей
Слайд 129
Критерии чувствительности
Staphylococcus spp
1) В практических лаборатриях
оценивать чувствительность Staphylococcus spp. к бета-лактамам кроме бензилпенициллина и
оксациллина нецелесообразно2) Штаммы, устойчивые к оксациллину должны однозначно рассматриваться как устойчивые ко всем доступным бета-лактамам.
Слайд 135
Выявление продукции бета-лактамаз (пенициллиназ)
Суть метода:
определение чувствительности
к бензилпенициллину
Методы:
При использовании ДДМ Недостаток: возможно получение результатов
ложной чувствительности, т.к. синтез бета-лактамаз у этого микроорганизма является индуцибельным процессом (продукция фермента усиливается после контакта с антибиотиком). Метод непосредственного выявления бета-лактамаз, основанного на использовании дисков с нитроцефином. Нитроцефин представляет собой хромогенный цефалоспорин, который легко гидролизуется под действием всех бета-лактамаз с образованием окрашенного продукта.
Слайд 136
Постановка теста с нитроцефином
Для проведения исследования используют чашку,
на которой оценивали чувствительность исследуемого штамма Staphylococcus spp. к
пенициллину и/или оксациллину ДДМ. С границы зоны ингибиции роста вокруг диска с оксациллином бактериологической петлей забирается незначительное количество культуры и наносится на предварительно увлажненный диск с нитроцефином. Диск инкубируют при комнатной температуре до 1 ч.Интерпретация результатов
Появление красного окрашивания свидетельствует о продукции бета-лактамаз исследуемым штаммом микроорганизма.
Штамм, продуцирующий бета-лактамазу, рассматривают как устойчивый к природным и полусинтетическим пенициллинам (за исключением оксациллина), независимо от конкретных результатов тестирования к перечисленным АБП.
Слайд 137
Определение чувствительности к оксациллину
Особенности:
для приготовления инокулюма используют
только прямой метод суспендирования колоний;
длительность инкубации до момента учета
результатов определения чувствительности к оксациллину должна составлять не менее 24 ч.необходимо использовать диски, содержащие 1 мкг оксациллина;
при учете результатов необходимо обращать внимание даже на единичные мелкие колонии стафилококков, обнаруженные в пределах зоны подавления роста.
критерии метициллинрезистентности для S. aureus и коагулазонегативных стафилококков различны.
Слайд 138
Интерпретация результатов тестирования
Штаммы стафилококков, резистентные к оксациллину, должны
рассматриваться как устойчивые ко всем бета-лактамным АБП.
Результаты определения чувствительности
стафилококков к оксациллину и к другим бета-лактамным АБП могут быть противоречивыми, при этом результаты определения чувствительности к оксациллину являются решающими.Определять чувствительность стафилококков к бета-лактамным АБП, кроме бензилпенициллина и оксациллина, нецелесообразно.
Для метициллинрезистентных стафилококков характерно наличие ассоциированной резистентности к АБП других групп. Выявление у стафилококков множественной резистентности при чувствительности к оксациллину требует проведения повторных исследований.
При получении сомнительных результатов необходимо использовать дополнительные методы (скрининг на агаре, прямое выявление гена mecА или белка ПСБ2а).
Определение чувствительности к оксациллину
Слайд 139
Выдача клиницистам результатов исследования и рекомендаций по лечению.
При
выделении пенициллино- и метициллино-чувствительных штаммов стафилококков микроорганизм считается чувствительным
ко всем бета-лактамным АБП, а препаратами выбора будут природные и аминопенициллины.При выявлении продукции бета-лактамаз и чувствительности к оксациллину микроорганизм является резистентным к природным пенициллинам, амино-, карбокси- и уреидопенициллинам, но чувствителен к оксациллину, ингибиторозащищенным пенициллинам и цефалоспоринам I - II поколений, которые являются препаратами выбора в данном случае. В отношении данных штаммов будут также активны цефалоспорины IV поколения и карбапенемы, однако преимуществами в сравнении с препаратами выбора они не обладают.
При выявлении метициллинрезистентности штамм считается устойчивым ко всем бета-лактамным антибиотикам, для лечения необходимо использовать препараты других групп, из которых препаратами выбора считаются гликопептиды.
Слайд 140
Постановка теста
Для проведения скрининга готовят чашки с агаром
Мюллера - Хинтон, содержащие 4% NaCl и 6,0 мкг/мл
оксациллина. Хлористый натрий вносят в питательную среду в необходимом количестве до автоклавирования. Рабочий раствор оксациллина добавляют в питательную среду после автоклавирования и охлаждения среды до 45 - 50 °С.Микробную взвесь следует готовить только методом прямого суспендирования из нескольких однотипных изолированных колоний стафилококка, выросших на чашке с неселективным питательным агаром, в стерильном физиологическом растворе и доводить до мутности 0,5 по Мак-Фарланду (1,5 x 108 КОЕ/мл).
Скрининг метициллинрезистентности
Слайд 141
Инокуляция
1) Метод I (микропипеткой):
готовят разведение 1:100
стандартного инокулюма, соответствующего стандарту мутности 0,5
по Мак-Фарланду для получения бактериальной взвеси, содержащей 1,5 x 106 КОЕ/мл (например, добавить 0,1 мл стандартной суспензии к 9,9 мл стерильного физиологического раствора);с помощью микропипетки наносят каплю (10 мкл) разведенной стандартной суспензии на поверхность агара с оксациллином.
2) Метод II (с помощью тампона):
стерильный ватный тампон погружают в пробирку со стандартизированной суспензией (0,5 по Мак-Фарланду), затем отжимают избыток влаги о стенку пробирки;
культуру наносят тампоном либо на ограниченную поверхность (диаметром 10 - 15 мм), либо на всю поверхность агара с оксациллином в чашке Петри.
Скрининг метициллинрезистентности
Слайд 142
Инкубация
Штаммы S. aureus инкубируются при температуре 35 °С
в течение полных 24 ч, а коагулазанегативных стафилококков -
в течение 48 ч.Учет результатов
появление видимого роста более 1 колонии или вуалеобразного роста на месте нанесения культуры означает устойчивость данного штамма к оксациллину (метициллину);
при отсутствии роста на месте нанесения культуры исследуемый штамм учитывается как чувствительный к метициллину (оксациллину);
при сомнительных результатах, а также для штаммов, выделенных у больных с клинически неэффективной терапией и у больных с серьезными инфекциями, необходимо провести развернутое исследование с определением МПК к оксациллину и гена mecА.
Скрининг метициллинрезистентности
Слайд 143
Скрининг метициллинрезистентности
Контроль качества
Исследование проводят при обязательном контроле роста
испытуемых культур на агаре Мюллера - Хинтон с 4%
NaCl без оксациллина (культуру наносят так же, как на агар с оксациллином).Параллельно с исследуемыми тестируют также контрольные штаммы метициллин-чувствительных и метициллинрезистентных стафилококков.
Слайд 144
Определение резистентности к другим антибиотикам
Макролиды и линкозамиды.
-
один из представителей 14- и 15-членных макролидов. Полная перекрестная
резистентность между отдельными представителями;- клиндамицин. Полная перекрестная резистентность между 16-членными макролидами и линкозамидами.
Фторированные хинолоны.
- левофлоксацин, спарфлоксацин, моксифлоксацин и др. Между перечисленными подгруппами препаратов нет полной перекрестной резистентности.
Аминогликозиды. При детекции устойчивости к гентамицину выделенный штамм следует рассматривать как устойчивый ко всем аминогликозидам. В этой связи гентамицин должен включаться в набор для тестирования в обязательном порядке.
Ванкомицин. Появление сообщений об устойчивости стафилококков к гликопептидам требует внимательного отношения к оценке результатов исследования.
Слайд 145
Определение чувствительности Enterobacteriaceae
Представители семейства Enterobacteriaceae являются одними
из ведущих этиологических агентов как внебольничных, так и нозокомиальных
инфекций, для них характерно крайнее разнообразие возможных механизмов резистентности к АБП.При тестировании микроорганизмов семейства Enterobacteriaceae рекомендуется использовать отдельные наборы АБП для определения чувствительности:
-возбудителей внекишечных инфекций (кроме инфекций мочевыводящих путей);
-возбудителей кишечных инфекций (Shigella spp., Salmonella spp., Escherichia spp.);
-возбудителей внебольничных инфекций мочевыводящих путей (ИМП).
Необходимость такого разделения связана с особенностями фармакокинетики отдельных АБП в желудочно-кишечном тракте и мочевыводящих путях, а также различиями в их клинической эффективности.
Слайд 146 Критерии чувствительности Enterobacteriaceae: значения диаметров зон подавления роста
(мм) и МПК (мг/л) АБП
Слайд 147 Критерии чувствительности Enterobacteriaceae: значения диаметров зон подавления роста
(мм) и МПК (мг/л) АБП
Слайд 148 Критерии чувствительности Enterobacteriaceae: значения диаметров зон подавления роста
(мм) и МПК (мг/л) АБП
Слайд 149 Критерии чувствительности Enterobacteriaceae: значения диаметров зон подавления роста
(мм) и МПК (мг/л) АБП
Слайд 150 Критерии чувствительности Enterobacteriaceae: значения диаметров зон подавления роста
(мм) и МПК (мг/л) АБП
Слайд 151 Критерии чувствительности Enterobacteriaceae: значения диаметров зон подавления роста
(мм) и МПК (мг/л) АБП
Слайд 152
Enterobacteriaceae – возбудители внекишечных инфекций
Основу лечения внекишечных инфекций,
вызываемых представителями семейства Enterobacteriaceae, составляют β-лактамные антибиотики. Выбор препаратов
и принципы интерпретации результатов основываются на данных о природной активности антибиотиков.Препаратами альтернативными β-лактамам являются аминогликозиды и фторхинолоны.
Оценивать чувствительность возбудителей внекишечных инфекций к тетрациклинам, хлорамфениколу и ко-тримоксазолу нецелесообразно.
Препараты относятся к бактериостатикам и существенно уступают по эффективности антибиотикам других групп, среди микроорганизмов к ним широко распространена резистентность.
Слайд 154
Enterobacteriaceae – возбудители внекишечных инфекций
Характеристика препаратов первого ряда.
Ампициллин. Получаемые результаты можно полностью экстраполировать на амоксициллин. Оценивать
чувствительность к амоксициллину нецелесообразно, поскольку критерии чувствительности к этому антибиотику для Enterobacteriaceae не обоснованы. Включение ампициллина в набор для тестирования Enterobacteriaceae объясняется не столько клиническим значением этого антибиотика, сколько важностью для оценки фенотипа исследуемого микроорганизма и внутреннего контроля качества Ингибиторзащищенный аминопенициллин. Амоксициллин/клавуланат и ампициллин/сульбактам во многом сходны по своим антибактериальным свойствам. В то же время необходимо иметь в виду, что клавуланат является более эффективным ингибитором бета-лактамаз. Возможны отдельные случаи сохранения чувствительности к амоксициллину/клавуланату при устойчивости к ампициллину/сульбактаму.
Слайд 155
Enterobacteriaceae – возбудители внекишечных инфекций
Цефотаксим или цефтриаксон. Оба
цефалоспорина практически идентичны по своим антибактериальным свойствам. Результаты оценки
чувствительности к указанным антибиотикам необходимо оценивать, учитывая возможную продукцию микроорганизмами БЛРС. При подтверждении продукции БЛРС все цефалоспорины необходимо рассматривать как клинически недостаточно эффективные независимо от конкретных результатов тестирования.Цефтазидим. Антибиотик не рекомендуется для лечения инфекций, вызываемых Enterobacteriaceae. Однако поскольку цефтазидим высоко чувствителен к действию большинства БЛРС, то он может служить маркером продукции этих ферментов исследуемым микроорганизмом.
Слайд 156
Enterobacteriaceae – возбудители внекишечных инфекций
Гентамицин. Результаты, получаемые при
оценке чувствительности к гентамицину, нельзя экстраполировать на другие аминогликозиды.
Фторхинолон.
Применительно к Enterobacteriaceae существенных различий в уровне антибактериальной активности между ципрофлоксацином, офлоксацином, пефлоксацином, а также новыми «антипневмококковыми» фторхинолонами нет. Между перечисленными препаратами наблюдают практически полную перекрестную резистентность. Выбор конкретного фторхинолона для включения в исследования должен основываться на местных условиях.
Слайд 157
Enterobacteriaceae – возбудители внекишечных инфекций
Характеристика дополнительных препаратов.
Включение
в набор для исследования дополнительных антибиотиков определяется особенностью ЛПУ.
В случае тяжелых, крайне тяжелых и, особенно, госпитальных инфекций, в исследование целесообразно включать следующие антибиотики.
Карбапенемы. Поскольку устойчивость к этим антибиотикам среди Enterobacteriaceae встречается очень редко и носит перекрестный характер между отдельными представителями группы, то в исследование достаточно включать лишь один препарат.
Слайд 158
Enterobacteriaceae – возбудители внекишечных инфекций
Цефепим. Антибиотик обладает значительно
большей устойчивостью к хромосомным бета-лактамазам класса С в сравнении
с цефалоспоринами III поколения, может также сохранять активность в отношении части продуцентов БЛРС.Цефоперазон/сульбактам, тикарциллин/клавуланат. Препараты могут сохранять активность in vitro в отношении части продуцентов БЛРС. Однако клиническое значение этого феномена не определено. Данные, подтверждающие наличие или отсутствие клинической эффективности указанных АБП при инфекциях, вызываемых продуцентами БЛРС, отсутствуют.
Слайд 159
Enterobacteriaceae – возбудители кишечных инфекций
Цефокситин. Антибиотик не имеет
реального значения в лечении инфекций, вызванных Enterobacteriaceae, однако может
быть использован для дифференцировки продуцентов БЛРС и АmрС. Продуценты БЛРС – чувствительны, продуценты АmрС – устойчивы.Амикацин. К амикацину сохраняет чувствительность значительная часть штаммов, устойчивых к гентамицину. Оценивать чувствительность Enterobacteriaceae к другим аминогликозидам нецелесообразно.
Для оценки чувствительности возбудителей инфекций легкой и средней степеней тяжести в исследование следует включать:
Цефалоспорины II поколения и оральные цефалоспорины II-III поколений
Слайд 160
Enterobacteriaceae – возбудители внекишечных инфекций
При выдаче результатов тестирования
микроорганизмов группы Enterobacter, Citrobacter, Serratia, Morganella, Providencia необходимо указывать,
что при монотерапии генерализованных инфекций, вызванных данными возбудителями, цефалоспоринами III поколения, возможно развитие резистентности в процессе лечения.При интерпретации результатов оценки устойчивости к аминогликозидам следует ориентироваться на следующие особенности. Широкий субстратный профиль аминогликозидмодифицирующих ферментов, возможность продукции микроорганизмами семейства Enterobacteriacae одновременно нескольких энзимов, приводят к частой перекрестной резистентности между отдельными препаратами.
На основании данных о чувствительности или устойчивости исследуемого микроорганизма к одному или нескольким аминогликозидам прогнозировать уровень резистентности к другим антибиотикам этой группы практически невозможно.
Слайд 161
Enterobacteriaceae – возбудители кишечных инфекций
Интерпретация результатов оценки резистентности
к хинолонам, как правило не вызывает затруднения. Штаммы, устойчивые
к нефторированным хинолонам, могут сохранять чувствительность к фторированным.Значительная часть штаммов, устойчивых к нефторированным хинолонам, сохраняет чувствительность к фторхинолонам. На практике можно считать, что между ципрофлоксацином, офлоксацином, пефлоксацином и ломефлоксацином имеется полная перекрестная резистентность.
Слайд 162
Enterobacteriaceae – возбудители кишечных инфекций
Основную роль в этиологии
кишечных инфекций играют представители родов Shigella, Salmonella, Escherichia и
Yersinia, относящихся к семейству Enterobacteriaceae, а также семейств Spirillaceae (род Campylobacter) и Vibrionaceae.В рутинной практике при кишечных инфекциях определение чувствительности следует проводить только для штаммов семейства Enterobacteriaceae.
Перечень АБП, подлежащих исследованию, весьма ограничен и включает препараты с подтвержденной клинической эффективностью.
Слайд 164
Enterobacteriaceae – возбудители кишечных инфекций
При генерализованных инфекциях, вызванных
микроорганизмами рода Salmonella (выделение возбудителя из стерильных локусов), в
исследование необходимо включать цефалоспорины III поколения (цефотаксим или цефтриаксон).Дополнительно возможно включение хлорамфеникола и тетрациклинов, однако их роль в лечении инфекций желудочно-кишечного тракта представляется на сегодняшний день крайне сомнительной.
В то же время результаты определения чувствительности к этим АБП могут иметь определенное значение для эпидемиологического мониторинга
Слайд 165
Тестирование Enterobacteriaceae – возбудителей ИМП
С практической точки зрения
ИМП крайне важно разделять на внебольничные и нозокомиальные. Для
тестирования штаммов Enterobacteriaceae, выделенных при нозокомиальных ИМП, следует использовать тот же перечень АБП, что и для определения чувствительности возбудителей инфекций различной локализации.Формирование отдельного набора антибактериальных препаратов для оценки чувствительности возбудителей внебольничных инфекций мочевыводящих путей целесообразно при наличии значительного потока таких исследований.
Слайд 167
Выявление БЛРС у штаммов Enterobacteriaceae (фенотипическими методами)
Рекомендации по
выявлению БЛРС фенотипическими методами распространяются только на штаммы Klebsiella
spp. и E. coli.Однако продукция БЛРС может отмечаться практически у всех видов семейства Enterobacteriaceae и ряда других грамотрицательных микроорганизмов.
Учитывая распространенность ферментов этой группы, представляется целесообразным проведение скрининга всех выделенных в лаборатории штаммов Enterobacteriaceae которые по данным предварительного тестирования проявляют пониженную чувствительность хотя бы к одному из цефалоспоринов III поколения
Слайд 168
Выявление БЛРС у штаммов Enterobacteriaceae (фенотипическими методами)
Скрининг проводится
в ходе рутинной практики.
Для эффективного скрининга в рутинное
микробиологическое исследование необходимо включать несколько цефалоспориновых антибиотиковНаиболее чувствительными к гидролизу БЛРС считаются цефподоксим и цефтазидим.
При отсутствии возможности тестирования цефподоксима: цефотаксим, цефтриаксон и цефтазидим.
Слайд 169
Выявление БЛРС у штаммов Enterobacteriaceae (фенотипическими методами)
Чем больше
цефалоспоринов использовано для тестирования, тем более достоверными будут результаты
выявления БЛРС.Результаты тестирования Klebsiella spp. и Е. coli к цефалоспоринам, указывающие на возможную продукцию БЛРС этими штаммами, приведены в табл. 10.
После выявления штамма, подозрительного на продукцию БЛРС, рекомендуется провести подтверждающий тест.
Слайд 170
Тесты, подтверждающие продукцию БЛРС
Принцип метода:
Основан на ингибиции БЛРС
клавуланатом. При постановке этих тестов проводится сравнение чувствительности исследуемых
микроорганизмов к различным цефалоспоринам III поколения и к комбинации этих антибиотиков с клавулановой кислотой.Диско-диффузионный метод предусматривает использование стандартных дисков с обычным содержанием
цефотаксима и цефтазидима (30 мкг)
цефподоксимом (10 мкг)
цефотаксим + клавуланат или цефтазидим + клавуланат (30/10 мкг)
цефподоксим + клавуланат (10/10 мкг).
В исследование целесообразно включать одновременно и диски с цефотаксимом и диски с цефтазидимом и их комбинациями с клавуланатом.
Слайд 171
Тесты, подтверждающие продукцию БЛРС
Постановка теста
Методика приготовления микробной взвеси
и инокуляции чашек с агаром стандартные. На поверхность агара
накладывают диски с цефалоспоринами и их комбинациями с клавулановой кислотой. Чашки инкубируют в термостате при 35 °С в течение 18 - 20 ч.Интерпретация результатов
Различие в диаметрах зон подавления роста для дисков с цефподоксимом/клавулановой кислотой и цефподоксимом на 6 мм и более, для дисков с цефотаксимом/клавулановой кислотой и цефотаксимом, цефтазидимом/клавулановой кислотой и цефтазидимом - на 5 мм и более свидетельствует о продукции штаммом БЛРС. Необходимо подчеркнуть, что результат считается положительным, если указанные различия получены хотя бы для одной пары дисков.
Слайд 172
Тесты, подтверждающие продукцию БЛРС
Контроль качества
Для контроля качества исследования
необходимо использовать два штамма (отрицательный и положительный контроли):
- отрицательный
контроль. При тестировании контрольного штамма Е. coli, не продуцирующего бета-лактамаз, различия в диаметрах зон между дисками с ингибитором и без него не должны превышать 2,0 мм;- положительный контроль. При тестировании контрольного штамма К. pneumoniae, продуцирующего БЛРС, различия в диаметрах зон между дисками с цефподоксимом/клавулановой кислотой и цефподоксимом ≥ 6 мм, с цефотаксимом/клавулановой кислотой и цефотаксимом > 3 мм, с цефтазидимом/клавулановой кислотой и цефтазидимом ≥ 5 мм.
Слайд 173
Метод двойных дисков
Принцип метода
Метод предполагает
использование доступных коммерческих дисков с цефалоспоринами III поколения и
с амоксициллином/клавуланатом.Метод "двойных дисков" представляет собой вариант классического ДДМ определения чувствительности, который позволяет выявить продукцию БЛРС по наличию расширенной зоны подавления роста вокруг диска с каким-либо цефалоспорином III поколения напротив диска, содержащего клавулановую кислоту (синергизм отмечается в участке пересечения зон диффузии двух дисков, расположенных на небольшом расстоянии друг от друга)
Слайд 174
Метод двойных дисков
Постановка теста
Методика приготовления микробной взвеси, инокуляции
и инкубации чашек не имеет отличий от стандартного ДДМ.
Особенностью метода является то, что через 5 - 10 мин. после инокуляции на поверхность агара накладывают диски с АБП:в центр - диск, содержащий клавулановую кислоту, обычно в виде комбинации амоксициллин/клавуланат (20/10 мкг),
по бокам от него на расстоянии 20 и 30 мм между центрами дисков - диски с цефтазидимом (30 мкг) и цефотаксимом (30 мкг).
Использование двух дисков каждого АБП, расположенных на разном расстоянии от диска с клавулановой кислотой, позволяет повысить эффективность обнаружения БЛРС.
Слайд 175
Метод двойных дисков
Интерпретация результатов
Если тестируемый микроорганизм вырабатывает БЛРС
(действие которых в большинстве случаев обратимо клавуланатом), зона подавления
роста вокруг диска с цефалоспорином III поколения окажется "вытянутой" в сторону диска с амоксициллином/клавуланатомПричиной данного эффекта является дополнительное подавление роста микроорганизма в той зоне, куда диффундируют и клавуланат и цефалоспорин III поколения. Тест сугубо качественный и требует определенных навыков при интерпретации.
Слайд 179 Определение чувствительности P.aeruginosa, Pseudomonas
spp., Acinetobacter spp. и других НГОБ
При определении чувствительности НГОБ
следует иметь в виду, что ДДМ достаточно стандартизован лишь для P.aeruginosa и Acinetobacter spp. При исследовании Stenotrophomonas maltophilia, Pseudomonas spp. (кроме P.aeruginosa) и других НГОБ, предпочтение следует отдавать методам серийных разведений.
Слайд 181
Определение чувствительности НГОБ
Препараты первого ряда В первую очередь
для оценки антибиотикочувствительности Pseudomonas spp. и Acinetobacter spp. следует
использовать препараты, отличающиеся наибольшей природной активностью.Цефтазидим. Является одним из основных АБП, используемых для лечения инфекций, вызываемых рассматриваемой группой микроорганизмов.
Цефепим. При сопоставимом с цефтазидимом уровне природной активности, в ряде случаев цефепим сохраняет активность в отношении микроорганизмов, устойчивых к цефтазидиму.
Гентамицин, амикацин. Аминогликозиды для монотерапии инфекций, вызываемых рассматриваемой группой бактерий не применяются, однако во многих случаях являются необходимым компонентом комбинированных схем терапии. Целесообразность включения в перечень препаратов первого ряда амикацина и гентамицина обосновывается высокой частотой устойчивости к последнему антибиотику в ряде учреждений.
Слайд 182
Определение чувствительности НГОБ
Ципрофлоксацин. Среди фторхинолонов ципрофлоксацин является препаратом
выбора при лечении рассматриваемой группы инфекций.
Меропенем, имипенем. Меропенем
характеризуются наибольшим уровнем активности в отношении рассматриваемой группы микроорганизмов, имипенем ему несколько уступает. Целесообразность включения обоих карбапенемов объясняется отсутствием между ними в некоторых случаях перекрестной резистентности.
Слайд 183
Определение чувствительности НГОБ
Дополнительные препараты. Необходимо учитывать, что неферментирующие
бактерии существенно различаются по уровню природной чувствительности к АБП.
Азтреонам, цефоперазон. По основным свойствам близки к цефтазидиму.
Цефоперазон/сульбактам, тикарциллин/клавуланат, Доступные ингибиторы не способны подавлять активность большинства бета-лактамаз распространенным среди P. aeruginosa и, в силу этого комбинированные препараты, не обладают существенными преимуществами с сравнении с исходными антибиотиками.
Слайд 184
Определение чувствительности НГОБ
Цефоперазон/сульбактам (а также ампициллин/сульбактам) могут иметь
реальное значение в лечении инфекций, вызываемых Acinetobacter spp. благодаря
наличию у сульбактама собственной активности в отношении указанного микроорганизма.При инфекциях вызываемых Stenotrophomonas maltophilia клиническое значение имеет ко-тримоксазол и тикарциллин/клавуланат. Микроорганизм обладает природной устойчивостью ко всем бета-лактамам кроме (тикарциллина/клавуланата)
Карбенициллин. В силу выраженной токсичности и высокой частоты устойчивости применение карбенициллина даже для лечения инфекций, вызываемых P. aeruginosa следует признать нецелесообразным.
Слайд 185
Определение чувствительности НГОБ
Очевидно, что «неферментирующие» микроорганизмы нельзя рассматривать
как единую группу с точки зрения их природной чувствительности
к антибиотикам.Оценка антибиотикочувствительности редких видов «неферментирующих» микроорганизмов требует индивидуального подхода.
Поскольку тяжелые инфекции, вызываемые псевдомонадами, являются показанием для назначения комбинированной терапии, целесообразно при выдаче ответа в клинику указывать на наиболее эффективную с микробиологической точки зрения комбинацию антибиотиков.
Слайд 186 Критерии чувствительности P.aeruginosa, Pseudomonas spp., Acinetobacter spp. и
НГОБ
1.ДДМ стандартизирован только для P.aeruginosa и Acinetobacter spp. Для
других НФБ использовать методы серийных разведений.2.Метод серийных разведений не стандартизован для определения чувствительности Acinetobacter spp. к тикарциллину/клавуланату
Слайд 191
Контроль качества
Параллельно с анализом исследуемых культур тестируют контрольные
штаммы.
К сожалению ни один из традиционных микробиологических методов, основанных
на оценке фенотипа микроорганизма, не обеспечивает выявление БЛРС в 100% случаев. Трудность в интерпретации результата при наличии у микроорганизмов нескольких детерминант устойчивости одновременно. Например, при продукции БЛРС и гиперпродукции хромосомных бета-лактамаз класса С устойчивость последних к клавуланату маскирует присутствие БЛРС.
Слайд 192
Контроль качества определения чувствительности
Контроль чистоты роста культуры
Образец инокулюма,
использованного для оценки чувствительности, необходимо засеять на чашку с
неселективной питательной средой и инкубировать в течение ночи.При выявлении на неселективной среде смешанной культуры результаты оценки антибиотикочувствительности не учитывают, исследование необходимо повторить.
Слайд 193
Контроль качества определения чувствительности
Контроль роста
Каждую
партию плотных питательных сред для определения чувствительности
должны проверять на пригодность для роста тестируемых микроорганизмов.Для этого используют соответствующие контрольные штаммы
Е. coli,
P. aeruginosa,
S. aureus,
E. faecalis,
S. pneumoniae,
H. influenzae,
N. gonorrhoeae.
Слайд 194
Контроль качества определения чувствительности
Из суточных культур указанных
микроорганизмов готовят микробную
взвесь, соответствующую по плотности 0,5 по стандарту Мак-Фарланда (содержащую приблизительно 1,5x 108 КОЕ/мл).Из полученной микробной взвеси готовят серию последовательных разведений 1:10. Затем на приготовленные чашки с соответствующим агаром высевают по 0,1 мл взвеси -5, -6, -7 разведений, содержащих соответственно 1х 103 , 1x 102, 1x 101 КОЕ/мл.
При хороших питательных свойствах среды должен отмечаться рост микроорганизмов из -6, -7 разведений.
Для контроля роста при определении чувствительности методами разведений (в агаре, в жидкой питательной среде) используют чашки с агаром, пробирки с бульоном или специально выделенные лунки микротитровального планшета, в которые не внесен АБП.
Слайд 195
Контроль качества определения чувствительности
Контроль стерильности
Для контроля стерильности проводят
инкубацию при 35 °С в течение 24 или более
часов репрезентативного количества чашек с агаром из каждой партии при определении чувствительности ДДМ, чашек с агаром или пробирок с бульоном, не содержащих антибиотиков, при тестировании методом разведений в агаре или макроразведений в бульоне соответственно.При определении чувствительности методом микроразведений контроль стерильности производят по специально выделенным для этой цели лункам микротитровального планшета, в которые не вносят растворы антибиотиков и микробную взвесь.
Слайд 196
Контроль качества питательных сред
Проверка pH агара 7,2 -
7,4.
Контроль катионного состава
Для
получения воспроизводимых результатов определения чувствительности к АБП (особенно к аминогликозидам, фторхинолонам, карбапенемам, тетрациклинам и некоторым другим) питательная среда должна содержать строго стандартизированные концентрации двухвалентных катионов, прежде всего Ca2+ и Mg2+ (Ca2+ = 20 - 25 мг/л и Mg2+ = 10,0 - 12,5 мг/л). Применение метода атомной абсорбционной спектрофотометрии для непосредственной оценки концентрации двухвалентных катионов в среде в повседневной практике мало реально.О содержании в среде двухвалентных катионов косвенно можно судить по результатам тестирования чувствительности контрольного штамма Pseudomonas aeruginosa к аминогликозидам (диаметр зоны вокруг диска с гентамицином должен быть в пределах 16 - 21 мм, а МПК гентамицина - в пределах 0,5 - 2,0 мкг/мл).
Слайд 197
Контроль качества питательных сред
Контроль содержания тимина и тимидина
При определении чувствительности к АБП из группы
антагонистов фолиевой кислоты (антифолатов) - сульфаниламидов и триметоприма - критически важным показателем является содержание антагонистов действия этих препаратов - тимина и тимидина в питательной среде.Питательные среды для определения чувствительности к сульфаниламидам и триметоприму должны содержать минимальные концентрации тимидина.
О пригодности питательной среды для определения чувствительности к антифолатам можно косвенно судить по результатам тестирования контрольного штамма Enterococcus faecalis. Среда считается удовлетворительной по качеству при МПК триметоприма/сульфаметоксазола в отношении Е. faecalis < 0,5/9,5 мг/л и диаметре зоны подавления роста вокруг диска с этим АБП ≥ 0 мм.
Слайд 198
Интегральный контроль качества определения чувствительности
сопоставление результатов определения чувствительности
контрольных (референтных) штаммов микроорганизмов с соответствующими показателями, приведенными в
их паспортной характеристике. Тестирование контрольных штаммов проводят в соответствии с описанными выше методами, параллельно тестированию клинических изолятов.Контрольные (референтные) штаммы микроорганизмов
Перед использованием для контроля качества определения чувствительности хранившийся контрольный штамм должен быть дважды субкультивирован на подходящих питательных средах.
Слайд 199
Хранение контрольных штаммов
В условиях лаборатории штаммы должны храниться
таким образом, чтобы возможность мутаций и контаминации культуры была
минимальной. Для этого создается банк контрольных штаммов, предназначенный для длительного хранения, а для ежедневной рутинной работы используются регулярно субкультивируемые культуры.Для непродолжительного хранения "рабочих" контрольных штаммов их выращивают в пробирке со скошенным агаром (триптиказо-соевым или другим аналогичным для "непривередливых" микроорганизмов, шоколадным для "привередливых" бактерий) и хранят в холодильнике при температуре 2 - 8 °С, субкультивируя еженедельно.
Слайд 200
Хранение контрольных штаммов
Для длительного хранения штаммов существуют два
основных способа.
Первый состоит в приготовлении суспензии микроорганизмов в
стабилизирующем растворе (50% фетальной телячьей сыворотки в бульоне, 10 - 15% глицерина в триптиказо-соевом бульоне, дефибринированная баранья или кроличья кровь). Наилучшую сохранность культур удается получить при хранении в замороженном состоянии при температуре -70 °С и ниже в морозильной камере или в жидком азоте. Другой метод длительного хранения контрольных штаммов - в лиофилизированном виде.
Слайд 201
Частота проведения контроля качества
Оптимально - ежедневно, параллельно с
тестированием клинических изолятов.
Однако на практике, при получении достаточно стабильных
результатов контроля качества в течение хотя бы одного месяца, частота контрольных исследований может быть сокращена до 1 - 2 раз в неделю. Контрольные исследования необходимо проводить при использовании новых партий реагентов, прежде всего, питательных сред.
В то же время, если при проведении подобного тестирования получаемые результаты окажутся за пределами указанных границ, необходимо вернуться к ежедневному контролю качества для выяснения причины получения неправильных результатов.
Слайд 202
Интерпретация результатов
Интерпретация осуществляется на основании сопоставления результатов исследования
(величины МПК АБП или диаметра зоны ингибиции роста) с
пограничными значениями этих параметров, отделяющих чувствительные штаммы от промежуточных и промежуточные от устойчивых. При выборе значений пограничных концентраций АБП учитывают микробиологические, фармакокинетические, фармакодинамические, а также клинические факторы. Обоснование значений пограничных концентраций является сложным и, во многом, субъективным процессом.Приведенные выше категории являются клинически ориентированными и не всегда коррелируют с микробиологическими. Возможны как ситуации, при которых чувствительный с микробиологической точки зрения штамм будет отнесен к устойчивым, так и обратные, при которых к чувствительным будет отнесен штамм, устойчивый с микробиологической точки зрения.
Слайд 203 Эпидемиологический надзор за резистентностью
к АБП
Определение
Эпидемиологический надзор за антимикробной резистентностью представляет собой
систематический постоянный процесс сбора и анализа данных для количественной оценки распространенности антибиотикорезистентности и ее временной динамики. Цель и задачи
Целью проведения эпидемиологического надзора за антимикробной резистентностью является получение информации, необходимой для разработки и внедрения более эффективных подходов к лечению инфекций, сдерживанию появления и распространения антимикробной резистентности на локальном, региональном, национальном и международном уровнях.
Слайд 204
Эпидемиологический надзор за резистентностью к АБП
Созданию системы эпидемиологического
надзора за антимикробной резистентностью на международном уделяет достаточно большое
внимание Всемирная организация здравоохранения , определяющая эпидемиологический надзор за антибиотико-резистентностью как одно из основных направлений Глобальной стратегии ВОЗ по сдерживанию антибиотикорезистентности.В Европе этой проблемой также активно занимается специальная Исследовательская группа по надзору за антимикробной резистентностью ESCMID (ESCMID Study Group for Antimicrobial Resistance Surveillance - ESGARS), которая в 2004 г. издала рекомендации по проведению эпидемиологического надзора за антибиотикорезистентностью.
Слайд 205
Эпидемиологический надзор
Общие принципы
При эпидемиологическом надзоре
за антибиотикорезистентностью микроорганизмов основное внимание следует уделять:
Инфекционным заболеваниям, встречающимся
с высокой частотой, сопровождающимся высокой летальностью, а также тем нозологическим формам, при которых инфекция резистентными штаммами возбудителя приводит к достоверному снижению эффективности терапии;Инфекционным заболеваниям, склонным к эпидемическому распространению, что может приводить к возникновению вспышек (шигеллез, сальмонеллёз и др.);
Получению и анализу данных по заболеваемости и смертности, связанной с инфекциями, вызванными резистентными штаммами.
Слайд 206
Эпидемиологический надзор
Полученные эпидемиологические данные по
уровню и характеру резистентности должны использоваться для:
Оценки временных тенденций
и прогнозирования вероятности возникновения и распространения антимикробной резистентности, с учетом ее механизмов, путей распространения, видовой принадлежности резистентных микроорганизмов, вызываемых ими нозологических форм инфекционных заболеваний, факторов риска и характеристик пациентов, предрасполагающих к возникновению подобных инфекций, последствий их для пациента и системы здравоохранения (неэффективность терапии, удлинение сроков госпитализации, повышение стоимости лечения и пр.)
Слайд 207
Эпидемиологический надзор
Информирования органов системы здравоохранения соответствующего уровня о
сложившейся ситуации с целью разработки стратегии по сдерживанию распространения
антибиотикорезистентнсоти, проведения надлежащих мероприятий по борьбе с распространением резистентных микроорганизмовВнедрения в практику работы микробиологических лабораторий соответствующих процедур и методов для своевременного и достоверного выявления резистентных микроорганизмов
Обновления руководств по эмпирической антибактериальной терапии инфекций, изменения формуляров антимикробных препаратов.
Слайд 208
Эпидемиологический надзор
Виды эпидемиологического надзора
Существуют два основных временных подхода
к проведению эпидемиологического надзора за антибиотикорезистентностью:
Постоянный мониторинг данных по
антибиотикорезистентности.Специальные (эпизодические) эпидемиологические исследования антибиотикорезистентности, касающиеся какой-либо отдельной проблемы.
Слайд 209
Эпидемиологический надзор
Выделяют два типа эпидемиологического надзора по степени
охвата:
Всеобъемлющий (полный) эпидемиологический надзор предусматривает исследование антибиотикорезистентности определенного микроорганизма
или возбудителей определенного инфекционного заболевания во всей популяции (т.е. включает в себя сбор данных обо всех случаях инфекции во всей популяции). Учитывая, что проведение подобного надзора требует вовлечения большого числа учреждений и специалистов различного профиля, обычно удается собрать только основную информацию об анализируемых случаях
демографические данные пациентов,
сведения о локализации инфекции,
виде клинического материала и
фенотипе резистентности.
Слайд 210
Эпидемиологический надзор
Сигнальный (неполный) эпидемиологический надзор подразумевает сбор данных
на ограниченной территории или у определённой части популяции для
получения данных, которые могут служить индикаторами состояния антибиотикорезистентности во всей популяции в целом.При этом обследуемая популяция должна быть репрезентативной для всей популяции. Данный тип эпидемиологического надзора является более предпочтительным при необходимости проведения длительного и детального сбора данных.
Слайд 211
Эпидемиологический надзор
По методике выполнения:
Пассивный, основанный на поступлении
отчётов с мест (когда не предпринимается специальных усилий по
получению данных из первоисточника);Активный, при котором затрачиваются регулярные усилия для получения данных по антимикробной резистентности из первоисточника.
Слайд 212
Эпидемиологический надзор
В зависимости от используемого подхода к сбору
данных:
Рутинный, включающий регулярное, систематическое получение определённого набора данных;
Расширенный, включающий
получение дополнительных данных, в соответствии с заранее определённым планом
Слайд 213
Эпидемиологический надзор
Эпидемиологический надзор за возникновением и распространением антибиотико-резистентности
не ограничивается только сферой медицинской практики.
Подобные эпидемиологические исследования
распространения антимикробной резистентности могут проводиться у бактерий, резистентность которых может представлять потенциальную угрозу для человека, выделенных из объектов окружающей среды, от сельскохозяйственных животных, из продуктов питания и т.д.
Слайд 214
Эпидемиологический надзор
Выбор штаммов микроорганизмов для включения в исследование
При проведении рутинного эпидемиологического надзора за
антибиотико-резистентностью могут быть использованы следующие подходы:определение чувствительности все штаммов определенного вида микроорганизмов, выделенных из определенного клинического материала; используется для изучения динамики резистентности.
исследование определенного вида клинического материала (полученного от пациентов с неэффективностью терапии). Используется для своевременного выявления возможного возникновения и распространения резистентности, представляющей потенциальную или теоретическую угрозу для данного региона или учреждения.
Слайд 215
Эпидемиологический надзор
Принципы проведения эффективного эпидемиологического надзора
Для эффективного проведения эпидемиологического надзора на каждом уровне
его проведения (локальном, региональном и т.д.) должен регистрироваться минимально необходимый объём информации. Мероприятия, разрабатываемые на основе полученных данных, должны соответствовать принципам доказательной медицины.Эффективность эпидемиологического надзора за инфекциями, вызванными резистентными микроорганизмами, зависит от:
получения качественных клинических образцов от пациентов с инфекциями;
успешного выделения возбудителя инфекции;
адекватного определения чувствительности к антимикробным препаратам;
качественного сбора, объединения и анализа данных;
своевременного использования полученной информации для внедрения практических мероприятий.
Слайд 216
Эпидемиологический надзор
Получение достоверных данных зависит от:
использования
единых правил забора клинического материала,
критериев и определений инфекционных
заболеваний, стандартизации методов выделения, идентификации и определения чувствительности микроорганизмов,
интерпретации полученных результатов,
соответствия работы лабораторий единым стандартам качества выполнения исследований.
Слайд 217
Эпидемиологический надзор
Клинический материал
Забор и последующее исследование клинического материала
для эпидемиологического надзора должно проводиться по единой методологии. Методики
забора материала должны быть приемлемыми и выполнимыми для пациента и медицинского персонала, обладать малым риском получения ложноотрицательных и ложноположительных результатов.В то же время необходимо учитывать, что исследования образцов, полученных из стерильных в норме источников (кровь, спинномозговая жидкость и пр.) имеют значительно более высокую ценность чем мазок с поверхности кожи и пр.
Для некоторых микроорганизмов (S. pneumoniae или H. influenzae) исследование чувствительности штаммов, колонизирующих носоглотку, коррелирует с резистентностью штаммов, вызывающих инфекции (острый средний отит, синусит).
Слайд 218
Эпидемиологический надзор
Решение вопроса о возможности использования материалов санитарной
микробиологии (смывы с оборудования, поверхностей, анализ микробной обсемененности воздуха,
воды и пр.),поверхностных культур, колонизирующих кожные покровы, слизистые оболочки, желудочно-кишечный тракт пациента (носительство)
должно приниматься в зависимости от эпидемиологической ситуации,
целей и задач проведения исследования,
видов выделяемых микроорганизмов,
нозологической структуры пациентов,
определенных характеристик обследуемых лиц (пациенты с факторами риска, медицинский персонал),
возможностей лаборатории и эпидемиологической службы медицинского учреждения
Слайд 219
Эпидемиологический надзор
Вид инфекции
Инфекции часто классифицируют в зависимости от
условий их возникновения:
внебольничные
нозокомиальные (госпитальные).
Это имеет существенное значение
для проведения эпидемиологического надзора, так как спектр возбудителей и их резистентность к АБП существенно различаются в вышеуказанных группах.
Слайд 220
Эпидемиологический надзор
Методы выделения и идентификации
Для получения сравнимых
данных о частоте выделения определенных микроорганизмов и об этиологической
структуре определенных нозологических форм инфекционных заболеваний выделение и идентификация микроорганизмов должны проводиться в соответствии с общепринятыми стандартными микробиологическими методами.
Слайд 221
Эпидемиологический надзор
Методы определения чувствительности
Предпочтение должно быть отдано количественным
методам определения чувствительности, позволяющим получить значения МПК АБП в
отношении исследуемого штамма микроорганизма.В случае использования ДДМ очень важным является регистрация не только качественных показателей категорий чувствительности микроорганизма:
чувствительный - Ч,
штамм с промежуточной чувствительностью - П
и резистентный – Р),
количественных показателей - диаметров зон подавления роста.
Слайд 222
Эпидемиологический надзор
Выбор набора АБП для тестирования также является
очень важным.
В большинстве случаев для проведения рутинного эпидемиологического
надзора за антибиотикорезистентностью достаточно определения чувствительности к АБП, приведенным в списке препаратов первого ряда для тестирования различных видов микроорганизмов. При проведении эпидемиологического надзора за антибиотикорезистентностью большое значение имеет проведение лабораторией специальных тестов для выявления отдельных видов резистентности
детекция БЛРС,
скрининг на агаре с оксациллином и солью для выявления MRSA и т.д.
Слайд 223
Эпидемиологический надзор
При наличии практической необходимости и возможности, а
также в целях научных исследований, набор АБП для проведения
эпидемиологического надзора за антибиотикорезистентностью может быть увеличен, в том числе и за счет применения скрининга в бульоне или на чашках с агаром, содержащих определенные концентрации антибиотиков, рекомендуемые в качестве «пороговых» концентраций для выявления штаммов, подозрительных на наличие резистентности, при скрининговых эпидемиологических исследованиях.В конечном итоге, выбор АБП и используемых тестов будет определяться целями, задачами и дизайном эпидемиологического исследования антибиотикорезистентности.
Слайд 224
Эпидемиологический надзор
При получении необычных фенотипов
антибиотикорезистентности:
умеренный или высокий уровень резистентности S. aureus к ванкомицину;
резистентность
S. pyogenes к пенициллину или другим β-лактамам;резистентность S. maltophilia к ко-тримоксазолу;
резистентность H. influenzae к цефалоспоринам III поколения;
чувствительность Klebsiella spp., P. aeruginosa к ампициллину
тестирование необходимо повторить, а резистентный штамм должен быть сохранен и передан для дальнейшего исследования в специализированную микробиологическую лабораторию, занимающуюся изучением антибиотикорезистентности.
Методы молекулярно-генетического выявления резистентности доказали свою эффективность в отношении некоторых возбудителей
определение mecА-гена с помощью ПЦР у штаммов стафилококков.
Слайд 225
Эпидемиологический надзор
Методы оценки клонального родства штаммов
В настоящее время
известны два основных механизма распространения антибиотикорезистентности:
распространение генетических детерминант
резистентности с подвижными генетическими элементами;распространение клонов резистентных бактерий; а также их сочетания.
Дифференцировка указанных механизмов имеет важное значение для планирования и проведения мероприятий по сдерживанию распространения резистентности.
Слайд 226
Эпидемиологический надзор
Методы типирования, используемые для оценки, родства микроорганизмов
можно разделить на
фенотипические (основанные на изучении антибиограмм, био-, серо-
и фаготипировании, иммуноблотинге и электрофорезе белков);генотипические (основанные на изучении плазмидного профиля, рестрикционном анализе плазмидной и хромосомной ДНК, риботипировании, электрофорезе макрорестриктов хромосомной ДНК в пульсирующем поле (puls-field gel electrophoresis - PFGE), амплификации нуклеиновых кислот, а также на секвенировании отдельных фрагментов генома).
Слайд 227
Эпидемиологический надзор
Приведенные методы существенно различаются по таким характеристикам
как
воспроизводимость,
разрешающая способность,
стоимость,
трудоемкость проведения
особенности интерпретации
результатов. По основным из приведенных характеристик (за исключением стоимости) генотипические методы обладают явными преимуществами.
Слайд 228
Эпидемиологический надзор
Для двух из генотипических методов (PFGE и
MLST – multilocus sequence typing) разработаны стандартные протоколы, что
позволяет получать в различных лабораториях полностью сопоставимые данные и анализировать распространение резистентных клонов в различных географических регионах, а также в пределах всего Земного шара.Использоваание генетипических методов позволило выявить клоны некоторых резистентных микроорганизмов (MRSA, S. pneumoniae), распространение которых приняло глобальный характер.
Основным недостатком PFGE и методов, основанных на секвенировании является их трудоемкость и высокая стоимость.
К наиболее дешевым и простым в проведении относятся методы основанные на амплификации, однако они отличаются недостаточной воспроизводимостью.
Слайд 229
Эпидемиологический надзор
Поддержание стандартов качества
Для обеспечения достоверности результатов все
лаборатории, участвующие в программах по эпидемиологическому надзору за антимикробной
резистентностью, должны иметь адекватную систему внутреннего контроля качества своей работы и регулярно участвовать в программах внешнего контроля качества.
Слайд 230
Эпидемиологический надзор
Дополнительные сведения
Для получения достоверной информации в
процессе эпидемиологического надзора за антибиотикорезистентностью получаемые данные о чувствительности
выделенного штамма микроорганизма должны быть взаимосвязаны с определёнными случаем заболевания у пациента:демографические данные,
вид инфекции,
наличие факторов риска,
результат лечения и пр..
Слайд 231
Эпидемиологический надзор
Минимальный рекомендуемый набор данных для проведения эпидемиологического
надзора за антибиотикорезистентностью должен включать:
уникальный идентификационный код пациента
(например, инициалы,
номер истории болезни, страхового полиса и т.п.);дату рождения пациента;
пол пациента;
место жительства;
тип медицинского учреждения;
название отделения, клиники и пр.;
тип отделения стационара (напр., терапевтическое, хирургическое и пр.);
Слайд 232
Эпидемиологический надзор
дату поступления пациента;
основные симптомы или особенности клинической
картины заболевания;
диагноз инфекции;
дату возникновения симптомов инфекции или установления
диагноза;характер инфекции (внебольничная или нозокомиальная)
вид клинического материала;
дату и время забора материала;
данные о предшествующей антибиотикотерапии;
данные об антимикробной терапии, проводимой в настоящее время;
сведений об исходе заболевания.
Слайд 233
Эпидемиологический надзор
Анализ и представление данных по антибиотикорезистентности
Провести анализ
больших объемов информации, собранной при проведении эпидемиологического мониторинга за
антибиотикорезистентностью, без использования компьютерной техники невозможно.Были созданы специальные компьютерные программы для сбора, хранения и анализа данных по антибиотикорезистентности микроорганизмов.
В частности компьютерная программа WHONET, рекомендованная ВОЗ, является бесплатной и свободно доступна в сети Интернет (версия для работы в операционной среде Windows).
Более ранняя версия этой программы (для работы в операционной среде DOS) переведена на русский язык.
Слайд 234
Эпидемиологический надзор
Кроме того, существует множество коммерческих компьютерных программ,
позволяющих создавать в микробиологической лаборатории базы данных, содержащие всю
перечисленную выше необходимую информацию, анализировать ее и представлять результаты эпидемиологического мониторинга.Дополнительным преимуществом большинства из этих программ (включая WHONET) является наличие встроенной экспертной системы, сигнализирующей о выявлении необычных фенотипов резистентности.
Слайд 235
Эпидемиологический надзор
Помимо перечисленной выше информации, для проведения анализа
и расчета соответствующих эпидемиологических показателей могут потребоваться данные медицинской
статистики, в частности:Для стационарных лечебных учреждений
Количество коек – в целом и по различным отделениям стационара
Число случаев госпитализации
Среднее число дней госпитализации – в целом и по различным отделениям стационара
Количество микробиологических исследований– в целом и по различным отделениям стационара
Слайд 236
Эпидемиологический надзор
Для лечебных учреждений амбулаторно-поликлинического профиля
Количество врачей, направляющих
образцы для микробиологического исследования
Численность обслуживаемого населения
Среднее число посещений
Количество микробиологических
исследований
Слайд 237
Эпидемиологический надзор
Перечисленные статистические данные могут использоваться:
В качестве контроля
получаемых результатов эпидемиологического мониторинга (например, ожидаемое число штаммов микроорганизмов
определенного вида, выделенных за определенный период времени).Для стратификации результатов (например, сравнительные показатели частоты MRSA в различных стационарах, в зависимости от количества коек или числа случаев госпитализации).
В качестве знаменателя при расчете статистических показателей (например, частота внебольничной пневмонии, вызванной пенициллинорезистентным штаммом S. рneumoniae, на 100 случаев госпитализации, частота MRSA на 1000 койко-дней).
Для экстраполяции результатов, полученных в определенной части популяции на всю популяцию в целом, используя региональные или национальные данные медицинской статистики (например, общую численность населения, численность по возрастам и т.д.).
Слайд 238
Эпидемиологический надзор
Процедуры для выявления и исключения из анализа
повторных изолятов
Для получения достоверных данных по антибиотикорезистентности в анализ
следует включать только первый штамм микроорганизма одного вида, выделенный у пациента из определенного очага инфекции. Все идентичные первому штаммы микроорганизма, выделенные при последующих микробиологических исследованиях клинического материала, полученного из очага инфекции у пациента, должны быть исключены из анализа. Для установления идентичности штаммов с целью выявления повторных изолятов используют несколько критериев:
Временной – в исследование включается только первый выделенный изолят данного вида микроорганизма, причём независимо от того, отмечалось или нет развитие резистентности данного микроорганизма к какому-либо АБП во время лечения.
Слайд 239
Эпидемиологический надзор
Фенотип чувствительности – при этом в анализ
может быть включен повторный изолят данного вида микроорганизма, при
условии доказанных значительных отличий в профиле его антибиотикочувствительности (Р → Ч или Ч → Р) к какому-либо АБП, по сравнению с первым изолятом.Минимальные отличия в антибиотико чувствительности (Р → П, П → Р, П → Ч или Ч → П), скорее всего являются проявлением фенотипической вариабельности экспрессии определенного механизма резистентности, или следствием некоторых методических проблем при определении чувствительности, не могут случить основанием для включения повторного изолята в анализ.
Кроме этих предлагаются и другие критерии для выявления повторных изолятов, однако они не превосходят по точности, достоверности и удобству использования приведенные выше и не рекомендуются руководствами ВОЗ, ESGARS и NCCLS.
Слайд 240
Эпидемиологический надзор
Виды представления данных по антибиотикорезистентности
Данные по антибиотикорезистентности
определенного микроорганизма или группы микроорганизмов к определенному АБП могут
быть представлены в следующем виде:Частотное распределение популяции микроорганизмов по степени чувствительности (по МПК или по диаметру зоны подавления роста), представленное в табличном или в графическом (в виде гистограммы) варианте. На основании данных о степени чувствительности (распределении значений МПК) можно рассчитать кумулятивные показатели чувствительности популяции штаммов к определенному АБП:
МПК50,
МПК90 и
диапазон значений МПК.
МПК50 – это значение МПК, подавляющей 50% штаммов исследуемой популяции микроорганизмов.
МПК90 – это значение МПК, подавляющей 90% штаммов исследуемой популяции микроорганизмов.
Слайд 241
Эпидемиологический надзор
Частоты встречаемости
резистентных (Р) штаммов,
штаммов с
промежуточной чувствительностью (П) и
чувствительных (Ч) штаммов в исследуемой популяции
микроорганизмов. Подобные качественные данные являются менее показательными, чем количественные показатели частотного распределения штаммов по степени чувствительности и не позволяют выявить ранние тенденции в возникновении и распространении антибиотикорезистентности.
Частоты встречаемости резистентных к определенному АБП микроорганизмов или определенных механизмов резистентности при определенных нозологических формах инфекций, в зависимости от возраста пациентов, пола пациентов, в определённой популяции пациентов, в течение определенного интервала времени и т.д.
Слайд 242
Результаты эпидемиологического надзора
Простые: Частота (%) резистентности к определенному
АБП у микроорганизма данного вида, например, частота (%) выделения
MRSA среди всех исследованных штаммов S. аureus.Средней степени сложности: Частота (%) резистентности к определенному АБП у микроорганизма данного вида, выделенных из определенного клинического материала, например, частота (%) выделения ципрофлоксацин-резистентных штаммов E.coli, выделенных из мочи.
Сложные: Частота (%) резистентности при инфекции определенного вида, например, частота (%) выделения ципрофлоксацин-резистентных штаммов E.coli при внебольничных инфекциях мочевыводящих путей.
Очень сложные: Частота инфекций определенного вида, вызванных определенным резистентным микроорганизмом в указанном подразделении, например, частота случаев бактериемии, вызванных MRSA, и развившихся в отделении интенсивной терапии, на 1000 дней пребывания в стационаре.
По возможности, частоты резистентности должны быть представлены в виде числа случаев в определенной популяции в течение определённого промежутка времени.
Слайд 243
Эпидемиологический надзор
Практические рекомендации по проведению анализа данных и
представлению его результатов
Если число штаммов одного вида менее 10,
то суммарные данные по их чувствительности представлять не рекомендуется. Для представления подобных результатов для последующей разработки стандартов эмпирической терапии существует несколько подходов:
объединение нескольких видов одного рода (например, представление данных по микроорганизмам всего рода Shigella – Shigella spp.)
объединение данных по чувствительности за несколько предшествующих лет;
объединение данных по чувствительности нескольких учреждений, находящихся в данном регионе;
использование ранее опубликованных данных.
Слайд 244
Эпидемиологический надзор
Использование полученной информации
Основной целью эпидемиологического надзора является
предоставление информации в соответствующие органы системы здравоохранения для разработки
надлежащих мероприятий по контролю и сдерживанию развития и распространения антибиотикорезистентности,
оптимизации антибактериальной терапии инфекций определенной локализации у различных категорий пациентов.
Слайд 245
Эпидемиологический надзор
В зависимости от уровня проведения эпидемиологического надзора
за антибиотикорезистентностью, его результаты могут быть представлены
для внутренней
информации клиницистам и администрации определенного лечебного учреждения, в виде информации для учреждений системы здравоохранения регионального (районного, городского и т.д.) уровней,
публикации данных по антибиотикорезистентности в Российской Федерации, (национальный уровень),
а также для интеграции их в Европейскую и Международную системы данных по антимикробной резистентности.
Особенно перспективным может быть представление этих данных для свободного доступа в сети Интернет, что позволяет своевременно дополнять и корректировать представленную информацию при появлении новых сведений.