- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Морфология, структура, химический состав вирусов, их классификация. Особенности патогенеза вирусных инфекций. (Тема 3)
Содержание
- 2. Вирус (от лат. virus — яд) — микроскопическая частица, состоящая из белков и нуклеиновых
- 3. I период (древнейший мир - 1892). Вирусология
- 4. Открытие вирусов (ІІ период). Впервые
- 5. Исторический очерк (ІІІ период)В 1930-е гг. –
- 6. Исторический очерк Дж.Солк и Сейбин (США)
- 7. Исторический очерк (ІV период)В 1979 году Балтимор
- 8. Исторический очеркБламберг (Blumberg), Нобелевский лауреат (1972) исследовал
- 9. Основные свойства вирусов 1. Ультрамикроскопические размеры (измеряются
- 10. Строение (морфология) вирусов 1. Геном вирусов образуют
- 11. Герпесвирус
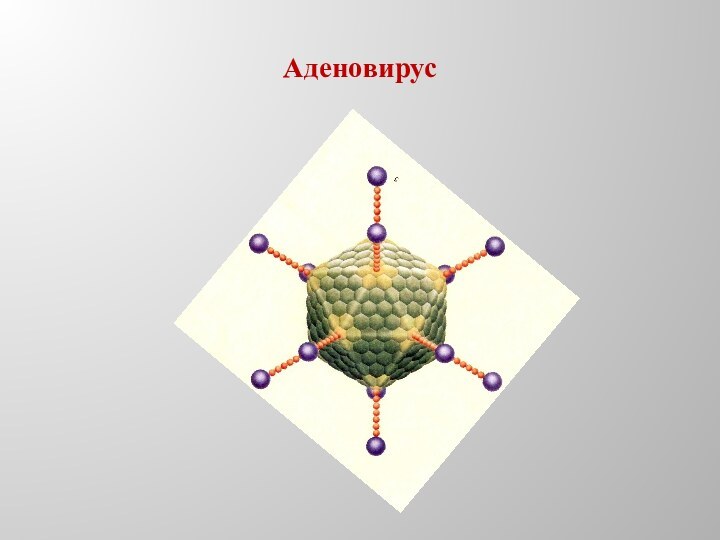
- 12. Аденовирус
- 13. Вирус табачной мозаики
- 14. Комбинированный тип симетрииВирусы с комбинированным типом симметрии
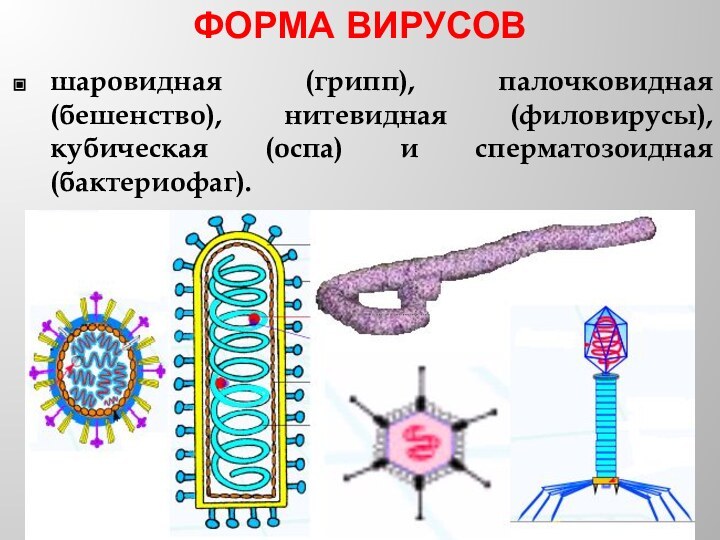
- 15. ФОРМА ВИРУСОВшаровидная (грипп), палочковидная (бешенство), нитевидная (филовирусы), кубическая (оспа) и сперматозоидная (бактериофаг).
- 16. Структура вириона: простые и сложные вирусыЕсли
- 17. Этапы взаимодействия вируса с клеткой Фаза инфицирования
- 18. Виропексис (на примере вируса гриппа) НА-сиаловая к-таСлияние
- 19. Этапы взаимодействия вируса с клеткой3. Депротеинизация («раздевание
- 20. Этапы взаимодействия вируса с клеткойФаза экспрессии вирусного
- 21. Транскрипция (переписывание информации с ДНК на РНК)
- 22. Репродукция вируса в клетке
- 23. Взаимодействие вирусов с клеткой хозяина Взаимодействие идет
- 24. Генетика вирусовГенофонд вирусов создается и пополняется из
- 25. КЛАССИФИКАЦИЯ ВИРУСОВОсновные признаки, используемые для современной классификации
- 26. Таксоны, применяемые в вирусологииЦарство ViraПодцарствоДНК-геномные вирусыРНК-геномные
- 27. Основные методы культивирования вирусов 1. В организме
- 28. Основные методы культивирования вирусов: в курином эмбрионе
- 29. Основные методы культивирования вирусов: в клеточных культурахОднослойная
- 30. Типы клеточных культур 1. Первичные (трипсинизированные) культуры
- 31. Специальные питательные среды для культур клеток Используются
- 32. Способы обнаружения (индикации) вирусов в клеточных культурах
- 33. Способы обнаружения (индикации) вирусов в клеточных культурах
- 34. Вирусы бактерий (бактериофаги)Естественной средой обитания фагов является
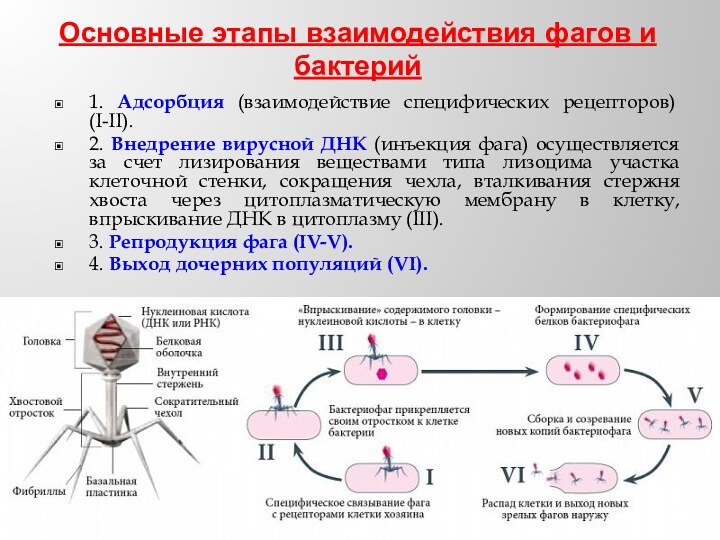
- 36. Основные этапы взаимодействия фагов и бактерий1. Адсорбция
- 37. Основные свойства фаговВирулентные фаги, способные вызвать продуктивную
- 38. Основные свойства фаговУмеренные фаги имеют важное значение
- 39. По спектру действия на бактерии фаги разделяют
- 40. Практическое использование бактериофагов. 1. Для идентификации (определение
- 41. Клетки иммунной системыКлетки, принимающие участие в становлении
- 42. Основные субпопуляции Т-клеток: 1. Цитотоксические лимфоциты (ЦТЛ,
- 43. Клетки врожденной иммунной системы:NK-клетки – нормальные киллеры,
- 44. Клетки врожденной иммунной системы:Главный комплекс гистосовместимости (МНС)
- 45. Механизмы врожденного противовирусного иммунитетаК механизмам врожденного иммунитета
- 46. Механизмы адаптивного противовирусного иммунитетаПрезентация антигена. Способностью представлять
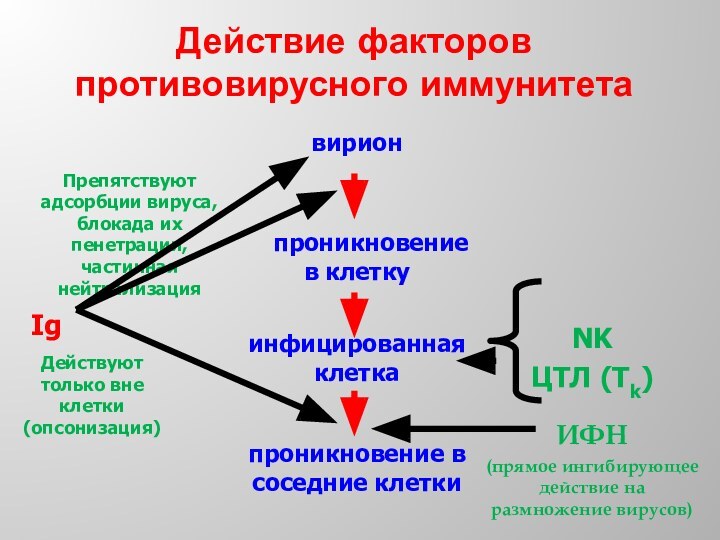
- 47. Действие факторов противовирусного иммунитетаДействуют только вне клетки(опсонизация)
- 50. Патогенез вирусных инфекций на клеточном уровне Вирусы,
- 51. Исходя из механизмов развития внутри пораженной клетки
- 52. Методы диагностики вирусных инфекцийЦитологическийВирусологическийСерологический (Иммунологический)Молекулярно-генетический
- 53. Иммунологические методы исследованияРеакция агглютинации – склеивание корпускулярных
- 54. Иммунологические методы исследованияРеакция преципитации – иммунологическая реакция,
- 55. Иммуноферментный анализ (ИФА) – метод количественного определения
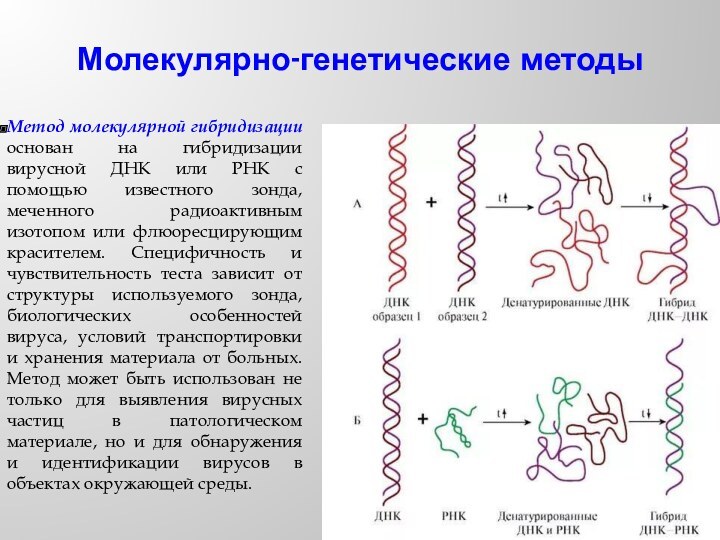
- 56. Молекулярно-генетические методыМетод молекулярной гибридизации основан на гибридизации
- 57. Молекулярно-генетические методыПолимеразная цепная реакция (ПЦР) – экспериментальный
- 58. ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯДля проведения ПЦР необходимы следующие
- 59. Скачать презентацию
- 60. Похожие презентации












































Слайд 2 Вирус (от лат. virus — яд) — микроскопическая частица, состоящая из белков и нуклеиновых кислот и
способная инфицировать клетки живых организмов.
разных формах: внеклеточной - вирион и внутриклеточной - вирус.Слайд 3 I период (древнейший мир - 1892). Вирусология как
наука не существовала, а все исследования носили эмпирический характер.
В это время Л. Пастер занимается бешенством. Создав первую вакцину против вирусного заболевания, он, однако, не раскрыл сущности вирусов.В последующем английским врачом Э. Дженнером предложена вакцина против оспы людей как метода иммунизации людей против этого заболевания.
Исторический очерк
Слайд 4 Открытие вирусов (ІІ период). Впервые существование вируса доказал
в 1892 году Д.И. Ивановский. На заседании Российской академии
наук он сообщил, что возбудителем мозаичной болезни табака является фильтрующийся вирус. Эту дату можно считать днем рождения вирусологии, а Д.И. Ивановского - ее основоположником.Д. И. Ивановский (1863—1920)
Слайд 5
Исторический очерк (ІІІ период)
В 1930-е гг. – изучены
все лейкозные вирусы.
В 1933 году был открыт вирус
гриппа А, в 1934 году – вирус гриппа В.
В конце 40-х годов был разработан метод культивирования вирусов в клеточных культурах.
В 1952 году Эндерс, Уэллер и Роббинс были удостоены Нобелевской премии за разработку методов культивирования вирусов.
Это позволило:
выделять новые вирусы,
их идентифицировать,
изучать их взаимодействие с клеткой
Слайд 6
Исторический очерк
Дж.Солк и Сейбин (США) разработали
технологию производства вакцин – сначала убитой, а затем живой
аттенуированной.Вакцина против полиомиелита стала первой культуральной вакциной.
В 50-х годах наши исследователи Чумаков и Смородинцев приняли участие в разработке вакцины против полиомиелита, которая проводилась в рамках международного сотрудничества в области медицины.
В результате в 1959 году была проведена массовая иммунизация детей в нашей стране.
Слайд 7
Исторический очерк (ІV период)
В 1979 году Балтимор и
одновременно Темин (США) открыли обратную транскриптазу в составе РНК-содержащих
онкогенных вирусов.Это фермент, с помощью которого РНК переписывается на ДНК (РНК-зависимая ДНК-полимераза); появилась возможность получения ДНК-копии на матрице вирусной РНК.
В 1972 году П. Бэрг (США) получил рекомбинантные молекулы ДНК – так началась эра генной инженерии.
Слайд 8
Исторический очерк
Бламберг (Blumberg), Нобелевский лауреат (1972) исследовал антигены
крови аборигенов Австралии. Он предположил, что открыл новый антиген
крови. Но позже, при медицинском обследовании пациентов, было установлено, что они больны гепатитом, а этот антиген – HbsAg -поверхностный антиген вируса гепатита В.В 1982-1983 г.г. Монтанье (Франция), а затем и Р. Галло (США) выделили вирус иммунодефицита человека (предварительно были изучены несколько лимфотропных ретровирусов). Вирус получил название HIV (ВИЧ). В 2007 году Монтанье был удостоен Нобелевской премии.
Слайд 9
Основные свойства вирусов
1. Ультрамикроскопические размеры (измеряются в
нанометрах). Крупные вирусы (вирус оспы) могут достигать размеров 300
нм, мелкие - от 20 до 40 нм. 1мм=1000мкм, 1мкм=1000нм.2. Вирусы содержат нуклеиновую кислоту только одного типа- или ДНК (ДНК- вирусы) или РНК (РНК- вирусы).
3. Вирусы не способны к росту и бинарному делению.
4. Вирусы размножаются путем воспроизводства себя в инфицированной клетке хозяина за счет собственной геномной нуклеиновой кислоты.
5. У вирусов нет собственных энергетической, ферментативной и белок- синтезирующей систем, в связи с чем вирусы являются абсолютными (облигатными) внутриклеточными паразитами.
6. Разобщённый (дизъюнктивный) способ размножения (репликации): происходит сборка компонентов вируса (нуклеиновая кислота+белок)
7. Средой обитания вирусов являются живые клетки - бактерии (это вирусы бактерий, или бактериофаги), клетки растений, животных и человека.
Слайд 10
Строение (морфология) вирусов
1. Геном вирусов образуют нуклеиновые кислоты,
представленные одноцепочечными молекулами РНК (у большинства РНК- вирусов) или
двухцепочечными молекулами ДНК (у большинства ДНК- вирусов).2. Капсид - белковая оболочка, в которую упакована геномная нуклеиновая кислота. Капсид состоит из идентичных белковых субъединиц - капсомеров.
Существуют три способа упаковки капсомеров в капсид - спиральный (спиральные вирусы), кубический (сферические вирусы) и комбинированный (бактериофаг).
При спиральной симметрии белковые субъединицы располагаются по спирали, а между ними, также по спирали, уложена геномная нуклеиновая кислота (нитевидные вирусы).
При кубическом типе симметрии вирионы могут быть в виде многогранников, чаще всего- двадцатигранники - икосаэдры.
Слайд 14
Комбинированный тип симетрии
Вирусы с комбинированным типом симметрии имеют
нуклеокапсид, характеризующийся кубической симметрией, а расположенный внутри нуклеопротеид уложен
спирально
Слайд 15
ФОРМА ВИРУСОВ
шаровидная (грипп), палочковидная (бешенство), нитевидная (филовирусы), кубическая
(оспа) и сперматозоидная (бактериофаг).
Слайд 16
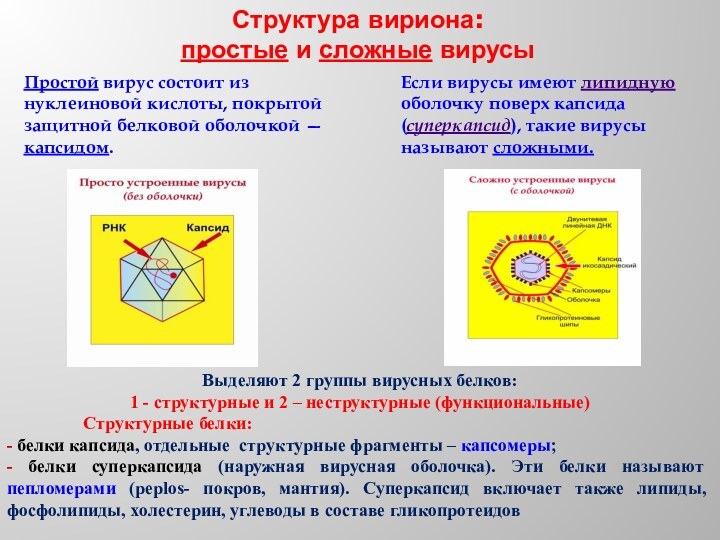
Структура вириона:
простые и сложные вирусы
Если вирусы имеют
липидную оболочку поверх капсида (суперкапсид), такие вирусы называют сложными.
Простой
вирус состоит из нуклеиновой кислоты, покрытой защитной белковой оболочкой — капсидом. Выделяют 2 группы вирусных белков:
1 - структурные и 2 – неструктурные (функциональные)
Структурные белки:
- белки капсида, отдельные структурные фрагменты – капсомеры;
- белки суперкапсида (наружная вирусная оболочка). Эти белки называют пепломерами (peplos- покров, мантия). Суперкапсид включает также липиды, фосфолипиды, холестерин, углеводы в составе гликопротеидов
Слайд 17
Этапы взаимодействия вируса с клеткой
Фаза инфицирования включает:
1.
Адсорбция (прикрепление вируса к рецептору клетки). Клеточные рецепторы находятся
на дне ямок (углублений), покрытых со стороны цитоплазмы высокомолекулярным белком клатрином. Прикрепление вируса – это сигнал для эндоцитоза ( ямка превращается в вакуоль и образуется рецептосома). Эндоцитоз.2. Слияние мембран (слияние вирусной оболочки с мембраной вакуоли, в результате белки вируса становятся частью клеточной мембраны. Белок слияния F (fusion) обеспечивает трансмембранный переход, а также образование синцития и симпластов.
Слайд 18
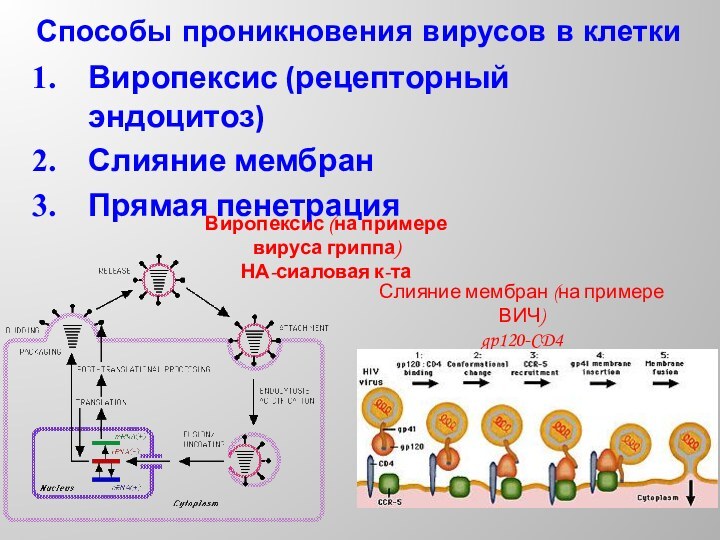
Виропексис (на примере вируса гриппа)
НА-сиаловая к-та
Слияние мембран (на
примере ВИЧ)
gp120-CD4
Способы проникновения вирусов в клетки
Виропексис (рецепторный эндоцитоз)
Слияние мембран
Прямая пенетрация
Слайд 19
Этапы взаимодействия вируса с клеткой
3. Депротеинизация («раздевание вируса»).
С поверхности нуклеокапсида удаляется матриксный белок М, в результате
нуклеокапсид приобретает функциональную активность и проникает в цитоплазму, вирус гриппа – в клеточное ядро.4. Проникновение нуклеиновой кислоты
ДНК-вирусы: встраивание генома вируса в геном клетки хозяина (вирус гепатита В, герпесвирусы)
РНК-ретровирусы: геномная РНК переписывается на ДНК с помощью обратной транскриптазы (РНК-зависимая ДНК-полимераза) и эта ДНК – провирус встраивается в геном клетки.
Слайд 20
Этапы взаимодействия вируса с клеткой
Фаза экспрессии вирусного генома:
5.
Репликация - экспрессия ранних и поздних генов и
синтез белка в направлениии ДНК - иРНК – белок.6. Сборка вирионов, морфогенез c последующим выходом из клетки-мишени путем почкования (вирусы с оболочкой) или лизиса клетки (вирусы без оболочки)
Слайд 21 Транскрипция (переписывание информации с ДНК на РНК) и
трансляция (синтез белка на молекуле РНК) вирусного генома
Геном вирусов
содержит или РНК, или ДНК (РНК- и ДНК- вирусы соответственно). Выделяют позитивную (+) РНК (пикорнавирусы), обладающую матричной активностью и соответственно - инфекционными свойствами, и негативную (-) РНК (парамиксовирусы), не проявляющую инфекционные свойства, которая для воспроизводства должна транскрибироваться (превращаться) в +РНК. Механизмы репродукции различных вирусов очень сложные и существенно отличаются. Основные их схематические варианты представлены ниже.
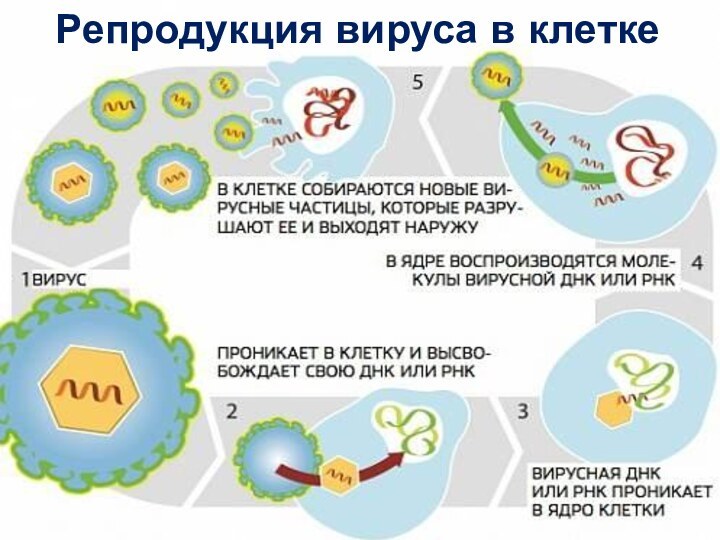
Слайд 23
Взаимодействие вирусов с клеткой хозяина
Взаимодействие идет в единой
биологической системе на генетическом уровне. Существует четыре типа взаимодействия:
1) продуктивный тип (взаимодействие, в результате которого происходит репродукция вируса, вызывая гибель (лизис) клетки );
2) абортивный тип (взаимодействие, при котором репродукции вируса не происходит, а клетка восстанавливает нарушенную функцию);
3) интегративный тип или вирус-индуцированная трансформация клетки (встраивание (интеграция) вирусной ДНК в виде провируса в хромосому клетки и их совместная репликация, при этом клетка, инфицированная вирусом, приобретает новые, ранее не присущие ей свойства);
4) латентная вирусная инфекция (идет репродукция вируса, а клетка сохраняет свою функциональную активность).
Слайд 24
Генетика вирусов
Генофонд вирусов создается и пополняется из четырех
основных источников:
двух внутренних (мутации, рекомбинации)
и двух внешних (включение
в геном генетического материала клетки хозяина, поток генов из других вирусных популяций).
Слайд 25
КЛАССИФИКАЦИЯ ВИРУСОВ
Основные признаки, используемые для современной классификации вирусов
1.
тип нуклеиновой кислоты (РНК или ДНК), ее структура;
2. наличие
липопротеидной оболочки;3. стратегия вирусного генома;
4. размер и морфология вириона, тип симметрии, число капсомеров;
5. феномены генетических взаимодействий;
6. круг восприимчивых хозяев;
7. патогенность;
8. географическое распространение;
9. антигенные свойства
Слайд 26
Таксоны, применяемые в вирусологии
Царство Vira
Подцарство
ДНК-геномные вирусы
РНК-геномные вирусы
Семейство
Название таксона заканчивается на – viridae
Подсемейство
Название таксона заканчивается
на – virinae (существует у некоторых семейств) Род
Название таксона заканчивается на – virus. Основной таксон в классификации вирусов
Вирус
Серовары
По антигенной структуре
Слайд 27
Основные методы культивирования вирусов
1. В организме лабораторных животных:
например, белых мышей (вирусы гриппа, Коксаки), кроликов (вирус бешенства).
Индикацию, то есть обнаружение вируса, проводят на основании развития типичных признаков заболевания и изменений органов животных.К лабораторным животным предъявляют строгие требования.
Животные должны быть в достаточной степени восприимчивы к инфекции данным вирусом и не нести в себе латентной инфекции и каких-либо паразитов. В эксперимент берут животных одного пола, возраста, массы, лучше из одного питомника или партии. После заражения особей вируссодержащим материалом важно своевременно и правильно взять материал для дальнейшего исследования. Результаты выделения вируса считают положительными, если у животного после соответствующего инкубационного
периода развиваются симптомы инфекции.
Слайд 28
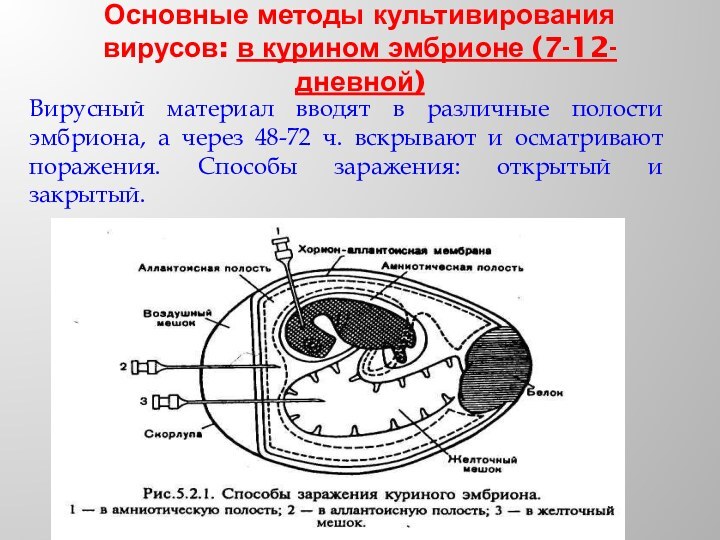
Основные методы культивирования вирусов: в курином эмбрионе (7-12-дневной)
Вирусный
материал вводят в различные полости эмбриона, а через 48-72
ч. вскрывают и осматривают поражения. Способы заражения: открытый и закрытый.
Слайд 29
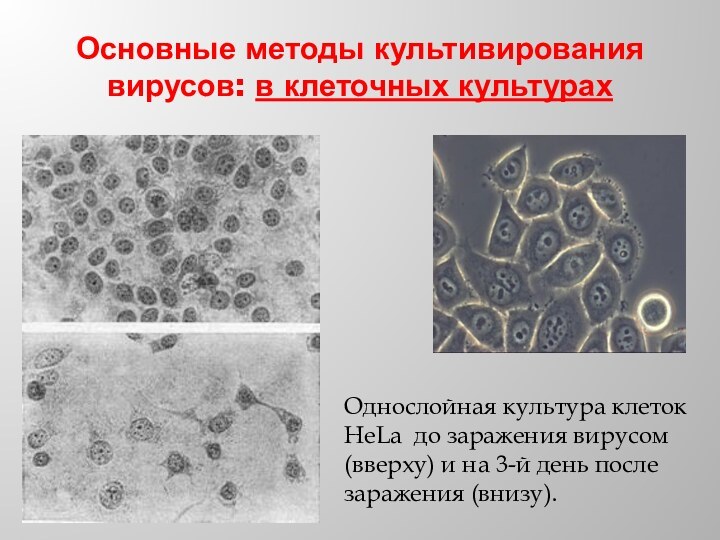
Основные методы культивирования вирусов: в клеточных культурах
Однослойная культура
клеток HeLa до заражения вирусом (вверху) и на 3-й
день после заражения (внизу).
Слайд 30
Типы клеточных культур
1. Первичные (трипсинизированные) культуры - фибробласты
эмбриона курицы (ФЭК), человека (ФЭЧ), клетки почки различных животных
и т.д. Первичные культуры получают из клеток различных тканей чаще путем их размельчения и трипсинизации, используют однократно, т.е. постоянно необходимо иметь соответствующие органы или ткани.2. Диплоидные (полуперевиваемые) культуры пригодны к повторному диспергированию и росту, как правило не более 20 пассажей (теряют исходные свойства).
3. Перевиваемые линии (гетероплоидные культуры), способны к многократному диспергированию и перевиванию, т.е. к многократным пассажам, наиболее удобны в вирусологической работе - например, HeLa – получена из карциномы шейки матки; Hep-2 – из карциномы гортани; Детройт -6 – из метастаза рака легкого в костный мозг; RH –из опухоли почки человека.
Слайд 31
Специальные питательные среды для культур клеток
Используются разнообразные синтетические
вирусологические питательные среды сложного состава, включающие большой набор различных
факторов роста - среда 199, Игла, раствор Хэнкса, гидролизат лактальбумина. В среды добавляют стабилизаторы рН (Hepes), различные в видовом отношении сыворотки крови (наиболее эффективной считают эмбриональную телячью сыворотку), L-цистеин и L-глютамин.В зависимости от функционального использования среды могут быть ростовые (с большим содержанием сыворотки крови) - их используют для выращивания клеточных культур до внесения вирусных проб, и поддерживающие (с меньшим содержанием сыворотки или ее отсутствием) - для содержания инфицированных вирусом клеточных культур.
Слайд 32
Способы обнаружения (индикации) вирусов в клеточных культурах
1. Цитопатическое
действие (ЦПД). В результате размножения вирусов в клетках происходят
морфологические изменения клеток (вакуолизация цитоплазмы, деструкция митохондрий, округление клеток). Часть клеток погибает и отслаивается от стекла. Вместо сплошного монослоя остаются отдельные клеточные островки.2. Выявление телец включений. Включения - скопления вирусов в клетках. Οʜᴎ имеют различную форму и размеры. Их окрашивают по Романовскому-Гимзе или флюорохромами и наблюдают под микроскопом.
3. Выявление вирусов методом флюоресцирующих антител (ИФА), электронной микроскопией.
4. Цветная проба. Обычный цвет используемых культуральных сред, содержащих в качестве индикатора рН феноловый красный, при оптимальных для клеток условиях культивирования (рН около 7,2) - красный. Размножение клеток меняет рН и соответственно - цвет среды с красного на желтый за счет смещения рН в кислую сторону. При размножении в клеточных культурах вирусов происходит лизис клеток, изменения рН и цвета среды не происходит.
Слайд 33
Способы обнаружения (индикации) вирусов в клеточных культурах
5. Выявление
гемагглютинина вирусов - гемадсорбция (Клетки, зараженные вирусами, могут адсорбировать
эритроциты. Вирусы выходят на поверхность клеток и связывают эритроциты. Эритроциты добавляют к культуре и через неĸᴏᴛᴏᴩᴏе время промывают физиологическим раствором. На поверхности клеток под микроскопом видны прилипшие эритроциты в виде разнообразных фигур), гемагглютинация (склеивание эритроцитов под влиянием вирусов).6. Метод бляшек (бляшкообразования). В результате цитолитического действия многих вирусов на клеточные культуры образуются зоны массовой гибели клеток. Выявляют бляшки - вирусные “ клеточно- негативные” колонии.
Слайд 34
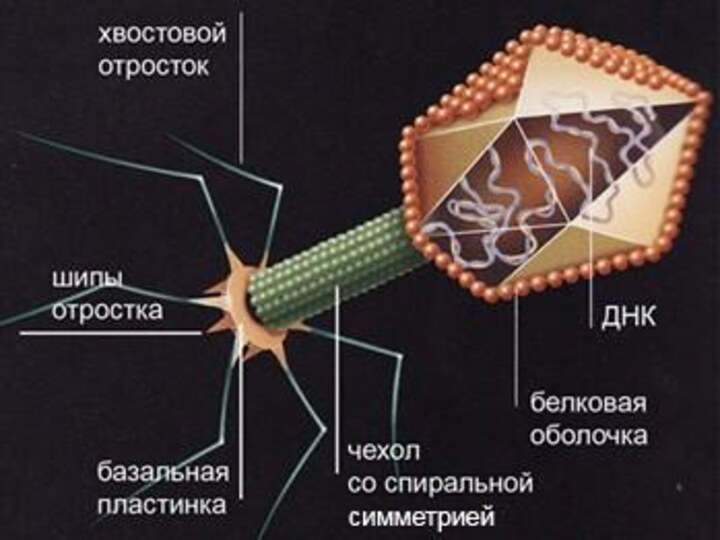
Вирусы бактерий (бактериофаги)
Естественной средой обитания фагов является бактериальная
клетка, поэтому фаги распространены повсеместно (например, в сточных водах).
Фагам присущи биологические особенности, свойственные и другим вирусам.Наиболее морфологически распространенный тип фагов характеризуется наличием головки-икосаэдра, отростка (хвоста) со спиральной симметрией (часто имеет полый стержень и сократительный чехол), шипов и отростков (нитей), т.е. внешне несколько напоминают сперматозоид.
Взаимодействие фагов с клеткой (бактерией) строго специфично, т.е. бактериофаги способны инфицировать только определенные виды и фаготипы бактерий.
Слайд 36
Основные этапы взаимодействия фагов и бактерий
1. Адсорбция (взаимодействие
специфических рецепторов) (I-II).
2. Внедрение вирусной ДНК (инъекция фага) осуществляется
за счет лизирования веществами типа лизоцима участка клеточной стенки, сокращения чехла, вталкивания стержня хвоста через цитоплазматическую мембрану в клетку, впрыскивание ДНК в цитоплазму (III).3. Репродукция фага (IV-V).
4. Выход дочерних популяций (VI).
Слайд 37
Основные свойства фагов
Вирулентные фаги, способные вызвать продуктивную форму
процесса;
умеренные фаги, вызывающие редуктивную фаговую инфекцию (редукцию фага).
При этом геном фага в клетке не реплицируется, а внедряется (интегрируется) в хромосому клетки хозяина (ДНК в ДНК), фаг превращается в профаг. Этот процесс получил название лизогении. Если в результате внедрения фага в хромосому бактериальной клетки она приобретает новые наследуемые признаки, такую форму изменчивости бактерий называют лизогенной (фаговой) конверсией. Бактериальную клетку, несущую в своем геноме профаг, называют лизогенной, поскольку профаг при нарушении синтеза особого белка-репрессора может перейти в литический цикл развития, вызвать продуктивную инфекцию с лизисом бактерии.
Слайд 38
Основные свойства фагов
Умеренные фаги имеют важное значение в
обмене генетическим материалом между бактериями - в трансдукции (одна
из форм генетического обмена). Например, способностью вырабатывать экзотоксин обладают только возбудитель дифтерии, в хромосому которого интегрирован умеренный профаг, несущий оперон tox, отвечающий за синтез дифтерийного экзотоксина. Умеренный фаг tox вызывает лизогенную конверсию нетоксигенной дифтерийной палочки в токсигенную.
Слайд 39
По спектру действия на бактерии фаги разделяют на:
-
поливалентные (лизируют близкородственные бактерии, например сальмонеллы);
- моновалентные (лизируют бактерии
одного вида);- типоспецифические (лизируют только определенные фаговары возбудителя).
Слайд 40
Практическое использование бактериофагов.
1. Для идентификации (определение фаготипа, т.н.
фаготипирование).
2. Для фагопрофилактики (купирование вспышек).
3. Для фаготерапии (лечение дисбактериозов).
4.
Для оценки санитарного состояния окружающей среды и эпидемиологического анализа.
Слайд 41
Клетки иммунной системы
Клетки, принимающие участие в становлении и
функционировании иммунной системы, можно разделить на две группы:
1.
Основные клетки лимфоидного комплекса: Т-, В-лимфоциты и их субпопуляции;2. Вспомогательные клетки иммунной системы: макрофаги, дендритные клетки, натуральные киллеры.
Слайд 42
Основные субпопуляции Т-клеток:
1. Цитотоксические лимфоциты (ЦТЛ, Т-киллеры) –
эффекторные клетки. Вызывают гибель клеток-мишеней, несущих на поверхности чужеродный
антиген.2. Т-супрессоры – регуляторные клетки. Ингибируют активность других клеток иммунной системы.
3. Т-хелперы – регуляторные клетки. Активируют макрофаги, стимулируют образование ЦТЛ, участвуют в аллергических реакциях, стимулируют размножение и активность натуральных киллеров, поддерживают пролиферацию Т-супрессоров. Индуцируют пролиферацию В-клеток и выработку ими иммуноглобулинов, синтезируют интерлейкины -4, -5, -6, -10.
Слайд 43
Клетки врожденной иммунной системы:
NK-клетки – нормальные киллеры, лимфоциты
периферии. Не обладают структурами для специфического распознавания антигена. Способны
убивать некоторые опухолевые, а так же инфицированные вирусами клетки. При активации выбрасывают перфорин, разрушающий мембрану модифицированной клетки.Макрофаги – фагоцитирующие мононуклеары. Участвуют в неспецифическом иммунитете, удалении отживших и разрушенных клеток собственного организма, презентации антигена, продуцируют разнообразные цитокины.
Дендритные клетки расположены в тимусе, лимфатических узлах, тканях слизистых. Способны представлять антиген в иммуногенной форме и сохранять его для ускоренного развития вторичного иммунного ответа.
Слайд 44
Клетки врожденной иммунной системы:
Главный комплекс гистосовместимости (МНС) –
группа близкосцепленных генов шестой хромосомы, кодирующих иммунологически значимые молекулы
трех классов. Продукты данных генов – лейкоцитарные антигены (human leukocyte antigens – HLA) – определяют биологическую индивидуальность каждого человека. Все гены комплекса наследуются по кодоминантному типу.Продукты генов МНС I класса присутствуют на поверхности всех ядросодержащих клеток и определяют специфичность организма. Играют важную роль в гуморальной регуляции, вовлечены в процессы дифференцировки при эмбриональном развитии.
Белки МНС II класса присутствуют на поверхности В-лимфоцитов и антигенпрезентирующих клеток. Обеспечивают взаимодействие между Т- лимфоцитами и макрофагами. Т-хелперы распознают чужеродный антиген только в комплексе с белками МНС II класса.
Продукты генов МНС III класса не участвуют в контроле иммунного ответа, основной их функцией является восстановление поврежденных белков в клетке.
Слайд 45
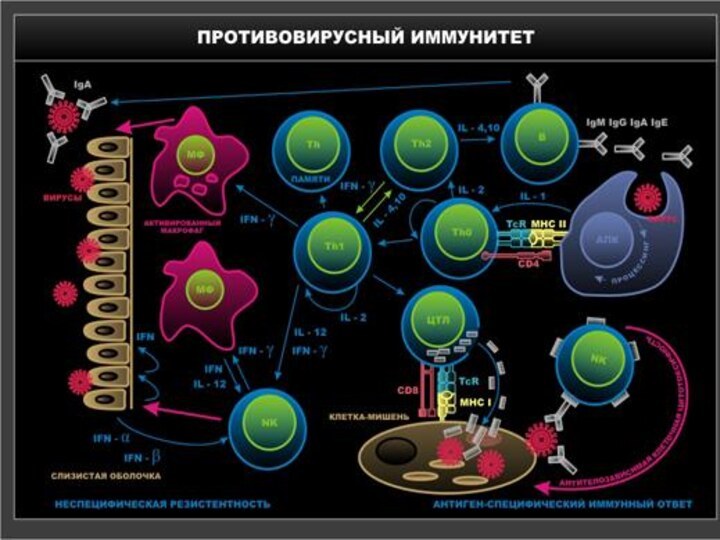
Механизмы врожденного противовирусного иммунитета
К механизмам врожденного иммунитета относятся
NK-клетки и интерфероны.
NK-клетки представляют собой крупные лимфоциты. Основной
их функцией является цитолитическая, которая обеспечивается содержанием в гранулах этих клеток белка перфорина и сериновых эстераз. Нормальные киллеры являются продуцентами ряда цитокинов, а также интерферона γ. Интерфероны – основные факторы врожденной защиты от вирусов. Интерфероны индуцируют в клетке биосинтез ферментов, нарушающих репликативный цикл вируса, а также приводят к активации NK-клеток.
Слайд 46
Механизмы адаптивного противовирусного иммунитета
Презентация антигена. Способностью представлять (презентировать)
антигены Т-лимфоцитам обладают антигенпрезентирующие клетки (АПК): дендритные клетки, макрофаги,
В-лимфоциты. Представлению антигена предшествуют следующие стадии:1. Захват поступившего в организм антигена.
2. Переработка (дезинтеграция) антигена.
3. Формирование комплексов накопившихся антигенов с собственными молекулами МНС 1 класса.
4. Транспортировка образовавшихся комплексов на мембрану АПК.
5. Доставка образовавшихся комплексов во вторичные лимфоидные органы для представления Т-лимфоцитам.
Основные эффекторные клетки при вирусной инфекции – цитотоксические Т- лимфоциты (Т-киллеры, ЦТЛ).
Этапы цитолитического действия ЦТЛ: распознавание антигена наивными Т-лимфоцитами, пролиферация и дифференцировка до зрелых Т-эффекторов, лизис (гибель) клетки (апоптоз или некроз).
Гуморальный иммунный ответ, направленный против внеклеточно расположенных вирионов: препятствие адсорбции вирусов на поверхности чувствительных клеток и нейтрализацию вирусов.
Слайд 49
ПАТОГЕНЕЗ ВИРУСНЫХ ИНФЕКЦИЙ
Патогенез вирусных инфекций – совокупность
процессов, вызывающих заболевание и определяющих его развитие и исход. Патогенез определяется следующими факторами: тропизмом вируса (чувствительность к вирусу определенных клеток, тканей и органов макроорганизма).
2. скоростью репродукции вируса и количеством инфекционных частиц в потомстве;
3. реакцией клетки на инфекцию;
4. реакцией организма на вызванные инфекцией изменения клеток и тканей.
Слайд 50
Патогенез вирусных инфекций на клеточном уровне
Вирусы, репродуцируясь
в клетке, обусловливают появление цитопатического действия (ЦПД) и цитопатического
эффекта (ЦПЭ). Это специфическая морфологическая деструкция (ЦПД) или функциональная патология без разрушения (ЦПЭ).Вирусы, которые вызывают ЦПД, называют цитопатическими.
Механизм возникновения и развития ЦПД - ЦПЭ:
1. Нарушение белкового синтеза клетки хозяина.
2. Нарушение проницаемости клеточных мембран
3. Патология лизосом.
Различают три типа ЦПД-ЦПЭ:
1. Цитолитический тип. Характеризуется общей деструкцией клеток. Этому явлению могут предшествовать сгущение цитоплазмы, округление или сморщивание клеток, пикноз ядра, разрушение митохондрий, подавление митоза (такой тип может быть вызван пикорнавирусами и др.).
2. Трансформирующий тип. Клетка при этом типе ЦПД не погибает, а приобретает способность к неограниченному размножению (трансформация клетки). Трансформацию вызывают онкогенные вирусы (вирус лейкоза, болезни Марека и др.).
3. Индуктивный тип. При этом типе ЦПД клетка не погибает и не трансформируется, а изменяет свои функции, в частности, способность приобретает способность продуцировать интерферон и другие вещества (например, репродукция вируса классической чумы свиней в макрофагах
Слайд 51 Исходя из механизмов развития внутри пораженной клетки цитопатических
изменений выделяют четыре типа вирусных инфекций:
а) литическая – при
этом типе инфекции наблюдают морфологические изменения в зараженной клетке, резко снижается метаболизм, отмечается деструкция и гибель клетки. Для вируса характерна высокая продукция с формированием нового поколения вирусов.
б) персистентная – в зараженной клетке отсутствует ЦПД и отмечается слабое нарушение метаболизма. При этом у вируса снижена репродукция (при определенных условиях вирус классической чумы свиней).
в) латентная – при этом в клетке отсутствует ЦПД и нарушение метаболизма. Вирусный геном интегрируется с клеточным
геномом. (вирус гепатита В).
г) трансформационная – при этом меняется морфология клетки, клетка размножается неограниченно. В организме появляются опухоли.
Слайд 52
Методы диагностики вирусных инфекций
Цитологический
Вирусологический
Серологический (Иммунологический)
Молекулярно-генетический
Слайд 53
Иммунологические методы исследования
Реакция агглютинации – склеивание корпускулярных антигенов
антителами в присутствии электролитов, в результате чего выпадает осадок.
В вирусологических исследованиях наиболее часто используют реакцию непрямой гемагглютинации.Гемагглютинация – это склеивание эритроцитов, приводящее к образованию конгломератов, видимых невооруженным глазом. Особенностью метода является использование эритроцитов животных (барана, кролика) в качестве носителей вирусной антигенной детерминанты (сенсибилизированные эритроциты). О качестве реакции судят по характеру осадка: наличие фестончатого осадка свидетельствует о положительной реакции, плотный осадок в виде пуговки – об отрицательной реакции
Слайд 54
Иммунологические методы исследования
Реакция преципитации – иммунологическая реакция, основанная
на осаждении комплекса растворимого молекулярного антигена с антителом, в
результате чего появляется помутнение (преципитат).Реакция нейтрализации – иммунологическая реакция, основанная на способности антител специфически подавлять (нейтрализовать) биологическую активность вируса в различных тест-системах – организме животных, куриных эмбрионах, культуре клеток.
Слайд 55
Иммуноферментный анализ (ИФА) – метод количественного определения антител
и антигенов, в котором используются антитела, меченные ферментом, и,
в результате ферментативной реакции изменяется цвет одного из компонентов. В качестве фермента используется пероксидаза хрена, β-галактозидаза или щелочная фосфатаза. При добавлении к ферменту его субстрата и хромогена, последний изменяет окраску. Интенсивность окраски хромогена прямо пропорциональна количеству связавшихся молекул антигена и антител. Изменение окраски определяют спектрофотометрически – по оптической плотности окрашенного раствора.
Слайд 56
Молекулярно-генетические методы
Метод молекулярной гибридизации основан на гибридизации вирусной
ДНК или РНК с помощью известного зонда, меченного радиоактивным
изотопом или флюоресцирующим красителем. Специфичность и чувствительность теста зависит от структуры используемого зонда, биологических особенностей вируса, условий транспортировки и хранения материала от больных. Метод может быть использован не только для выявления вирусных частиц в патологическом материале, но и для обнаружения и идентификации вирусов в объектах окружающей среды.
Слайд 57
Молекулярно-генетические методы
Полимеразная цепная реакция (ПЦР) – экспериментальный метод
молекулярной биологии, позволяющий добиться значительного увеличения малых концентраций определённых
фрагментов нуклеиновой кислоты в биологическом материале. ПЦР дает возможность существенно ускорить и облегчить диагностику вирусных заболеваний. Метод основан на многократном избирательном копировании определённого участка ДНК при помощи ферментов в искусственных условиях. При этом происходит копирование только того участка, который удовлетворяет заданным условиям, и только в том случае, если он присутствует в исследуемом образце.
Слайд 58
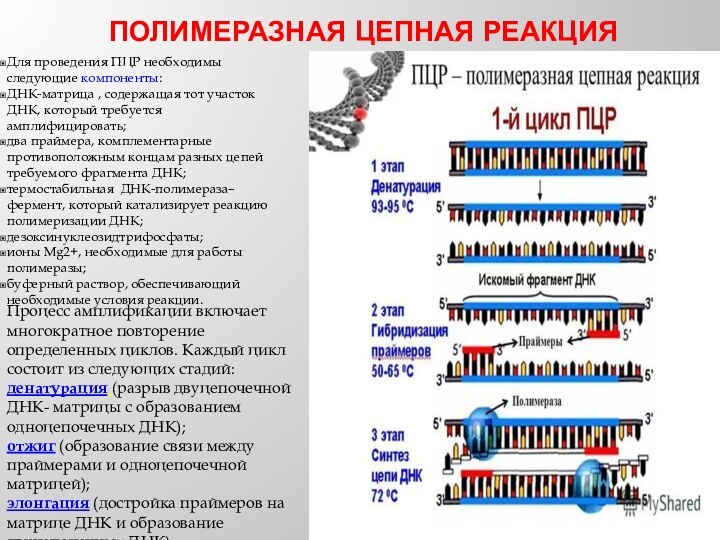
ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ
Для проведения ПЦР необходимы следующие компоненты:
ДНК-матрица , содержащая тот участок ДНК, который требуется амплифицировать;
два праймера, комплементарные противоположным концам разных цепей требуемого фрагмента ДНК;
термостабильная ДНК-полимераза–фермент, который катализирует реакцию полимеризации ДНК;
дезоксинуклеозидтрифосфаты;
ионы Mg2+, необходимые для работы полимеразы;
буферный раствор, обеспечивающий необходимые условия реакции.
Процесс амплификации включает многократное повторение определенных циклов. Каждый цикл состоит из следующих стадий:
денатурация (разрыв двуцепочечной ДНК- матрицы с образованием одноцепочечных ДНК);
отжиг (образование связи между праймерами и одноцепочечной матрицей);
элонгация (достройка праймеров на матрице ДНК и образование двуцепочечных ДНК).