Слайд 2
Эпидемиология
Рак желудка является второй по частоте причиной
смерти от злокачественных новообразований .
Наиболее высокая заболеваемость
регистрируется в Японии, Китае, Корее, странах Южной и Центральной Америки, а также в Восточной Европе, включая бывшие советские республики.
В РФ ежегодно регистрируют около 40 тыс. первичных больных раком желудка, 35 тыс. умирает. Заболеваемость составляет 28,4 на 100 тыс. населения.
Начиная с середины XX века, во всем мире отмечается снижение заболеваемости раком желудка за счет больных раком дистальных отделов желудка кишечного типа, в то время как удельный вес рака кардии растет, причем наиболее быстро – среди лиц моложе 40 лет.
Слайд 3
Эпидемиологическая классификация
по Lauren’у
Кишечный тип: опухоль
имеет строение, схожее с колоректальным раком, и характеризуется отчетливыми
железистыми структурами, состоящими из хорошо дифференцированного цилиндрического эпителия с развитой щеточной каемкой.
Диффузный тип: опухоль представлена слабо организованными группами или одиночными клетками с большим содержанием муцина (перстневидные) и характеризуется диффузным инфильтративным ростом.
Слайд 4
Эпидемиология рака желудка
Пик заболеваемости 50-60 лет
Мужчины в 2-12
раз чаще болеют
Локализация: чаще дистальные отделы. Однако наблюдается тенденция
к учащению проксимального и кардио-эзофагеального рака, особенно в странах Европы и Америки
Азия – значительно чаще дистальный рак (лучше результаты лечения и прогноз!)
Слайд 5
Эпидемиология рака желудка в Европе
2006г. - 159 900
новых случаев и 118 200 смертей, что занимает четвертое
и пятое места в структуре заболеваемости и смертности соответственно.
Мужчины болеют в 1,5 раза чаще женщин, пик заболеваемости приходится на возраст 60-70 лет.
Слайд 6
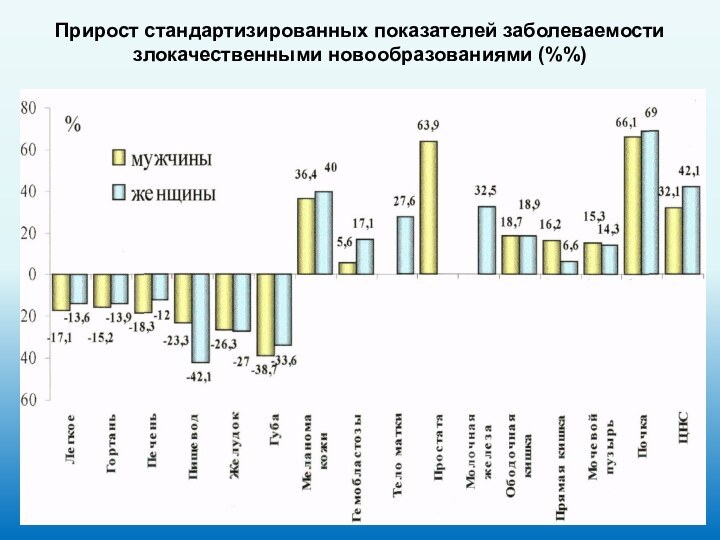
Прирост стандартизированных показателей заболеваемости злокачественными новообразованиями (%%)
Слайд 7
СРАВНИТЕЛЬНАЯ ОЦЕНКА РАЗЛИЧНЫХ ФАКТОРОВ, ВЛИЮЩИХ НА ЗАБОЛЕВАЕМОСТЬ РАКОМ
Слайд 8
Johannes Fibiger 1867- 1928
Слайд 9
Биография
Род. 23 апреля 1867 в Силькеборге, Дания.
Изучал бактериологию

под руководством Р.Коха и Э.фон Беринга, работал совместно с
Карлом Саломонсеном в Копенгагенском университет.
Докторская диссертация по бактериологии дифтерии была завершена в 1895 году, а в 1900 году – профессор патанатомии университета.
Внедрил сыворотку Беринга для лечения дифтерии в Дании и исследовал взаимосвязь между вспышками туберкулеза у коров и и распространение этого заболевания у человека.
Tуберкулез крыс и рак желудка с Spiroptera neoplastica (Gongylonema neoplasticum).
В 20-е годы проводит сравнительное экспериментальное исследование рака, вызванного каменноугольной смолой, Spiroptera neoplastica и клиническими проявлениями.
Сочетание внешних влияний с генетической не общей, а органной предрасположенностью к раку.
Нобелевская премия по медицине и физиологии за 1926 год.
«Впервые стало возможным добиться экспериментального превращения нормальных клеток в злокачественные клетки раковых опухолей. Тем самым было убедительно показано не то, что рак всегда вызывается червями, а то, что его могут провоцировать внешние воздействия» (В. Вернштедт).
Умер в Копенгагене 30 января 1928 года от рака прямой кишки.
Слайд 10
Этиология
А. Пищевые факторы риска
Избыточное потребление поваренной
соли и нитратов
Недостаток витаминов А и С
Потребление
копченых, маринованных и вяленых продуктов
Сохранение пищи без использования холодильника
Качество питьевой воды
Б. Факторы внешней среды и образа жизни
Профессиональные вредности (производство резины, угля)
Курение табака
Ионизирующее излучение
Резекция желудка в анамнезе
Ожирение
В. Инфекционные факторы
Helicobacter pylori
Epstein-Barr virus
Слайд 11
Этиология
Г. Генетические факторы
Группа крови А (II)
Пернициозная анемия
Семейный рак желудка
Синдром наследственного рака желудка
диффузного типа (HDGC).
Наследственный неполипозный колоректальный рак
Синдром Li Fraumeni (синдром наследственного рака)
Наследственные синдромы, сопровождающиеся полипозом желудочно-кишечного тракта: семейный аденоматозный полипоз толстой кишки, синдром Gardner, синдром Peutz-Jeghers, семейный ювенильный полипоз
Д. Предраковые заболевания и изменения слизистой желудка
Аденоматозные полипы желудка
Хронический атрофический гастрит
Болезнь Менетрие (гиперпластический гастрит)
Пищевод Барретта, гастро-эзофагеальный рефлюкс
Дисплазия желудочного эпителия
Кишечная метаплазия
Слайд 12
Этиологические факторы рака желудка
Питание
Рефлюкс желчи
Helicobacter pylori
Генетические нарушения
Факторы
риска - экзогенные источники
нитратов и нитритов, эндогенное образование нитратов,
повышенное потребление соли, хранение пищевых продуктов, алкоголь.
Защитные факторы - антиоксиданты и бета-каротин.
Слайд 13
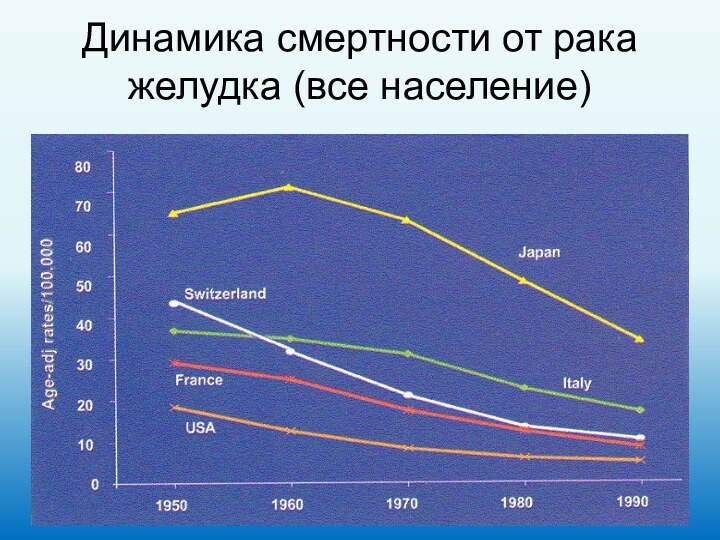
Динамика смертности от рака желудка (все население)
Слайд 14
Helicobacter pylori
Этиологический фактор некоторых форм гастритов (гиперацидного и
гипоацидного)
Патогенетическая связь с язвенной болезнью 12-перстной кишки, аденокарциномой и
MALT- лимфомой желудка
Ген СаgА
Вакуолизирующий токсин (vac-A) - 50-60% (выключение ионтранспортирующих АТФ-аз)
Активация EGF, HB-EGF, VEGF
Алкоголь-дегидрогеназа – ацетальадельгид –
перекисное окисление липидов – повреждение ДНК
Муколитические ферменты
Слайд 15
Helicobacter pylori
Терапия I линии – в течение 7-14
дней :
ИПП: Омепразол (Ультоп, Рабепразол, Эзомепразол) 20 мг х
2 р в день; или Лансопразол 30 мг х 2 р в день; или Эзомепразол 40 мг х 2 р в день
Кларитромицин (Фромилид) 500 мг х2 р/ день
Амоксициллин (Хиконцил) 1000 мг х 2 р/ день
N.B.:
При повышенной чувствительности к пенициллиновым антибиотикам – можно заменить метронидазолом или сразу назначить квадротерапию
Эффективность схем лечения I линии превышает 80%.
Эффективность лечения проверяется дыхательным тестом с 13СО(NH)2 через 4 недели после лечения антибиотиками или через две недели после ИПП.
Слайд 16
Helicobacter pylori
Терапия II линии – к в а
д р о т е р а п и
я:
Висмут субсалицилат или субцитрат 1 табл. х 4 р/ день
ИПП: Омепразол (Ультоп, Рабепразол, Эзомепразол) 20 мг х 2 р в день; или Лансопразол 30 мг х 2 р в день; или Эзомепразол 40 мг х 2 р в день
Метронидазол 500 мг х 3 р/ день
Тетрациклин гидрохлорид 500 мг х 4 р/ день
Слайд 17
Наследственный рак желудка
Исследование семей с наследственными формами рака
желудка показало, что наследования соответствует моногенному автосомно-доминантному типу с
высокой пенетрантностью (75-95%) гена
Морфологическая форма – диффузная аденокарцинома
Наследственные синдромы, при которых рак желудка развивается с повышенной частотой-семейные наследственные полипозы толстой кишки, синдромы Гарднера и Пейтца-Егерса
Синдром Линча
CDH1 – ген, ассоциированный с карциномой желудка. Располагается на хромосоме 16 и кодирует белок Е-кадхерин, который относится к адгезивным белкам, участвующим в формировании межклеточных контактов. Он также играет роль в передаче сигналов от мембраны к ядру
Слайд 18
Молекулярный патогенез
Супрессоры
р53 – инактивация путем микромутаций или делеций
соответствующего локуса хромосомы
Метилирование промоторных областей супрессорных генов приводит к
фенотипу микросателлитной нестабильности, угнетению экспрессии гена рецептора ретиноевой кислоты (RAR-beta), регуляторов клеточного цикла, генов семейства RUNX
Слайд 19
Паранеопластические синдромы
Acantosis nigricans
Полимиозит с дерматомиозитом
Кольцевидная эритема, буллезный пемфигоид
Деменция,
мозжечковая атаксия
Венозные тромбозы конечностей
Множественные старческие кератомы (Симптом Лезера-Трела)
Слайд 22
Кольцевидная эритема
В основе кольцевидной эритемы – кожный васкулит либо вазомоторная реакция
Слайд 23
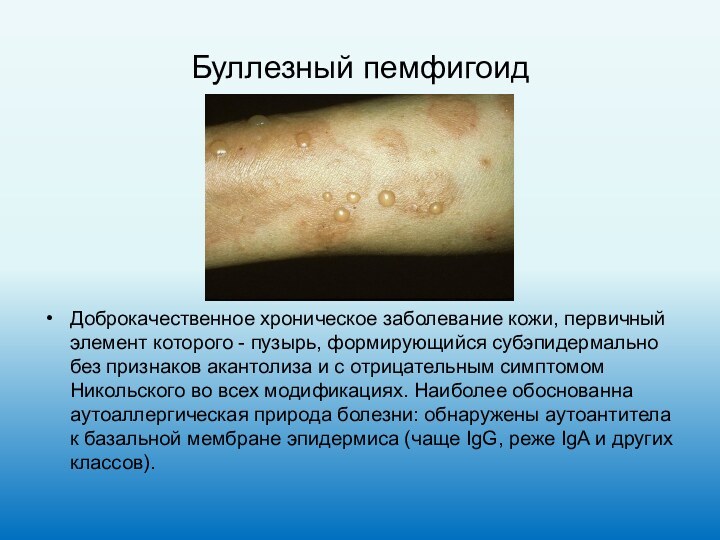
Буллезный пемфигоид
Доброкачественное хроническое заболевание кожи, первичный элемент которого
- пузырь, формирующийся субэпидермально без признаков акантолиза и с
отрицательным симптомом Никольского во всех модификациях. Наиболее обоснованна аутоаллергическая природа болезни: обнаружены аутоантитела к базальной мембране эпидермиса (чаще IgG, реже IgA и других классов).
Слайд 24
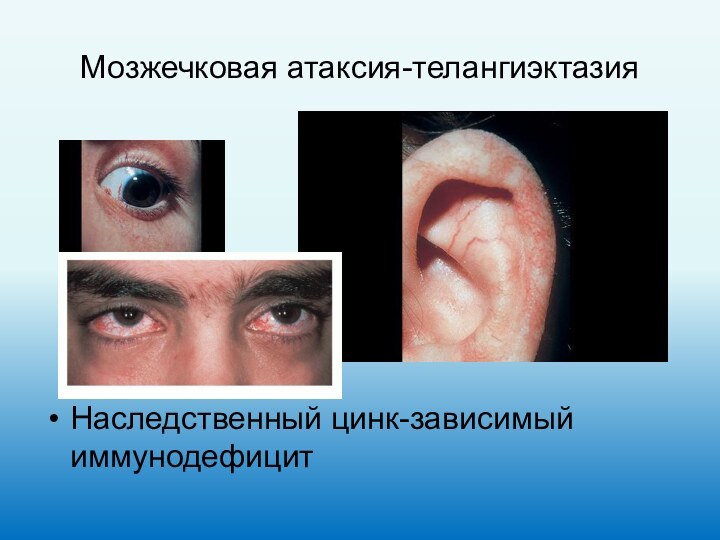
Мозжечковая атаксия-телангиэктазия
Наследственный цинк-зависимый иммунодефицит
Слайд 25
Венозные тромбозы конечностей
Различают тромбофлебит поверхностных (преимущественно варикозно-расширенных) вен
и тромбофлебит глубоких вен нижних конечностей. К более редким
формам тромбофлебита относят болезнь Педжета — Шреттера (тромбоз подмышечной и подключичной вен), болезнь Мондора (тромбофлебит подкожных вен передней грудной стенки), облитерирующий тромбангиит (мигрирующий тромбофлебит Бюргера), Бадда — Киари болезнь (тромбоз печеночных вен) и др.
Слайд 26
Эруптивный себорейный кератоз
(Синдром Лезера-Трела)
Характеризуется внезапным появлением множественного себорейного
кератоза в сочетании со злокачественными новообразованиями внутренних органов
Слайд 27
ГИСТОЛОГИЧЕСКАЯ КЛАССИФИКАЦИЯ
ОПУХОЛЕЙ ЖЕЛУДКА (ВОЗ, 2000 год)
Слайд 28
Диагностика
Клиническая картина
Данные лабораторных исследований
Рентгенологическое исследование
ЭГДС с биопсией
УЗИ периферических
и забрюшинных лимфатических узлов, печени, органов малого таза, передней
брюшной стенки околопупочной области
Лапароскопия
Результаты морфологических исследований
Слайд 29
Классификация рака желудка
По локализации.
Анатомические области:
Кардиальный отдел;
Дно желудка;
Тело желудка;
Антральный
и
Пилорический отдел.
+тотальное поражение
Слайд 30
Клиника рака желудка
Часто бессимптомна
Боль в животе (60%)
Похудание (50%)
Тошнота
и рвота (40%)
Анемия (40%)
Пальпаторное выявление опухоли желудка (у 30%)
Гематемезис
и мелена (25%)
Слайд 31
ОСНОВНЫЕ СИМПТОМЫ РАКА ЖЕЛУДКА
18 365 б-ных (Wanebo и
соавт., 1993)
Слайд 32
Синдром «малых признаков»
А.И. Савицкого
Изменение самочувствия больного
Общая слабость
Стойкое снижение
аппетита
«Желудочный дискомфорт»
Похудание
Анемия
Потеря интереса к окружающим
Психическая депрессия
Слайд 33
Первичная диагностика рака желудка
Клиническое обследование
ЭГДС с
множественной биопсией
Гистологическое / цитологическое исследование биоптатов
Слайд 34
Роль ЭГДС
1982г. - 1 биоптат – 70%;
7 биоптатов – 98% (Graham D.)
2013г. – современные технологии
эндоскопии
эндоскопия высокого разрешения (HRE)
увеличительная (ZOOM) эндоскопия (х 80 – 150)
узкоспектральная эндоскопия (NBI)
флюоресцентная эндоскопия
хромоэндоскопия
Слайд 35
Узкоспектральная эндоскопия
(NBI эндоскопия)
Слайд 36
Уточняющая диагностика
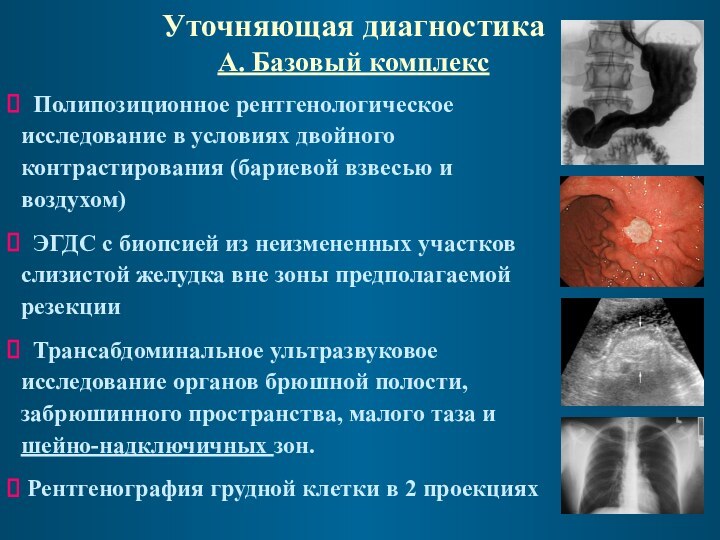
А. Базовый комплекс
Полипозиционное рентгенологическое исследование в
условиях двойного контрастирования (бариевой взвесью и воздухом)
ЭГДС с
биопсией из неизмененных участков слизистой желудка вне зоны предполагаемой резекции
Трансабдоминальное ультразвуковое исследование органов брюшной полости, забрюшинного пространства, малого таза и шейно-надключичных зон.
Рентгенография грудной клетки в 2 проекциях
Слайд 37
Уточняющая диагностика
В. Дополнительные методы
Компьютерная или магнитно-резонансная
томография
Диагностическая лапароскопия
Эндосонография
Флуоресцентная диагностика
Онкомаркеры (РЭА,
СА-72-4, СА-125)
Слайд 38
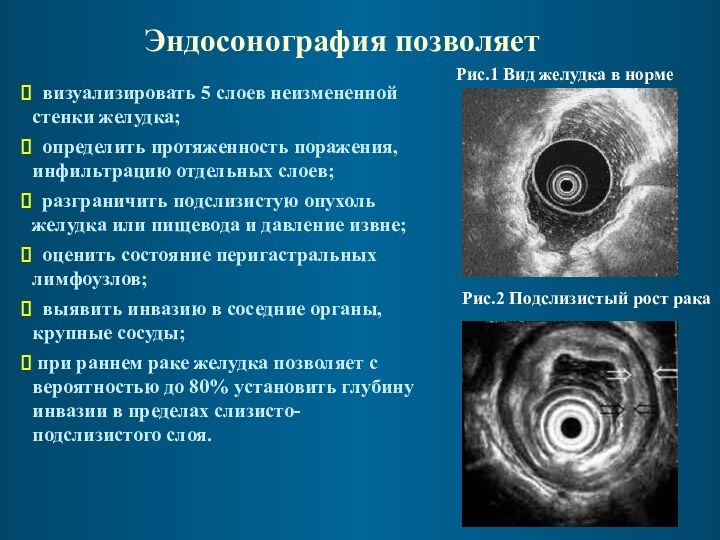
Эндосонография позволяет
визуализировать 5 слоев неизмененной стенки желудка;
определить протяженность поражения, инфильтрацию отдельных слоев;
разграничить подслизистую
опухоль желудка или пищевода и давление извне;
оценить состояние перигастральных лимфоузлов;
выявить инвазию в соседние органы, крупные сосуды;
при раннем раке желудка позволяет с вероятностью до 80% установить глубину инвазии в пределах слизисто-подслизистого слоя.
Рис.1 Вид желудка в норме
Рис.2 Подслизистый рост рака
Слайд 39
Показания к диагностической лапароскопии:
Уточняющая диагностика
субтотальное / тотальное
поражение
выход на серозу по данным УЗИ/КТ
наличие множественных
увеличенных регионарных лимфатических узлов по данным УЗИ/КТ
начальные проявления асцита
визуализируемые при УЗИ/КТ изменения брюшины
Противопоказания:
осложненный рак желудка, требующий ургентного вмешательства (стеноз, кровотечение, перфорация)
выраженный спаечный процесс в брюшной полости после ранее перенесенных операций
Слайд 40
Лапароскопическая флуоресцентная диагностика
L Диссеминация по брюшине выявляется у
63,3%.
У 16,7% больных диссеминация определялась только в режиме флуоресценции.
Чувствительность метода при раке желудка составляет 72,3%, специфичность – 64%, общая точность метода – 69%.
МНИОИ им. П.А. Герцена
Слайд 41
Показания к КТ/МРТ:
значительное несоответствие результатов различных
методов обследования в оценке распространенности опухолевого процесса
Невозможность оценки
резектабельности по данным других методов исследования
прорастание в поджелудочную железу
вовлечение крупных сосудов
метастазы в печени
подозрение на внутригрудное метастазирование
Планирование комбинированного лечения
Уточняющая диагностика
Слайд 42
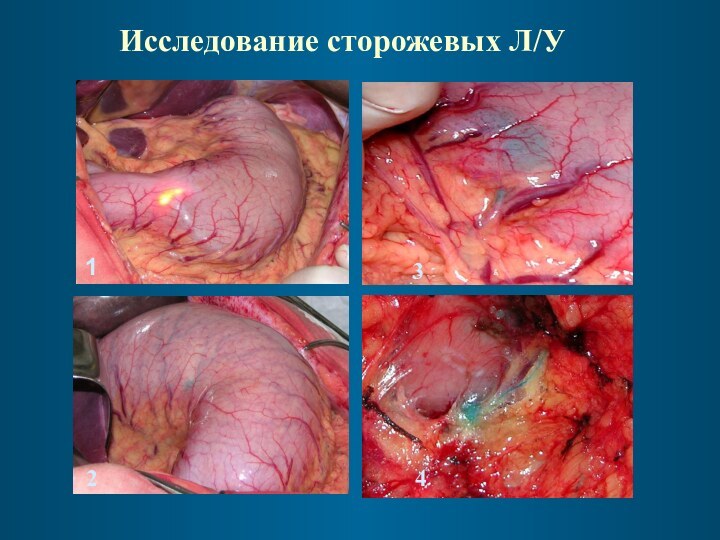
Исследование сторожевых Л/У
1
2
3
4
Слайд 43
Терминология
Версия JGCA
Ранний рак – Т1 N любое
Местно-распространенный
рак – Т2-4 N любое
Российская версия
Ранний рак – Т1
N0
Местно-распространенный рак
– Т1-4, N+
– Т4 N0
Слайд 44
Эндоскопическая классификация раннего рака желудка (T1, N любая,
M0)
I тип – возвышенный (высота опухоли больше толщины
слизистой оболочки)
II тип – поверхностный
IIa – приподнятый тип
IIb – плоский тип
IIc – углубленный
III тип – изъязвленный (язвенный дефект слизистой оболочки)
Слайд 45
Классификация распросраненного рака желудка по Borrman’у
Слайд 46
Дифференциальная диагностика
Полипы и другие доброкачественные опухоли, в т.ч.
и лейомиомы
Язвы
Лимфомы
Другие саркомы, включая лейомиосаркомы, ГИСТ’ы
Метастатические опухоли желудка (меланома,
рак молочной железы, рак почки)
Слайд 52
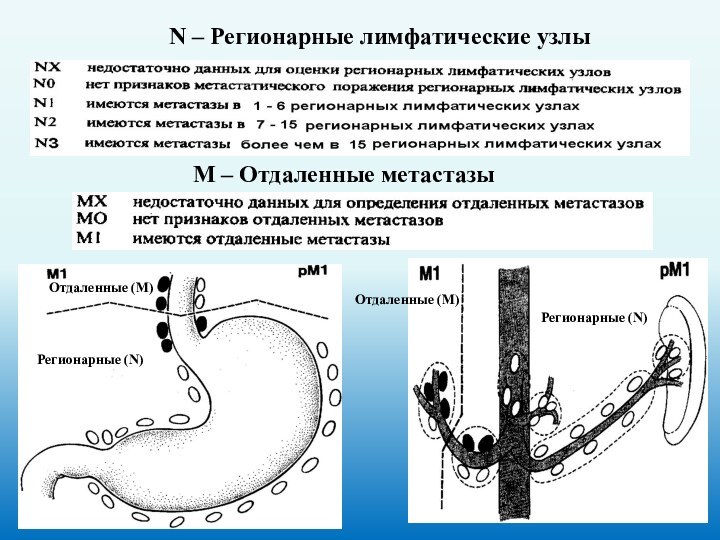
N – Регионарные лимфатические узлы
М – Отдаленные метастазы
Отдаленные
(М)
Регионарные (N)
Отдаленные (М)
Регионарные (N)
Слайд 53
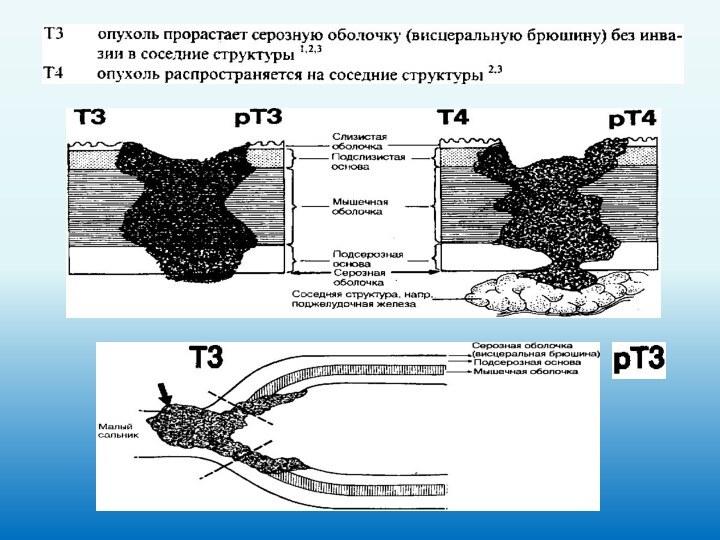
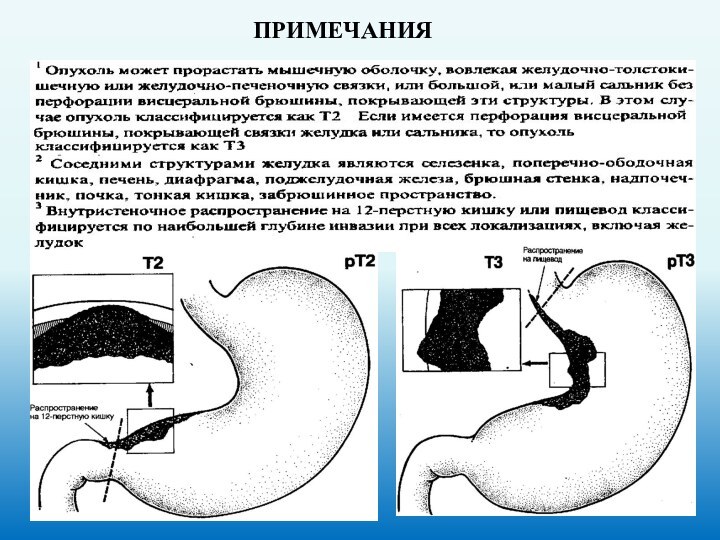
Прорастание опухоли:
в малый и большой сальник;
в
печень и диафрагму;
в поджелудочную железу;
в селезенку;
в
желчевыводящие пути;
в поперечно-ободочную кишку;
в переднюю брюшную стенку.
Лимфогенное метастазирование:
в регионарные лимфоузлы;
в отдаленные лимфоузлы (метастаз Вирхова, метастаз в левой подмышечной области),
Гематогенное метастазирование:
в печень;
в легкие;
в кости;
в мозг.
Имплантационные метастазы:
диссеминация, локальная или тотальная;
в малом тазу (метастаз Крукенберга, Шницлера).
ПУТИ РАСПРОСТРАНЕНИЯ РАКА ЖЕЛУДКА
Слайд 54
pTNM Патологическая классификация
pT, pN и pM категории соответствуют
T, N и M категориям.
pN0 При гистологическом анализе материала
регионарной лимфаденэктомии должно исследоваться не менее 15 лимфатических узлов
G Гистопатологическая дифференцировка
Gx Степень дифференцировки не может быть установлена
G1 Высокая степень дифференцировки
G2 Средняя степень дифференцировки
G3 Низкая степень дифференцировки
G4 Недифференциированная опухоль
Слайд 56
Лечение рака желудка
Оперативные вмешательства
Химиотерапия
Лучевая терапия
Комбинированное лечение
Слайд 57
Лечение рака желудка
Операция является единственным потенциально курабельным методом
лечения для стадий I-IV M0;
Оптимальный объем регионарной лимфаденэктомии
до сих пор не установлен. В известных на сегодняшний день рандомизированных исследованиях не было показано преимущества D2 над D1 резекцией, что, по-видимому, обусловлено большей частотой осложнений после выполнения спленэктомии и резекции хвоста поджелудочной железы (ESMO)
В настоящее время рекомендуется выполнение D2 резекции без удаления селезенки и резекции поджелудочной железы. Не менее 14 (оптимально — 25) ЛУ должно быть удалено (ESMO)
Слайд 58
Виды хирургических вмешательств
Радикальные операции:
хирургические
эндоскопические
Паллиативные операции
Слайд 59
Эндоскопическая резекция (ЭР) слизистой при раннем раке желудка
Показания:
рак желудка строения папиллярной
или тубулярной аденокарциномы;
I-IIа-b типы опухоли размерами до 2 см
IIс тип без изъязвления размером до 1 см.
I
IIa
IIb
IIc
Частота лимфогенных метастазов – 0%
Местные рецидивы – 5%
5-летняя выживаемость –95%
Слайд 60
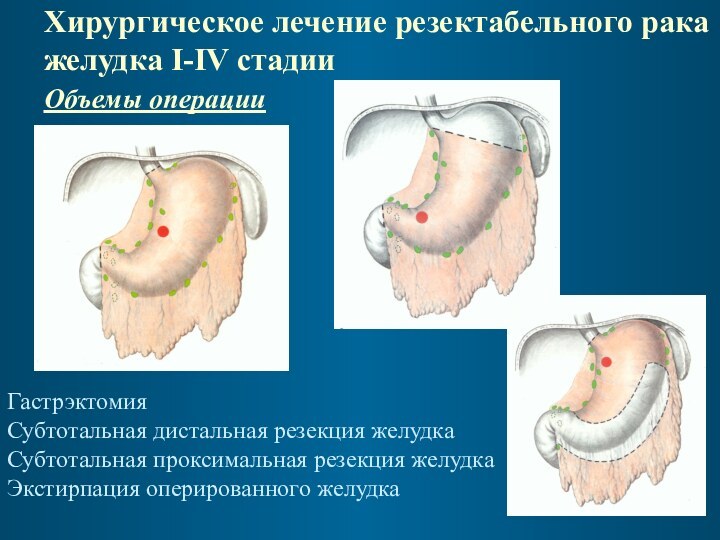
Хирургическое лечение резектабельного рака желудка I-IV стадии
Объемы
операции
Гастрэктомия
Субтотальная дистальная резекция желудка
Субтотальная проксимальная резекция желудка
Экстирпация
оперированного желудка
Слайд 61
Выбор объема операции
Дистальная субтотальная резекция желудка
показана при опухолях экзофитной или смешанной формы роста, расположенных
ниже условной линии, соединяющей точку, расположенную на 5 см ниже кардии по малой кривизне, и промежуток между правой и левой желудочно-сальниковыми артериями по большой кривизне.
Проксимальную субтотальную резекцию желудка выполняют при раке кардии и кардиоэзофагеального перехода. При раке верхней трети желудка возможно выполнение как проксимальной субтотальной резекции, так и гастрэктомии.
Во всех остальных случаях показана гастрэктомия
Слайд 62
Выбор объема операции
Дополнительные критерии, влияющие на выбор объема
операции:
возраст
сопутствующая патология
фоновые заболевания желудка
прогноз
прочие факторы (течение анестезии, анатомические особенности, субъективные и т.п.)
Слайд 63
Выбор объема операции
При распространении на пищевод опухолей
экзофитной и смешанной формы роста допустимым является отступление на
5 см от пальпируемого края опухоли в проксимальном направлении
При опухолях эндофитной формы роста распространение раковых клеток в проксимальном направлении может достигать 10-12 см от видимого края опухоли.
При вовлечении ретроперикардиального сегмента пищевода целесообразно выполнять субтотальную резекцию пищевода.
Морфологический контроль краев резекции обязателен
Слайд 64
Выбор оперативного доступа
При раке желудка без вовлечения
розетки кардии выполняют верхнесрединную лапаротомию до тела грудины
и широкую диафрагмотомию по Савиных.
При опухолях, поражающих розетку кардии или переходящих на пищевод до уровня диафрагмы операцию производят из тораколапаротомного доступа в VI-VII межреберье слева.
При распространении опухоли выше диафрагмы необходимо выполнение раздельной лапаротомии и торакотомии в V-VI межреберье справа.
Слайд 67
Регионарные лимфатические узлы желудка N1
№1 правые паракардиальные
№2 левые
паракардиальные
№3 вдоль малой кривизны
№4 большой кривизны
№5 надпривратниковые
№6 подпривратниковые
Слайд 68
Регионарные лимфатические узлы желудка N2
№7 левой желудочной
артерии
№8 общей печеночной артерии
№9 чревного ствола
№10 ворот селезенки
№11 селезеночной артерии
Слайд 69
Регионарные лимфатические узлы желудка N3
№12 печеночно-двенадцатиперстной связки
№13
позади головки поджелудочной железы
№14 верхних брыжеечных
сосудов
№15 - средних ободочных сосудов
№16 - парааортальные ЛУ
№17 передней поверхности головки поджелудочной железы
№18 по нижнему краю поджелудочной железы
№19 поддиафрагмальные ЛУ
№20 пищеводного отверстия диафрагмы
Слайд 70
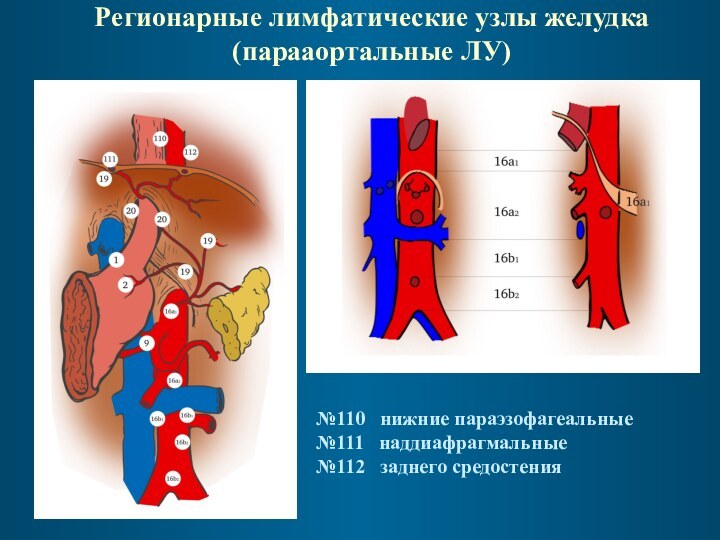
Регионарные лимфатические узлы желудка
(парааортальные ЛУ)
№110 нижние параэзофагеальные
№111 наддиафрагмальные
№112 заднего средостения
Слайд 71
D1
D2
Объемы лимфаденэктомии
D3
№1 правые паракардиальные
№2 левые паракардиальные
№3
вдоль малой кривизны
№4 большой кривизны
№5 надпривратниковые
№6 подпривратниковые
№7 вдоль левой желудочной артерии
№8 вдоль общей печеночной артерии
№9 вокруг чревного ствола
№10 ворот селезенки
№11 вдоль селезеночной артерии
№12 печеночно-двенадцатиперстной связки
№19 поддиафрагмальные
№20 пищеводного отверстия диафрагмы
№110 нижние параэзофагеальные
№111 наддиафрагмальные
№112 лимфатические узлы заднего средостения
№13 позади головки поджелудочной железы
№14 вдоль верхних брыжеечных сосудов
№15 вдоль средних ободочных сосудов
№16 парааортальные
№17 на передней поверхности головки поджелудочной железы
№18 по нижнему краю поджелудочной железы
при переходе на
пищевод
Слайд 72
Спленэктомия при раке желудка
Увеличение количества гнойно-септических и инфекционных
осложнений (поддиафрагмальные абсцессы, панкреатиты, плевриты, пневмонии)
Иммунологические нарушения
Отрицательное влияние спленэктомии
на отдаленные результаты
Последствия:
Слайд 73
Абсолютные показания к спленэктомии
врастание опухоли в селезенку
врастание опухоли
в дистальные отделы поджелудочной железы
врастание опухоли в селезеночную артерию
метастазы
в паренхиму селезенки
опухолевая инфильтрация желудочно-селезеночной связки в области ворот селезенки
невозможность контроля гемостаза при нарушении целостности капсулы селезенки (техническая спленэктомия)
Слайд 74
Спленэктомия не показана
локализация опухоли в нижней трети
желудка
локализация опухоли по передней стенке и малой кривизне
желудка
глубина инвазии T1 – T2
Слайд 75
Классификация хирургических вмешательств
Слайд 76
10-летние результаты D2 лимфодиссекции по сравнению с D1
(Hartgrink et al., 2004)
Параметры*
D1 D2
Локорегионарный рецидив 21% 19%
Локорегионарный рецидив 37% 26%
+ отдаленные метастазы
Отдаленные метастазы 11% 15%
*Все различия статистически не достоверны
Слайд 77
Результаты D2/D3 лимфодиссекции по сравнению с D1
(D’Angelica
et al., 2004)
Параметры*
D1 D2/D3
Локорегионарный рецидив 53% 56%
Перитонеальные метастазы 30% 27%
3. Гематогенные метастазы 49% 53%
*Все различия статистически не достоверны
Слайд 78
Результаты D2/D3 лимфодиссекции по сравнению с D1
(Roviello
et al., 2003)
Параметры*
D1 D2/D3
Локорегионарный рецидив 39% 27%
Перитонеальные метастазы 16% 18%
Кумулятивный риск развития 65% 70% рецидива
*Все различия статистически не достоверны
Слайд 79
Комбинированные операции при раке желудка
Разработана методология расширенных комбинированных
операций при местнораспространенном раке желудка по типу верхней левой
брюшной эвисцерации с резекцией поперечно-ободочной кишки, поджелудочной железы, диафрагмы, левой доли печени, надпочечника, почки
Слайд 80
Комбинированные операции при раке желудка
Схема резекции и
реконструкции при верхней левой брюшной эвисцерации по поводу местно-распространенного
рака желудка
Слайд 81
Прогноз
Выживаемость после радикального хирургического лечения:
IA — 95%;
IB — 85%;
II — 54%;
IIIA —
37%;
IIIB — 11%;
IV — 7%.
Факторы неблагоприятного прогноза:
наличие опухоли по краю резекции
(R1/R2)
диффузно-инфильтративная форма роста (linitis plastica)
инвазия сосудов
проксимальная локализация опухоли в желудке
молодой возраст больного (до 40 лет)
значительная потеря в весе до начала лечения
Слайд 82
Выживаемость больных раком желудка после хирургического лечения (п=3212)
(Российский Онкологический Научный Центр им. Н.Н.Блохина РАМН)
годы
Слайд 83
ФУНКЦИОНАЛЬНЫЕ АСПЕКТЫ ОПЕРАЦИИ Варианты пластики после гастрэктомии
Петлевая пластика
Пластика
по Roux-en-Y
Петлевой резервуар
Слайд 84
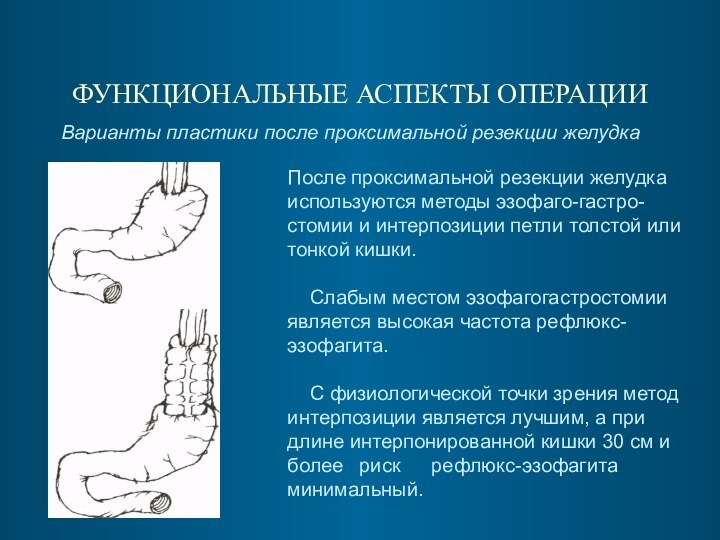
ФУНКЦИОНАЛЬНЫЕ АСПЕКТЫ ОПЕРАЦИИ
Варианты пластики после проксимальной резекции
желудка
После проксимальной резекции желудка используются методы эзофаго-гастро-стомии и
интерпозиции петли толстой или тонкой кишки.
Слабым местом эзофагогастростомии является высокая частота рефлюкс-эзофагита.
С физиологической точки зрения метод
интерпозиции является лучшим, а при
длине интерпонированной кишки 30 см и
более риск рефлюкс-эзофагита
минимальный.
Слайд 85
Значение реконструкции
Улучшение качества жизни пациентов
за счет увеличения количества
принимаемой
пищи и уменьшения
кратности питания;
Стабилизации показателей массы тела;
Профилактика пищеводного рефлюкса.
Слайд 86
Методы реконструкции с включением 12-перстной кишки
Hunt-Lawrence-Rodino
Слайд 87
Резектабельный рак желудка IV стадии
1. Циторедуктивные операции показаны:
при местнораспространенном раке желудка IV стадии (T3N3),
солитарном
и единичных изолированных метастазах в печени
ограниченной диссеминации по брюшине при возможности выполнения полной циторедукции R0.
2. После операции целесообразно проведение полихимиотерапии.
3. При массивном канцероматозе, множественных отдаленных метастазах, невозможности полной циторедукции R0 результаты хирургического лечения неудовлетворительные. Операции целесообразны только с паллиативной целью у больных с осложненным течением рака.
Слайд 88
Химиотерапия
Неоадъювантная
Адъювантная
Внутрибрюшинная
а) интраоперационная
б) адъювантная
Паллиативная
Слайд 89
Адъювантная терапия
Результаты хирургического лечения остаются малоудовлетворительными
Адъювантная лучевая терапия, снижая частоту местных рецидивов, не улучшает
выживаемость
Адъювантная химиотерапия после радикальных операций лишь незначительно улучшает отдаленные результаты, что подтверждено многочисленными исследованиями
Hermans et al, 1993, 11 исследований, n=2096
Earle and Maroun, 1999, 13 исследований, n=1990
Слайд 90
Адъювантная терапия
В 2007 году опубликованы результаты
Японского рандомизированного исследования, изучавшего эффективность адъювантной монохимиотерапии новым пероральным
химиопрепаратом из группы фторпиримидинов – S-1
Препарат назначали перорально по 80 мг/кв.м в день в течение года после радикальной операции при раке желудка II-III стадий. Длительность одного курса составляла 4 недели с 2 недельным перерывом.
Анализ отдаленных результатов показал достоверное увеличение 3-летней выживаемости больных, получавших адъювантную химиотерапию препаратом S-1, с 70,1% до 80,1%.99
Слайд 91
Периоперационная химиотерапия
Рандомизированное исследование MAGIC
Лечение включало в себя 3
курса неоадъювантной химиотерапии по схеме ECF (эпирубицин, цисплатин, 5-ФУ)
с последующей операцией и еще тремя курсами химиотерапии по аналогичной схеме.
Исследование продемонстрировало достоверное повышение 5-летней выживаемости с 23 до 36% в группе комбинированного лечения.
Cunningham D, Allum WH, Stenning SP, et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med 2006;355:11-20
Слайд 92
Межгрупповое рандомизированное исследование (INT-0116). 603 пациента с
резектабельным раком желудка
хирургия +адъювантная терапия
либо
только хирургия
Режим адъювантной терапии:
1 курс 5-ФУ + лейковорин
лучевая терапия 45 Гр (25 дней) + 5ФУ / лейковорин в 1, 4, 23 и 25 дни облучения
2 курса химиотерапии 5-ФУ / лейковорин
Адъювантная химиолучевая терапия
Слайд 93
Адъювантная химиолучевая терапия
Эффективность:
безрецидивная 3-летняя выживаемость 49%
против 32%
3-летняя выживаемость 52% против 41%
медиана выживаемости
35 против 28 месяцев
Критический анализ исследования INT-0166 показал, что объем хирургического лечения был неадекватным у большинства больных. Так расширенная лимфаденэктомия D2 была выполнена лишь у 10% больных, стандартная лимфаденэктомия D1 – 36%, а у 54% больных объем лимфодиссекции характеризовался как D0.
На этом фоне частота местных рецидивов в группе только хирургического лечения достигала 64%, что значительно хуже результатов лечения рака желудка в Европе и Японии.
В группе больных, которым была выполнена лимфаденэктомия D2, не было отмечено достоверного увеличения выживаемости в результате комплексного лечения.
Слайд 94
Адъювантная химиолучевая терапия
В исследование включено 990 больных.
Основная
группа (544) – D2 операция + ХЛТ (схема аналогична
INT 0116), контроль – только D2 операция (446)
Результаты:
Kim S., Lim DH., Lee J., et al. Int J Radiat Oncol Biol Phys. 2005 Dec 1;63(5):1279-85
Слайд 95
Внутрибрюшная гипертермическая химиотерапия (HIPEC) при раке желудка
Kim
et al. 2001
(n=103)
Профилактика канцероматоза при раке
желудка с инвазией серозного покрова
5-летняя выживаемость при опухолях с инвазией серозы (исключая IV стадию) увеличилась с 44,4% до 58,5%, а при IIIB стадии – с 25% до 41,7%.
T3-T4
IIIB
HIPEC
HIPEC
control
control
Слайд 96
Паллиативная химиотерапия рака желудка
Монохимиотерапия редко приводит к ремиссии
Полихимиотерапия
более эффективна, но увеличивает токсичность и стоимость лечения
Химиотерапия рака
желудка в монорежиме 5-фторурацилом
Слайд 97
Современные схемы химиотерапии рака желудка IV стадии
Слайд 98
Паллиативная химиотерапия
Медиана продолжительности жизни больных с диссеминированным раком
желудка при химиотерапевтическом лечении не превышает 8-12 месяцев.
Перспективными могут
считаться режимы комбинированной химиотерапии с включением таргетных препаратов
Слайд 99
Лучевая терапия рака желудка
В неоадъювантном режиме в СОД
40 Гр. повышает резектабельность (с 79 до 89%, р
< 0,01) и улучшает 5-летние и 10-летние отдаленные результаты лечения кардиального рака (Zhang et.al.,1998)
Предоперационная лучевая терапия по схеме динамического фракционирования на фоне применения капцетабина в дозе 1650 мг/м² привела к терапевтическому патоморфозу 2-3 степени у 86% больных (Слугарев В.В. и др.,2005).
Послеоперационная химио-лучевая терапия у больных с неблагоприятным прогнозом (Т2-4N+) при 3-х годичном наблюдении достоверно увеличила выживаемость больных по сравнению с больными, получившими только хирургическое лечение.